دوره 29، شماره 4 - ( 10-1399 )
جلد 29 شماره 4 صفحات 113-102 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Hajizadeh Moghaddam A, Abbasalipour H, Ranjbar M, Khanjani Jelodar S. Effect of Sumac Nano-phytosome on Memory and Oxidative Stress in Valproic Acid-induced Rat Model of Autism Spectrum Disorder. JGUMS 2021; 29 (4) :102-113
URL: http://journal.gums.ac.ir/article-1-2212-fa.html
URL: http://journal.gums.ac.ir/article-1-2212-fa.html
حاجیزاده مقدم اکبر، عباسعلیپور هانیه، رنجبر مجتبی، خانجانی جلودار صدیقه. اثر نانوفیتوزوم سماق بر اختلالات شناختی و استرس اکسیداتیو القاشده با والپروئیک اسید در مدل اُتیسمی موش صحرایی. مجله علوم پزشکی گیلان. 1399; 29 (4) :102-113
1- گروه زیست جانوری، دانشکده علوم پایه، دانشگاه مازندران، بابلسر، ایران. ، a.hajizadeh@umz.ac.ir
2- گروه زیست جانوری، دانشکده علوم پایه، دانشگاه مازندران، بابلسر، ایران.
3- دانشکده بیوتکنولوژی، دانشگاه تخصصی فناوریهای نوین آمل، آمل، ایران.
4- گروه زیست جانوری، دانشکده علوم و زیست فناوری، دانشگاه شهید بهشتی، تهران، ایران.
2- گروه زیست جانوری، دانشکده علوم پایه، دانشگاه مازندران، بابلسر، ایران.
3- دانشکده بیوتکنولوژی، دانشگاه تخصصی فناوریهای نوین آمل، آمل، ایران.
4- گروه زیست جانوری، دانشکده علوم و زیست فناوری، دانشگاه شهید بهشتی، تهران، ایران.
متن کامل [PDF 4482 kb]
(1151 دریافت)
| چکیده (HTML) (1847 مشاهده)
References
1.Meguid NA, Dardir AA, Abdel-Raouf ER, Hashish A. Evaluation of oxidative stress in autism: Defective antioxidant enzymes and increased lipid peroxidation. Biological Trace Element Research. 2011; 143(1):58-65. [DOI:10.1007/s12011-010-8840-9] [PMID]
2.Mousavinejad E, Ghaffari MA, Riahi F, Hajmohammadi M, Tiznobeyk Z, Mousavinejad M. Coenzyme Q10 supplementation reduces oxidative stress and decreases antioxidant enzyme activity in children with Autism Spectrum Disorders. Psychiatry Research. 2018; 265:62-9. [DOI:10.1016/j.psychres.2018.03.061] [PMID]
3.Cheaha D, Bumrungsri S, Chatpun S, Kumarnsit E. Characterization of in utero valproic acid mouse model of autism by local field potential in the hippocampus and the olfactory bulb. Neuroscience Research. 2015; 98:28-34. [DOI:10.1016/j.neures.2015.04.006] [PMID]
4.Silvestrin RB, Bambini-Junior V, Galland F, Bobermim LD, Quincozes-Santos A, Abib RT, et al. Animal model of autism induced by prenatal exposure to valproate: Altered glutamate metabolism in the hippocampus. Brain Research. 2013; 1495:52-60. [DOI:10.1016/j.brainres.2012.11.048] [PMID]
5.Kumaravel P, Melchias G, Vasanth N, Manivasagam T. Epigallocatechin gallate attenuates behavioral defects in sodium valproate induced autism rat model. Research Journal of Pharmacy and Technology. 2017; 10:1477-80.[DOI:10.5958/0974-360X.2017.00260.8]
6.Fontella FU, Siqueira IR, Vasconcellos AP, Tabajara AS, Netto CA, Dalmaz C. Repeated restraint stress induces oxidative damage in rat hippocampus. Neurochemical Research. 2005; 30(1):105-11. [DOI:10.1007/s11064-004-9691-6] [PMID]
7.Sağlam M, Köseoğlu S, Hatipoğlu M, Esen HH, Köksal E. Effect of sumac extract on serum oxidative status, RANKL/OPG system and alveolar bone loss in experimental periodontitis in rats. Journal of Applied Oral Science. 2015; 23(1):33-41. [DOI:10.1590/1678-775720140288] [PMID] [PMCID]
8.Rajan VK, Muraleedharan K. A computational investigation on the structure, global parameters and antioxidant capacity of a polyphenol, Gallic acid. Food Chemistry. 2017; 220:93-9. [DOI:10.1016/j.foodchem.2016.09.178] [PMID]
9.Peng Y, Zhang H, Liu R, Mine Y, McCallum J, Kirby C, et al. Antioxidant and anti-inflammatory activities of pyranoanthocyanins and other polyphenols from staghorn sumac (Rhus hirta L.) in Caco-2 cell models. Journal of Functional Foods. 2016; 20:139-47.[DOI:10.1016/j.jff.2015.10.026]
10.Riaz H, Raza SA, Aslam MS, Ahmad MS, Ahmad MA, Maria P. An updated review of pharmacological, standardization methods and formulation development of rutin. Journal of Pure and Applied Microbiology. 2018; 12:127-32. [DOI:10.22207/JPAM.12.1.16]
11.Karimi N, Ghanbarzadeh B, Hamishehkar H, Keyvani F, Pezeshki A, Gholian MM. [Phytosome and liposome: The beneficial encapsulation systems in drug delivery and food application (Persian)]. Applied Food Biotechnology. 2015; 2(3), 17-27. https://www.sid.ir/en/journal/ViewPaper.aspx?id=466705
12.Shin GH, Chung SK, Kim JT, Joung HJ, Park HJ. Preparation of chitosan-coated nanoliposomes for improving the mucoadhesive property of curcumin using the ethanol injection method. Journal of Agricultural and Food Chemistry. 2013; 61(46):11119-26. [DOI:10.1021/jf4035404] [PMID]
13.Zavvari F, Karimzadeh F. A review on the behavioral tests for learning and memory assessments in rat. The Neuroscience Journal of Shefaye Khatam. 2017; 5(4):110-24. [DOI:10.18869/acadpub.shefa.5.4.110]
14.Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 1976; 72(1-2):248-54. [DOI:10.1016/0003-2697(76)90527-3]
15.Aebi H. [13] Catalase in vitro. Methods in enzymology. 1984; 105:121-6. [DOI:10.1016/S0076-6879(84)05016-3]
16.Hara Y, Ago Y, Higuchi M, Hasebe S, Nakazawa T, Hashimoto H, et al. Oxytocin attenuates deficits in social interaction but not recognition memory in a prenatal valproic acid-induced mouse model of autism. Hormones and Behavior. 2017; 96:130-6. [DOI:10.1016/j.yhbeh.2017.09.013] [PMID]
17.Pinto RE, Bartley W. The effect of age and sex on glutathione reductase and glutathione peroxidase activities and on aerobic glutathione oxidation in rat liver homogenates. Biochemical Journal. 1969; 112(1):109-15. [DOI:10.1042/bj1120109] [PMID] [PMCID]
18.Benzie IF, Strain JJ. The Ferric Reducing Ability of Plasma (FRAP) as a measure of “antioxidant power”: The FRAP assay. Analytical Bochemistry. 1996; 239(1):70-6. [DOI:10.1006/abio.1996.0292] [PMID]
19.Wei H, Alberts I, Li X. The apoptotic perspective of autism. International Journal of Developmental Neuroscience. 2014; 36:13-8. [DOI:10.1016/j.ijdevneu.2014.04.004] [PMID]
20.Cezar LC, Kirsten TB, da Fonseca CC, de Lima AP, Bernardi MM, Felicio LF. Zinc as a therapy in a rat model of autism prenatally induced by valproic acid. Progress in Neuro-psychopharmacology and Biological Psychiatry. 2018; 84:173-80. [DOI:10.1016/j.pnpbp.2018.02.008] [PMID]
21.Nicolini C, Fahnestock M. The valproic acid-induced rodent model of autism. Experimental Neurology. 2018; 299:217-27. [DOI:10.1016/j.expneurol.2017.04.017] [PMID]
22.Khalaj R, Moghaddam AH, Zare M. Hesperetin and it nanocrystals ameliorate social behavior deficits and oxido-inflammatory stress in rat model of autism. International Journal of Developmental Neuroscience. 2018; 69:80-7.[DOI:10.1016/j.ijdevneu.2018.06.009] [PMID]
23.Pragnya B, Kameshwari JS, Veeresh B. Ameliorating effect of piperine on behavioral abnormalities and oxidative markers in sodium valproate induced autism in BALB/C mice. Behavioural Brain Research. 2014; 270:86-94. [DOI:10.1016/j.bbr.2014.04.045] [PMID]
24.Gao J, Wang X, Sun H, Cao Y, Liang S, Wang H, et al. Neuroprotective effects of docosahexaenoic acid on hippocampal cell death and learning and memory impairments in a valproic acid-induced rat autism model. International Journal of Developmental Neuroscience. 2016; 49:67-78. [DOI:10.1016/j.ijdevneu.2015.11.006] [PMID]
25.Chakraborty A, Ferk F, Simić T, Brantner A, Dušinská M, Kundi M, et al. DNA-protective effects of sumach (Rhus coriaria L.), a common spice: Results of human and animal studies. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 2009; 661(1-2):10-7. [DOI:10.1016/j.mrfmmm.2008.10.009] [PMID]
26.Al-Amin MM, Rahman MM, Khan FR, Zaman F, Reza HM. Astaxanthin improves behavioral disorder and oxidative stress in prenatal valproic acid-induced mice model of autism. Behavioural Brain Research. 2015; 286:112-21.[DOI:10.1016/j.bbr.2015.02.041] [PMID]
27.Shivanand P, Kinjal P. Phytosomes: Technical revolution in phytomedicine. International Journal of PharmTech Research. 2010; 2(1):627-31. https://www.researchgate.net/publication/266065880_Phytosomes_Technical_Revolution_in_Phytomedicine
28.Nazari M, Ghanbarzadeh B, Kafil HS, Zeinali M, Hamishehkar H. Garlic essential oil nanophytosomes as a natural food preservative: Its application in yogurt as food model. Colloid and Interface Science Communications. 2019; 30:100176. [DOI:10.1016/j.colcom.2019.100176]
متن کامل: (1344 مشاهده)
مقدمه
اُتیسم اختلال تکوین عصبی است که با اختلال رفتارهای ارتباطی، کلامی و یادگیری همراه است. این اختلال که در سه سال اول زندگی ظاهر میشود و با شیوع بالای یک در هر 68 نفر یکی از شایعترین اختلالات روانپزشکی به شمار میآید. شیوع این اختلال در پسران بیشتر از دختران است. به علت طیف وسیع علائم این بیماری به آن اختلال طیف اُتیسم گفته میشود. علت عمده بروز این اختلال تعامل بین فاکتورهای ژنتیکی و محیطی است [2 ،1].
هیپوکامپ یکی از نواحی مغز است که عملکردش در بیماری اُتیسم دچار آسیب میشود. مطالعات متعددی نشان داد که اختلال یادگیری، حافظه، زبان و عملکرد شناختی از جمله مشکلات افراد اُتیسمی است که احتمالاً ناشی از نقص در عملکرد ناحیه هیپوکامپ است [3]. برای بررسی اختلالات طیف اُتیسم از مدلهای حیوانی متعددی استفاده میشود. از متداولترین روشهای القا مدل حیوانی اُتیسم، تزریق والپروئیک اسید در دوران بارداری است. امروزه مطالعات گسترده نشان دادهاند که تزریق والپروئیک اسید در دوران بارداری میتواند سبب القا اختلال شبهاُتیسمی شود. والپروئیک اسید با نامهای تجاری دپاکین و والپاکین از داروهای ضدصرع و ضدتشنج است. والپروئیک اسید از طریق کاهش سطح گلوتاتیون احیاشده، افزایش گونه اکسیژن فعال و غیرفعالسازی میتوکندری سبب افزایش استرس اکسیداتیو و التهابی در سیستم عصبی میشود [5, 4].
عدم تعادل میان گونههای فعال اکسیژن و ظرفیت آنتیاکسیدانی نقش مهمی در بسیاری از بیماریهای عصبی از جمله اُتیسم دارد. کنش رادیکالهای آزاد با ترکیبات لیپیدی، کربوهیدراتها، پروتئینها و نوکلئیک اسیدها منجر به تغییر ساختار آنها و نهایتاً اختلال عملکرد میتوکندریایی و مرگ برنامهریزیشده نورونها میشود. در مراحل اولیه تکوین سیستم عصبی، نورونها به استرس اکسیداتیو آسیبپذیرتر هستند، به طوری که منجر به بروز اختلالات رفتاری از جمله نقص شناختی، افسردگی، اضطراب در بیماری اسکیزوفرنی و اُتیسم میشود [7, 6].
اگرچه درمان قطعی بیماری اُتیسم تاکنون دقیقاً مشخص نشده است اما استفاده از ترکیبات دارویی طبیعی میتواند تا حدودی علائم بیماری را، بدون ظهور عوارض جانبی، کاهش دهد. امروزه به دلیل اثرات سوء داروهای شیمیایی، استفاده از گیاهان دارویی با اقبال بیشتری مواجه شده است.
میوه سماق به دلیل داشتن خاصیت آنتیاکسیدانی، ضدالتهابی و آنتیباکتریایی در طب سنتی گیاهی برای درمان بیماری دیابت، سکته، سرطان و بیماریهای عصبی شناخته شده است. عصاره میوه این گیاه غنی از تانین، پلیفنولها و فلانوئیدها مانند گالیک اسید، متیل گالات، کوئرستین و آنتوسیانین و اسید چرب است [9 ,8, 7]. علیرغم اثرات دارویی فراوان، کاربرد درمانی عصاره میوه سماق به دلیل جذب و دسترسی زیستی اندک با محدودیت روبهرو است. در سالهای اخیر برای افزایش کارایی و اثربخشی گیاهان دارویی رویکرد مختلفی از قبیل استفاده از ترکیبات طبیعی به فرم نانو و حاملهای دارویی همچون لیپوزوم و فیتوزوم مدنظر محققین قرار گرفته [10]. نانوفیتوزوم از جمله نانوحامل دارویی نوین است که در سیستم انتقال دارو استفاده میشود [11]. هدف ما از این مطالعه بررسی اثرات عصاره میوه سماق و فرم نانوفیتوزوم آن بر اختلال یادگیری و استرس اکسیدانی هیپوکامپ موشهایی است که در دوران بارداری در معرض VPA قرار گرفتند.
مواد و روشها
در این مطالعه تجربی موشهای صحرایی ماده باردار نژاد ویستار از پژوهشکده انستیتو پاستور آمل خریداری شدند و در اتاق حیوانات در شرایط استاندارد 12 ساعت نور و 12 ساعت تاریکی در دمای 2±23 درجه سانتیگراد، در مرکز تکثیر و پروش حیوانات آزمایشگاهی گروه علوم جانوری دانشگاه مازندران نگهداری شدند. غذای مخصوص حیوانات به میزان کافی در دسترس بود. موشهای نر و ماده به مدت 24 ساعت برای آمیزش در کنار هم قرار گرفتند. روز اول بارداری بعد از مشاهده پلاک واژینال در نظر گرفته شد. ابتدا موشهای ماده باردار به دو گروه کنترل و آزمایش تقسیم شدند. موشهای باردار گروه آزمایش 500 میلیگرم بر کیلوگرم وزن بدن والپروئیک اسید (سیگما، آمریکا) را در روز 12/5 بارداری به صورت درونصفاقی دریافت کردند و موشهای باردار گروه کنترل در همان روز سالین دریافت کردند. در ادامه موشهای نر متولد شده از مادران گروه کنترل، به دو گروه کنترل سالم و کنترل مثبت تقسیم شدند که 21 روز بعد از تولد به ترتیب سالین و نانوفیتوزوم عصاره سماق با دُز 40 میلیگرم بر کیلوگرم را به مدت چهار هفته به صورت گاواژ دریافت کردند. همچنین موشهای نر متولدشده از گروه آزمایش نیز 21 روز بعد از تولد به سه گروه آزمایش، آزمایش تیمارشده با عصاره سماق و آزمایش تیمارشده با نانوفیتوزوم عصاره سماق تقسیم شدند. عصاره سماق و نانوفیتوزوم آن با دُز 40 میلیگرم بر کیلوگرم به مدت چهار هفته به صورت خوراکی دریافت کردند. در تمامی گروهها از 6 سر موش صحرایی نر استفاده شده است.
روش تهیه نانو فیتوزوم سماق
میوه سماق از منطقه لاریجان آمل (مازندران) جمعآوری شد و در گروه علوم گیاهی دانشگاه مازندران از نظر علمی با کد هرباریومی 11526 تأیید شد. میوهها به مدت 2 روز در دمای 60 درجه سانتیگراد خشک و پودر شدند. سپس مقدار 100 گرم از پودر میوه با 200 سیسی اتانول (96 درصد) به مدت 3 روز در دمای اتاق بر روی شیکر قرار داده شد. در پایان از طریق کاغذ صافی فیلتر و با استفاده از دستگاه روتاری، الکل عصاره حذف شد. عصاره نهایی در دمای 4 درجه سانتیگراد، نگهداری شد. نانوفیتوزوم سماق به روش اتانولی تهیه شده است [12]. به طور خلاصه عصاره سماق در دمای 55 درجه سانتیگراد در 3 گرم فسفاتیدیل کولین و 2/16 گرم تویین 80 حل شده و سپس محلول فوق همراه با 120 میلیلیتر اتانول 96 درصد به بافر هیدراتاسیون (محلول بافر فسفات 0/01 مولار، 150 میلیمولار NaCl ،pH4.7) در دمای 55 درجه سانتیگراد اضافه شد. برای حذف اتانول، محلول نهایی با همزن مغناطیسی به مدت30 دقیقه درون حمام آب در تبخیرکننده روتاری در دمای 55 درجه سانتیگراد قرار گرفت. در پایان برای تشکیل نانوفیتوزوم و تولید ذرات کوچکتر از صد نانومتر، محلول نهایی به مدت 30 دقیقه در دستگاه اولتراسونیک در دمای 4 درجه سانتیگراد قرار داده شد.
تست شناسایی شیء جدید
آزمون شناسایی شی جدید برای ارزیابی میزان اختلال حافظه انجام شد. این آزمون شامل سه مرحله است. مرحله اول (عادت) در مدت 3 تا 5 دقیقه انجام شد. در مرحله دوم یا مرحله آموزش دو شی کاملاً یکسان در کف اتاقک قرار گرفت و موش به مدت 10 دقیقه در اتاقک به صورت آزادانه قرار داده شد. در مرحله سوم که مرحله آزمون حافظه حیوان است، شی جدیدی که از نظر مورفولوژی متفاوت با دو شی قبلی بود، جایگزین یکی از اشیا شده و موش به مدت 5 دقیقه در اتاقک قرار گرفت. در پایان با تقسیم زمان بررسی شی جدید بر مجموع مدت زمان بررسی شی آشنا و جدید، شاخص زمانی تشخیص شیء جدید محاسبه شد [13].
نمونهبرداری
پس از ارزیابی اختلالات شناختی، حیوانات با کلروفرم بیهوش شدند و برای خارج شدن خون از بدن رپرفیوژن قلبی انجام شد. در ادامه به کمک ماتریکس مغزی ناحیه هیپوکامپ جدا شده و بلافاصله در نیتروژن مایع قرار گرفت. بافت هموژنشده هیپوکامپ با سرعت rpm 13000 به مدت 30 دقیقه در دمای 4+ درجه سانتیگراد سانتریفیوژ شد و محلول شفاف رویی آن برای سنجش فعالیت آنزیمهای آنتیاکسیدانی استفاده شد.
تعیین غلظت پروتئین به روش برادفورد
برای تعیین غلظت پروتئین نمونهها از روش برادفورد استفاده شد و جذب هر نمونه در طول موج 595 نانومتر خوانده شد. هرچه غلظت پروتئین حلشده بیشتر باشد، میزان رنگ آبی حاصل و جذب نوری آن افزایش مییابد [14].
سنجش فعالیت آنزیمهای آنتیاکسیدانی
برای سنجش فعالیت آنزیم کاتالاز از روش ابی استفاده شد [15]. محلول نهایی واکنش شامل بافر سدیم فسفات 50 میلیمولار درpH=7 است که حاوی10 میلیمولار H2O2 است. 60 میکرولیتر از محلول رویی بافت هیپوکامپ هموژنشده به 740 میکرولیتر مخلوط واکنش اضافه شد. جذب محلول در طول موج 240 نانومتر به مدت 2 دقیقه در دمای 25 درجه سانتیگراد خوانده شد. برای سنجش فعالیت آنزیم گلوتاتیون پراکسیداز در هر نمونه از مخلوط واکنشی که شامل سدیم آزید 5 میلیمولار، گلوتاتیون کاهیده 4 میلیمولار، سدیم فسفات 0/4 مولار با pH=7 که 0/4 میلیمولار EDTA و 0/1 میلیمولار NADPH در آن حل شده است. سپس 200 میکرولیتر محلول رویی بافت هموژنشده به مخلوط واکنش اضافه شد و اجازه داده شد به مدت 5 دقیقه در دمای 37 درجه سانتیگراد انکوبه شود و درنهایت پراکسید هیدروژن 4 میلیمولار به مخلوط اضافه شد و جذب محلول در طول موج 340 نانومتر و به مدت 2 دقیقه خوانده شد [16]. فعالیت آنزیم گلوتاتیونردوکتاز به روش رومرو و براساس اکسیداسیون NADPH محاسبه شد [17]. مخلوط واکنش حاوی بافر پتاسیم فسفات 0/1 مولار با pH=7 به همراه 2/5 میلیمولار GSSG و 0/1 میلیمولار NADPH است. سپس60 میکرولیتر محلول رویی از بافت هموژنشده و 740 میکرولیتر محلول واکنش اضافه شد. تغییرات جذب نوری مربوط به فعالیت این آنزیم در طول موج 340 نانومتر و طی 3 دقیقه اندازهگیری شد.
سنجش سطح آنتیاکسیدان تام
برای سنجش سطح آنتیاکسیدان تام (TAC) 50 میکرولیتر از محلول رویی به 1/5 میلیلیتر معرف FRAP افزوده شد و بعد از 10 دقیقه در دمای 37 درجه بنماری، در طول موج 593 نانومتر جذب اندازهگیری شد. برای صفر کردن دستگاه از مخلوط 20 میکرولیتر آب مقطر در 1/5 میلیلیتر محلول FRAP، به عنوان بلانک، استفاده شد. با استفاده از منحنی استانداردها و معادله خط بهدستآمده از FeSO4 غلظت آنتیاکسیدان تام نمونهها محاسبه شد. غلظت آنتیاکسیدان بر حسب µM/g Tissue گزارش شد [18].
آنالیز آماری
برای تجزیه و تحلیل آماری و مقایسه بین گروهها از آزمون تحلیل واریانس یکطرفه و در صورت معنیدار شدن از آزمون تعقیبی Tukey استفاده شد. تمامی محاسبات با استفاده از نرمافزار SPSS نسخه 19 و Prism نسخه 8 انجام شده و مقادیر P کمتر از 0/05 معنیدار در نظر گرفته شد. نتایج به صورت میانگین و انحراف معیار بیان شدند. برای رسم نمودارها نیز از نرمافزار Prism استفاده شد.
نتایج
بررسی اثر عصاره سماق و نانو فیتوزوم سماق بر شاخص تبعیض در آزمون شناسایی شی جدید
نتایج آزمون شناسایی شی جدید نشان داد که شاخص تبعیض در گروه بیمار کاهش معنیدار (001/P>0) یافت. این شاخص در گروه آزمایش تیمارشده با غلظت 40 میلیگرم بر کیلوگرم سماق نسبت به گروه آزمایش افزایش معنیداری (001/P>0) نشان داده است؛ همچنین شاخص تبعیض در گروه آزمایش تیمارشده با نانو فیتوزوم سماق با دُز 40 میلیگرم به کیلوگرم نیز افزایش معنیداری (001/P>0) نسبت به گروه آزمایش نشان داد و افزایش این شاخص در گروه تیمارشده با نانوفیتوزوم در مقایسه با گروه تیمارشده با عصاره سماق نیز چشمگیر بود (P>0/05) (تصویر شماره 1).
اُتیسم اختلال تکوین عصبی است که با اختلال رفتارهای ارتباطی، کلامی و یادگیری همراه است. این اختلال که در سه سال اول زندگی ظاهر میشود و با شیوع بالای یک در هر 68 نفر یکی از شایعترین اختلالات روانپزشکی به شمار میآید. شیوع این اختلال در پسران بیشتر از دختران است. به علت طیف وسیع علائم این بیماری به آن اختلال طیف اُتیسم گفته میشود. علت عمده بروز این اختلال تعامل بین فاکتورهای ژنتیکی و محیطی است [2 ،1].
هیپوکامپ یکی از نواحی مغز است که عملکردش در بیماری اُتیسم دچار آسیب میشود. مطالعات متعددی نشان داد که اختلال یادگیری، حافظه، زبان و عملکرد شناختی از جمله مشکلات افراد اُتیسمی است که احتمالاً ناشی از نقص در عملکرد ناحیه هیپوکامپ است [3]. برای بررسی اختلالات طیف اُتیسم از مدلهای حیوانی متعددی استفاده میشود. از متداولترین روشهای القا مدل حیوانی اُتیسم، تزریق والپروئیک اسید در دوران بارداری است. امروزه مطالعات گسترده نشان دادهاند که تزریق والپروئیک اسید در دوران بارداری میتواند سبب القا اختلال شبهاُتیسمی شود. والپروئیک اسید با نامهای تجاری دپاکین و والپاکین از داروهای ضدصرع و ضدتشنج است. والپروئیک اسید از طریق کاهش سطح گلوتاتیون احیاشده، افزایش گونه اکسیژن فعال و غیرفعالسازی میتوکندری سبب افزایش استرس اکسیداتیو و التهابی در سیستم عصبی میشود [5, 4].
عدم تعادل میان گونههای فعال اکسیژن و ظرفیت آنتیاکسیدانی نقش مهمی در بسیاری از بیماریهای عصبی از جمله اُتیسم دارد. کنش رادیکالهای آزاد با ترکیبات لیپیدی، کربوهیدراتها، پروتئینها و نوکلئیک اسیدها منجر به تغییر ساختار آنها و نهایتاً اختلال عملکرد میتوکندریایی و مرگ برنامهریزیشده نورونها میشود. در مراحل اولیه تکوین سیستم عصبی، نورونها به استرس اکسیداتیو آسیبپذیرتر هستند، به طوری که منجر به بروز اختلالات رفتاری از جمله نقص شناختی، افسردگی، اضطراب در بیماری اسکیزوفرنی و اُتیسم میشود [7, 6].
اگرچه درمان قطعی بیماری اُتیسم تاکنون دقیقاً مشخص نشده است اما استفاده از ترکیبات دارویی طبیعی میتواند تا حدودی علائم بیماری را، بدون ظهور عوارض جانبی، کاهش دهد. امروزه به دلیل اثرات سوء داروهای شیمیایی، استفاده از گیاهان دارویی با اقبال بیشتری مواجه شده است.
میوه سماق به دلیل داشتن خاصیت آنتیاکسیدانی، ضدالتهابی و آنتیباکتریایی در طب سنتی گیاهی برای درمان بیماری دیابت، سکته، سرطان و بیماریهای عصبی شناخته شده است. عصاره میوه این گیاه غنی از تانین، پلیفنولها و فلانوئیدها مانند گالیک اسید، متیل گالات، کوئرستین و آنتوسیانین و اسید چرب است [9 ,8, 7]. علیرغم اثرات دارویی فراوان، کاربرد درمانی عصاره میوه سماق به دلیل جذب و دسترسی زیستی اندک با محدودیت روبهرو است. در سالهای اخیر برای افزایش کارایی و اثربخشی گیاهان دارویی رویکرد مختلفی از قبیل استفاده از ترکیبات طبیعی به فرم نانو و حاملهای دارویی همچون لیپوزوم و فیتوزوم مدنظر محققین قرار گرفته [10]. نانوفیتوزوم از جمله نانوحامل دارویی نوین است که در سیستم انتقال دارو استفاده میشود [11]. هدف ما از این مطالعه بررسی اثرات عصاره میوه سماق و فرم نانوفیتوزوم آن بر اختلال یادگیری و استرس اکسیدانی هیپوکامپ موشهایی است که در دوران بارداری در معرض VPA قرار گرفتند.
مواد و روشها
در این مطالعه تجربی موشهای صحرایی ماده باردار نژاد ویستار از پژوهشکده انستیتو پاستور آمل خریداری شدند و در اتاق حیوانات در شرایط استاندارد 12 ساعت نور و 12 ساعت تاریکی در دمای 2±23 درجه سانتیگراد، در مرکز تکثیر و پروش حیوانات آزمایشگاهی گروه علوم جانوری دانشگاه مازندران نگهداری شدند. غذای مخصوص حیوانات به میزان کافی در دسترس بود. موشهای نر و ماده به مدت 24 ساعت برای آمیزش در کنار هم قرار گرفتند. روز اول بارداری بعد از مشاهده پلاک واژینال در نظر گرفته شد. ابتدا موشهای ماده باردار به دو گروه کنترل و آزمایش تقسیم شدند. موشهای باردار گروه آزمایش 500 میلیگرم بر کیلوگرم وزن بدن والپروئیک اسید (سیگما، آمریکا) را در روز 12/5 بارداری به صورت درونصفاقی دریافت کردند و موشهای باردار گروه کنترل در همان روز سالین دریافت کردند. در ادامه موشهای نر متولد شده از مادران گروه کنترل، به دو گروه کنترل سالم و کنترل مثبت تقسیم شدند که 21 روز بعد از تولد به ترتیب سالین و نانوفیتوزوم عصاره سماق با دُز 40 میلیگرم بر کیلوگرم را به مدت چهار هفته به صورت گاواژ دریافت کردند. همچنین موشهای نر متولدشده از گروه آزمایش نیز 21 روز بعد از تولد به سه گروه آزمایش، آزمایش تیمارشده با عصاره سماق و آزمایش تیمارشده با نانوفیتوزوم عصاره سماق تقسیم شدند. عصاره سماق و نانوفیتوزوم آن با دُز 40 میلیگرم بر کیلوگرم به مدت چهار هفته به صورت خوراکی دریافت کردند. در تمامی گروهها از 6 سر موش صحرایی نر استفاده شده است.
روش تهیه نانو فیتوزوم سماق
میوه سماق از منطقه لاریجان آمل (مازندران) جمعآوری شد و در گروه علوم گیاهی دانشگاه مازندران از نظر علمی با کد هرباریومی 11526 تأیید شد. میوهها به مدت 2 روز در دمای 60 درجه سانتیگراد خشک و پودر شدند. سپس مقدار 100 گرم از پودر میوه با 200 سیسی اتانول (96 درصد) به مدت 3 روز در دمای اتاق بر روی شیکر قرار داده شد. در پایان از طریق کاغذ صافی فیلتر و با استفاده از دستگاه روتاری، الکل عصاره حذف شد. عصاره نهایی در دمای 4 درجه سانتیگراد، نگهداری شد. نانوفیتوزوم سماق به روش اتانولی تهیه شده است [12]. به طور خلاصه عصاره سماق در دمای 55 درجه سانتیگراد در 3 گرم فسفاتیدیل کولین و 2/16 گرم تویین 80 حل شده و سپس محلول فوق همراه با 120 میلیلیتر اتانول 96 درصد به بافر هیدراتاسیون (محلول بافر فسفات 0/01 مولار، 150 میلیمولار NaCl ،pH4.7) در دمای 55 درجه سانتیگراد اضافه شد. برای حذف اتانول، محلول نهایی با همزن مغناطیسی به مدت30 دقیقه درون حمام آب در تبخیرکننده روتاری در دمای 55 درجه سانتیگراد قرار گرفت. در پایان برای تشکیل نانوفیتوزوم و تولید ذرات کوچکتر از صد نانومتر، محلول نهایی به مدت 30 دقیقه در دستگاه اولتراسونیک در دمای 4 درجه سانتیگراد قرار داده شد.
تست شناسایی شیء جدید
آزمون شناسایی شی جدید برای ارزیابی میزان اختلال حافظه انجام شد. این آزمون شامل سه مرحله است. مرحله اول (عادت) در مدت 3 تا 5 دقیقه انجام شد. در مرحله دوم یا مرحله آموزش دو شی کاملاً یکسان در کف اتاقک قرار گرفت و موش به مدت 10 دقیقه در اتاقک به صورت آزادانه قرار داده شد. در مرحله سوم که مرحله آزمون حافظه حیوان است، شی جدیدی که از نظر مورفولوژی متفاوت با دو شی قبلی بود، جایگزین یکی از اشیا شده و موش به مدت 5 دقیقه در اتاقک قرار گرفت. در پایان با تقسیم زمان بررسی شی جدید بر مجموع مدت زمان بررسی شی آشنا و جدید، شاخص زمانی تشخیص شیء جدید محاسبه شد [13].
نمونهبرداری
پس از ارزیابی اختلالات شناختی، حیوانات با کلروفرم بیهوش شدند و برای خارج شدن خون از بدن رپرفیوژن قلبی انجام شد. در ادامه به کمک ماتریکس مغزی ناحیه هیپوکامپ جدا شده و بلافاصله در نیتروژن مایع قرار گرفت. بافت هموژنشده هیپوکامپ با سرعت rpm 13000 به مدت 30 دقیقه در دمای 4+ درجه سانتیگراد سانتریفیوژ شد و محلول شفاف رویی آن برای سنجش فعالیت آنزیمهای آنتیاکسیدانی استفاده شد.
تعیین غلظت پروتئین به روش برادفورد
برای تعیین غلظت پروتئین نمونهها از روش برادفورد استفاده شد و جذب هر نمونه در طول موج 595 نانومتر خوانده شد. هرچه غلظت پروتئین حلشده بیشتر باشد، میزان رنگ آبی حاصل و جذب نوری آن افزایش مییابد [14].
سنجش فعالیت آنزیمهای آنتیاکسیدانی
برای سنجش فعالیت آنزیم کاتالاز از روش ابی استفاده شد [15]. محلول نهایی واکنش شامل بافر سدیم فسفات 50 میلیمولار درpH=7 است که حاوی10 میلیمولار H2O2 است. 60 میکرولیتر از محلول رویی بافت هیپوکامپ هموژنشده به 740 میکرولیتر مخلوط واکنش اضافه شد. جذب محلول در طول موج 240 نانومتر به مدت 2 دقیقه در دمای 25 درجه سانتیگراد خوانده شد. برای سنجش فعالیت آنزیم گلوتاتیون پراکسیداز در هر نمونه از مخلوط واکنشی که شامل سدیم آزید 5 میلیمولار، گلوتاتیون کاهیده 4 میلیمولار، سدیم فسفات 0/4 مولار با pH=7 که 0/4 میلیمولار EDTA و 0/1 میلیمولار NADPH در آن حل شده است. سپس 200 میکرولیتر محلول رویی بافت هموژنشده به مخلوط واکنش اضافه شد و اجازه داده شد به مدت 5 دقیقه در دمای 37 درجه سانتیگراد انکوبه شود و درنهایت پراکسید هیدروژن 4 میلیمولار به مخلوط اضافه شد و جذب محلول در طول موج 340 نانومتر و به مدت 2 دقیقه خوانده شد [16]. فعالیت آنزیم گلوتاتیونردوکتاز به روش رومرو و براساس اکسیداسیون NADPH محاسبه شد [17]. مخلوط واکنش حاوی بافر پتاسیم فسفات 0/1 مولار با pH=7 به همراه 2/5 میلیمولار GSSG و 0/1 میلیمولار NADPH است. سپس60 میکرولیتر محلول رویی از بافت هموژنشده و 740 میکرولیتر محلول واکنش اضافه شد. تغییرات جذب نوری مربوط به فعالیت این آنزیم در طول موج 340 نانومتر و طی 3 دقیقه اندازهگیری شد.
سنجش سطح آنتیاکسیدان تام
برای سنجش سطح آنتیاکسیدان تام (TAC) 50 میکرولیتر از محلول رویی به 1/5 میلیلیتر معرف FRAP افزوده شد و بعد از 10 دقیقه در دمای 37 درجه بنماری، در طول موج 593 نانومتر جذب اندازهگیری شد. برای صفر کردن دستگاه از مخلوط 20 میکرولیتر آب مقطر در 1/5 میلیلیتر محلول FRAP، به عنوان بلانک، استفاده شد. با استفاده از منحنی استانداردها و معادله خط بهدستآمده از FeSO4 غلظت آنتیاکسیدان تام نمونهها محاسبه شد. غلظت آنتیاکسیدان بر حسب µM/g Tissue گزارش شد [18].
آنالیز آماری
برای تجزیه و تحلیل آماری و مقایسه بین گروهها از آزمون تحلیل واریانس یکطرفه و در صورت معنیدار شدن از آزمون تعقیبی Tukey استفاده شد. تمامی محاسبات با استفاده از نرمافزار SPSS نسخه 19 و Prism نسخه 8 انجام شده و مقادیر P کمتر از 0/05 معنیدار در نظر گرفته شد. نتایج به صورت میانگین و انحراف معیار بیان شدند. برای رسم نمودارها نیز از نرمافزار Prism استفاده شد.
نتایج
بررسی اثر عصاره سماق و نانو فیتوزوم سماق بر شاخص تبعیض در آزمون شناسایی شی جدید
نتایج آزمون شناسایی شی جدید نشان داد که شاخص تبعیض در گروه بیمار کاهش معنیدار (001/P>0) یافت. این شاخص در گروه آزمایش تیمارشده با غلظت 40 میلیگرم بر کیلوگرم سماق نسبت به گروه آزمایش افزایش معنیداری (001/P>0) نشان داده است؛ همچنین شاخص تبعیض در گروه آزمایش تیمارشده با نانو فیتوزوم سماق با دُز 40 میلیگرم به کیلوگرم نیز افزایش معنیداری (001/P>0) نسبت به گروه آزمایش نشان داد و افزایش این شاخص در گروه تیمارشده با نانوفیتوزوم در مقایسه با گروه تیمارشده با عصاره سماق نیز چشمگیر بود (P>0/05) (تصویر شماره 1).
بررسی اثر عصاره سماق و نانو فیتوزوم سماق بر فعالیت آنزیمهای آنتیاکسیدانی
با توجه به تصویر شماره 2، فعالیت آنزیم کاتالاز هیپوکامپی در گروه آزمایش در مقایسه با گروه کنترل کاهش معنیدار (001/P>0) را نشان داده است و تنها تیمار با نانوفیتوزوم سماق سبب افزایش معنیدار (P>0/05) فعالیت این آنزیم در مقایسه با گروه آزمایش شد.
با توجه به تصویر شماره 2، فعالیت آنزیم کاتالاز هیپوکامپی در گروه آزمایش در مقایسه با گروه کنترل کاهش معنیدار (001/P>0) را نشان داده است و تنها تیمار با نانوفیتوزوم سماق سبب افزایش معنیدار (P>0/05) فعالیت این آنزیم در مقایسه با گروه آزمایش شد.
بر اساس تصویر شماره 3، فعالیت آنزیم GRx درگروه آزمایش نسبت به گروه کنترل کاهش معنیدار(P>0/05) داشته است.
این در حالی است که فعالیت این آنزیم در گروه SNP نسبت به گروه آزمایش افزایش معنیدار (001/P>0) نشان داد. همچنین سطح فعالیت این آنزیم در گروه SNP نسبت به گروه SE نیز افزایش معنیداری نشان داده است (P>0/05).
با توجه به تصویر شماره 4، فعالیت آنزیم GPx هیپوکامپ در گروه آزمایش نسبت به گروه کنترل کاهش معنیداری (001/P>0) نشان داده است.
با توجه به تصویر شماره 4، فعالیت آنزیم GPx هیپوکامپ در گروه آزمایش نسبت به گروه کنترل کاهش معنیداری (001/P>0) نشان داده است.
تیمار با عصاره میوه سماق با دُز 40 میلیگرم بر کیلوگرم (SE40) بر فعالیت این آنزیم تأثیری ندارد و گروه آزمایش تیمارشده با SE کاهش معنیداری (001/P>0) در مقایسه با گروه کنترل نشان میدهد. در حالی که فعالیت آنزیم GPx در گروه تیمارشده با SNP در مقایسه با گروه آزمایش افزایش معنیداری (001/P>0) نشان داد، به طوری که درگروه SNP40 نسبت بهSE نیز افزایش معنیدار (001/P>0) مشاهده شد.
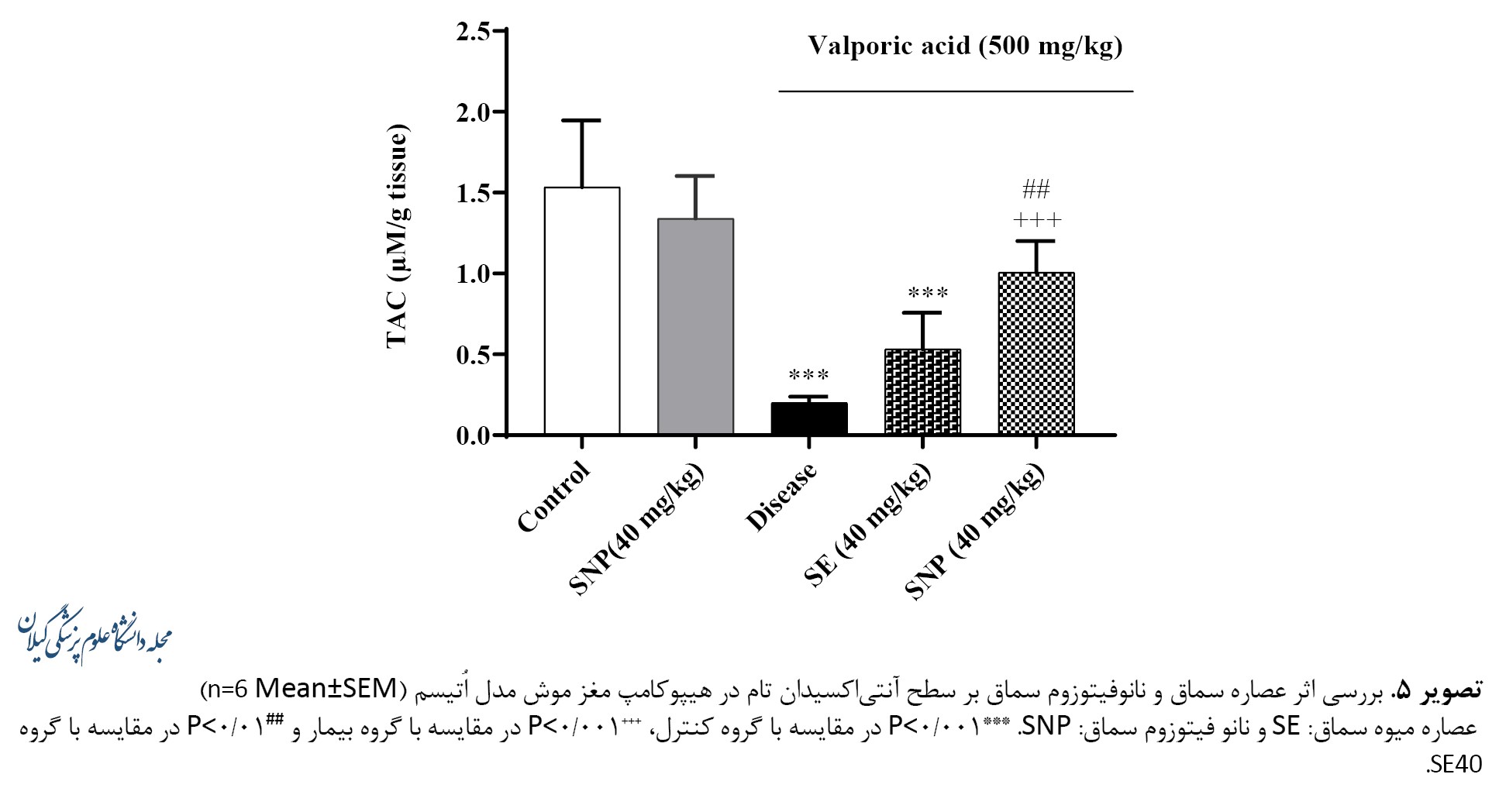
بررسی اثر عصاره سماق و نانوفیتوزوم سماق بر سطح فعالیت آنتیاکسیدان تام
تصویر شماره 5 نشان میدهد که سطح آنتیاکسیدان تام هیپوکامپ بین گروه کنترل و کنترل مثبت اختلاف معنیداری وجود ندارد اما در گروه آزمایش کاهش معنیدار (001/P>0) نسبت به گروه کنترل نشان داده است.
بررسی اثر عصاره سماق و نانوفیتوزوم سماق بر سطح فعالیت آنتیاکسیدان تام
تصویر شماره 5 نشان میدهد که سطح آنتیاکسیدان تام هیپوکامپ بین گروه کنترل و کنترل مثبت اختلاف معنیداری وجود ندارد اما در گروه آزمایش کاهش معنیدار (001/P>0) نسبت به گروه کنترل نشان داده است.
این در حالی است که تنها تیمار باSNP سبب افزایش معنیدار (001/P>0) سطح آنتیاکسیدان تام نسبت به گروه آزمایش شده است. همچنین در گروه SNP نسبت به گروه SE نیز افزایش معنیداری (001/P>0) مشاهده شد.
بحث و نتیجهگیری
اُتیسم طیفی از اختلالات عصبی است که با اختلال در ارتباطات، حافظه و عملکرد شناختی همراه است. مطالعات قبلی نشان داده است که برهمکنشهای ژنتیکی و محیطی در طی مراحل تکوین سیستم عصبی در بروز این اختلال مؤثر است [19]. مصرف داروی ضدصرع والپروئیک اسید در اوایل دوران بارداری به عنوان یکی از فاکتورهای محیطی احتمال بروز اُتیسم را در فرزندان افزایش میدهد. مطالعات متعددی نشان داده است که قرار گرفتن در معرض VPA در طول دوران بارداری در رتهای نژاد ویستار سبب القا مدل اُتیسم میشود [20]. مطالعات نشان داده است یکی از مناطق درگیر در اُتیسم ناحیه هیپوکامپ است [4]. در مطالعه حاضر دادههای آزمون رفتاری شناسایی شی جدید نشان داد که تزریق VPA در دوران بارداری موجب کاهش شاخص تبعیض میشود و این نتایج در راستای تأیید گزارش هارا و همکاران است [16]. مطالعه نیکولینی و همکاران نیز نشان داد تزریق VPA سبب القا رفتارهای شبهاُتیسمی در جوندگان میشود [21].
نتایج بیوشیمیایی پژوهش ما حاکی از آن است که تزریق VPA در دوران بارداری موجب کاهش معنیدار فعالیت آنزیمهای آنتیاکسیدانی کاتالاز، گلوتاتیون ردوکتاز و گلوتاتیون پراکسیداز و همچنین باعث کاهش تغییرات سطوح آنتیاکسیدان تام در ناحیه هیپوکامپ مغز شده است. افزایش استرس اکسیداتیو در مغز افراد مبتلا به اُتیسم عامل مهمی در پاتوفیزیولوژی اُتیسم است. در پژوهش قبلی القا رفتارهای شبهاُتیسمی ناشی از تزریق VPA و کاهش فعالیت آنزیمهای آنتیاکسیدانی گزارش شده است [22]. پراگنیا و همکاران نشان دادند تزریق VPA موجب کاهش فعالیت آنزیمهای آنتیاکسیدانی میشود [23]. گائو و همکارانش نیز گزارش کردند که تزریق VPA به موشهای ماده باردار سبب کاهش فعالیت آنزیمهای آنتیاکسیدانی در زادهها میشود [24].
از آنجایی که مطالعات متعدد نشان میدهد سطوح ترکیبات آنتیاکسیدانی در افراد مبتلا به اُتیسم تغییر میکند، بنابراین اختلال در مکانیسمهای دفاعی آنتیاکسیدانی نقش مهمی در بروز اختلال اُتیسمی ایفا میکنند [25]. علاوه بر این آنزیمهای آنتیاکسیدانی از جمله GP-x مانع از آسیب رساندن سوپراکسیدها به DNA میشوند. GSH آنتیاکسیدان اندوژنی است که توسط سلولها تولید میشود و نقش مهمی در خنثی کردن ROS، سمزدایی و حذف سموم زیستمحیطی ایفا میکند. افزایش استرس اکسیداتیو در هیپوکامپ افراد مبتلا به اُتیسم نشان میدهد که استرس اکسیداتیو ممکن است عامل مهمی در پاتوفیزیولوژی اُتیسم باشد [26].
در این مطالعه اثر حفاظتی سماق و نانوفیتوزوم آن بر شاخص رفتار شناختی و همچنین بر میزان سطح آنتیاکسیدان تام و فعالیت آنزیمهای آنتیاکسیدانی بافت هیپوکامپ در فرزندان اُتیسمی که مادران آنها در دوره بارداری در معرض VPA قرار گرفتند، بررسی شد. نتایج دادههای رفتاری این پژوهش نشان داد که مصرف سماق و نانوفیتوزوم سماق سبب بهبود رفتارهای شناختی در فرزندان اُتیسمی میشود. بررسی شاخصهای آنتیاکسیدانی هیپوکامپ نشان داد که نانوفیتوزوم سماق موجب افزایش فعالیت آنزیمهای کاتالاز، گلوتاتیون پراکسیداز، گلوتاتیون ردوکتاز و سطح آنتیاکسیدان تام میشود. همچنین نتایج این پژوهش حاکی از آن است که نانوفیتوزوم سماق احتمالاً به واسطه قابلیت زیستی بالاتر و جذب بهتر در لوله گوارش نسبت به عصاره خام سماق سبب بهبود اختلال شناختی و استرس اکسیداتیو هیپوکامپی القاشده با VPA در مدل اُتیسم میشود.
آنتیاکسیدانها نقش مهمی در کنترل یا درمان اختلالات تحلیل عصبی مانند آلزایمر، پارکینسون، سکته و اُتیسم ایفا میکنند. سماق نیز با روشهای مختلفی به فعالیت آنتیاکسیدانی کمک میکند. مطالعات اخیر حضور آنتیاکسیدانهای گوناگون شامل اسیدگالیک، فنولها و اسیدهای چرب را در سماق ثابت کردهاند [15]. آنتوسیانین و تاننهای هیدرولیزشده در سماق از پراکسیداسیون لیپید جلوگیری میکند. علاوه بر این گالیک اسید موجود در سماق از آسیب DNA در برابر ROS محافظت میکند و نیز رادیکال هیدروکسیل را مهار میکند [7].
استرس اکسیداتیو منجر به افزایش H2O2 و ROS میشود که ROS سبب پراکسیداسیون لیپید و آسیب سلولی و آسیب بهDNA میشود. بنابراین درمان با سماق موجب کاهش H2O2 میشود و در نتیجه میتواند از پراکسیداسیون لیپید و آسیب به DNA جلوگیری کند و نیز گالیکاسید موجود در سماق از DNA در برابر ROS محافظت میکند [15]. هرچند سماق در درمان بیماریهای مختلف استفاده میشود اما به دلیل داشتن مشکلاتی همچون قابلیت زیستی و جذب پایین که ناشی از حلّپذیری ضعیف در چربی و اندازه بزرگ آنهاست، درمان را تا حدودی دچار مشکل میکند [7]. تکنولوژی نانو با افزایش قابلیت زیستی و جذب رودهای روش جدیدی برای حل این مشکل است. در میان ساختارهای مختلف نانوحامل، فیتوزوم کارآمدترین شکل نانوحامل است [27].
در نتایج تحقیق حاضر اثرات بهبودی نانوفیتوزوم سماق با غلظت 40 میلیگرم بر کیلوگرم در مقایسه با گروه دریافتکننده عصاره سماق با غلظت مشابه چشمگیرتر بود. به طوری که در شاخص تبعیض نسبت گروه سماق افزایش معنیداری مشاهده شد. بررسی مقایسهای شاخصهای آنزیمی و غیرآنزیمی آنتیاکسیدانی هیپوکامپ بیانگر اثرات بارز ساختار نانوفیتوزومی سماق با غلظت 40 در مقایسه با عصاره با همین غلظت است. در همین راستا، مشاهده شد که نانوفیتوزوم سماق با خواص آنتیاکسیدانی، ضدالتهابی و محافظ نورونی خود موجب افزایش معنیدار فعالیت آنزیمهای آنتیاکسیدانی و سطح آنتیاکسیدان تام و بهبود رفتار یادگیری در رتهای مدل اوتیستیک شده است. نانوفیتوزوم سماق احتمالاً با خاصیت آنتیاکسیدانی خود سبب حفاظت نورون شده و از این رو توانسته است اثر مخرب VPA را در هیپوکمپ موشهای اُتیسمی مهار کند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
در این مطالعه تمامی مراحل کار با حیوان ازمایشگاهی مطابق با منشور اخلاق زیستی دانشگاه مازندران با کد اخلاقی IR.UMZ.REC.1397.021 انجام شد.
حامی مالی
این مطالعه با حمایت مالی ستاد توسعه علوم و فناوریهای شناختی معاونت علمی و فناوری ریاستجمهوری انجام گرفته است (طرح شماره: 0786).
مشارکت نویسندگان
مفهومسازی، نظارت، ویراستاری و نهاییسازی نوشته: اکبر حاجیزاده مقدم؛ جمعآوری دادهها: هانیه عباسعلیپور، آنالیز و بررسی دادهها: صدیقه خانجانی جلودار و مجتبی رنجبر.
تعارض منافع
بنابر اظهار نویسندگان این مقاله تعارض منافع ندارد.
بحث و نتیجهگیری
اُتیسم طیفی از اختلالات عصبی است که با اختلال در ارتباطات، حافظه و عملکرد شناختی همراه است. مطالعات قبلی نشان داده است که برهمکنشهای ژنتیکی و محیطی در طی مراحل تکوین سیستم عصبی در بروز این اختلال مؤثر است [19]. مصرف داروی ضدصرع والپروئیک اسید در اوایل دوران بارداری به عنوان یکی از فاکتورهای محیطی احتمال بروز اُتیسم را در فرزندان افزایش میدهد. مطالعات متعددی نشان داده است که قرار گرفتن در معرض VPA در طول دوران بارداری در رتهای نژاد ویستار سبب القا مدل اُتیسم میشود [20]. مطالعات نشان داده است یکی از مناطق درگیر در اُتیسم ناحیه هیپوکامپ است [4]. در مطالعه حاضر دادههای آزمون رفتاری شناسایی شی جدید نشان داد که تزریق VPA در دوران بارداری موجب کاهش شاخص تبعیض میشود و این نتایج در راستای تأیید گزارش هارا و همکاران است [16]. مطالعه نیکولینی و همکاران نیز نشان داد تزریق VPA سبب القا رفتارهای شبهاُتیسمی در جوندگان میشود [21].
نتایج بیوشیمیایی پژوهش ما حاکی از آن است که تزریق VPA در دوران بارداری موجب کاهش معنیدار فعالیت آنزیمهای آنتیاکسیدانی کاتالاز، گلوتاتیون ردوکتاز و گلوتاتیون پراکسیداز و همچنین باعث کاهش تغییرات سطوح آنتیاکسیدان تام در ناحیه هیپوکامپ مغز شده است. افزایش استرس اکسیداتیو در مغز افراد مبتلا به اُتیسم عامل مهمی در پاتوفیزیولوژی اُتیسم است. در پژوهش قبلی القا رفتارهای شبهاُتیسمی ناشی از تزریق VPA و کاهش فعالیت آنزیمهای آنتیاکسیدانی گزارش شده است [22]. پراگنیا و همکاران نشان دادند تزریق VPA موجب کاهش فعالیت آنزیمهای آنتیاکسیدانی میشود [23]. گائو و همکارانش نیز گزارش کردند که تزریق VPA به موشهای ماده باردار سبب کاهش فعالیت آنزیمهای آنتیاکسیدانی در زادهها میشود [24].
از آنجایی که مطالعات متعدد نشان میدهد سطوح ترکیبات آنتیاکسیدانی در افراد مبتلا به اُتیسم تغییر میکند، بنابراین اختلال در مکانیسمهای دفاعی آنتیاکسیدانی نقش مهمی در بروز اختلال اُتیسمی ایفا میکنند [25]. علاوه بر این آنزیمهای آنتیاکسیدانی از جمله GP-x مانع از آسیب رساندن سوپراکسیدها به DNA میشوند. GSH آنتیاکسیدان اندوژنی است که توسط سلولها تولید میشود و نقش مهمی در خنثی کردن ROS، سمزدایی و حذف سموم زیستمحیطی ایفا میکند. افزایش استرس اکسیداتیو در هیپوکامپ افراد مبتلا به اُتیسم نشان میدهد که استرس اکسیداتیو ممکن است عامل مهمی در پاتوفیزیولوژی اُتیسم باشد [26].
در این مطالعه اثر حفاظتی سماق و نانوفیتوزوم آن بر شاخص رفتار شناختی و همچنین بر میزان سطح آنتیاکسیدان تام و فعالیت آنزیمهای آنتیاکسیدانی بافت هیپوکامپ در فرزندان اُتیسمی که مادران آنها در دوره بارداری در معرض VPA قرار گرفتند، بررسی شد. نتایج دادههای رفتاری این پژوهش نشان داد که مصرف سماق و نانوفیتوزوم سماق سبب بهبود رفتارهای شناختی در فرزندان اُتیسمی میشود. بررسی شاخصهای آنتیاکسیدانی هیپوکامپ نشان داد که نانوفیتوزوم سماق موجب افزایش فعالیت آنزیمهای کاتالاز، گلوتاتیون پراکسیداز، گلوتاتیون ردوکتاز و سطح آنتیاکسیدان تام میشود. همچنین نتایج این پژوهش حاکی از آن است که نانوفیتوزوم سماق احتمالاً به واسطه قابلیت زیستی بالاتر و جذب بهتر در لوله گوارش نسبت به عصاره خام سماق سبب بهبود اختلال شناختی و استرس اکسیداتیو هیپوکامپی القاشده با VPA در مدل اُتیسم میشود.
آنتیاکسیدانها نقش مهمی در کنترل یا درمان اختلالات تحلیل عصبی مانند آلزایمر، پارکینسون، سکته و اُتیسم ایفا میکنند. سماق نیز با روشهای مختلفی به فعالیت آنتیاکسیدانی کمک میکند. مطالعات اخیر حضور آنتیاکسیدانهای گوناگون شامل اسیدگالیک، فنولها و اسیدهای چرب را در سماق ثابت کردهاند [15]. آنتوسیانین و تاننهای هیدرولیزشده در سماق از پراکسیداسیون لیپید جلوگیری میکند. علاوه بر این گالیک اسید موجود در سماق از آسیب DNA در برابر ROS محافظت میکند و نیز رادیکال هیدروکسیل را مهار میکند [7].
استرس اکسیداتیو منجر به افزایش H2O2 و ROS میشود که ROS سبب پراکسیداسیون لیپید و آسیب سلولی و آسیب بهDNA میشود. بنابراین درمان با سماق موجب کاهش H2O2 میشود و در نتیجه میتواند از پراکسیداسیون لیپید و آسیب به DNA جلوگیری کند و نیز گالیکاسید موجود در سماق از DNA در برابر ROS محافظت میکند [15]. هرچند سماق در درمان بیماریهای مختلف استفاده میشود اما به دلیل داشتن مشکلاتی همچون قابلیت زیستی و جذب پایین که ناشی از حلّپذیری ضعیف در چربی و اندازه بزرگ آنهاست، درمان را تا حدودی دچار مشکل میکند [7]. تکنولوژی نانو با افزایش قابلیت زیستی و جذب رودهای روش جدیدی برای حل این مشکل است. در میان ساختارهای مختلف نانوحامل، فیتوزوم کارآمدترین شکل نانوحامل است [27].
در نتایج تحقیق حاضر اثرات بهبودی نانوفیتوزوم سماق با غلظت 40 میلیگرم بر کیلوگرم در مقایسه با گروه دریافتکننده عصاره سماق با غلظت مشابه چشمگیرتر بود. به طوری که در شاخص تبعیض نسبت گروه سماق افزایش معنیداری مشاهده شد. بررسی مقایسهای شاخصهای آنزیمی و غیرآنزیمی آنتیاکسیدانی هیپوکامپ بیانگر اثرات بارز ساختار نانوفیتوزومی سماق با غلظت 40 در مقایسه با عصاره با همین غلظت است. در همین راستا، مشاهده شد که نانوفیتوزوم سماق با خواص آنتیاکسیدانی، ضدالتهابی و محافظ نورونی خود موجب افزایش معنیدار فعالیت آنزیمهای آنتیاکسیدانی و سطح آنتیاکسیدان تام و بهبود رفتار یادگیری در رتهای مدل اوتیستیک شده است. نانوفیتوزوم سماق احتمالاً با خاصیت آنتیاکسیدانی خود سبب حفاظت نورون شده و از این رو توانسته است اثر مخرب VPA را در هیپوکمپ موشهای اُتیسمی مهار کند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
در این مطالعه تمامی مراحل کار با حیوان ازمایشگاهی مطابق با منشور اخلاق زیستی دانشگاه مازندران با کد اخلاقی IR.UMZ.REC.1397.021 انجام شد.
حامی مالی
این مطالعه با حمایت مالی ستاد توسعه علوم و فناوریهای شناختی معاونت علمی و فناوری ریاستجمهوری انجام گرفته است (طرح شماره: 0786).
مشارکت نویسندگان
مفهومسازی، نظارت، ویراستاری و نهاییسازی نوشته: اکبر حاجیزاده مقدم؛ جمعآوری دادهها: هانیه عباسعلیپور، آنالیز و بررسی دادهها: صدیقه خانجانی جلودار و مجتبی رنجبر.
تعارض منافع
بنابر اظهار نویسندگان این مقاله تعارض منافع ندارد.
References
1.Meguid NA, Dardir AA, Abdel-Raouf ER, Hashish A. Evaluation of oxidative stress in autism: Defective antioxidant enzymes and increased lipid peroxidation. Biological Trace Element Research. 2011; 143(1):58-65. [DOI:10.1007/s12011-010-8840-9] [PMID]
2.Mousavinejad E, Ghaffari MA, Riahi F, Hajmohammadi M, Tiznobeyk Z, Mousavinejad M. Coenzyme Q10 supplementation reduces oxidative stress and decreases antioxidant enzyme activity in children with Autism Spectrum Disorders. Psychiatry Research. 2018; 265:62-9. [DOI:10.1016/j.psychres.2018.03.061] [PMID]
3.Cheaha D, Bumrungsri S, Chatpun S, Kumarnsit E. Characterization of in utero valproic acid mouse model of autism by local field potential in the hippocampus and the olfactory bulb. Neuroscience Research. 2015; 98:28-34. [DOI:10.1016/j.neures.2015.04.006] [PMID]
4.Silvestrin RB, Bambini-Junior V, Galland F, Bobermim LD, Quincozes-Santos A, Abib RT, et al. Animal model of autism induced by prenatal exposure to valproate: Altered glutamate metabolism in the hippocampus. Brain Research. 2013; 1495:52-60. [DOI:10.1016/j.brainres.2012.11.048] [PMID]
5.Kumaravel P, Melchias G, Vasanth N, Manivasagam T. Epigallocatechin gallate attenuates behavioral defects in sodium valproate induced autism rat model. Research Journal of Pharmacy and Technology. 2017; 10:1477-80.[DOI:10.5958/0974-360X.2017.00260.8]
6.Fontella FU, Siqueira IR, Vasconcellos AP, Tabajara AS, Netto CA, Dalmaz C. Repeated restraint stress induces oxidative damage in rat hippocampus. Neurochemical Research. 2005; 30(1):105-11. [DOI:10.1007/s11064-004-9691-6] [PMID]
7.Sağlam M, Köseoğlu S, Hatipoğlu M, Esen HH, Köksal E. Effect of sumac extract on serum oxidative status, RANKL/OPG system and alveolar bone loss in experimental periodontitis in rats. Journal of Applied Oral Science. 2015; 23(1):33-41. [DOI:10.1590/1678-775720140288] [PMID] [PMCID]
8.Rajan VK, Muraleedharan K. A computational investigation on the structure, global parameters and antioxidant capacity of a polyphenol, Gallic acid. Food Chemistry. 2017; 220:93-9. [DOI:10.1016/j.foodchem.2016.09.178] [PMID]
9.Peng Y, Zhang H, Liu R, Mine Y, McCallum J, Kirby C, et al. Antioxidant and anti-inflammatory activities of pyranoanthocyanins and other polyphenols from staghorn sumac (Rhus hirta L.) in Caco-2 cell models. Journal of Functional Foods. 2016; 20:139-47.[DOI:10.1016/j.jff.2015.10.026]
10.Riaz H, Raza SA, Aslam MS, Ahmad MS, Ahmad MA, Maria P. An updated review of pharmacological, standardization methods and formulation development of rutin. Journal of Pure and Applied Microbiology. 2018; 12:127-32. [DOI:10.22207/JPAM.12.1.16]
11.Karimi N, Ghanbarzadeh B, Hamishehkar H, Keyvani F, Pezeshki A, Gholian MM. [Phytosome and liposome: The beneficial encapsulation systems in drug delivery and food application (Persian)]. Applied Food Biotechnology. 2015; 2(3), 17-27. https://www.sid.ir/en/journal/ViewPaper.aspx?id=466705
12.Shin GH, Chung SK, Kim JT, Joung HJ, Park HJ. Preparation of chitosan-coated nanoliposomes for improving the mucoadhesive property of curcumin using the ethanol injection method. Journal of Agricultural and Food Chemistry. 2013; 61(46):11119-26. [DOI:10.1021/jf4035404] [PMID]
13.Zavvari F, Karimzadeh F. A review on the behavioral tests for learning and memory assessments in rat. The Neuroscience Journal of Shefaye Khatam. 2017; 5(4):110-24. [DOI:10.18869/acadpub.shefa.5.4.110]
14.Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 1976; 72(1-2):248-54. [DOI:10.1016/0003-2697(76)90527-3]
15.Aebi H. [13] Catalase in vitro. Methods in enzymology. 1984; 105:121-6. [DOI:10.1016/S0076-6879(84)05016-3]
16.Hara Y, Ago Y, Higuchi M, Hasebe S, Nakazawa T, Hashimoto H, et al. Oxytocin attenuates deficits in social interaction but not recognition memory in a prenatal valproic acid-induced mouse model of autism. Hormones and Behavior. 2017; 96:130-6. [DOI:10.1016/j.yhbeh.2017.09.013] [PMID]
17.Pinto RE, Bartley W. The effect of age and sex on glutathione reductase and glutathione peroxidase activities and on aerobic glutathione oxidation in rat liver homogenates. Biochemical Journal. 1969; 112(1):109-15. [DOI:10.1042/bj1120109] [PMID] [PMCID]
18.Benzie IF, Strain JJ. The Ferric Reducing Ability of Plasma (FRAP) as a measure of “antioxidant power”: The FRAP assay. Analytical Bochemistry. 1996; 239(1):70-6. [DOI:10.1006/abio.1996.0292] [PMID]
19.Wei H, Alberts I, Li X. The apoptotic perspective of autism. International Journal of Developmental Neuroscience. 2014; 36:13-8. [DOI:10.1016/j.ijdevneu.2014.04.004] [PMID]
20.Cezar LC, Kirsten TB, da Fonseca CC, de Lima AP, Bernardi MM, Felicio LF. Zinc as a therapy in a rat model of autism prenatally induced by valproic acid. Progress in Neuro-psychopharmacology and Biological Psychiatry. 2018; 84:173-80. [DOI:10.1016/j.pnpbp.2018.02.008] [PMID]
21.Nicolini C, Fahnestock M. The valproic acid-induced rodent model of autism. Experimental Neurology. 2018; 299:217-27. [DOI:10.1016/j.expneurol.2017.04.017] [PMID]
22.Khalaj R, Moghaddam AH, Zare M. Hesperetin and it nanocrystals ameliorate social behavior deficits and oxido-inflammatory stress in rat model of autism. International Journal of Developmental Neuroscience. 2018; 69:80-7.[DOI:10.1016/j.ijdevneu.2018.06.009] [PMID]
23.Pragnya B, Kameshwari JS, Veeresh B. Ameliorating effect of piperine on behavioral abnormalities and oxidative markers in sodium valproate induced autism in BALB/C mice. Behavioural Brain Research. 2014; 270:86-94. [DOI:10.1016/j.bbr.2014.04.045] [PMID]
24.Gao J, Wang X, Sun H, Cao Y, Liang S, Wang H, et al. Neuroprotective effects of docosahexaenoic acid on hippocampal cell death and learning and memory impairments in a valproic acid-induced rat autism model. International Journal of Developmental Neuroscience. 2016; 49:67-78. [DOI:10.1016/j.ijdevneu.2015.11.006] [PMID]
25.Chakraborty A, Ferk F, Simić T, Brantner A, Dušinská M, Kundi M, et al. DNA-protective effects of sumach (Rhus coriaria L.), a common spice: Results of human and animal studies. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 2009; 661(1-2):10-7. [DOI:10.1016/j.mrfmmm.2008.10.009] [PMID]
26.Al-Amin MM, Rahman MM, Khan FR, Zaman F, Reza HM. Astaxanthin improves behavioral disorder and oxidative stress in prenatal valproic acid-induced mice model of autism. Behavioural Brain Research. 2015; 286:112-21.[DOI:10.1016/j.bbr.2015.02.041] [PMID]
27.Shivanand P, Kinjal P. Phytosomes: Technical revolution in phytomedicine. International Journal of PharmTech Research. 2010; 2(1):627-31. https://www.researchgate.net/publication/266065880_Phytosomes_Technical_Revolution_in_Phytomedicine
28.Nazari M, Ghanbarzadeh B, Kafil HS, Zeinali M, Hamishehkar H. Garlic essential oil nanophytosomes as a natural food preservative: Its application in yogurt as food model. Colloid and Interface Science Communications. 2019; 30:100176. [DOI:10.1016/j.colcom.2019.100176]
| بازنشر اطلاعات | |
 | این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |








.jpg)
.jpg)
.jpg)