دوره 32، شماره 3 - ( 7-1402 )
جلد 32 شماره 3 صفحات 183-166 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Rezaeian S, Pourianfar H R. Effectiveness of Reishi (Ganoderma lucidum) in Preventing the Aging Process: A Review Study. JGUMS 2023; 32 (3) :166-183
URL: http://journal.gums.ac.ir/article-1-2560-fa.html
URL: http://journal.gums.ac.ir/article-1-2560-fa.html
رضائیان شراره، پوریان فر حمید رضا. مروری بر اثرات قارچ ریشی (گانودرما لوسیدوم) در پیشگیری از پیشرفت فرایند پیری. مجله علوم پزشکی گیلان. 1402; 32 (3) :166-183
1- گروه پژوهشی زیستفناوری قارچهای صنعتی، پژوهشکده بیوتکنولوژی صنعتی، سازمان جهاد دانشگاهی، خراسان رضوی، مشهد، ایران.
متن کامل [PDF 8868 kb]
(998 دریافت)
| چکیده (HTML) (2097 مشاهده)
References
1.Rezaeian SP, Hamid R. [Principles of cultivation of medicinal mushrooms the Iran perspective (Persian)]. Mashhad: Jahad Daneshgahi Publications; 2017.
2.Mojani Qomi MS, Hatami M. [Effects of powder, extracts, and components of Ganoderma lucidum in treatment of diabetes (Persian)]. Journal of Guilan University of Medical Sciences. 2021; 29(4):86-101. [DOI:10.32598/JGUMS.29.4.1509.1]
3.Wang J, Cao B, Zhao H, Feng J. Emerging roles of ganoderma lucidum in anti-aging. Aging and Disease. 2017; 8(6):691-707.[DOI:10.14336/AD.2017.0410] [PMID] [PMCID]
4.Tajalli F, Malekzadeh K, Soltanian H, Janpoor J, Rezaeian S, Pourianfar HR. Antioxidant capacity of several Iranian, wild and cultivated strains of the button mushroom. Brazilian Journal of Microbiology. 2015; 46(3):769-76. [DOI:10.1590/S1517-838246320140180] [PMID] [PMCID]
5.Kayali R, Çakatay U, Akçay T, Altuğ T. Effect of alpha-lipoic acid supplementation on markers of protein oxidation in post-mitotic tissues of ageing rat. Cell Biochemistry and Function. 2006; 24(1):79-85. [DOI:10.1002/cbf.1190] [PMID]
6.Muscari C, Giaccari A, Giordano E, Clô C, Guarnieri C, Caldarera CM. Role of reactive oxygen species in cardiovascular aging. In: Krause EG, Vetter R, editors. Biochemical mechanisms in heart function. Boston: Springer; 1996. [DOI:10.1007/978-1-4613-1279-6_22]
7.Vulevic J, Drakoularakou A, Yaqoob P, Tzortzis G, Gibson GR. Modulation of the fecal microflora profile and immune function by a novel trans-galactooligosaccharide mixture (B-GOS) in healthy elderly volunteers. The American Journal of Clinical Nutrition. 2008; 88(5):1438-46. [DOI:10.3945/ajcn.2008.26242] [PMID]
8.Alimadadi N, Pourianfar HR, Amoozegar MA, Zabihi SS, Mahdizadeh V, Shahzadeh Fazeli SA. Molecular identification of some wild medicinal macrofungi from Northern Iran. Studies in Fungi. 2019; 4(1):26-36. [DOI:10.5943/sif/4/1/4]
9.Shayan A. [Field guide to Iran’s mushrooms (Persian)]. Iran: Iran Shenasi Publications; 2020. [Link]
10.Keypour S, Riahi H, Rafati H. A review on the biological active compounds and medicinal properties of Ganoderma lucidum. Journal of Medicinal Plants. 2013; 12(46):13-24. [Link]
11.Rezaeian S, Saadatmand S, Nejad Sattari T, Mirshamsi Kakhki A. Antioxidant potency of Iranian newly cultivated wild mushrooms of Agaricus and Pleurotus species. Biomedical Research. 2015; 26(3):534-42. [Link]
12.Xia D. Effects of Ganoderma polysaccharides on immune function in mice. Journal of Beijing Medical University. 1989; 21:533-7. [Link]
13.Lei LS, Lin ZB. [Effects of Ganoderma polysaccharides on the activity of DNA polymerase alpha of splenocytes and immune function in aged mice (Chinese)]. Yao Xue Xue Bao. 1993; 28(8):577-82. [PMID]
14.Li WJ, Nie SP, Peng XP, Liu XZ, Li C, Chen Y, et al. Ganoderma atrum polysaccharide improves age-related oxidative stress and immune impairment in mice. Journal of Agricultural and food Chemistry. 2012; 60(6):1413-8. [DOI:10.1021/jf204748a] [PMID]
15.Yuan S, Yang Y, Li J, Tan X, Cao Y, Li S, et al. Ganoderma lucidum Rhodiola compound preparation prevent D-galactose-induced immune impairment and oxidative stress in aging rat model. Scientific Reports. 2020; 10(1):19244. [DOI:10.1038/s41598-020-76249-1] [PMID] [PMCID]
16.Wang C, Liu X, Lian C, Ke J, Liu J. Triterpenes and aromatic meroterpenoids with antioxidant activity and neuroprotective effects from Ganoderma lucidum. Molecules. 2019; 24(23):4353. [DOI:10.3390/molecules24234353] [PMID] [PMCID]
17.Trushina E, McMurray CT. Oxidative stress and mitochondrial dysfunction in neurodegenerative diseases. Neuroscience. 2007; 145(4):1233-48. [DOI:10.1016/j.neuroscience.2006.10.056] [PMID]
18.Sudheesh NP, Ajith TA, Ramnath V, Janardhanan KK. Therapeutic potential of Ganoderma lucidum (Fr.) P. Karst. against the declined antioxidant status in the mitochondria of post-mitotic tissues of aged mice. Clinical Nutrition. 2010; 29(3):406-12.[DOI:10.1016/j.clnu.2009.12.003] [PMID]
19.Cherian E, Sudheesh NP, Janardhanan KK, Patani G. Free-radical scavenging and mitochondrial antioxidant activities of Reishi-Ganoderma lucidum (curt: Fr) P. Karst and Arogyapacha-Trichopus zeylanicus Gaertn extracts. Journal of Basic and Clinical Physiology and Pharmacology. 2009; 20(4):289-307.[DOI:10.1515/JBCPP.2009.20.4.289] [PMID]
20.Ajith TA, Sudheesh NP, Roshny D, Abishek G, Janardhanan KK. Effect of Ganoderma lucidum on the activities of mitochondrial dehydrogenases and complex I and II of electron transport chain in the brain of aged rats. Experimental Gerontology. 2009; 44(3):219-23. [DOI:10.1016/j.exger.2008.11.002] [PMID]
21.Yu Q, Nie S, Li W, Li J, Xie M. Anti-aging effect of Polysaccharide of Ganoderma atrum on D-Galactose-induced mouse aging model. Shi Pin Ke Xue (Food Science). 2009; 30(17):305-7. [Link]
22.Li WJ, Nie SP, Xie MY, Yu Q, Chen Y, He M. Ganoderma atrum polysaccharide attenuates oxidative stress induced by d-galactose in mouse brain. Life Sciences. 2011; 88(15-16):713-8. [DOI:10.1016/j.lfs.2011.02.010] [PMID]
23.Liu K, Liu YY, Sun F, Ren LQ. Anti-aging effect of recombinant Ganoderma lucidum immunomodulatory protein on aging model mice. Chinese Older Medical Joural. 2018; 38:5539-40. [Link]
24.Lin X, Pan W. Ganoderma lucidum polysaccharide anti-skin senile function research. Journal of Liaoning University of Traditional Chinese Medicine. 2009; 11:174-5. [Link]
25.Dringen R, Gutterer JM, Hirrlinger J. Glutathione metabolism in brain metabolic interaction between astrocytes and neurons in the defense against reactive oxygen species. European Journal of Biochemistry. 2000; 267(16):4912-6. [DOI:10.1046/j.1432-1327.2000.01597.x] [PMID]
26.Xiang L, Jie L. Ganoderma lucidum polysaccharide prevents oxidation and skin aging. Chinese Journal of Tissue Engineering Research. 2013; 17(41):7272-7. [DOI:10.3969/j.issn.2095-4344.2013.41.013]
27.You YH, Lin ZB. Protective effects of Ganoderma lucidum polysaccharides peptide on injury of macrophages induced by reactive oxygen species. Acta Pharmacologica Sinica. 2002; 23(9):787-91. [Link]
28.Li Y, Liang W, Han Y, Zhao W, Wang S, Qin C. Triterpenoids and polysaccharides from Ganoderma lucidum Improve the Histomorphology and function of testes in Middle-Aged male mice by alleviating oxidative stress and cellular apoptosis. Nutrients. 2022; 14(22):4733. [DOI:10.3390/nu14224733] [PMID] [PMCID]
29.Smina TP, Joseph J, Janardhanan KK. Ganoderma lucidum total triterpenes prevent γ-radiation induced oxidative stress in Swiss albino mice in vivo. Redox Report. 2016; 21(6):254-61. [DOI:10.1080/13510002.2015.1126098] [PMID] [PMCID]
30.Hu S, Huang J, Pei S, Ouyang Y, Ding Y, Jiang L ,et al. Ganoderma lucidum polysaccharide inhibits UVB-induced melanogenesis by antagonizing cAMP/PKA and ROS/MAPK signaling pathways. Journal of Cellular Physiology. 2019; 234(5):7330-40. [DOI:10.1002/jcp.27492] [PMID]
31.Zhao Y, Li Q, Wang M, Wang Y, Piao C, Yu H, et al. Structural characterization of polysaccharides after fermentation from Ganoderma lucidum and its antioxidant activity in HepG2 cells induced by H2O2. Food Chemistry: X. 2023;18:100682. [PMID]
32.Lee YH, Kim JH, Song CH, Jang KJ, Kim CH, Kang JS, et al. Ethanol extract of Ganoderma lucidum augments cellular anti-oxidant defense through activation of Nrf2/HO-1. Journal of Pharmacopuncture. 2016; 19(1):59-69. [DOI:10.3831/KPI.2016.19.008] [PMID] [PMCID]
33.Ding W, Zhang X, Yin X, Zhang Q, Wang Y, Guo C, et al. Ganoderma lucidum aqueous extract inducing PHGPx to inhibite membrane lipid hydroperoxides and regulate oxidative stress based on single-cell animal transcriptome. Scientific Reports. 2022; 12(1):3139. [DOI:10.1038/s41598-022-06985-z] [PMID] [PMCID]
34.Guo M, Zhang K, Zhang D, Zhou Y, Liu L, Wu Y, et al. Ganoderma atrum polysaccharide relieves mitochondrial dysfunction to alleviate hydrogen peroxide-induced senescence via activating autophagy. Journal of Future Foods. 2022; 2(3):241-52. [DOI:10.1016/j.jfutfo.2022.06.005]
35.Chiu HF, Fu HY, Lu YY, Han YC, Shen YC, Venkatakrishnan K, et al. Triterpenoids and polysaccharide peptides-enriched Ganoderma lucidum: A randomized, double-blind placebo-controlled crossover study of its antioxidation and hepatoprotective efficacy in healthy volunteers. Pharmaceutical Biology. 2017; 55(1):1041-6. [DOI:10.1080/13880209.2017.1288750] [PMID] [PMCID]
36.Komaki A, Salehi I, Keymoradzadeh A, Taheri Azandaryani M, Golipoor Z. [Effect of long-term exposure to extremely low-frequency electromagnetic fields on β-amyloid deposition and microglia cells in an alzheimer model in rats (Persian)]. Journal of Guilan University of Medical Sciences. 2021; 30(3):218-29. [DOI:10.32598/JGUMS.30.3.1609.2]
37.Sun XZ, Liao Y, Li W, Guo LM. Neuroprotective effects of ganoderma lucidum polysaccharides against oxidative stress-induced neuronal apoptosis. Neural Regeneration Research. 2017; 12(6):953-8. [DOI:10.4103/1673-5374.208590] [PMID] [PMCID]
38.Yoon HM, Jang KJ, Han MS, Jeong JW, Kim GY, Lee JH, et al. Ganoderma lucidum ethanol extract inhibits the inflammatory response by suppressing the NF-κB and toll-like receptor pathways in lipopolysaccharide-stimulated BV2 microglial cells. Experimental and Therapeutic Medicine. 2013; 5(3):957-63. [DOI:10.3892/etm.2013.895] [PMID] [PMCID]
39.Hilliard A, Mendonca P, Soliman KFA. Involvement of NFƙB and MAPK signaling pathways in the preventive effects of Ganoderma lucidum on the inflammation of BV-2 microglial cells induced by LPS. Journal of Neuroimmunology. 2020; 345:577269.[DOI:10.1016/j.jneuroim.2020.577269] [PMID] [PMCID]
40.Huang S, Mao J, Ding K, Zhou Y, Zeng X, Yang W, et al. Polysaccharides from Ganoderma lucidum promote cognitive function and neural progenitor proliferation in mouse model of alzheimer's disease. Stem Cell Reports. 2017; 8(1):84-94.[DOI:10.1016/j.stemcr.2016.12.007] [PMID] [PMCID]
41.Wang A, Xiao C, Zheng J, Ye C, Dai Z, Wu Q, et al. Terpenoids of Ganoderma lucidum reverse cognitive impairment through attenuating neurodegeneration via suppression of PI3K/AKT/mTOR expression in vivo model. Journal of Functional Foods. 2020; 73:104142. [DOI:10.1016/j.jff.2020.104142]
42.Ćilerdžić JL, Sofrenić IV, Tešević VV, Brčeski ID, Duletić-Laušević SN, Vukojević JB, et al. Neuroprotective potential and chemical profile of alternatively cultivated Ganoderma lucidum basidiocarps. Chemistry & Biodiversity. 2018; 15(5):e1800036. [DOI:10.1002/cbdv.201800036] [PMID]
43.Liu X, Yang L, Li G, Jiang Y, Zhang G, Ling J. A novel promising neuroprotective agent: Ganoderma lucidum polysaccharide. International Journal of Biological Macromolecules. 2023; 229:168-80. [DOI:10.1016/j.ijbiomac.2022.12.276] [PMID]
44.Kusaka J, Koga H, Hagiwara S, Hasegawa A, Kudo K, Noguchi T. Age-dependent responses to renal ischemia-reperfusion injury. The Journal of Surgical Research. 2012; 172(1):153-8. [DOI:10.1016/j.jss.2010.08.034] [PMID]
45.Muroya Y, He X, Fan L, Wang S, Xu R, Fan F, et al. Enhanced renal ischemia-reperfusion injury in aging and diabetes. American Journal of Physiology. 2018; 315(6):F1843-54. [DOI:10.1152/ajprenal.00184.2018] [PMID] [PMCID]
46.Zhong D, Wang H, Liu M, Li X, Huang M, Zhou H, et al. Ganoderma lucidum polysaccharide peptide prevents renal ischemia reperfusion injury via counteracting oxidative stress. Scientific Reports. 2015; 5:16910. [DOI:10.1038/srep16910] [PMID] [PMCID]
47.Gurovic MSV, Viceconte FR, Pereyra MT, Bidegain MA, Cubitto MA. DNA damaging potential of Ganoderma lucidum extracts. Journal of Ethnopharmacology. 2018; 217:83-8. [DOI:10.1016/j.jep.2018.02.005] [PMID]
48.Cuong VT, Chen W, Shi J, Zhang M, Yang H, Wang N, et al. The anti-oxidation and anti-aging effects of Ganoderma lucidum in Caenorhabditis elegans. Experimental Gerontology. 2019; 117:99-105. [DOI:10.1016/j.exger.2018.11.016] [PMID]
49.Weng Y, Xiang L, Matsuura A, Zhang Y, Huang Q, Qi J. Ganodermasides A and B, two novel anti-aging ergosterols from spores of a medicinal mushroom Ganoderma lucidum on yeast via UTH1 gene. Bioorganic & Medicinal Chemistry. 2010; 18(3):999-1002. [DOI:10.1016/j.bmc.2009.12.070] [PMID]
50.Weng Y, Lu J, Xiang L, Matsuura A, Zhang Y, Huang Q, et al. Ganodermasides C and D, two new anti-aging ergosterols from spores of the medicinal mushroom Ganoderma lucidum. Bioscience, Biotechnology, and Biochemistry. 2011; 75(4):800-3. [DOI:10.1271/bbb.100918] [PMID]
متن کامل: (4330 مشاهده)
مقدمه
قارچ چتری (کلاهکدار) ریشی (که به تسامح و البته غیردقیق در زبان فارسی گانودرما نامیده میشود) با نام علمی گانودرما لوسیدوم و نامهای انگلیسی ریشی (برخاسته از ژاپن) یا لینگژی (برخاسته از چین)، یک گونه متعلق به رده آگاریکومیستها و راسته قارچهای حفرهدار (متخلخل) و از خانواده گانودرماتاسه است. تحقیقات در حوزه شیمی غذایی تا کنون وجود حدوداً 400 ترکیب زیستفعال از گروههای پلیفنولها، پلیساکاریدها، استروئیدها، تریترپنوئیدها، نوکلئوتیدها، اسیدهای آمینه، مواد معدنی، عناصر کمیاب و انواع ویتامینها را در اندام میوهدهی، میسلیوم و اسپورهای قارچ ریشی به اثبات رسانده است [1]. مکملیاری با قارچ گانودرما لوسیدوم در بیشتر موارد به کاهش قند خون ناشتا، هموگلوبین گلیکوزیله و کاهش مقاومت به انسولین در دیابت ملیتوس میانجامد که ناشی از ترکیبات مؤثره این قارچ شامل پلیساکاریدهای استخراجشده، نوع پروتئینها و تریترپنوئیدهای موجود در آن است. همچنین به نظر میرسد خواص آنتیاکسیدانی و ضدالتهابی آن نیز بتواند از عوارض دیابت بکاهد [2]. برخی از این ترکیبات زیستفعال از جمله پلیساکاریدها، تریترپنها و پپتیدها دارای عملکرد ضدپیری هستند. عصاره اتانولی و عصاره آبی میوه قارچ، عصاره میسلیوم و عصاره اسپورهای (گانودرماسیتهای A ،B ،C و D) قارچ ریشی بیشترین محل توجه محققین برای بررسی عملکردهای ضدپیری مرتبط با قارچ ریشی بودهاند [3].
افزایش سن تقریباً همیشه با کاهش عملکرد فیزیولوژیکی بدن و بهدنبال آن، افزایش برخی اختلالات همراه است. در میان تئوریهای متعدد مرتبط با پیری، نظریههای استرس اکسیداتیو و تجمع رادیکالهای آزاد بیش از همه برجسته هستند. سیستم آنتیاکسیدانی بهعنوان تابعی از سن عمل میکند و با افزایش سن ضعیفتر میشود. ضعف این سیستم موجب ایجاد اختلال در تعادل بین تولید و حذف گونههای فعال اکسیژن و سایر رادیکالهای آزاد میشود که درنهایت به آسیب سلولی اکسیداتیو منجر میشود [4]. اندامها و بافتهایی مانند مغز، قلب و ماهیچههای اسکلتی در مقایسه با سایر اندامها بیشتر مستعد پیری هستند [5]. انقباض قلب به فسفوریلاسیون اکسیداتیو و زنجیره انتقال الکترون میتوکندری وابسته است، بنابراین تجمع رادیکالهای آزاد و اختلال عملکرد میتوکندری، به تغییرات ساختاری و عملکردی در ماهیچه قلب و درنتیجه به پیری قلب منجر میشود [6]. در مغز نیز تجمع رادیکالهای آزاد و تضعیف فعالیت آنزیم زنجیره تنفسی باعث آسیب به میتوکندریهای مغزی شده و باعث شروع برخی بیماریهای تخریبکننده عصبی مانند پارکینسون، آلزایمر و بیماری هانتینگتون میشود. علاوه بر استرس اکسیداتیو، پیری همچنین با ایجاد نقصهای ساختاری و عملکردی در سیستم ایمنی ارتباط نزدیکی دارد. اختلال عملکرد ایمنی میتواند علت افزایش حساسیت جمعیت سالمند به عفونتهای باکتریایی و ویروسی باشد که معمولاً در افراد مسن دیده میشود [7].
اگرچه قارچ ریشی هزاران سال است که بهعنوان یک اکسیر مورد استفاده قرار میگیرد، اما ادعای اثرات ضدپیری و افزایش طول عمر مرتبط با قارچ ریشی تنها نوک کوه یخ است. بنابراین اینکه آیا قارچ ریشی واقعاً طی مکانیسمهای مشخصی اثرات ضدپیری دارد یا نه، سؤالی است که تحقیقات متعدد تلاش کردهاند که به آن پاسخ روشنی بدهند. از سوی دیگر، تحقیقات متعدد قبلی نشان از وجود و تأیید چندین گونه از قارچ جنس گانودرما و از جمله ریشی (گانودرما لوسیدوم) در محیط طبیعی ایران دارد [8, 9]. علیرغم مطالعات متعدد بر روی جنبههای مختلف دارویی این قارچ در کشور ما [10]، در زمینه اثرات ضدپیری این قارچ بهویژه انواع بومی آن هنوز مطالعه تحقیقاتی آزمایشگاهی، حیوانی یا بالینی به زبان فارسی منتشر نشده است. همچنانکه مطالعات قبلی نویسندگان این مقاله نشان داده است، اثرات آنتیاکسیدانی قارچهای دارویی بومی ایران در مقایسه با انواع تجاری آن بسیار قابلتوجه است [11]. بنابراین قارچهای بومی ایرانی جنس گانودرما و بهخصوص قارچ ریشی (گانودرما لوسیدوم) میتواند در زمینه اثرات ضدپیری آن مورد مطالعه قرار گیرد. از اینرو هدف این مقاله مروری آن است که از یکسو زمینه را برای روشن کردن کامل مکانیسمهای بالقوه قارچ ریشی در زمینه اثرات ضدپیری آن به منظور ترویج کاربرد بالینی آن بهعنوان یک داروی طبیعی ضدپیری فراهم کند. از سوی دیگر، مقاله مروری حاضر ممکن است در زمینه گشودن پنجرههای جدیدی در زمینه تشویق به تحقیقات آزمایشگاهی، حیوانی یا بالینی بر روی اثرات ضدپیری قارچ ریشی بهویژه انواع بومی آن برای پژوهشگران داخل کشور مفید باشد.
روشها
در نگارش این مقاله مروری، اثرات ضدپیری قارچ ریشی و مکانیسم این اثرات بررسی شد. جستوجوی مقالات چاپشده در محدوده زمانی سال 1989 تا 2023 با استفاده از کلیدواژههای قارچ ریشی، گانودرما لوسیدوم، خواص ضدپیری، خواص آنتیاکسیدانی و رادیکالهای آزاد به هر دو زبان فارسی و انگلیسی در پایگاههای اطلاعاتی پابمد، اسکوپوس، گوگلاسکولار، پایگاه اطلاعات علمی جهاد دانشگاهی و مگایران بهصورت مجزا و ترکیبی انجام شد. در میان مقالات یافتشده، تلاش شد تا بیشتر آنهایی مورد استناد قرار گیرند که کار تحقیقاتی کرده باشند و نه اینکه خود مقاله مروری باشند. همچنین تلاش شد تا از مطالعات مرتبط داخل کشور تا جایی که به موضوع مرتبط باشد، استفاده شود.
یافتهها
اثر ضدپیری قارچ ریشی با بهبود عملکرد سیستم ایمنی
کاملاً روشن شده است که پیری یکی از مهمترین ریسکفاکتورهای ضعف عملکرد سیستم ایمنی است. با افزایش سن، عملکرد لنفوسیتهای T و توانایی تولید سایتوکاینها کم میشود و تیموس، تحلیل میرود و همین مسئله علت اصلی کمکار بودن سیستم ایمنی در سالمندان است. با افزایش سن همچنین توانایی مغز استخوان برای تنظیم عملکرد لنفوسیتهای B و توانایی این لنفوسیتها برای ترشح ایمنوگلوبولین نیز کم میشود. اختلال عملکرد سیستم ایمنی به مستعدتر شدن جمعیت مسن برای ابتلا به عفونتهای باکتریایی و ویروسی میانجامد؛ این مسئله در بین سالمندان بهوفور دیده میشود [3]. در تحقیقاتی که با هدف بررسی اثر قارچ ریشی بر بهبود عملکرد سیستم ایمنی همزمان با پیری انجام میشود، از روش سنجش سلول تشکیلدهنده پلاک استفاده میشود. سنجش سلول تشکیلدهنده پلاک با هدف بررسی توانایی یک فرد برای ایجاد یک پاسخ ایمنی هومورال (پاسخ آنتیبادی) به یک آنتیژن خاص صورت میگیرد. این نوع سنجش یک روش اختصاصی برای بررسی اثر شیوههای درمانی بر عملکرد ایمنی همورال جانوران است. یک مطالعه قدیمی نشان داد تزریق سه نوع پلیساکارید قارچ ریشی (BN3A، BN3B و BN3C) به داخل صفاق موشهای مسن 14ماهه (که سلول تشکیلدهنده پلاک در آنها تحت تأثیر دریافت گلبول قرمز گوسفند القا شده بود) موجب بازگشت به حالت طبیعی شد (یعنی شبیه به موشهای 3ماهه غیرتیمارشده شد). این سه نوع پلیساکارید با تحریک تولید کانکاناوالینA و اینترلوکین-2 در موشهای معمولی مسن 14ماهه در محیط آزمایشگاه، تکثیر لنفوسیتها را بهصورت معنیداری زیاد کردند [12]. در تحقیق دیگری روشن شد که واکنش انواع لنفوسیتها در محیط آزمایشگاه به آلوآنتیژنها (تشکیلشده از آنتیژنهای مختلف)، تکثیر خودکار و تولید اینترلوکین-2 در سلولهای طحال موشهای 24ماهه بهصورت معنیداری کمتر از موشهای 3ماهه بود. پلیساکاریدهای قارچ ریشی (در غلظتهای 50، 100 و 200 میکروگرم بر میلیلیتر) توانستند مقدار این عوامل ایمنی سلولی را در موشهای 24ماهه بهطور معنیداری به سطح طبیعی برگردانند. فعالیت DNA پلیمراز آلفا در سلولهای طحال موشهای 24ماهه، 35/6 تا 43/3 درصد و کمتر از موشهای معمولی 3ماهه بود. تزریق درونصفاقی پلیساکاریدهای قارچ ریشی به سلولهای طحال موشهای 24ماهه مسن (25 و 50 میلیگرم برکیلوگرم، یکبار در روز، بهمدت 4روز) توانست فعالیت DNA پلیمراز آلفا را زیاد کند (به ترتیب 44/0 درصد و 58/4 درصد) و آن را به وضعیت طبیعی برساند [13]. در تحقیق دیگری این نکته بررسی شد که آیا پلیساکارید قارچ گانودرما آتروم (گونه دیگری از جنس گانودرما) میتواند تنش اکسیداسیون دیگالاکتوز و اختلال عملکرد سیستم ایمنی را در موشهای معمولی در حال پیر شدن، تضعیف کند. یافتههای این تحقیق نشان داد این پلیساکارید در غلظت 50، 100 و 150 میلیگرم بر کیلوگرم توانست موجب کاهش معنیدار پراکسیداسیون چربی در کبد، مغز و طحال و افزایش قابلتوجه فعالیت آنزیمهای سوپراکسید دیسموتاز، کاتالاز و گلوتاتیون پراکسیداز شود (در مقایسه با گروه آسیبدیده در اثر دیگالاکتوز). بالارفتن محتوای گلوتاتیون و پایین آمدن مقدار گلوتاتیون دیسولفید نیز در جانوران تیمارشده با این پلیساکارید مشاهده شد. بهعلاوه، تیمار با PSG-1، تکثیر لنفوسیتهای اولیه و تمایزنیافته، تکثیر لنفوسیتهای T و B و تولید اینترلوکین-2 را زیاد کرد. درمجموع، PSG-1 میتواند عامل بالقوه جدیدی برای ارتقای سلامتی و بهبود آسیبهای دوران پیری باشد و حداقل تا حدودی این کار را از طریق اصلاح مجموعه اکسیداسیون ـ احیا و بهبود عملکرد سیستم ایمنی انجام میدهد [14].
علاوه بر بررسی قارچ ریشی بهتنهایی، عصاره آن همراه با عصارههای برخی گیاهان دیگر نیز مورد بررسی قرار گرفته است. در طی یک تحقیق، اثر ضدپیری عصاره قارچ ریشی همراه با عصاره گیاه ریشه طلایی در موشهای صحرایی که پیری در آنها با دی-گالاکتوز القا شده بود، بررسی شد. ترکیب GRCP در دُزهای 25 تا 100 میلیگرم بر کیلوگرم وزن بدن بهصورت تزریق درونمعدوی تجویز شد. نتایج حاکی از بهبود کارکرد شناختی، بهبود واکنش به استرس اکسیداتیو، افزایش فعالیت ایمنی و کاهش التهاب در موشهای صحرایی پیر بود [15].
همچنین اثر قارچ ریشی بر عملکرد ایمنی سلولی انسانی نیز بررسی شده است. تجویز خوراکی پودر قارچ ریشی (1/5 گرم، سه بار در روز، بهمدت 30 روز) فعالیت اینترلوکین-2، اینترفرون گاما و سلولهای کشنده طبیعی را در 30 داوطلب پیر سالم افزایش داد. نتایج مطالعه مذکور نشان داد 20 روز پس از مصرف پودر قارچ ریشی (روز بیستم) مقدار فعالیت این عناصر به اوج خود رسید (جدول شماره 1).
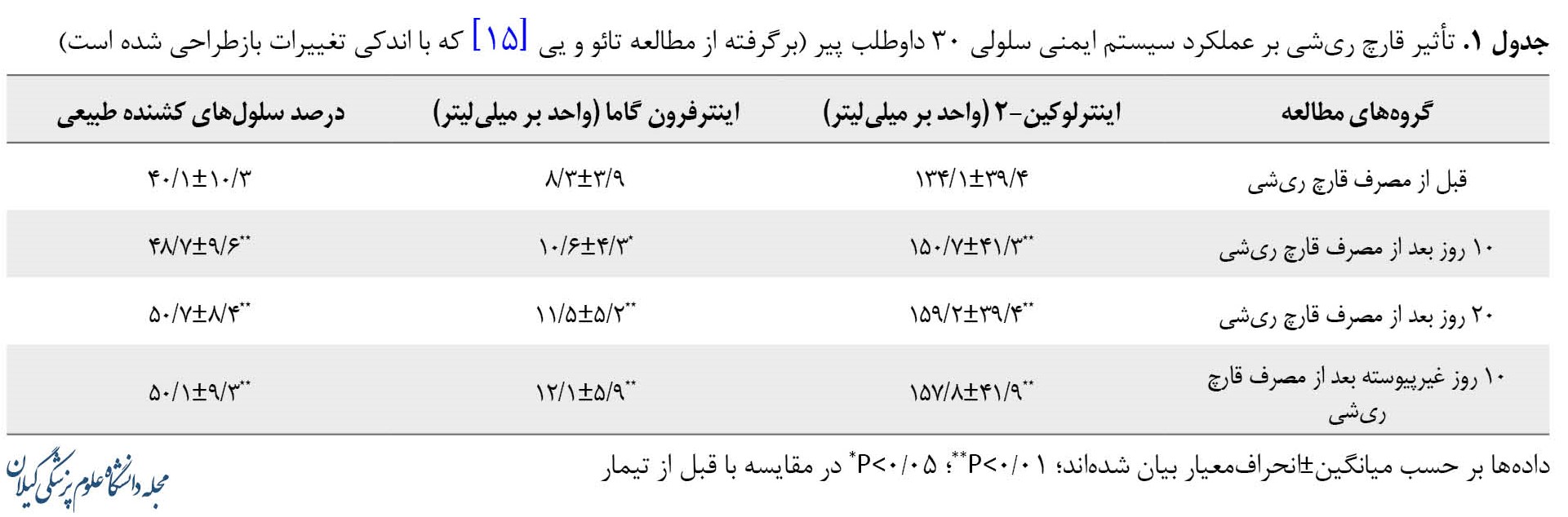
مطالعه مذکور نتیجه گرفته است که قارچ ریشی قادر است عملکرد سیستم ایمنی در افراد پیر را بهبود بخشد [15].
اثر ضدپیری قارچ ریشی با مهار تنش اکسیداتیو
مشخص شده است که تنش اکسیداتیو و تجمع گونههای فعال اکسیژن و سایر رادیکالهای آزاد، یکی از عوامل مهم و کلیدی در تخریب DNA سلولی، پروتئین، لیپیدها و درنهایت تسریع فرایند پیری است [16]. با افزایش سن، عملکرد آنتیاکسیدانی بدن رو به زوال میرود، تعادل بین تولید و حذف رادیکالهای آزاد به هم میریزد و نهایتاً سلولها بهخاطر اکسیداسیون آسیب میبینند. تجمع رادیکالهای آزاد و تضعیف فعالیت مجموعههای آنزیمی زنجیره تنفسی مغز موجب آسیب دیدن میتوکندری در سلولهای مغزی میشود [17]. اختلال عملکرد این سلولها میتواند به شروع بعضی بیماریهای تحلیلرونده اعصاب مانند پارکینسون، آلزایمر، هانتینگتون و نظایر آنها بیانجامد. واکنشهای اکسیداسیون و رادیکالهای آزاد میتوانند در گذر سن به لیپیدها، غشاهای سلولی، پروتئینها و آنزیمها، اسیدهای نوکلئیک و کروموزومها آسیب بزنند. پراکسیداسیون لیپیدها و تولید بیش از حد رادیکالهای آزاد میتواند به آسیب سلولی، بافتی و اندامی بیانجامد. هرچند پیر شدن بر تمام انواع سلولهای هستهدار تأثیر میگذارد، اما بافتهای فاقد تقسیم سلولی یا دارای تقسیم سلولی اندک، از نظر تئوری محلهای مستعدتری برای تجمع آسیبهای ناشی از رادیکالهای آزاد هستند. بر همین اساس، بسیاری از تغییرات قابلتوجه مرتبط با پیری بهدلیل تنش اکسیداتیو در بافتهای پسامیتوزی مانند مغز، قلب و ماهیچه اسکلتی ظاهر میشوند [5].
تحقیقات روشن ساخته است که عصارههای قارچ ریشی میتوانند عمدتاً بهخاطر ماهیت آنتیاکسیدانی خود از قلب، کبد و مغز موشهای معمولی در برابر پیری محافظت کنند. تصویر شماره 1 یک تصویر شماتیک از اثرات عصاره قارچ ریشی بر این سه اندام حیاتی بدن در ارتباط با پیشگیری از پیری را نشان میدهد.
قارچ چتری (کلاهکدار) ریشی (که به تسامح و البته غیردقیق در زبان فارسی گانودرما نامیده میشود) با نام علمی گانودرما لوسیدوم و نامهای انگلیسی ریشی (برخاسته از ژاپن) یا لینگژی (برخاسته از چین)، یک گونه متعلق به رده آگاریکومیستها و راسته قارچهای حفرهدار (متخلخل) و از خانواده گانودرماتاسه است. تحقیقات در حوزه شیمی غذایی تا کنون وجود حدوداً 400 ترکیب زیستفعال از گروههای پلیفنولها، پلیساکاریدها، استروئیدها، تریترپنوئیدها، نوکلئوتیدها، اسیدهای آمینه، مواد معدنی، عناصر کمیاب و انواع ویتامینها را در اندام میوهدهی، میسلیوم و اسپورهای قارچ ریشی به اثبات رسانده است [1]. مکملیاری با قارچ گانودرما لوسیدوم در بیشتر موارد به کاهش قند خون ناشتا، هموگلوبین گلیکوزیله و کاهش مقاومت به انسولین در دیابت ملیتوس میانجامد که ناشی از ترکیبات مؤثره این قارچ شامل پلیساکاریدهای استخراجشده، نوع پروتئینها و تریترپنوئیدهای موجود در آن است. همچنین به نظر میرسد خواص آنتیاکسیدانی و ضدالتهابی آن نیز بتواند از عوارض دیابت بکاهد [2]. برخی از این ترکیبات زیستفعال از جمله پلیساکاریدها، تریترپنها و پپتیدها دارای عملکرد ضدپیری هستند. عصاره اتانولی و عصاره آبی میوه قارچ، عصاره میسلیوم و عصاره اسپورهای (گانودرماسیتهای A ،B ،C و D) قارچ ریشی بیشترین محل توجه محققین برای بررسی عملکردهای ضدپیری مرتبط با قارچ ریشی بودهاند [3].
افزایش سن تقریباً همیشه با کاهش عملکرد فیزیولوژیکی بدن و بهدنبال آن، افزایش برخی اختلالات همراه است. در میان تئوریهای متعدد مرتبط با پیری، نظریههای استرس اکسیداتیو و تجمع رادیکالهای آزاد بیش از همه برجسته هستند. سیستم آنتیاکسیدانی بهعنوان تابعی از سن عمل میکند و با افزایش سن ضعیفتر میشود. ضعف این سیستم موجب ایجاد اختلال در تعادل بین تولید و حذف گونههای فعال اکسیژن و سایر رادیکالهای آزاد میشود که درنهایت به آسیب سلولی اکسیداتیو منجر میشود [4]. اندامها و بافتهایی مانند مغز، قلب و ماهیچههای اسکلتی در مقایسه با سایر اندامها بیشتر مستعد پیری هستند [5]. انقباض قلب به فسفوریلاسیون اکسیداتیو و زنجیره انتقال الکترون میتوکندری وابسته است، بنابراین تجمع رادیکالهای آزاد و اختلال عملکرد میتوکندری، به تغییرات ساختاری و عملکردی در ماهیچه قلب و درنتیجه به پیری قلب منجر میشود [6]. در مغز نیز تجمع رادیکالهای آزاد و تضعیف فعالیت آنزیم زنجیره تنفسی باعث آسیب به میتوکندریهای مغزی شده و باعث شروع برخی بیماریهای تخریبکننده عصبی مانند پارکینسون، آلزایمر و بیماری هانتینگتون میشود. علاوه بر استرس اکسیداتیو، پیری همچنین با ایجاد نقصهای ساختاری و عملکردی در سیستم ایمنی ارتباط نزدیکی دارد. اختلال عملکرد ایمنی میتواند علت افزایش حساسیت جمعیت سالمند به عفونتهای باکتریایی و ویروسی باشد که معمولاً در افراد مسن دیده میشود [7].
اگرچه قارچ ریشی هزاران سال است که بهعنوان یک اکسیر مورد استفاده قرار میگیرد، اما ادعای اثرات ضدپیری و افزایش طول عمر مرتبط با قارچ ریشی تنها نوک کوه یخ است. بنابراین اینکه آیا قارچ ریشی واقعاً طی مکانیسمهای مشخصی اثرات ضدپیری دارد یا نه، سؤالی است که تحقیقات متعدد تلاش کردهاند که به آن پاسخ روشنی بدهند. از سوی دیگر، تحقیقات متعدد قبلی نشان از وجود و تأیید چندین گونه از قارچ جنس گانودرما و از جمله ریشی (گانودرما لوسیدوم) در محیط طبیعی ایران دارد [8, 9]. علیرغم مطالعات متعدد بر روی جنبههای مختلف دارویی این قارچ در کشور ما [10]، در زمینه اثرات ضدپیری این قارچ بهویژه انواع بومی آن هنوز مطالعه تحقیقاتی آزمایشگاهی، حیوانی یا بالینی به زبان فارسی منتشر نشده است. همچنانکه مطالعات قبلی نویسندگان این مقاله نشان داده است، اثرات آنتیاکسیدانی قارچهای دارویی بومی ایران در مقایسه با انواع تجاری آن بسیار قابلتوجه است [11]. بنابراین قارچهای بومی ایرانی جنس گانودرما و بهخصوص قارچ ریشی (گانودرما لوسیدوم) میتواند در زمینه اثرات ضدپیری آن مورد مطالعه قرار گیرد. از اینرو هدف این مقاله مروری آن است که از یکسو زمینه را برای روشن کردن کامل مکانیسمهای بالقوه قارچ ریشی در زمینه اثرات ضدپیری آن به منظور ترویج کاربرد بالینی آن بهعنوان یک داروی طبیعی ضدپیری فراهم کند. از سوی دیگر، مقاله مروری حاضر ممکن است در زمینه گشودن پنجرههای جدیدی در زمینه تشویق به تحقیقات آزمایشگاهی، حیوانی یا بالینی بر روی اثرات ضدپیری قارچ ریشی بهویژه انواع بومی آن برای پژوهشگران داخل کشور مفید باشد.
روشها
در نگارش این مقاله مروری، اثرات ضدپیری قارچ ریشی و مکانیسم این اثرات بررسی شد. جستوجوی مقالات چاپشده در محدوده زمانی سال 1989 تا 2023 با استفاده از کلیدواژههای قارچ ریشی، گانودرما لوسیدوم، خواص ضدپیری، خواص آنتیاکسیدانی و رادیکالهای آزاد به هر دو زبان فارسی و انگلیسی در پایگاههای اطلاعاتی پابمد، اسکوپوس، گوگلاسکولار، پایگاه اطلاعات علمی جهاد دانشگاهی و مگایران بهصورت مجزا و ترکیبی انجام شد. در میان مقالات یافتشده، تلاش شد تا بیشتر آنهایی مورد استناد قرار گیرند که کار تحقیقاتی کرده باشند و نه اینکه خود مقاله مروری باشند. همچنین تلاش شد تا از مطالعات مرتبط داخل کشور تا جایی که به موضوع مرتبط باشد، استفاده شود.
یافتهها
اثر ضدپیری قارچ ریشی با بهبود عملکرد سیستم ایمنی
کاملاً روشن شده است که پیری یکی از مهمترین ریسکفاکتورهای ضعف عملکرد سیستم ایمنی است. با افزایش سن، عملکرد لنفوسیتهای T و توانایی تولید سایتوکاینها کم میشود و تیموس، تحلیل میرود و همین مسئله علت اصلی کمکار بودن سیستم ایمنی در سالمندان است. با افزایش سن همچنین توانایی مغز استخوان برای تنظیم عملکرد لنفوسیتهای B و توانایی این لنفوسیتها برای ترشح ایمنوگلوبولین نیز کم میشود. اختلال عملکرد سیستم ایمنی به مستعدتر شدن جمعیت مسن برای ابتلا به عفونتهای باکتریایی و ویروسی میانجامد؛ این مسئله در بین سالمندان بهوفور دیده میشود [3]. در تحقیقاتی که با هدف بررسی اثر قارچ ریشی بر بهبود عملکرد سیستم ایمنی همزمان با پیری انجام میشود، از روش سنجش سلول تشکیلدهنده پلاک استفاده میشود. سنجش سلول تشکیلدهنده پلاک با هدف بررسی توانایی یک فرد برای ایجاد یک پاسخ ایمنی هومورال (پاسخ آنتیبادی) به یک آنتیژن خاص صورت میگیرد. این نوع سنجش یک روش اختصاصی برای بررسی اثر شیوههای درمانی بر عملکرد ایمنی همورال جانوران است. یک مطالعه قدیمی نشان داد تزریق سه نوع پلیساکارید قارچ ریشی (BN3A، BN3B و BN3C) به داخل صفاق موشهای مسن 14ماهه (که سلول تشکیلدهنده پلاک در آنها تحت تأثیر دریافت گلبول قرمز گوسفند القا شده بود) موجب بازگشت به حالت طبیعی شد (یعنی شبیه به موشهای 3ماهه غیرتیمارشده شد). این سه نوع پلیساکارید با تحریک تولید کانکاناوالینA و اینترلوکین-2 در موشهای معمولی مسن 14ماهه در محیط آزمایشگاه، تکثیر لنفوسیتها را بهصورت معنیداری زیاد کردند [12]. در تحقیق دیگری روشن شد که واکنش انواع لنفوسیتها در محیط آزمایشگاه به آلوآنتیژنها (تشکیلشده از آنتیژنهای مختلف)، تکثیر خودکار و تولید اینترلوکین-2 در سلولهای طحال موشهای 24ماهه بهصورت معنیداری کمتر از موشهای 3ماهه بود. پلیساکاریدهای قارچ ریشی (در غلظتهای 50، 100 و 200 میکروگرم بر میلیلیتر) توانستند مقدار این عوامل ایمنی سلولی را در موشهای 24ماهه بهطور معنیداری به سطح طبیعی برگردانند. فعالیت DNA پلیمراز آلفا در سلولهای طحال موشهای 24ماهه، 35/6 تا 43/3 درصد و کمتر از موشهای معمولی 3ماهه بود. تزریق درونصفاقی پلیساکاریدهای قارچ ریشی به سلولهای طحال موشهای 24ماهه مسن (25 و 50 میلیگرم برکیلوگرم، یکبار در روز، بهمدت 4روز) توانست فعالیت DNA پلیمراز آلفا را زیاد کند (به ترتیب 44/0 درصد و 58/4 درصد) و آن را به وضعیت طبیعی برساند [13]. در تحقیق دیگری این نکته بررسی شد که آیا پلیساکارید قارچ گانودرما آتروم (گونه دیگری از جنس گانودرما) میتواند تنش اکسیداسیون دیگالاکتوز و اختلال عملکرد سیستم ایمنی را در موشهای معمولی در حال پیر شدن، تضعیف کند. یافتههای این تحقیق نشان داد این پلیساکارید در غلظت 50، 100 و 150 میلیگرم بر کیلوگرم توانست موجب کاهش معنیدار پراکسیداسیون چربی در کبد، مغز و طحال و افزایش قابلتوجه فعالیت آنزیمهای سوپراکسید دیسموتاز، کاتالاز و گلوتاتیون پراکسیداز شود (در مقایسه با گروه آسیبدیده در اثر دیگالاکتوز). بالارفتن محتوای گلوتاتیون و پایین آمدن مقدار گلوتاتیون دیسولفید نیز در جانوران تیمارشده با این پلیساکارید مشاهده شد. بهعلاوه، تیمار با PSG-1، تکثیر لنفوسیتهای اولیه و تمایزنیافته، تکثیر لنفوسیتهای T و B و تولید اینترلوکین-2 را زیاد کرد. درمجموع، PSG-1 میتواند عامل بالقوه جدیدی برای ارتقای سلامتی و بهبود آسیبهای دوران پیری باشد و حداقل تا حدودی این کار را از طریق اصلاح مجموعه اکسیداسیون ـ احیا و بهبود عملکرد سیستم ایمنی انجام میدهد [14].
علاوه بر بررسی قارچ ریشی بهتنهایی، عصاره آن همراه با عصارههای برخی گیاهان دیگر نیز مورد بررسی قرار گرفته است. در طی یک تحقیق، اثر ضدپیری عصاره قارچ ریشی همراه با عصاره گیاه ریشه طلایی در موشهای صحرایی که پیری در آنها با دی-گالاکتوز القا شده بود، بررسی شد. ترکیب GRCP در دُزهای 25 تا 100 میلیگرم بر کیلوگرم وزن بدن بهصورت تزریق درونمعدوی تجویز شد. نتایج حاکی از بهبود کارکرد شناختی، بهبود واکنش به استرس اکسیداتیو، افزایش فعالیت ایمنی و کاهش التهاب در موشهای صحرایی پیر بود [15].
همچنین اثر قارچ ریشی بر عملکرد ایمنی سلولی انسانی نیز بررسی شده است. تجویز خوراکی پودر قارچ ریشی (1/5 گرم، سه بار در روز، بهمدت 30 روز) فعالیت اینترلوکین-2، اینترفرون گاما و سلولهای کشنده طبیعی را در 30 داوطلب پیر سالم افزایش داد. نتایج مطالعه مذکور نشان داد 20 روز پس از مصرف پودر قارچ ریشی (روز بیستم) مقدار فعالیت این عناصر به اوج خود رسید (جدول شماره 1).

مطالعه مذکور نتیجه گرفته است که قارچ ریشی قادر است عملکرد سیستم ایمنی در افراد پیر را بهبود بخشد [15].
اثر ضدپیری قارچ ریشی با مهار تنش اکسیداتیو
مشخص شده است که تنش اکسیداتیو و تجمع گونههای فعال اکسیژن و سایر رادیکالهای آزاد، یکی از عوامل مهم و کلیدی در تخریب DNA سلولی، پروتئین، لیپیدها و درنهایت تسریع فرایند پیری است [16]. با افزایش سن، عملکرد آنتیاکسیدانی بدن رو به زوال میرود، تعادل بین تولید و حذف رادیکالهای آزاد به هم میریزد و نهایتاً سلولها بهخاطر اکسیداسیون آسیب میبینند. تجمع رادیکالهای آزاد و تضعیف فعالیت مجموعههای آنزیمی زنجیره تنفسی مغز موجب آسیب دیدن میتوکندری در سلولهای مغزی میشود [17]. اختلال عملکرد این سلولها میتواند به شروع بعضی بیماریهای تحلیلرونده اعصاب مانند پارکینسون، آلزایمر، هانتینگتون و نظایر آنها بیانجامد. واکنشهای اکسیداسیون و رادیکالهای آزاد میتوانند در گذر سن به لیپیدها، غشاهای سلولی، پروتئینها و آنزیمها، اسیدهای نوکلئیک و کروموزومها آسیب بزنند. پراکسیداسیون لیپیدها و تولید بیش از حد رادیکالهای آزاد میتواند به آسیب سلولی، بافتی و اندامی بیانجامد. هرچند پیر شدن بر تمام انواع سلولهای هستهدار تأثیر میگذارد، اما بافتهای فاقد تقسیم سلولی یا دارای تقسیم سلولی اندک، از نظر تئوری محلهای مستعدتری برای تجمع آسیبهای ناشی از رادیکالهای آزاد هستند. بر همین اساس، بسیاری از تغییرات قابلتوجه مرتبط با پیری بهدلیل تنش اکسیداتیو در بافتهای پسامیتوزی مانند مغز، قلب و ماهیچه اسکلتی ظاهر میشوند [5].
تحقیقات روشن ساخته است که عصارههای قارچ ریشی میتوانند عمدتاً بهخاطر ماهیت آنتیاکسیدانی خود از قلب، کبد و مغز موشهای معمولی در برابر پیری محافظت کنند. تصویر شماره 1 یک تصویر شماتیک از اثرات عصاره قارچ ریشی بر این سه اندام حیاتی بدن در ارتباط با پیشگیری از پیری را نشان میدهد.
پژوهشها حاکی از آن هستند که تجویز قارچ ریشی میتواند اُفت وضعیت آنتیاکسیدانی ناشی از پیر شدن را بهبود بخشد؛ مسئلهای که تا حدودی به خاصیت این قارچ برای پاکسازی رادیکالهای آزاد برمیگردد. در همین ارتباط، تجویز عصارههای قارچ ریشی موجب بالارفتن معنیدار (p<0/05) مقادیر گلوتاتیون احیاشده و افزایش فعالیت سوپراکسید دیسموتاز منگنزدار، گلوتاتیون پراکسیداز و گلوتاتیون S ترانسفراز شد و کاهش معنیدار (p<0/05) پراکسیداسیون لیپیدی، محصولات اکسیداسیون پیشرفته پروتئینها و گونههای فعال اکسیژن را به همراه داشت [18]. در تحقیقی دیگر، اثر عصاره قارچ ریشی در به دام انداختن رادیکالهای آزاد و مهار اکسیداسیون در میتوکندریهای کبد موشهای معمولی 15ماهه مورد مطالعه قرار گرفت. در این مطالعه، عصاره قارچ ریشی در دُزهای 50 و 250 میلیگرم بر کیلوگرم وزن بدن بهصورت خوراکی و بهمدت 15روز به موشهای پیر BALB/c تجویز شد. فعالیت آنزیمهای سوپراکسید دیسموتاز و کاتالاز، سطح گلوتاتیون احیاشده و پراکسیداسیون لیپیدها براساس میزان تولید متان دیکربوکسیلیک آلدئید ارزیابی شدند. گروه موشهای معمولی جوان و پیر بهعنوان شاهد در نظر گرفته شدند. فعالیت آنتیاکسیدانی میتوکندریهای کبد در موشهای پیر تیمارشده با عصارههای قارچ ریشی، بیشتر از موشهای پیر گروه شاهد بود. گلوتاتیون احیاشده، سوپراکسید دیسموتاز و کاتالاز در گروه تیمارشده با عصارههای قارچ ریشی، بیشتر از گروه شاهد بود. عصارههای قارچ ریشی خاصیت قابلتوجهی در پاکسازی رادیکالهای 2،2-دیفنیل-1-پیکریلهیدرازین و رادیکالهای ABTS و قدرت زیادی در اکسیداسیون و احیای آهن (III) داشتند. پاکسازی رادیکالهای آزاد DPPH و ABTS و قدرت اکسیداسیون ـ احیای آهن در عصاره قارچ ریشی قابلتوجه بود. بهعلاوه، عصاره قارچ ریشی توانست رادیکالهای سوپراکسید و هیدروکسیل را نیز به دام اندازد [19].
همچنین نشان داده شده است که عصاره اتانولی قارچ ریشی بر فعالیت دهیدروژنازهای میتوکندری و مجموعه 1 و 2 زنجیره انتقال الکترون موشهای صحرایی مُسن تأثیر میگذارد. عصاره اتانولی قارچ ریشی (50 و 250 میلیگرم بر کیلوگرم) بهصورت روزی یکبار بهمدت 15 روز برای موشهای صحرایی نر مُسن ویستار تجویز شد. همچنین گروه تیمارشده با دیال-آلفا لیپوئیک اسید (100 میلیگرم/کیلوگرم) بهعنوان شاهد مثبت انتخاب شد. طبق نتایج، عصاره قارچ ریشی (50 و 250 میلیگرم برکیلوگرم) فعالیت پیروات دهیدروژناز، آلفا کتوگلوتارات، سوکسینات دهیدروژناز و مجموعه 1 و 2 زنجیره انتقال الکترون در مغز موشهای صحرایی تیمارشده را در مقایسه با گروه شاهد مُسن، بهصورت معنیداری افزایش داد. سطح مالوندیآلدئید در گروه تیمارشده با قارچ ریشی بهصورت معنیداری کمتر از گروه شاهد مسن بود. مهار دهیدروژنازهای این پژوهش توسط عصاره قارچ ریشی میتواند تا حدودی ناشی از فعالیت آنتیاکسیدانی این عصاره باشد. نتایج پژوهش نشان داد عصاره قارچ ریشی احتمالاً برای بهبود عملکرد میتوکندریهای مغز موشهای صحرایی مسن، مفید است و میتوان از آن برای درمان بالقوه بیماریهای تحلیلرونده عصبی مرتبط با پیری استفاده کرد [20].
اثر پلیساکاریدهای قارچ گانودرما آتروم در جلوگیری از پیر شدن موشهای معمولی در اثر دیگالاکتوز بررسی شد. نتایج نشان داد در مقایسه با گروه موشهای معمولی در حال پیر شدن، پلیساکاریدهای قارچ گانودرما آتروم در دُز 50، 100 و 150 میلیگرم بر کیلوگرم وزن بدن، روزی یکبار بهمدت 10هفته بهصورت معنیداری فعالیت آنزیمهای سوپراکسید دیسموتاز، گلوتاتیون پراکسیداز و کاتالار در بافت کبد و مغز را زیاد و محتوای مالوندیآلدئید را کم کرد. بهعلاوه، کاهش وزن و آتروفی بافت کبد در گروههای تیمارشده با این پلیساکاریدها بهطور قابلتوجهی مهار شد. این بدانمعنی است که پلیساکاریدهای قارچ گانودرما آتروم اثر ضدپیری بر موشهای معمولی در حال افزایش سن دارد و سازوکار احتمالی آن به مهار رادیکالهای آزاد، افزایش فعالیت آنتیاکسیدانها و کاهش پراکسیداسیون لیپیدها برمیگردد [21]. پس از این تحقیق، در مطالعه دیگری نتایج مشابهی با اثر آنتیاکسیدانی پلیساکاریدهای گانودرما آتروم به دست آمد و نشان داده شد که پلیساکاریدهای گانودرما آتروم میتوانند از مغز جانوران زنده در برابر تنش اکسیداسیون دیگالاکتوز محافظت کنند [22].
در تحقیق دیگری مشخص شد که پروتئین نوترکیب و تنظیمکننده سیستم ایمنی جداشده از قارچ ریشی (rlz-8) میتواند جلوی پیر شدن موشهای معمولی در اثر دیگالاکتوز را بگیرد. براساس نتایج، تزریق زیرجلدی دیگالاکتوز به موشهای معمولی موجب کاهش معنیدار سطح سوپراکسید دیسموتاز، کاتالاز و گلوتاتیون پراکسیداز در سرم و بافت پوست، افزایش سطح مالوندیآلدئید و کاهش معنیدار سطح ملاتونین سرم میشود. این بدان معناست که تنش اکسیداتیو، مسئول ایجاد تغییرات دوران پیری ناشی از دیگالاکتوز است. با اینحال، فقط دُز بالای rlz-8 (1320 میکروگرم بر کیلوگرم) میتواند تمام آنتیاکسیدانهای فوقالذکر و سطح ملاتونین سرم را بهصورت معنیداری زیاد و سطح مالوندیآلدئید را کم کند. این یافتهها حاکی از آن هستند که rlz-8 میتواند فعالیت آنتیاکسیدانها در موشهای معمولی رو به پیری را زیاد کند و پیر شدن آنها را به تأخیر اندازد [23]. مطالعه حیوانی دیگری نیز تأیید کرده است که پلیساکارید قارچ ریشی (0/5 تا 2/0 گرم بر کیلوگرم) توانست احیای هیدروکسی پرولین و محتوای سوپراکسید دیسموتاز پوست موشهای صحرایی 16ماهه را بهصورت معنیداری زیاد کند [24].
این نکته روشن شده است که اختلال در عملکرد آنزیمهای آنتیاکسیدان، فرایند پیری را تسریع میکند، زیرا این آنزیمها، خط مقدم دفاع سلولها از درشتمولکولهای زیستی علیه تنش اکسیداتیو هستند. گلوتاتیون احیاشده، غنیترین مولکول تیولدار غیرپروتئینی در بافتهاست که میتواند بهواسطه واکنش مستقیم با گونههای فعال اکسیژن و متابولیتهای الکتروندوست، جلوی تجمع گونههای فعال اکسیژن در بافت مغز را بگیرد. در یک تحقیق مشخص شد قارچ ریشی میتواند فعالیت آنزیمهای آنتیاکسیدان در میتوکندریهای قلب، کبد و مغز موشهای معمولی مسن را زیاد کند [25].
سازوکار آنتیاکسیدانی پلیساکاریدهای قارچ ریشی برای به تعویق انداختن پیری پوست موشهای معمولی تحریکشده با دیگالاکتوز مورد مطالعه قرار گرفته است. نتایج آسیبشناسی ساختار بافت پوست نشان داد ضخامت دِرم (پوست) و اندودرم (روپوست) گروه تحریکشده، بهصورت معنیداری کمتر از گروه شاهد سالم است. ضخامت پوست و روپوست در گروه تیمارشده با پلیساکارید قارچ ریشی و گروه تیمارشده با ویتامین E (شاهد مثبت) بهطور قابلتوجهی بیشتر از گروه مدل تحریکشده بود و فقط ضخامت روپوست در گروه تیمارشده با پلیساکارید قارچ ریشی بهصورت معنیداری بیشتر از گروه تیمارشده با ویتامین E بود. فعالیت سوپراکسید دیسموتاز در بافت پوست گروه در حال پیر شدن، در مقایسه با گروه شاهد سالم، کم بود. فعالیت سوپراکسید دیسموتاز گروه تیمارشده با پلیساکارید قارچ ریشی، بیشتر از گروه مسن و گروه تیمارشده با ویتامین E بود. آستانه شروع چرخه بیانی mRNA سوپراکسید دیسموتاز مس ـ روی در گروه تیمارشده با پلیساکارید قارچ ریشی، پایینتر از گروه مسن و گروه تیمارشده با ویتامین E بود. پلیساکارید قارچ ریشی میتواند آسیبهای شدید وارده به بافت پوست در اثر اکسیداسیون را که با ویتامین E قابل ترمیم نیستند، بازسازی کند. این موضوع، ارزش بالینی و بالقوه پلیساکارید قارچ ریشی را برای درمان آسیبهای ناشی از پیری نشان میدهد [26].
اثر پلیساکارید ـ پپتیدهای بهدستآمده از قارچ گانودرما لوسیدوم در محافظت از ماکروفاژهای صفاقی (آبشامه شکم) موش در برابر گونههای فعال اکسیژن بررسی شده است. ابتدا موشها با پلیساکارید ـ پپتیدهای بهدستآمده از قارچ گانودرما لوسیدوم تیمار شدند و سپس ماکروفاژهای صفاقی آنها استخراج و در کشت سلولی در معرض ترتبوتیل هیدروپراکسید بهعنوان یک اکسیدکننده و تولیدکننده گونههای فعال اکسیژن قرار گرفتند. نتایج نشان داد پلیساکاریدـپپتیدهای بهدستآمده از قارچ گانودرما لوسیدوم در دُزهای 100 و 200 میلیگرم بر وزن بدن بهصورت تزریق داخلصفاقی توانست ماکروفاژهای موش را در برابر آسیب اکسیداتیو ناشی از tBuOOH در شرایط آزمایشگاهی محافظت کند. این اثر حتی در ماکروفاژهای بهدستآمده از موشهایی که با قارچ گانودرما لوسیدوم درمان نشده بودند نیز در کشت سلول این ماکروفاژها دیده شد [27].
اثر آنتیاکسیدانی عصاره حاوی پلیساکارید و تریترپنهای قارچ گانودرما لوسیدم از طریق کاهش عوارض پیری بر ساختار و عملکرد بافت بیضه موش بررسی شده است. این مطالعه مجدداً تأیید کرد که خاصیت ضدپیری این قارچ از طریق کاهش گونههای فعال اکسیژن و مالوندیآلدئید، افزایش فعالیت ژن ضد آپوپتوزی Bcl-2 و کاهش فعالیت ژنهای تحریککننده آپوپتوز نظیر Bax اعمال میشود [28].
ارتباط بین پیری و استرس اکسیداتیو در اثر تابش اشعه بهخوبی روشن شده است. از سوی دیگر، نقشی که عصارهها و ترکیبات قارچ گانودرما لوسیدوم در این زمینه ایفا میکنند نیز مطالعه شده است. در یک مطالعه، اثر ضدپیری قارچ گانودرما لوسیدوم در برابر تابش اشعه گاما بررسی شد. تریترپنهای قارچ گانودرما لوسیدوم (50 و 100 میلیگرم بر کیلوگرم وزن بدن) بهصورت خوراکی در طی 14 روز پشت سر هم قبل از تابش اشعه گاما به موشها تجویز شد. نتایج نشان داد این ترکیبات در کاهش پراکسیداسیون لیپید و اکسیداسیون پروتئین در بافتهای کبد و مغز موشهای در معرض اشعه گاما و افزایش سطح آنزیمهای آنتیاکسیدان این دو اندام مؤثر بودهاند [29]. همزمان با گذر سن و افزایش عمر، پوست، بیشتر و بیشتر در معرض اشعه ماورای بنفش قرار میگیرد، بنابراین ممکن است اختلالات پوستی، ککومک و سندرم هیپرپیگمانتاسیون ایجاد شود که به نوعی با پیری پوست در ارتباط است. پلیساکاریدهای قارچ گانودرما لوسیدوم میتوانند تأثیر اشعه ماورای بنفش در ملانوژنز (تولید و تجمع بیش از حد ملانین در پوست) را خنثی کنند. تحقیقات نشان داده است این ترکیبات این کار را از طریق تنظیم فسفوریلاسیون و جلوگیری از تحریک و فعالسازی مسیرMAPK و همچنین جلوگیری از تحریک و فعالسازی مسیر پروتئینکیناز A در اثر تحریک اشعه ماورای بنفش انجام میدهند [30].
از دید مولکولی و سلولی، پیری سلول یک فرایند پیچیده است که توسط چند ژن و چند مسیر سلولی تحت کنترل است. در این ارتباط، تأثیر پلیساکاریدهای قارچ ریشی بر ژنهای سایکلینD1 ،Rb ،CDK4 و P16INK4a و تغییر Rb فسفریله (pRb) در سلول فیبروبلاست انسان که روند پیری آن با هیدروژن پراکسید تحریک شده بود، بررسی شده است. براساس این پژوهش، سلولهای کشتشده فیبروبلاست انسان در گروه جوان، دارای شکل منشورمانند منظم و فاقد رشتههای کراتینی در طول رشد بودند، اما این سلولها در گروه مسن ظاهری نامنظم و حجیمتر داشتند و گرانولها و واکوئلهای درونسلولی آنها نیز بیشتر بود. پلیساکارید قارچ ریشی توانست تعداد واکوئلهای درونسلولی را کم کند اما تأثیر واضحی بر فنوتیپ پیری نداشت. در قیاس با گروه جوان و گروه شاهد، زندهمانی سلولی، بیان ژن CDK4 و فسفریله شدن ژن Rb در گروه مُسن بهصورت معنیداری کم بود؛ و فعالیت بتاگالاکتوزیداز، بیان ژن سایکلین D1، p16INK4a و Rb در این گروه افزایش معنیداری داشت. اختلاف نتایج بین گروه مدل در حال پیر شدن و گروه شاهد نشان میدهد تیمار سلولهای فیبروبلاست انسان با دُزهای متوسط و بالای پلیساکارید قارچ ریشی میتواند جلوی بروز تغییرهای فوقالذکر ناشی از پیر شدن با هیدروژن پراکسید را بگیرد. درمجموع، اثر پلیساکارید قارچ ریشی در محافظت از سلولهای فیبروبلاست انسان علیه پیر شدن ناشی از هیدروژن پراکسید احتمالاً مربوط به تنظیم چرخه تکثیر سلولی است [31]. همچنین مکانیسم مولکولیِ اثر آنتیاکسیدانی عصاره اتانولی قارچ گانودرما لوسیدوم با جزئیات بیشتری در مطالعات اخیر بررسی شده است. یافتههای یکی از این مطالعات نشان داد عصاره اتانولی قارچ گانودرما لوسیدوم اثرات تنش اکسیداتیو القاشده در سلول میوبلاست (یاخته پیشساز جنینی بهوجودآورنده سلول ماهیچه) توسط آب اکسیژنه (H2O2) را کاهش میدهد. مکانیسم عمل از طریق فعالسازی ژن Nrf2 بهعنوان یک تنظیمکننده اصلی برای شروع واکنشهای آنتیاکسیدانی در سطح سلول و همچنین ژن HO-1 بهعنوان ژن تولیدکننده یک آنزیم آنتیاکسیدانی تحت تأثیر فعالیت ژن Nrf2 و مسئول کاتالیز گروههای هِم صورت میگیرد [32]. اخیراً در یک مطالعه، بهطور مفصل و با جزئیات، مکانیسم مولکولی آنتیاکسیدانی عصاره آبی قارچ گانودرما لوسیدوم و همچنین ترکیباتی از این قارچ شامل پلیساکاریدهای قارچ گانودرما لوسیدوم، گانودریک اسید A، گانودرال A و ارگوسترول بررسی شده است. این مطالعه بر روی یک پروتوزوآ بهعنوان یک مدل انجام شد. یافتههای این مطالعه نشان داد این ترکیبات موجب افزایش بیان ژنهای کلیدی آنتیاکسیدانی از جمله PHGP و افزایش تولید آنزیم آنتیاکسیدانی PHGP میشوند. این ترکیبات علاوه بر کاهش استرس اکسیداتیو موجب حفظ تمامیت غشای سلولی از طریق کاهش اکسیداسیون لیپیدها در غشای سلولی نیز میشوند. همچنین نشان داده شد که ترکیبات قارچ گانودرما لوسیدوم از طریق غشای سالم سلولی وارد سلول میشوند و در آنجا واکنشهایی را علیه فرایند پیری تحریک میکنند [33]. همچنین مشخص شده است اثر ضدپیری مرتبط با آنتیاکسیدانی عصاره قارچ گانودرما آتروم (گونه دیگری از جنس گانودرما) بهخاطر فعالسازی اتوفاژی و کاهش تنش اکسیداتیو در میتوکندری سلولهای پیر است [34].
علاوه بر تحقیقات در شرایط آزمایشگاهی و حیوانی، کارآزماییهای بالینی نیز حاکی از تأثیر ضدپیری عصارههای قارچ گانودرما لوسیدوم از طریق مهار تنش اکسیداتیو هستند. نتایج یک کارآزمایی بالینی نشان داد مصرف قارچ گانودرما لوسیدوم غنی از پلیساکاریدها و تریترپنوئیدها (225 میلیگرم در روز بهمدت 6 ماه) از طریق مهار تنش اکسیداتیو میتواند اثرات ضدپیری داشته باشد [35].
اثر ضدپیری قارچ ریشی با جلوگیری و درمان اختلالات عصبی ـ شناختی
افزایش سن و تغییرات متعاقب آن، ریسکفاکتور مهمی برای بیماریهای رایج عصبی ـ شناختی یا تخریبکننده بافت عصبی (نورودژنراتیو) مانند اختلال شناختی خفیف، بیماری آلزایمر، بیماری عروق مغزی و پارکینسون محسوب میشود. شیوع بالای این دسته از اختلالات مغزی تحلیلرونده غیرقابلبرگشت در سراسر جهان توجیهکننده استفاده از روش های درمانی نوین و غیرتهاجمی با عوارض کمتر است [36]. بنابراین تأثیری که عصارهها یا ترکیبات قارچ گانودرما لوسیدوم میتواند بر درمان یا پیشگیری از بیماریهای نورودژنراتیو داشته باشد، بهطور مستقیم بر جلوگیری از فرایند پیری مؤثر است. در یک پژوهش آزمایشگاهی بر روی سلولهای گرانول مخچه، آپوپتوز القاشده توسط تنش اکسیداتیو ناشی از آباکسیژنه در کشت سلولی سلولهای گرانول مخچه موش صحرایی توسط پلیساکاریدهای قارچ گانودرما لوسیدوم خنثی شد [37]. در مطالعات آزمایشگاهی بعدی مشخص شد ترکیباتی از قارچ گانودرما لوسیدوم اثر محافظتی از سلولهای عصبی (نوروبلاستومای انسانی SH-SY5Y) در برابر استرس اکسیداتیو دارند. این ترکیبات شامل مروترپنوئیدهای آروماتیک بودند. از آنجایی که پیری خود یک فاکتور خطر برای بیماریهای تخریبکننده بافت عصبی (نظیر پارکینسون و آلزایمر) محسوب میشود، بنابراین نتایج این تحقیق، اساسی را برای کارآزماییهای بالینی برای کاربرد ترکیبات بهدستآمده از قارچ گانودرما لوسیدوم به منظور استفاده از اثرات ضدپیری آن از طریق محافظت در برابر بیماریهای تخریبکننده بافت عصبی فراهم میکند [16]. در یک مطالعه دیگر، اثر بالقوه عصاره اتانولی قارچ گانودرما لوسیدوم بر بیماریهای تخریبکننده بافت عصبی بررسی شد. این مطالعه بر روی سلولهای میکروگلیای موش تحریکشده با اندوتوکسین باکتریایی (لیپوپلیساکارید) انجام شد. سلولهای میکروگلیا شبیه به ماکروفاژها عمل میکنند و اولین سد دفاعی در مغز در برابر آسیبها، عفونتها و التهابات مغزی هستند، اما فعالیت بیش از اندازه آنها موجب تولید سایتوکاینهای التهابی و عوامل سیتوتوکسیک میشود که درنتیجه میتواند موجب ایجاد بیماریهای تخریبکننده بافت عصبی نظیر آلزایمر و اماس شود. این مطالعه نشان داد عصاره اتانولی قارچ گانودرما لوسیدوم از فعالسازی پروتئینهای هستهای کاپا ـ بی و نیز از اتصال اندوتوکسین به پذیرنده سلولی خود یعنی TLR4 و شروع مسیر التهابی جلوگیری میکند [38]. مکانیسم دقیق اثر عصاره قارچ گانودرما لوسیدوم در مطالعه مستقل بعدی تعیین و تأیید شد، بهطوریکه نشان داده شد عصاره قارچ گانودرما لوسیدوم در سلولهای میکروگلیای موش تحریکشده با اندوتوکسین باکتریایی میتواند از یکسو سطح سایتوکاینها و کموکاینها بهویژه کموکاین RANTES و MIP3α را بهطور بسیار زیادی کاهش دهد و از سوی دیگر بیان مجموعه ژنهای مرتبط با آلزایمر و پارکینسون یعنی CHUK ،NF-κB و IKBKE را کاهش دهد [39].
مطالعات حیوانی بر روی تأثیر عصارههای قارچ گانودرما لوسیدوم در جلوگیری از آسیب به بافت مغزی و جلوگیری از اختلالات نورودژنراتیو بهطور محسوسی اندک است. در مطالعهای بر روی موش سوری مدل آلزایمر (APP/PS1 transgenic mice) پلیساکاریدهای بهدستآمده از قارچ گانودرما لوسیدوم توانستند در دُز 30 میلیگرم برکیلوگرم وزن بدن (بهصورت گاواژ) تکثیر سلولهای پیشساز عصبی موش را افزایش دهند و از رسوب پروتئین آمیلوئید (یکی از شاخصهای بیماری آلزایمر) جلوگیری کنند. هر دوی این مکانیسمها به خاصیت ضدپیری قارچ گانودرما لوسیدوم نسبت داده است [40]. در این مطالعه همچنین نشان داده شد پلیساکاریدهای بهدستآمده از قارچ گانودرما لوسیدوم احتمالاً از طریق فعالسازیپذیرنده FGFR (که نقش مهمی در نورونزایی دارد) نقش آنتینورودژنراتیو خود را انجام میدهند. در مطالعه دیگری، عصاره حاوی تریترپنوئید قارچ گانودرما لوسیدوم (خلوص 28 درصد) در دُز 10 میلیگرم بر کیلوگرم وزن بدن (بهصورت گاواژ) به موشهای صحرایی که علائم پیری در آنها به واسطه دیگالاکتوز القا شده بود، تجویز شد. نتایج حاکی از اثر مثبت عصاره این قارچ در بهبود یادگیری و حافظه موشهای صحرایی پیر و کاهش سطح التهاب در آنها بود. همچنین اختلال در متابولیسم لیپید (که در اثر دیگالاکتوز القا شده بود) را تخفیف داد. این عصاره همچنین موجب بهبود مجموعه علائم مرتبط با پیری در بافت هیپوکامپ موشهای صحرایی پیر شد. در این مطالعه روشن شد که از نظر مکانیسم مولکولی، عصاره حاوی تریترپنوئید قارچ گانودرما لوسیدوم بیان ژنهای ضد آپوپتوز FOXO4 و SIRT1 (یکی از اعضای خانواده Sirtuin) را افزایش داد و مسیر تکثیر سلولی PI3K/Akt/mTOR را فعال و درنتیجه بیان ژنهای آپوپتوتیک (نظیر خانواده کاسپاز) را کاهش داد [41].
یکی از نکات جالب در مورد خواص آنتینورودژنراتیو قارچ گانودرما لوسیدوم این است که ترکیبات مؤثرهای که این خواص را به قارچ اعطا میکنند بهطور عمدهای به ترکیب و فرمولاسیون بستر کشت قارچ بستگی دارند. بهطور مشخص در طی یک تحقیق مقایسهای بر روی چندین بستر کشت نشان داده شده است که استفاده از کاه ـ کلش خالص گندم (یعنی بدون هیچ افزودنی دیگر در فرمولاسیون بستر کشت) بیشترین اثر مثبت را بر ترکیبات مفید دارویی میوه قارچ گانودرما لوسیدوم دارد. از نظر مولکولی و مکانیسم عمل، عصاره این قارچ خاصیت آنتینورودژنراتیو خود را از طریق کاهش فعالیت تیروزیناز و استیلکولین استراز به نمایش میگذارد [42].
به هر حال با توجه به یک مقاله مروری بسیار جدید، قارچ گانودرما لوسیدوم و بهویژه پلیساکاریدهای آن یکی از ترکیبات امیدبخش برای مقابله با اختلالات نورودژنراتیو هستند [43].
اثر ضدپیری قارچ ریشی با بهبود آسیب کلیوی ناشی از ایسکمی و برقراری مجدد جریان خون
کاملاً روشن شده است که همزمان با پیری بهعنوان یک ریسکفاکتور، آسیبهای کلیوی از جمله آسیب کلیوی ناشی از ایسکمی و برقراری مجدد جریان خون شدیدتر میشود [44, 45]. اثر پلیساکارید ـ پپتیدهای بهدستآمده از قارچ گانودرما لوسیدوم در بهبود آسیب کلیوی ناشی از ایسکمی و برقراری مجدد جریان خون بررسی شده است. هنگام برقراری مجدد جریان خون پس از ایسکمی، آسیبهای دیگری همچون تجمع کلسیم، نفوذ نوتروفیلها به داخل بافت کلیوی و تولید گونههای فعال اکسیژن به وجود میآید. تولید گونههای فعال اکسیژن در میتوکندری سلول، خود آسیبهای دیگری همچون آپوپتوز و آسیب به غشای سلولی را به همراه دارد. در یک مطالعه حیوانی بر روی موشهای دچار آسیب کلیوی ایسکمی نشان داده شد پلیساکارید ـ پپتیدهای بهدستآمده از قارچ گانودرما لوسیدوم در دُز 100 میلیگرم بر کیلوگرم وزن بدن بهصورت تزریق درونصفاقی بهمدت 7 روز قبل از القای آسیب کلیوی ایسکمی و برقراری مجدد جریان خون یا بهصورت درمان با شروع برقراری مجدد جریان خون توانستند ناهنجاری کلیوی و آسیبهای وارده به آن را کاهش دهند. این اثرات از طریق کاهش استرس اکسیداتیو و آپوپتوز ناشی از آن در میتوکندری اعمال شد [46].
تداخلات اثرات ضدپیری قارچ ریشی با داروهای شیمیدرمانی
یکی از موضوعات چالشبرانگیز در مورد قارچ گانودرما لوسیدوم و سایر ترکیبات گیاهی، احتمال اثرات ناشناخته و غیرمطلوب آنها بر سلولهای نرمال و تداخل با داروهای شیمیدرمانی است. در این ارتباط، یکی از موضوعات جالب آن است که خاصیت ضدپیری و ضدسرطانی ترکیبات قارچ گانودرما لوسیدوم از طریق حفاظت از DNA سلولی اعمال میشود و نمیتواند از طریق آسیب به DNA سلولی باشد، حال آنکه داروهای شیمیدرمانی از طریق آسیب به DNA سلولهای سرطانی به درمان سرطان کمک میکنند. نتایج یک تحقیق آزمایشگاهی با استفاده از روش القای فاژ درون سلول باکتریایی در اثر عوامل آسیبزننده به DNA باکتری (که در حقیقت یکی از واکنشهای SOS به یک باکتری در مقابل عوامل آسیبزننده به DNA آن است) با استفاده از داروی شیمیدرمانی دوکسوروبیسین (بهعنوان یک دارو با اثرات شناختهشده اتصال به DNA سلولی و تخریب آن) نشان داد عصارههای قارچ گانودرما لوسیدوم آسیبی به DNA وارد نمیکنند و بنابراین این عصارهها در کاربرد سنتی آنها بهعنوان ترکیبات ضدپیری کاربرد دارند [47].
مطالعه اثرات ضدپیری قارچ ریشی در جاندارن با ساختار ساده
علاوه بر پژوهشهای حیوانی بر روی موش، پژوهشهای دیگری در زمینه به تأخیر انداختن روند پیری در جانداران سادهتری مانند کرمهای لولهای و مخمرها در حال انجام است. بررسیهای انجامشده روی کرم لولهای الگانس (یک نوع نماتود با نام علمی کائنورابدیتیس الگانس) نشان داد قارچ ریشی اثر مطلوبی بر مقاومتر شدن این کرمها در برابر تنش اکسیداتیو و افزایش قابلتوجه طول عمرشان دارد.
در یک پژوهش، از کرم لولهای الگانس بهعنوان مدل جانوری برای بررسی اثر عصاره آبی قارچ ریشی علیه تنش اکسیداتیو و پیری استفاده شد. نتایج نشان داد قارچ ریشی اثر مطلوبی بر مقاومتر شدن این کرمها در برابر تنش اکسیداتیو و فلز سنگین Cr6+ و افزایش قابلتوجه طول عمر این جانوران دارد. براساس بررسیهای بیشتر، قارچ ریشی به کمک مسیر پیامرسانی mTOR/S6K و مسیر محدودیت غذایی از این کرمها در برابر آسیب فلزهای سنگین و علفکُش پاراکوآت محافظت کردند. این درحالی است که اثر قارچ ریشی بر طول عمر کرمهای لولهای عمدتاً به مسیر پیامرسانی سلولهای زاینده آنها بستگی دارد. از روش ریزآرایه DNA ، برای نمایش نمایه بیانی ژنها استفاده شد. در طول روند پیری، بیان 2746 ژن تغییر معنیداری پیدا کرد؛ بیان 2082 ژن، کم و بیان 664 ژن، زیاد شد که از این بین، روند بیان 34 ژن پس از تیمار نماتودهای مسن با گانودرما لوسیدوم، معکوس شد.
در این میان، روند افزایشی بیان 25 ژن در طول فرایند پیری، پس از تیمار با عصاره قارچ ریشی بهصورت معنیداری کم شد و پس از تجویز این عصاره، مهار از روی بیان 9 ژن در طول فرایند پیری برداشته شد. بیش از نیمی از این ژنها بهخوبی بررسی نشدهاند یا عملکرد آنها هنوز مشخص نیست. اما براساس پژوهشهای انجامشده، پروتئین smg-1 مسئول طول عمر کرم لولهای الگانس است. smg-1، سرین ـ ترئونین کینازی است که نقش حفاظتشدهای در تجزیه mRNA بهواسطه کدونهای بیمعنی در کرمها و پستانداران ایفا میکند [48].
همچنین چهار ترکیب ارگوسترولی جدید و خالص از اسپورهای قارچ ریشی (با نام گانودرمازید A ،B ،C و D) تهیه و خاصیت ضدپیری آنها در مخمر بررسی شده است. براساس نتایج، این ترکیبها طول عمر سویه همانندساز مخمر یعنی K6001 را بهطور معنیداری افزایش دادند. گانودرمازیدهای A ،B ،C و D بیان ژن UTH1 را تنظیم کردند. این ژن، مسئول افزایش طول عمر مخمر همانندساز است. خاصیت ضدپیری این ترکیبات در مخمر، قابل مقایسه با ترکیب مشهوری به نام رسوراترول است [49، 50].
بحث و نتیجهگیری
درمجموع، این مقاله مروری نشان میدهد عصارههای مختلف بهدستآمده از قارچ ریشی دارای خواص ضدپیری قابل اندازهگیری و قابل مشاهده بهویژه در سه بافت قلبی، کبدی و مغزی هستند. این اثرات عمدتاً از طریق تنظیم سیستم ایمنی، مقابله با اکسیداسیون، به دام انداختن رادیکالهای آزاد، افزایش دهیدروژنازهای میتوکندری، تقویت عناصر مجموعههای 1 و 2 زنجیره انتقال الکترون و پیشگیری از تحلیل عصبی ناشی از تنش اکسیداتیو اعمال میشوند. حضور مولکولهای فعال زیستی مختلف در این قارچ بهویژه پلیساکاریدها و تریترپنها اهمیت این قارچ را در تحقیقات مرتبط با پیری پررنگ کرده است (جدول شماره 2).
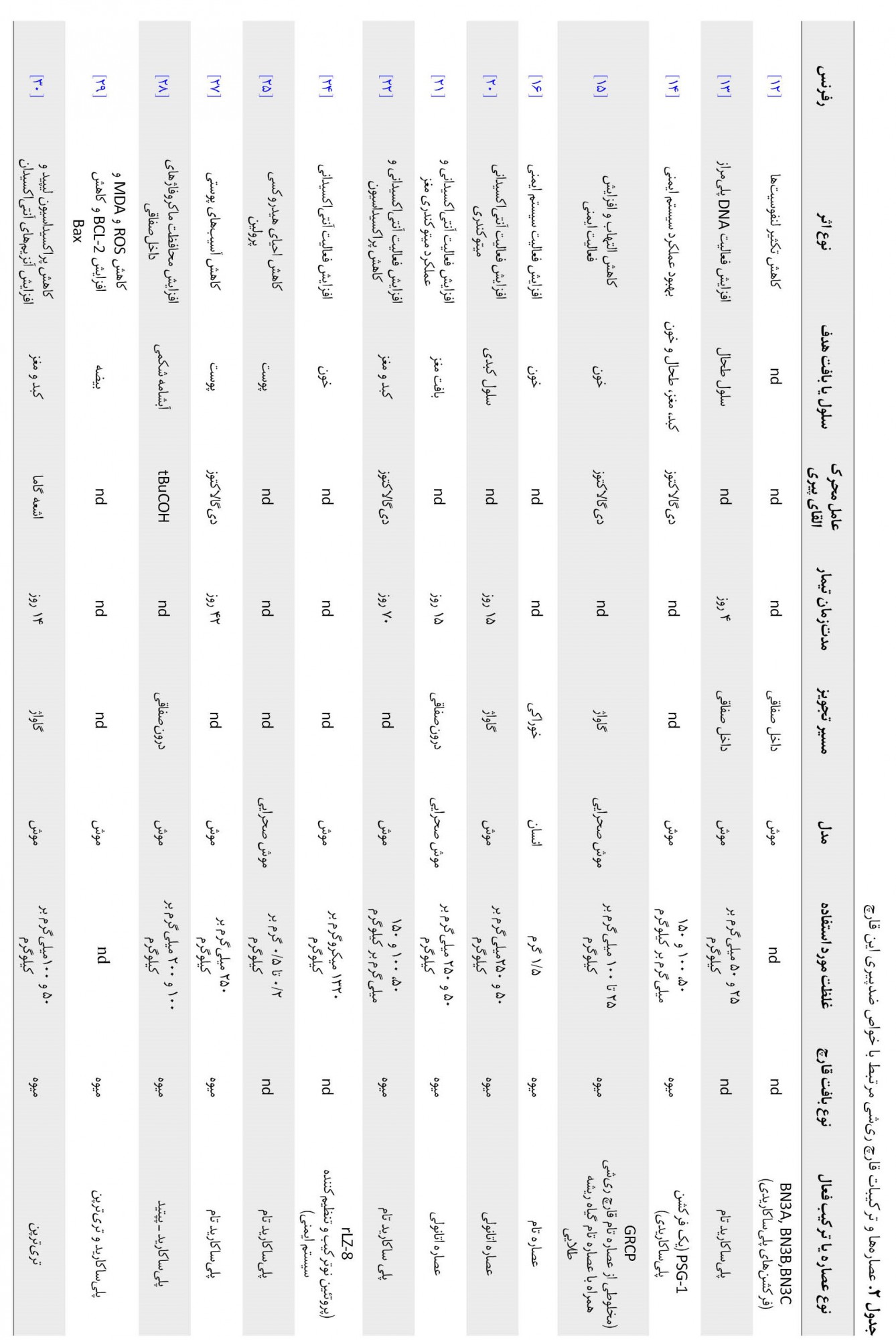
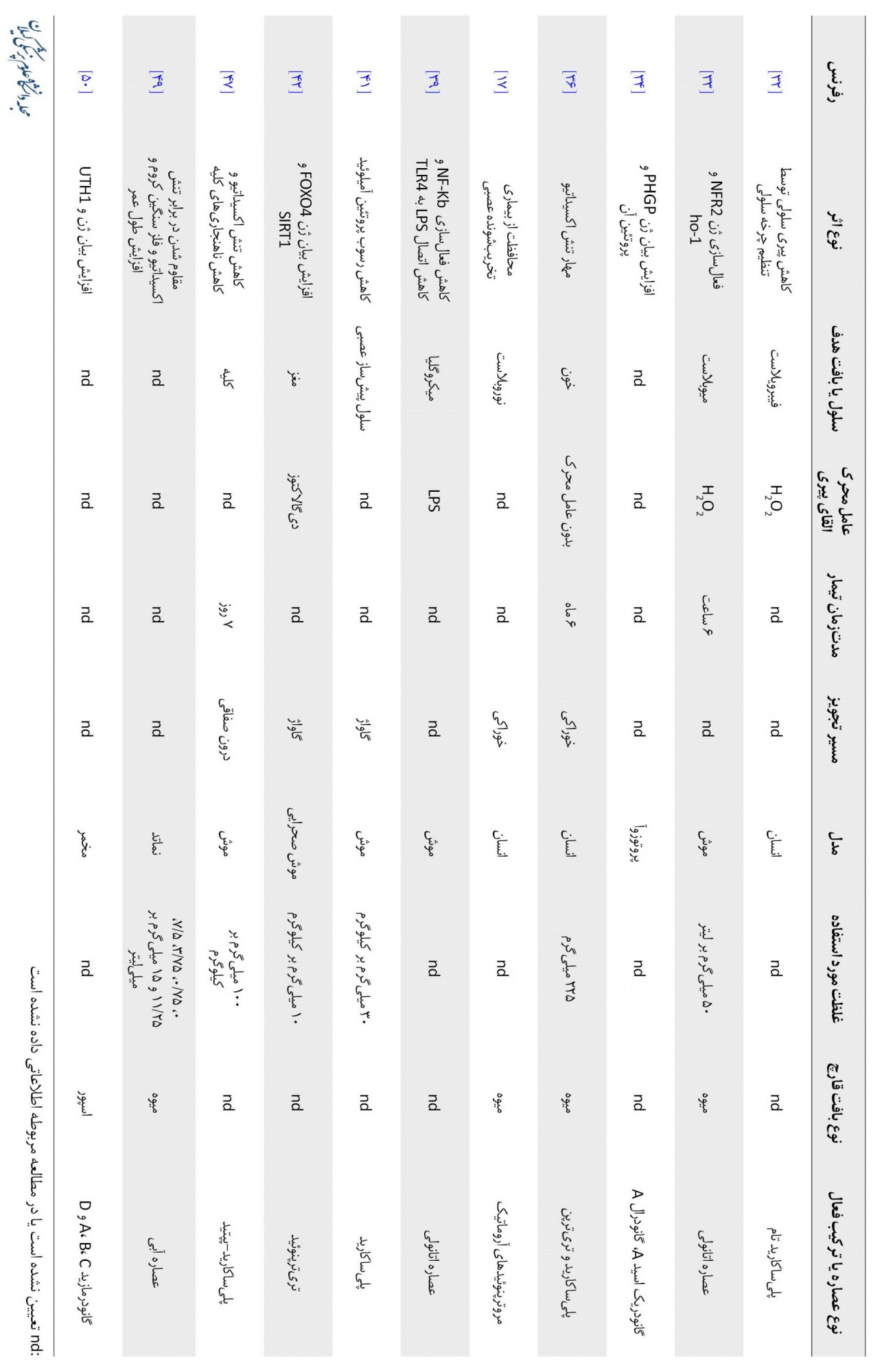
از آنجاییکه متابولیتهای زیستفعال قارچ ریشی افقهای جدیدی برای ساخت داروهای طبیعی جدید جهت جلوگیری از پیری در اختیار میگذارند، به دست آوردن یک تصویر کامل از تمام ترکیبات و عصارههای ضدپیری موجود در قارچ ریشی از اهمیت بالایی برخوردار است. اما همچنان محدودیتهایی وجود دارد، از جمله اینکه شواهد بالینی انسانی بیشتری برای ارائه توضیحی جامع از مکانیسمهای زیربنایی خاصیت ضدپیری قارچ ریشی مورد نیاز است. با توجه به وجود چندین گونه از قارچ جنس گانودرما و از جمله ریشی (گانودرما لوسیدوم) در محیط طبیعی ایران از یکسو و تأیید اثرات آنتیاکسیدانی قابل ملاحظه قارچهای دارویی بومی ایران در مقایسه با انواع تجاری آن از سوی دیگر، قارچهای بومی جنس گانودرما و بهخصوص قارچ ریشی در کشور ما میتواند در زمینه اثرات ضدپیری آن مورد مطالعه جدیتری قرار گیرد. اما در حال حاضر، جای خالی تحقیقات آزمایشگاهی، حیوانی و بالینی بر روی اثرات ضدپیری انواع بومی قارچهای جنس گانودرما در کشور ما احساس میشود. نتایج چنین تحقیقاتی علاوه بر ارزش علمی ـ پژوهشی، از حیث کاربرد در صنایع آرایشی ـ بهداشتی و دارویی در کشور ما مهم تلقی میشود، چراکه میتواند سنگ بنای صحیحی را برای استارت آپها و شرکتهای دانشبنیان علاقهمند به ورود به کاربردهای آرایشی ـ بهداشتی عصارهها و ترکیبات قارچ ریشی پایهگذاری کند و از برخی سادهانگاریهای غیرعلمی متکی بر نگاه صرفاً تجاری در مورد خواص ضدپیری قارچ ریشی و تأثیر منفی آن بر سلامت و بهداشت عمومی جامعه جلوگیری نماید. مطالعات حیوانی بر روی تأثیر عصارههای قارچ گانودرما لوسیدوم در جلوگیری از آسیب به بافت مغزی و جلوگیری از اختلالات نورودژنراتیو بهطور محسوسی اندک است. بدون این مطالعات امکان کاربردی کردن نتایج آزمایشگاهی در کارآزماییهای بالینی وجود ندارد. همچنین مطالعات حیوانی و کارآزمایی بالینی باید با ترکیبات شناختهشده منفرد و جدا (و نه عصاره) انجام شود. در سالهای اخیر تمرکز مطالعات بر کشف مکانیسمهای مولکولی و انجام آزمایشات حیوانی و کارآزمایی بالینی بوده است.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
هیچ دادهای در حمایت از نتیجهگیری ما در پژوهش حاضر ساخته و دستکاری نشده است. تمام مطالعات در دسترس در این زمینه، برای بررسی گنجانده شده است.
حامی مالی
این تحقیق هیچگونه کمک مالی از سازمانهای تأمین مالی در بخشهای عمومی ، تجاری یا غیرانتفاعی دریافت نکرده است.
مشارکت نویسندگان
گردآوری دادهها و جستوجو در منابع: شراره رضائیان؛ نوشتن و ویرایش مقاله: حمیدرضا پوریانفر؛ تصحیح و تأیید نسخه نهایی مقاله: شراره رضائیان و حمیدرضا پوریانفر.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
همچنین نشان داده شده است که عصاره اتانولی قارچ ریشی بر فعالیت دهیدروژنازهای میتوکندری و مجموعه 1 و 2 زنجیره انتقال الکترون موشهای صحرایی مُسن تأثیر میگذارد. عصاره اتانولی قارچ ریشی (50 و 250 میلیگرم بر کیلوگرم) بهصورت روزی یکبار بهمدت 15 روز برای موشهای صحرایی نر مُسن ویستار تجویز شد. همچنین گروه تیمارشده با دیال-آلفا لیپوئیک اسید (100 میلیگرم/کیلوگرم) بهعنوان شاهد مثبت انتخاب شد. طبق نتایج، عصاره قارچ ریشی (50 و 250 میلیگرم برکیلوگرم) فعالیت پیروات دهیدروژناز، آلفا کتوگلوتارات، سوکسینات دهیدروژناز و مجموعه 1 و 2 زنجیره انتقال الکترون در مغز موشهای صحرایی تیمارشده را در مقایسه با گروه شاهد مُسن، بهصورت معنیداری افزایش داد. سطح مالوندیآلدئید در گروه تیمارشده با قارچ ریشی بهصورت معنیداری کمتر از گروه شاهد مسن بود. مهار دهیدروژنازهای این پژوهش توسط عصاره قارچ ریشی میتواند تا حدودی ناشی از فعالیت آنتیاکسیدانی این عصاره باشد. نتایج پژوهش نشان داد عصاره قارچ ریشی احتمالاً برای بهبود عملکرد میتوکندریهای مغز موشهای صحرایی مسن، مفید است و میتوان از آن برای درمان بالقوه بیماریهای تحلیلرونده عصبی مرتبط با پیری استفاده کرد [20].
اثر پلیساکاریدهای قارچ گانودرما آتروم در جلوگیری از پیر شدن موشهای معمولی در اثر دیگالاکتوز بررسی شد. نتایج نشان داد در مقایسه با گروه موشهای معمولی در حال پیر شدن، پلیساکاریدهای قارچ گانودرما آتروم در دُز 50، 100 و 150 میلیگرم بر کیلوگرم وزن بدن، روزی یکبار بهمدت 10هفته بهصورت معنیداری فعالیت آنزیمهای سوپراکسید دیسموتاز، گلوتاتیون پراکسیداز و کاتالار در بافت کبد و مغز را زیاد و محتوای مالوندیآلدئید را کم کرد. بهعلاوه، کاهش وزن و آتروفی بافت کبد در گروههای تیمارشده با این پلیساکاریدها بهطور قابلتوجهی مهار شد. این بدانمعنی است که پلیساکاریدهای قارچ گانودرما آتروم اثر ضدپیری بر موشهای معمولی در حال افزایش سن دارد و سازوکار احتمالی آن به مهار رادیکالهای آزاد، افزایش فعالیت آنتیاکسیدانها و کاهش پراکسیداسیون لیپیدها برمیگردد [21]. پس از این تحقیق، در مطالعه دیگری نتایج مشابهی با اثر آنتیاکسیدانی پلیساکاریدهای گانودرما آتروم به دست آمد و نشان داده شد که پلیساکاریدهای گانودرما آتروم میتوانند از مغز جانوران زنده در برابر تنش اکسیداسیون دیگالاکتوز محافظت کنند [22].
در تحقیق دیگری مشخص شد که پروتئین نوترکیب و تنظیمکننده سیستم ایمنی جداشده از قارچ ریشی (rlz-8) میتواند جلوی پیر شدن موشهای معمولی در اثر دیگالاکتوز را بگیرد. براساس نتایج، تزریق زیرجلدی دیگالاکتوز به موشهای معمولی موجب کاهش معنیدار سطح سوپراکسید دیسموتاز، کاتالاز و گلوتاتیون پراکسیداز در سرم و بافت پوست، افزایش سطح مالوندیآلدئید و کاهش معنیدار سطح ملاتونین سرم میشود. این بدان معناست که تنش اکسیداتیو، مسئول ایجاد تغییرات دوران پیری ناشی از دیگالاکتوز است. با اینحال، فقط دُز بالای rlz-8 (1320 میکروگرم بر کیلوگرم) میتواند تمام آنتیاکسیدانهای فوقالذکر و سطح ملاتونین سرم را بهصورت معنیداری زیاد و سطح مالوندیآلدئید را کم کند. این یافتهها حاکی از آن هستند که rlz-8 میتواند فعالیت آنتیاکسیدانها در موشهای معمولی رو به پیری را زیاد کند و پیر شدن آنها را به تأخیر اندازد [23]. مطالعه حیوانی دیگری نیز تأیید کرده است که پلیساکارید قارچ ریشی (0/5 تا 2/0 گرم بر کیلوگرم) توانست احیای هیدروکسی پرولین و محتوای سوپراکسید دیسموتاز پوست موشهای صحرایی 16ماهه را بهصورت معنیداری زیاد کند [24].
این نکته روشن شده است که اختلال در عملکرد آنزیمهای آنتیاکسیدان، فرایند پیری را تسریع میکند، زیرا این آنزیمها، خط مقدم دفاع سلولها از درشتمولکولهای زیستی علیه تنش اکسیداتیو هستند. گلوتاتیون احیاشده، غنیترین مولکول تیولدار غیرپروتئینی در بافتهاست که میتواند بهواسطه واکنش مستقیم با گونههای فعال اکسیژن و متابولیتهای الکتروندوست، جلوی تجمع گونههای فعال اکسیژن در بافت مغز را بگیرد. در یک تحقیق مشخص شد قارچ ریشی میتواند فعالیت آنزیمهای آنتیاکسیدان در میتوکندریهای قلب، کبد و مغز موشهای معمولی مسن را زیاد کند [25].
سازوکار آنتیاکسیدانی پلیساکاریدهای قارچ ریشی برای به تعویق انداختن پیری پوست موشهای معمولی تحریکشده با دیگالاکتوز مورد مطالعه قرار گرفته است. نتایج آسیبشناسی ساختار بافت پوست نشان داد ضخامت دِرم (پوست) و اندودرم (روپوست) گروه تحریکشده، بهصورت معنیداری کمتر از گروه شاهد سالم است. ضخامت پوست و روپوست در گروه تیمارشده با پلیساکارید قارچ ریشی و گروه تیمارشده با ویتامین E (شاهد مثبت) بهطور قابلتوجهی بیشتر از گروه مدل تحریکشده بود و فقط ضخامت روپوست در گروه تیمارشده با پلیساکارید قارچ ریشی بهصورت معنیداری بیشتر از گروه تیمارشده با ویتامین E بود. فعالیت سوپراکسید دیسموتاز در بافت پوست گروه در حال پیر شدن، در مقایسه با گروه شاهد سالم، کم بود. فعالیت سوپراکسید دیسموتاز گروه تیمارشده با پلیساکارید قارچ ریشی، بیشتر از گروه مسن و گروه تیمارشده با ویتامین E بود. آستانه شروع چرخه بیانی mRNA سوپراکسید دیسموتاز مس ـ روی در گروه تیمارشده با پلیساکارید قارچ ریشی، پایینتر از گروه مسن و گروه تیمارشده با ویتامین E بود. پلیساکارید قارچ ریشی میتواند آسیبهای شدید وارده به بافت پوست در اثر اکسیداسیون را که با ویتامین E قابل ترمیم نیستند، بازسازی کند. این موضوع، ارزش بالینی و بالقوه پلیساکارید قارچ ریشی را برای درمان آسیبهای ناشی از پیری نشان میدهد [26].
اثر پلیساکارید ـ پپتیدهای بهدستآمده از قارچ گانودرما لوسیدوم در محافظت از ماکروفاژهای صفاقی (آبشامه شکم) موش در برابر گونههای فعال اکسیژن بررسی شده است. ابتدا موشها با پلیساکارید ـ پپتیدهای بهدستآمده از قارچ گانودرما لوسیدوم تیمار شدند و سپس ماکروفاژهای صفاقی آنها استخراج و در کشت سلولی در معرض ترتبوتیل هیدروپراکسید بهعنوان یک اکسیدکننده و تولیدکننده گونههای فعال اکسیژن قرار گرفتند. نتایج نشان داد پلیساکاریدـپپتیدهای بهدستآمده از قارچ گانودرما لوسیدوم در دُزهای 100 و 200 میلیگرم بر وزن بدن بهصورت تزریق داخلصفاقی توانست ماکروفاژهای موش را در برابر آسیب اکسیداتیو ناشی از tBuOOH در شرایط آزمایشگاهی محافظت کند. این اثر حتی در ماکروفاژهای بهدستآمده از موشهایی که با قارچ گانودرما لوسیدوم درمان نشده بودند نیز در کشت سلول این ماکروفاژها دیده شد [27].
اثر آنتیاکسیدانی عصاره حاوی پلیساکارید و تریترپنهای قارچ گانودرما لوسیدم از طریق کاهش عوارض پیری بر ساختار و عملکرد بافت بیضه موش بررسی شده است. این مطالعه مجدداً تأیید کرد که خاصیت ضدپیری این قارچ از طریق کاهش گونههای فعال اکسیژن و مالوندیآلدئید، افزایش فعالیت ژن ضد آپوپتوزی Bcl-2 و کاهش فعالیت ژنهای تحریککننده آپوپتوز نظیر Bax اعمال میشود [28].
ارتباط بین پیری و استرس اکسیداتیو در اثر تابش اشعه بهخوبی روشن شده است. از سوی دیگر، نقشی که عصارهها و ترکیبات قارچ گانودرما لوسیدوم در این زمینه ایفا میکنند نیز مطالعه شده است. در یک مطالعه، اثر ضدپیری قارچ گانودرما لوسیدوم در برابر تابش اشعه گاما بررسی شد. تریترپنهای قارچ گانودرما لوسیدوم (50 و 100 میلیگرم بر کیلوگرم وزن بدن) بهصورت خوراکی در طی 14 روز پشت سر هم قبل از تابش اشعه گاما به موشها تجویز شد. نتایج نشان داد این ترکیبات در کاهش پراکسیداسیون لیپید و اکسیداسیون پروتئین در بافتهای کبد و مغز موشهای در معرض اشعه گاما و افزایش سطح آنزیمهای آنتیاکسیدان این دو اندام مؤثر بودهاند [29]. همزمان با گذر سن و افزایش عمر، پوست، بیشتر و بیشتر در معرض اشعه ماورای بنفش قرار میگیرد، بنابراین ممکن است اختلالات پوستی، ککومک و سندرم هیپرپیگمانتاسیون ایجاد شود که به نوعی با پیری پوست در ارتباط است. پلیساکاریدهای قارچ گانودرما لوسیدوم میتوانند تأثیر اشعه ماورای بنفش در ملانوژنز (تولید و تجمع بیش از حد ملانین در پوست) را خنثی کنند. تحقیقات نشان داده است این ترکیبات این کار را از طریق تنظیم فسفوریلاسیون و جلوگیری از تحریک و فعالسازی مسیرMAPK و همچنین جلوگیری از تحریک و فعالسازی مسیر پروتئینکیناز A در اثر تحریک اشعه ماورای بنفش انجام میدهند [30].
از دید مولکولی و سلولی، پیری سلول یک فرایند پیچیده است که توسط چند ژن و چند مسیر سلولی تحت کنترل است. در این ارتباط، تأثیر پلیساکاریدهای قارچ ریشی بر ژنهای سایکلینD1 ،Rb ،CDK4 و P16INK4a و تغییر Rb فسفریله (pRb) در سلول فیبروبلاست انسان که روند پیری آن با هیدروژن پراکسید تحریک شده بود، بررسی شده است. براساس این پژوهش، سلولهای کشتشده فیبروبلاست انسان در گروه جوان، دارای شکل منشورمانند منظم و فاقد رشتههای کراتینی در طول رشد بودند، اما این سلولها در گروه مسن ظاهری نامنظم و حجیمتر داشتند و گرانولها و واکوئلهای درونسلولی آنها نیز بیشتر بود. پلیساکارید قارچ ریشی توانست تعداد واکوئلهای درونسلولی را کم کند اما تأثیر واضحی بر فنوتیپ پیری نداشت. در قیاس با گروه جوان و گروه شاهد، زندهمانی سلولی، بیان ژن CDK4 و فسفریله شدن ژن Rb در گروه مُسن بهصورت معنیداری کم بود؛ و فعالیت بتاگالاکتوزیداز، بیان ژن سایکلین D1، p16INK4a و Rb در این گروه افزایش معنیداری داشت. اختلاف نتایج بین گروه مدل در حال پیر شدن و گروه شاهد نشان میدهد تیمار سلولهای فیبروبلاست انسان با دُزهای متوسط و بالای پلیساکارید قارچ ریشی میتواند جلوی بروز تغییرهای فوقالذکر ناشی از پیر شدن با هیدروژن پراکسید را بگیرد. درمجموع، اثر پلیساکارید قارچ ریشی در محافظت از سلولهای فیبروبلاست انسان علیه پیر شدن ناشی از هیدروژن پراکسید احتمالاً مربوط به تنظیم چرخه تکثیر سلولی است [31]. همچنین مکانیسم مولکولیِ اثر آنتیاکسیدانی عصاره اتانولی قارچ گانودرما لوسیدوم با جزئیات بیشتری در مطالعات اخیر بررسی شده است. یافتههای یکی از این مطالعات نشان داد عصاره اتانولی قارچ گانودرما لوسیدوم اثرات تنش اکسیداتیو القاشده در سلول میوبلاست (یاخته پیشساز جنینی بهوجودآورنده سلول ماهیچه) توسط آب اکسیژنه (H2O2) را کاهش میدهد. مکانیسم عمل از طریق فعالسازی ژن Nrf2 بهعنوان یک تنظیمکننده اصلی برای شروع واکنشهای آنتیاکسیدانی در سطح سلول و همچنین ژن HO-1 بهعنوان ژن تولیدکننده یک آنزیم آنتیاکسیدانی تحت تأثیر فعالیت ژن Nrf2 و مسئول کاتالیز گروههای هِم صورت میگیرد [32]. اخیراً در یک مطالعه، بهطور مفصل و با جزئیات، مکانیسم مولکولی آنتیاکسیدانی عصاره آبی قارچ گانودرما لوسیدوم و همچنین ترکیباتی از این قارچ شامل پلیساکاریدهای قارچ گانودرما لوسیدوم، گانودریک اسید A، گانودرال A و ارگوسترول بررسی شده است. این مطالعه بر روی یک پروتوزوآ بهعنوان یک مدل انجام شد. یافتههای این مطالعه نشان داد این ترکیبات موجب افزایش بیان ژنهای کلیدی آنتیاکسیدانی از جمله PHGP و افزایش تولید آنزیم آنتیاکسیدانی PHGP میشوند. این ترکیبات علاوه بر کاهش استرس اکسیداتیو موجب حفظ تمامیت غشای سلولی از طریق کاهش اکسیداسیون لیپیدها در غشای سلولی نیز میشوند. همچنین نشان داده شد که ترکیبات قارچ گانودرما لوسیدوم از طریق غشای سالم سلولی وارد سلول میشوند و در آنجا واکنشهایی را علیه فرایند پیری تحریک میکنند [33]. همچنین مشخص شده است اثر ضدپیری مرتبط با آنتیاکسیدانی عصاره قارچ گانودرما آتروم (گونه دیگری از جنس گانودرما) بهخاطر فعالسازی اتوفاژی و کاهش تنش اکسیداتیو در میتوکندری سلولهای پیر است [34].
علاوه بر تحقیقات در شرایط آزمایشگاهی و حیوانی، کارآزماییهای بالینی نیز حاکی از تأثیر ضدپیری عصارههای قارچ گانودرما لوسیدوم از طریق مهار تنش اکسیداتیو هستند. نتایج یک کارآزمایی بالینی نشان داد مصرف قارچ گانودرما لوسیدوم غنی از پلیساکاریدها و تریترپنوئیدها (225 میلیگرم در روز بهمدت 6 ماه) از طریق مهار تنش اکسیداتیو میتواند اثرات ضدپیری داشته باشد [35].
اثر ضدپیری قارچ ریشی با جلوگیری و درمان اختلالات عصبی ـ شناختی
افزایش سن و تغییرات متعاقب آن، ریسکفاکتور مهمی برای بیماریهای رایج عصبی ـ شناختی یا تخریبکننده بافت عصبی (نورودژنراتیو) مانند اختلال شناختی خفیف، بیماری آلزایمر، بیماری عروق مغزی و پارکینسون محسوب میشود. شیوع بالای این دسته از اختلالات مغزی تحلیلرونده غیرقابلبرگشت در سراسر جهان توجیهکننده استفاده از روش های درمانی نوین و غیرتهاجمی با عوارض کمتر است [36]. بنابراین تأثیری که عصارهها یا ترکیبات قارچ گانودرما لوسیدوم میتواند بر درمان یا پیشگیری از بیماریهای نورودژنراتیو داشته باشد، بهطور مستقیم بر جلوگیری از فرایند پیری مؤثر است. در یک پژوهش آزمایشگاهی بر روی سلولهای گرانول مخچه، آپوپتوز القاشده توسط تنش اکسیداتیو ناشی از آباکسیژنه در کشت سلولی سلولهای گرانول مخچه موش صحرایی توسط پلیساکاریدهای قارچ گانودرما لوسیدوم خنثی شد [37]. در مطالعات آزمایشگاهی بعدی مشخص شد ترکیباتی از قارچ گانودرما لوسیدوم اثر محافظتی از سلولهای عصبی (نوروبلاستومای انسانی SH-SY5Y) در برابر استرس اکسیداتیو دارند. این ترکیبات شامل مروترپنوئیدهای آروماتیک بودند. از آنجایی که پیری خود یک فاکتور خطر برای بیماریهای تخریبکننده بافت عصبی (نظیر پارکینسون و آلزایمر) محسوب میشود، بنابراین نتایج این تحقیق، اساسی را برای کارآزماییهای بالینی برای کاربرد ترکیبات بهدستآمده از قارچ گانودرما لوسیدوم به منظور استفاده از اثرات ضدپیری آن از طریق محافظت در برابر بیماریهای تخریبکننده بافت عصبی فراهم میکند [16]. در یک مطالعه دیگر، اثر بالقوه عصاره اتانولی قارچ گانودرما لوسیدوم بر بیماریهای تخریبکننده بافت عصبی بررسی شد. این مطالعه بر روی سلولهای میکروگلیای موش تحریکشده با اندوتوکسین باکتریایی (لیپوپلیساکارید) انجام شد. سلولهای میکروگلیا شبیه به ماکروفاژها عمل میکنند و اولین سد دفاعی در مغز در برابر آسیبها، عفونتها و التهابات مغزی هستند، اما فعالیت بیش از اندازه آنها موجب تولید سایتوکاینهای التهابی و عوامل سیتوتوکسیک میشود که درنتیجه میتواند موجب ایجاد بیماریهای تخریبکننده بافت عصبی نظیر آلزایمر و اماس شود. این مطالعه نشان داد عصاره اتانولی قارچ گانودرما لوسیدوم از فعالسازی پروتئینهای هستهای کاپا ـ بی و نیز از اتصال اندوتوکسین به پذیرنده سلولی خود یعنی TLR4 و شروع مسیر التهابی جلوگیری میکند [38]. مکانیسم دقیق اثر عصاره قارچ گانودرما لوسیدوم در مطالعه مستقل بعدی تعیین و تأیید شد، بهطوریکه نشان داده شد عصاره قارچ گانودرما لوسیدوم در سلولهای میکروگلیای موش تحریکشده با اندوتوکسین باکتریایی میتواند از یکسو سطح سایتوکاینها و کموکاینها بهویژه کموکاین RANTES و MIP3α را بهطور بسیار زیادی کاهش دهد و از سوی دیگر بیان مجموعه ژنهای مرتبط با آلزایمر و پارکینسون یعنی CHUK ،NF-κB و IKBKE را کاهش دهد [39].
مطالعات حیوانی بر روی تأثیر عصارههای قارچ گانودرما لوسیدوم در جلوگیری از آسیب به بافت مغزی و جلوگیری از اختلالات نورودژنراتیو بهطور محسوسی اندک است. در مطالعهای بر روی موش سوری مدل آلزایمر (APP/PS1 transgenic mice) پلیساکاریدهای بهدستآمده از قارچ گانودرما لوسیدوم توانستند در دُز 30 میلیگرم برکیلوگرم وزن بدن (بهصورت گاواژ) تکثیر سلولهای پیشساز عصبی موش را افزایش دهند و از رسوب پروتئین آمیلوئید (یکی از شاخصهای بیماری آلزایمر) جلوگیری کنند. هر دوی این مکانیسمها به خاصیت ضدپیری قارچ گانودرما لوسیدوم نسبت داده است [40]. در این مطالعه همچنین نشان داده شد پلیساکاریدهای بهدستآمده از قارچ گانودرما لوسیدوم احتمالاً از طریق فعالسازیپذیرنده FGFR (که نقش مهمی در نورونزایی دارد) نقش آنتینورودژنراتیو خود را انجام میدهند. در مطالعه دیگری، عصاره حاوی تریترپنوئید قارچ گانودرما لوسیدوم (خلوص 28 درصد) در دُز 10 میلیگرم بر کیلوگرم وزن بدن (بهصورت گاواژ) به موشهای صحرایی که علائم پیری در آنها به واسطه دیگالاکتوز القا شده بود، تجویز شد. نتایج حاکی از اثر مثبت عصاره این قارچ در بهبود یادگیری و حافظه موشهای صحرایی پیر و کاهش سطح التهاب در آنها بود. همچنین اختلال در متابولیسم لیپید (که در اثر دیگالاکتوز القا شده بود) را تخفیف داد. این عصاره همچنین موجب بهبود مجموعه علائم مرتبط با پیری در بافت هیپوکامپ موشهای صحرایی پیر شد. در این مطالعه روشن شد که از نظر مکانیسم مولکولی، عصاره حاوی تریترپنوئید قارچ گانودرما لوسیدوم بیان ژنهای ضد آپوپتوز FOXO4 و SIRT1 (یکی از اعضای خانواده Sirtuin) را افزایش داد و مسیر تکثیر سلولی PI3K/Akt/mTOR را فعال و درنتیجه بیان ژنهای آپوپتوتیک (نظیر خانواده کاسپاز) را کاهش داد [41].
یکی از نکات جالب در مورد خواص آنتینورودژنراتیو قارچ گانودرما لوسیدوم این است که ترکیبات مؤثرهای که این خواص را به قارچ اعطا میکنند بهطور عمدهای به ترکیب و فرمولاسیون بستر کشت قارچ بستگی دارند. بهطور مشخص در طی یک تحقیق مقایسهای بر روی چندین بستر کشت نشان داده شده است که استفاده از کاه ـ کلش خالص گندم (یعنی بدون هیچ افزودنی دیگر در فرمولاسیون بستر کشت) بیشترین اثر مثبت را بر ترکیبات مفید دارویی میوه قارچ گانودرما لوسیدوم دارد. از نظر مولکولی و مکانیسم عمل، عصاره این قارچ خاصیت آنتینورودژنراتیو خود را از طریق کاهش فعالیت تیروزیناز و استیلکولین استراز به نمایش میگذارد [42].
به هر حال با توجه به یک مقاله مروری بسیار جدید، قارچ گانودرما لوسیدوم و بهویژه پلیساکاریدهای آن یکی از ترکیبات امیدبخش برای مقابله با اختلالات نورودژنراتیو هستند [43].
اثر ضدپیری قارچ ریشی با بهبود آسیب کلیوی ناشی از ایسکمی و برقراری مجدد جریان خون
کاملاً روشن شده است که همزمان با پیری بهعنوان یک ریسکفاکتور، آسیبهای کلیوی از جمله آسیب کلیوی ناشی از ایسکمی و برقراری مجدد جریان خون شدیدتر میشود [44, 45]. اثر پلیساکارید ـ پپتیدهای بهدستآمده از قارچ گانودرما لوسیدوم در بهبود آسیب کلیوی ناشی از ایسکمی و برقراری مجدد جریان خون بررسی شده است. هنگام برقراری مجدد جریان خون پس از ایسکمی، آسیبهای دیگری همچون تجمع کلسیم، نفوذ نوتروفیلها به داخل بافت کلیوی و تولید گونههای فعال اکسیژن به وجود میآید. تولید گونههای فعال اکسیژن در میتوکندری سلول، خود آسیبهای دیگری همچون آپوپتوز و آسیب به غشای سلولی را به همراه دارد. در یک مطالعه حیوانی بر روی موشهای دچار آسیب کلیوی ایسکمی نشان داده شد پلیساکارید ـ پپتیدهای بهدستآمده از قارچ گانودرما لوسیدوم در دُز 100 میلیگرم بر کیلوگرم وزن بدن بهصورت تزریق درونصفاقی بهمدت 7 روز قبل از القای آسیب کلیوی ایسکمی و برقراری مجدد جریان خون یا بهصورت درمان با شروع برقراری مجدد جریان خون توانستند ناهنجاری کلیوی و آسیبهای وارده به آن را کاهش دهند. این اثرات از طریق کاهش استرس اکسیداتیو و آپوپتوز ناشی از آن در میتوکندری اعمال شد [46].
تداخلات اثرات ضدپیری قارچ ریشی با داروهای شیمیدرمانی
یکی از موضوعات چالشبرانگیز در مورد قارچ گانودرما لوسیدوم و سایر ترکیبات گیاهی، احتمال اثرات ناشناخته و غیرمطلوب آنها بر سلولهای نرمال و تداخل با داروهای شیمیدرمانی است. در این ارتباط، یکی از موضوعات جالب آن است که خاصیت ضدپیری و ضدسرطانی ترکیبات قارچ گانودرما لوسیدوم از طریق حفاظت از DNA سلولی اعمال میشود و نمیتواند از طریق آسیب به DNA سلولی باشد، حال آنکه داروهای شیمیدرمانی از طریق آسیب به DNA سلولهای سرطانی به درمان سرطان کمک میکنند. نتایج یک تحقیق آزمایشگاهی با استفاده از روش القای فاژ درون سلول باکتریایی در اثر عوامل آسیبزننده به DNA باکتری (که در حقیقت یکی از واکنشهای SOS به یک باکتری در مقابل عوامل آسیبزننده به DNA آن است) با استفاده از داروی شیمیدرمانی دوکسوروبیسین (بهعنوان یک دارو با اثرات شناختهشده اتصال به DNA سلولی و تخریب آن) نشان داد عصارههای قارچ گانودرما لوسیدوم آسیبی به DNA وارد نمیکنند و بنابراین این عصارهها در کاربرد سنتی آنها بهعنوان ترکیبات ضدپیری کاربرد دارند [47].
مطالعه اثرات ضدپیری قارچ ریشی در جاندارن با ساختار ساده
علاوه بر پژوهشهای حیوانی بر روی موش، پژوهشهای دیگری در زمینه به تأخیر انداختن روند پیری در جانداران سادهتری مانند کرمهای لولهای و مخمرها در حال انجام است. بررسیهای انجامشده روی کرم لولهای الگانس (یک نوع نماتود با نام علمی کائنورابدیتیس الگانس) نشان داد قارچ ریشی اثر مطلوبی بر مقاومتر شدن این کرمها در برابر تنش اکسیداتیو و افزایش قابلتوجه طول عمرشان دارد.
در یک پژوهش، از کرم لولهای الگانس بهعنوان مدل جانوری برای بررسی اثر عصاره آبی قارچ ریشی علیه تنش اکسیداتیو و پیری استفاده شد. نتایج نشان داد قارچ ریشی اثر مطلوبی بر مقاومتر شدن این کرمها در برابر تنش اکسیداتیو و فلز سنگین Cr6+ و افزایش قابلتوجه طول عمر این جانوران دارد. براساس بررسیهای بیشتر، قارچ ریشی به کمک مسیر پیامرسانی mTOR/S6K و مسیر محدودیت غذایی از این کرمها در برابر آسیب فلزهای سنگین و علفکُش پاراکوآت محافظت کردند. این درحالی است که اثر قارچ ریشی بر طول عمر کرمهای لولهای عمدتاً به مسیر پیامرسانی سلولهای زاینده آنها بستگی دارد. از روش ریزآرایه DNA ، برای نمایش نمایه بیانی ژنها استفاده شد. در طول روند پیری، بیان 2746 ژن تغییر معنیداری پیدا کرد؛ بیان 2082 ژن، کم و بیان 664 ژن، زیاد شد که از این بین، روند بیان 34 ژن پس از تیمار نماتودهای مسن با گانودرما لوسیدوم، معکوس شد.
در این میان، روند افزایشی بیان 25 ژن در طول فرایند پیری، پس از تیمار با عصاره قارچ ریشی بهصورت معنیداری کم شد و پس از تجویز این عصاره، مهار از روی بیان 9 ژن در طول فرایند پیری برداشته شد. بیش از نیمی از این ژنها بهخوبی بررسی نشدهاند یا عملکرد آنها هنوز مشخص نیست. اما براساس پژوهشهای انجامشده، پروتئین smg-1 مسئول طول عمر کرم لولهای الگانس است. smg-1، سرین ـ ترئونین کینازی است که نقش حفاظتشدهای در تجزیه mRNA بهواسطه کدونهای بیمعنی در کرمها و پستانداران ایفا میکند [48].
همچنین چهار ترکیب ارگوسترولی جدید و خالص از اسپورهای قارچ ریشی (با نام گانودرمازید A ،B ،C و D) تهیه و خاصیت ضدپیری آنها در مخمر بررسی شده است. براساس نتایج، این ترکیبها طول عمر سویه همانندساز مخمر یعنی K6001 را بهطور معنیداری افزایش دادند. گانودرمازیدهای A ،B ،C و D بیان ژن UTH1 را تنظیم کردند. این ژن، مسئول افزایش طول عمر مخمر همانندساز است. خاصیت ضدپیری این ترکیبات در مخمر، قابل مقایسه با ترکیب مشهوری به نام رسوراترول است [49، 50].
بحث و نتیجهگیری
درمجموع، این مقاله مروری نشان میدهد عصارههای مختلف بهدستآمده از قارچ ریشی دارای خواص ضدپیری قابل اندازهگیری و قابل مشاهده بهویژه در سه بافت قلبی، کبدی و مغزی هستند. این اثرات عمدتاً از طریق تنظیم سیستم ایمنی، مقابله با اکسیداسیون، به دام انداختن رادیکالهای آزاد، افزایش دهیدروژنازهای میتوکندری، تقویت عناصر مجموعههای 1 و 2 زنجیره انتقال الکترون و پیشگیری از تحلیل عصبی ناشی از تنش اکسیداتیو اعمال میشوند. حضور مولکولهای فعال زیستی مختلف در این قارچ بهویژه پلیساکاریدها و تریترپنها اهمیت این قارچ را در تحقیقات مرتبط با پیری پررنگ کرده است (جدول شماره 2).


از آنجاییکه متابولیتهای زیستفعال قارچ ریشی افقهای جدیدی برای ساخت داروهای طبیعی جدید جهت جلوگیری از پیری در اختیار میگذارند، به دست آوردن یک تصویر کامل از تمام ترکیبات و عصارههای ضدپیری موجود در قارچ ریشی از اهمیت بالایی برخوردار است. اما همچنان محدودیتهایی وجود دارد، از جمله اینکه شواهد بالینی انسانی بیشتری برای ارائه توضیحی جامع از مکانیسمهای زیربنایی خاصیت ضدپیری قارچ ریشی مورد نیاز است. با توجه به وجود چندین گونه از قارچ جنس گانودرما و از جمله ریشی (گانودرما لوسیدوم) در محیط طبیعی ایران از یکسو و تأیید اثرات آنتیاکسیدانی قابل ملاحظه قارچهای دارویی بومی ایران در مقایسه با انواع تجاری آن از سوی دیگر، قارچهای بومی جنس گانودرما و بهخصوص قارچ ریشی در کشور ما میتواند در زمینه اثرات ضدپیری آن مورد مطالعه جدیتری قرار گیرد. اما در حال حاضر، جای خالی تحقیقات آزمایشگاهی، حیوانی و بالینی بر روی اثرات ضدپیری انواع بومی قارچهای جنس گانودرما در کشور ما احساس میشود. نتایج چنین تحقیقاتی علاوه بر ارزش علمی ـ پژوهشی، از حیث کاربرد در صنایع آرایشی ـ بهداشتی و دارویی در کشور ما مهم تلقی میشود، چراکه میتواند سنگ بنای صحیحی را برای استارت آپها و شرکتهای دانشبنیان علاقهمند به ورود به کاربردهای آرایشی ـ بهداشتی عصارهها و ترکیبات قارچ ریشی پایهگذاری کند و از برخی سادهانگاریهای غیرعلمی متکی بر نگاه صرفاً تجاری در مورد خواص ضدپیری قارچ ریشی و تأثیر منفی آن بر سلامت و بهداشت عمومی جامعه جلوگیری نماید. مطالعات حیوانی بر روی تأثیر عصارههای قارچ گانودرما لوسیدوم در جلوگیری از آسیب به بافت مغزی و جلوگیری از اختلالات نورودژنراتیو بهطور محسوسی اندک است. بدون این مطالعات امکان کاربردی کردن نتایج آزمایشگاهی در کارآزماییهای بالینی وجود ندارد. همچنین مطالعات حیوانی و کارآزمایی بالینی باید با ترکیبات شناختهشده منفرد و جدا (و نه عصاره) انجام شود. در سالهای اخیر تمرکز مطالعات بر کشف مکانیسمهای مولکولی و انجام آزمایشات حیوانی و کارآزمایی بالینی بوده است.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
هیچ دادهای در حمایت از نتیجهگیری ما در پژوهش حاضر ساخته و دستکاری نشده است. تمام مطالعات در دسترس در این زمینه، برای بررسی گنجانده شده است.
حامی مالی
این تحقیق هیچگونه کمک مالی از سازمانهای تأمین مالی در بخشهای عمومی ، تجاری یا غیرانتفاعی دریافت نکرده است.
مشارکت نویسندگان
گردآوری دادهها و جستوجو در منابع: شراره رضائیان؛ نوشتن و ویرایش مقاله: حمیدرضا پوریانفر؛ تصحیح و تأیید نسخه نهایی مقاله: شراره رضائیان و حمیدرضا پوریانفر.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
References
1.Rezaeian SP, Hamid R. [Principles of cultivation of medicinal mushrooms the Iran perspective (Persian)]. Mashhad: Jahad Daneshgahi Publications; 2017.
2.Mojani Qomi MS, Hatami M. [Effects of powder, extracts, and components of Ganoderma lucidum in treatment of diabetes (Persian)]. Journal of Guilan University of Medical Sciences. 2021; 29(4):86-101. [DOI:10.32598/JGUMS.29.4.1509.1]
3.Wang J, Cao B, Zhao H, Feng J. Emerging roles of ganoderma lucidum in anti-aging. Aging and Disease. 2017; 8(6):691-707.[DOI:10.14336/AD.2017.0410] [PMID] [PMCID]
4.Tajalli F, Malekzadeh K, Soltanian H, Janpoor J, Rezaeian S, Pourianfar HR. Antioxidant capacity of several Iranian, wild and cultivated strains of the button mushroom. Brazilian Journal of Microbiology. 2015; 46(3):769-76. [DOI:10.1590/S1517-838246320140180] [PMID] [PMCID]
5.Kayali R, Çakatay U, Akçay T, Altuğ T. Effect of alpha-lipoic acid supplementation on markers of protein oxidation in post-mitotic tissues of ageing rat. Cell Biochemistry and Function. 2006; 24(1):79-85. [DOI:10.1002/cbf.1190] [PMID]
6.Muscari C, Giaccari A, Giordano E, Clô C, Guarnieri C, Caldarera CM. Role of reactive oxygen species in cardiovascular aging. In: Krause EG, Vetter R, editors. Biochemical mechanisms in heart function. Boston: Springer; 1996. [DOI:10.1007/978-1-4613-1279-6_22]
7.Vulevic J, Drakoularakou A, Yaqoob P, Tzortzis G, Gibson GR. Modulation of the fecal microflora profile and immune function by a novel trans-galactooligosaccharide mixture (B-GOS) in healthy elderly volunteers. The American Journal of Clinical Nutrition. 2008; 88(5):1438-46. [DOI:10.3945/ajcn.2008.26242] [PMID]
8.Alimadadi N, Pourianfar HR, Amoozegar MA, Zabihi SS, Mahdizadeh V, Shahzadeh Fazeli SA. Molecular identification of some wild medicinal macrofungi from Northern Iran. Studies in Fungi. 2019; 4(1):26-36. [DOI:10.5943/sif/4/1/4]
9.Shayan A. [Field guide to Iran’s mushrooms (Persian)]. Iran: Iran Shenasi Publications; 2020. [Link]
10.Keypour S, Riahi H, Rafati H. A review on the biological active compounds and medicinal properties of Ganoderma lucidum. Journal of Medicinal Plants. 2013; 12(46):13-24. [Link]
11.Rezaeian S, Saadatmand S, Nejad Sattari T, Mirshamsi Kakhki A. Antioxidant potency of Iranian newly cultivated wild mushrooms of Agaricus and Pleurotus species. Biomedical Research. 2015; 26(3):534-42. [Link]
12.Xia D. Effects of Ganoderma polysaccharides on immune function in mice. Journal of Beijing Medical University. 1989; 21:533-7. [Link]
13.Lei LS, Lin ZB. [Effects of Ganoderma polysaccharides on the activity of DNA polymerase alpha of splenocytes and immune function in aged mice (Chinese)]. Yao Xue Xue Bao. 1993; 28(8):577-82. [PMID]
14.Li WJ, Nie SP, Peng XP, Liu XZ, Li C, Chen Y, et al. Ganoderma atrum polysaccharide improves age-related oxidative stress and immune impairment in mice. Journal of Agricultural and food Chemistry. 2012; 60(6):1413-8. [DOI:10.1021/jf204748a] [PMID]
15.Yuan S, Yang Y, Li J, Tan X, Cao Y, Li S, et al. Ganoderma lucidum Rhodiola compound preparation prevent D-galactose-induced immune impairment and oxidative stress in aging rat model. Scientific Reports. 2020; 10(1):19244. [DOI:10.1038/s41598-020-76249-1] [PMID] [PMCID]
16.Wang C, Liu X, Lian C, Ke J, Liu J. Triterpenes and aromatic meroterpenoids with antioxidant activity and neuroprotective effects from Ganoderma lucidum. Molecules. 2019; 24(23):4353. [DOI:10.3390/molecules24234353] [PMID] [PMCID]
17.Trushina E, McMurray CT. Oxidative stress and mitochondrial dysfunction in neurodegenerative diseases. Neuroscience. 2007; 145(4):1233-48. [DOI:10.1016/j.neuroscience.2006.10.056] [PMID]
18.Sudheesh NP, Ajith TA, Ramnath V, Janardhanan KK. Therapeutic potential of Ganoderma lucidum (Fr.) P. Karst. against the declined antioxidant status in the mitochondria of post-mitotic tissues of aged mice. Clinical Nutrition. 2010; 29(3):406-12.[DOI:10.1016/j.clnu.2009.12.003] [PMID]
19.Cherian E, Sudheesh NP, Janardhanan KK, Patani G. Free-radical scavenging and mitochondrial antioxidant activities of Reishi-Ganoderma lucidum (curt: Fr) P. Karst and Arogyapacha-Trichopus zeylanicus Gaertn extracts. Journal of Basic and Clinical Physiology and Pharmacology. 2009; 20(4):289-307.[DOI:10.1515/JBCPP.2009.20.4.289] [PMID]
20.Ajith TA, Sudheesh NP, Roshny D, Abishek G, Janardhanan KK. Effect of Ganoderma lucidum on the activities of mitochondrial dehydrogenases and complex I and II of electron transport chain in the brain of aged rats. Experimental Gerontology. 2009; 44(3):219-23. [DOI:10.1016/j.exger.2008.11.002] [PMID]
21.Yu Q, Nie S, Li W, Li J, Xie M. Anti-aging effect of Polysaccharide of Ganoderma atrum on D-Galactose-induced mouse aging model. Shi Pin Ke Xue (Food Science). 2009; 30(17):305-7. [Link]
22.Li WJ, Nie SP, Xie MY, Yu Q, Chen Y, He M. Ganoderma atrum polysaccharide attenuates oxidative stress induced by d-galactose in mouse brain. Life Sciences. 2011; 88(15-16):713-8. [DOI:10.1016/j.lfs.2011.02.010] [PMID]
23.Liu K, Liu YY, Sun F, Ren LQ. Anti-aging effect of recombinant Ganoderma lucidum immunomodulatory protein on aging model mice. Chinese Older Medical Joural. 2018; 38:5539-40. [Link]
24.Lin X, Pan W. Ganoderma lucidum polysaccharide anti-skin senile function research. Journal of Liaoning University of Traditional Chinese Medicine. 2009; 11:174-5. [Link]
25.Dringen R, Gutterer JM, Hirrlinger J. Glutathione metabolism in brain metabolic interaction between astrocytes and neurons in the defense against reactive oxygen species. European Journal of Biochemistry. 2000; 267(16):4912-6. [DOI:10.1046/j.1432-1327.2000.01597.x] [PMID]
26.Xiang L, Jie L. Ganoderma lucidum polysaccharide prevents oxidation and skin aging. Chinese Journal of Tissue Engineering Research. 2013; 17(41):7272-7. [DOI:10.3969/j.issn.2095-4344.2013.41.013]
27.You YH, Lin ZB. Protective effects of Ganoderma lucidum polysaccharides peptide on injury of macrophages induced by reactive oxygen species. Acta Pharmacologica Sinica. 2002; 23(9):787-91. [Link]
28.Li Y, Liang W, Han Y, Zhao W, Wang S, Qin C. Triterpenoids and polysaccharides from Ganoderma lucidum Improve the Histomorphology and function of testes in Middle-Aged male mice by alleviating oxidative stress and cellular apoptosis. Nutrients. 2022; 14(22):4733. [DOI:10.3390/nu14224733] [PMID] [PMCID]
29.Smina TP, Joseph J, Janardhanan KK. Ganoderma lucidum total triterpenes prevent γ-radiation induced oxidative stress in Swiss albino mice in vivo. Redox Report. 2016; 21(6):254-61. [DOI:10.1080/13510002.2015.1126098] [PMID] [PMCID]
30.Hu S, Huang J, Pei S, Ouyang Y, Ding Y, Jiang L ,et al. Ganoderma lucidum polysaccharide inhibits UVB-induced melanogenesis by antagonizing cAMP/PKA and ROS/MAPK signaling pathways. Journal of Cellular Physiology. 2019; 234(5):7330-40. [DOI:10.1002/jcp.27492] [PMID]
31.Zhao Y, Li Q, Wang M, Wang Y, Piao C, Yu H, et al. Structural characterization of polysaccharides after fermentation from Ganoderma lucidum and its antioxidant activity in HepG2 cells induced by H2O2. Food Chemistry: X. 2023;18:100682. [PMID]
32.Lee YH, Kim JH, Song CH, Jang KJ, Kim CH, Kang JS, et al. Ethanol extract of Ganoderma lucidum augments cellular anti-oxidant defense through activation of Nrf2/HO-1. Journal of Pharmacopuncture. 2016; 19(1):59-69. [DOI:10.3831/KPI.2016.19.008] [PMID] [PMCID]
33.Ding W, Zhang X, Yin X, Zhang Q, Wang Y, Guo C, et al. Ganoderma lucidum aqueous extract inducing PHGPx to inhibite membrane lipid hydroperoxides and regulate oxidative stress based on single-cell animal transcriptome. Scientific Reports. 2022; 12(1):3139. [DOI:10.1038/s41598-022-06985-z] [PMID] [PMCID]
34.Guo M, Zhang K, Zhang D, Zhou Y, Liu L, Wu Y, et al. Ganoderma atrum polysaccharide relieves mitochondrial dysfunction to alleviate hydrogen peroxide-induced senescence via activating autophagy. Journal of Future Foods. 2022; 2(3):241-52. [DOI:10.1016/j.jfutfo.2022.06.005]
35.Chiu HF, Fu HY, Lu YY, Han YC, Shen YC, Venkatakrishnan K, et al. Triterpenoids and polysaccharide peptides-enriched Ganoderma lucidum: A randomized, double-blind placebo-controlled crossover study of its antioxidation and hepatoprotective efficacy in healthy volunteers. Pharmaceutical Biology. 2017; 55(1):1041-6. [DOI:10.1080/13880209.2017.1288750] [PMID] [PMCID]
36.Komaki A, Salehi I, Keymoradzadeh A, Taheri Azandaryani M, Golipoor Z. [Effect of long-term exposure to extremely low-frequency electromagnetic fields on β-amyloid deposition and microglia cells in an alzheimer model in rats (Persian)]. Journal of Guilan University of Medical Sciences. 2021; 30(3):218-29. [DOI:10.32598/JGUMS.30.3.1609.2]
37.Sun XZ, Liao Y, Li W, Guo LM. Neuroprotective effects of ganoderma lucidum polysaccharides against oxidative stress-induced neuronal apoptosis. Neural Regeneration Research. 2017; 12(6):953-8. [DOI:10.4103/1673-5374.208590] [PMID] [PMCID]
38.Yoon HM, Jang KJ, Han MS, Jeong JW, Kim GY, Lee JH, et al. Ganoderma lucidum ethanol extract inhibits the inflammatory response by suppressing the NF-κB and toll-like receptor pathways in lipopolysaccharide-stimulated BV2 microglial cells. Experimental and Therapeutic Medicine. 2013; 5(3):957-63. [DOI:10.3892/etm.2013.895] [PMID] [PMCID]
39.Hilliard A, Mendonca P, Soliman KFA. Involvement of NFƙB and MAPK signaling pathways in the preventive effects of Ganoderma lucidum on the inflammation of BV-2 microglial cells induced by LPS. Journal of Neuroimmunology. 2020; 345:577269.[DOI:10.1016/j.jneuroim.2020.577269] [PMID] [PMCID]
40.Huang S, Mao J, Ding K, Zhou Y, Zeng X, Yang W, et al. Polysaccharides from Ganoderma lucidum promote cognitive function and neural progenitor proliferation in mouse model of alzheimer's disease. Stem Cell Reports. 2017; 8(1):84-94.[DOI:10.1016/j.stemcr.2016.12.007] [PMID] [PMCID]
41.Wang A, Xiao C, Zheng J, Ye C, Dai Z, Wu Q, et al. Terpenoids of Ganoderma lucidum reverse cognitive impairment through attenuating neurodegeneration via suppression of PI3K/AKT/mTOR expression in vivo model. Journal of Functional Foods. 2020; 73:104142. [DOI:10.1016/j.jff.2020.104142]
42.Ćilerdžić JL, Sofrenić IV, Tešević VV, Brčeski ID, Duletić-Laušević SN, Vukojević JB, et al. Neuroprotective potential and chemical profile of alternatively cultivated Ganoderma lucidum basidiocarps. Chemistry & Biodiversity. 2018; 15(5):e1800036. [DOI:10.1002/cbdv.201800036] [PMID]
43.Liu X, Yang L, Li G, Jiang Y, Zhang G, Ling J. A novel promising neuroprotective agent: Ganoderma lucidum polysaccharide. International Journal of Biological Macromolecules. 2023; 229:168-80. [DOI:10.1016/j.ijbiomac.2022.12.276] [PMID]
44.Kusaka J, Koga H, Hagiwara S, Hasegawa A, Kudo K, Noguchi T. Age-dependent responses to renal ischemia-reperfusion injury. The Journal of Surgical Research. 2012; 172(1):153-8. [DOI:10.1016/j.jss.2010.08.034] [PMID]
45.Muroya Y, He X, Fan L, Wang S, Xu R, Fan F, et al. Enhanced renal ischemia-reperfusion injury in aging and diabetes. American Journal of Physiology. 2018; 315(6):F1843-54. [DOI:10.1152/ajprenal.00184.2018] [PMID] [PMCID]
46.Zhong D, Wang H, Liu M, Li X, Huang M, Zhou H, et al. Ganoderma lucidum polysaccharide peptide prevents renal ischemia reperfusion injury via counteracting oxidative stress. Scientific Reports. 2015; 5:16910. [DOI:10.1038/srep16910] [PMID] [PMCID]
47.Gurovic MSV, Viceconte FR, Pereyra MT, Bidegain MA, Cubitto MA. DNA damaging potential of Ganoderma lucidum extracts. Journal of Ethnopharmacology. 2018; 217:83-8. [DOI:10.1016/j.jep.2018.02.005] [PMID]
48.Cuong VT, Chen W, Shi J, Zhang M, Yang H, Wang N, et al. The anti-oxidation and anti-aging effects of Ganoderma lucidum in Caenorhabditis elegans. Experimental Gerontology. 2019; 117:99-105. [DOI:10.1016/j.exger.2018.11.016] [PMID]
49.Weng Y, Xiang L, Matsuura A, Zhang Y, Huang Q, Qi J. Ganodermasides A and B, two novel anti-aging ergosterols from spores of a medicinal mushroom Ganoderma lucidum on yeast via UTH1 gene. Bioorganic & Medicinal Chemistry. 2010; 18(3):999-1002. [DOI:10.1016/j.bmc.2009.12.070] [PMID]
50.Weng Y, Lu J, Xiang L, Matsuura A, Zhang Y, Huang Q, et al. Ganodermasides C and D, two new anti-aging ergosterols from spores of the medicinal mushroom Ganoderma lucidum. Bioscience, Biotechnology, and Biochemistry. 2011; 75(4):800-3. [DOI:10.1271/bbb.100918] [PMID]
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |










