دوره 32، شماره 4 - ( 10-1402 )
جلد 32 شماره 4 صفحات 317-308 |
برگشت به فهرست نسخه ها
Research code: IR.IAU.SHAHROOD.REC.1398.049
Ethics code: IR.IAU.SHAHROOD.REC.1398.049
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Yahyaei B, Babaei H, Khojasteh L, Arminfar A, Jorjani A, Jannati Toupkanloo K et al . Histopathological Study of the Kidney Tissue of Neonatal Rats Born From Mothers Receiving Short-term and Long-term Ketamine Injections. JGUMS 2024; 32 (4) :308-317
URL: http://journal.gums.ac.ir/article-1-2577-fa.html
URL: http://journal.gums.ac.ir/article-1-2577-fa.html
یحیایی بهروز، بابایی حسام الدین، خجسته لیلا، آرمین فر عارف، جرجانی علی، جنتی توپکانلو کیمیا و همکاران.. مطالعه هیستوپاتولوژی کلیه در موشهای صحرایی نوزاد حاصل از مادران دریافتکننده دُزهای کوتاهمدت و بلندمدت کتامین تزریقی. مجله علوم پزشکی گیلان. 1402; 32 (4) :308-317
بهروز یحیایی1 

 ، حسام الدین بابایی2
، حسام الدین بابایی2 

 ، لیلا خجسته1
، لیلا خجسته1 

 ، عارف آرمین فر*3
، عارف آرمین فر*3 

 ، علی جرجانی1
، علی جرجانی1 

 ، کیمیا جنتی توپکانلو2
، کیمیا جنتی توپکانلو2 

 ، علیرضا عوض زاده2
، علیرضا عوض زاده2 




 ، حسام الدین بابایی2
، حسام الدین بابایی2 

 ، لیلا خجسته1
، لیلا خجسته1 

 ، عارف آرمین فر*3
، عارف آرمین فر*3 

 ، علی جرجانی1
، علی جرجانی1 

 ، کیمیا جنتی توپکانلو2
، کیمیا جنتی توپکانلو2 

 ، علیرضا عوض زاده2
، علیرضا عوض زاده2 


1- بخش بافت شناسی، گروه پزشکی، دانشکده علوم پزشکی، دانشگاه آزاد اسلامی شاهرود، شاهرود، ایران
2- گروه پزشکی، کمیته تحقیقات دانشجویی، دانشکده علوم پزشکی، دانشگاه آزاد اسلامی شاهرود، شاهرود، ایران
3- . گروه پزشکی، کمیته تحقیقات دانشجویی، دانشکده علوم پزشکی، دانشگاه آزاد اسلامی شاهرود، شاهرود، ایران
2- گروه پزشکی، کمیته تحقیقات دانشجویی، دانشکده علوم پزشکی، دانشگاه آزاد اسلامی شاهرود، شاهرود، ایران
3- . گروه پزشکی، کمیته تحقیقات دانشجویی، دانشکده علوم پزشکی، دانشگاه آزاد اسلامی شاهرود، شاهرود، ایران
متن کامل [PDF 6509 kb]
(473 دریافت)
| چکیده (HTML) (2012 مشاهده)
References
1.Hoggard A, Shienbaum R, Mokhtar M, Singh P. Gaseous anesthetics. 2023 Apr 17. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023. [PMID]
2.Roy K, Panigrahi M, Mukhopadhyay B, Bisak S, Kumar B. Efficacy of preoperative melatonin and ramelteon (melatonin agonist) therapy on dose requirement of propofol for induction of general anaesthesia: A comparative prospective study. Indian Journal of Clinical Anaesthesia. 2020; 7(1):172-6. [DOI:10.18231/j.ijca.2020.030]
3.Kelz MB, Mashour GA. The biology of general anesthesia from paramecium to primate. Current Biology. 2019; 29(22):R1199-R210. [DOI:10.1016/j.cub.2019.09.071] [PMID]
4.Iqbal SZ, Mathew SJ. Ketamine for depression clinical issues. Advances in Pharmacology (San Diego, Calif.). 2020; 89:131-62. [DOI:10.1016/bs.apha.2020.02.005] [PMID]
5.Huang W, Wu T, Wu K. Zebrafish (Danio rerio): A potential model to assess developmental toxicity of ketamine. Chemosphere. 2022; 291(Pt 3):133033. [DOI:10.1016/j.chemosphere.2021.133033] [PMID]
6.Le Daré B, Pelletier R, Morel I, Gicquel T. [History of Ketamine: An ancient molecule that is still popular today (French)]. Annales Pharmaceutiques Francaises. 2022; 80(1):1-8. [DOI:10.1016/j.pharma.2021.04.005] [PMID]
7.Tarwade P, Smischney NJ. Endotracheal intubation sedation in the intensive care unit. World Journal of Critical Care Medicine. 2022; 11(1):33-9. [DOI:10.5492/wjccm.v11.i1.33] [PMID]
8.Kohtala S. Ketamine-50 years in use: From anesthesia to rapid antidepressant effects and neurobiological mechanisms. Pharmacological Reports. 2021; 73(2):323-45. [DOI:10.1007/s43440-021-00232-4] [PMID]
9.Mihaljević S, Pavlović M, Reiner K, Ćaćić M. Therapeutic mechanisms of ketamine. Psychiatria Danubina. 2020; 32(3-4):325-33. [Link]
10.Jonkman K, Dahan A, van de Donk T, Aarts L, Niesters M, van Velzen M. Ketamine for pain. F1000Research. 2017; 6:F1000 Faculty Rev-1711. [DOI:10.12688/f1000research.11372.1] [PMID]
11.Bokor G, Anderson PD. Ketamine: An update on its abuse. Journal of Pharmacy Practice. 2014; 27(6):582-6. [DOI:10.1177/0897190014525754] [PMID]
12.Degenhardt L, Dunn M. The epidemiology of GHB and ketamine use in an Australian household survey. International Journal of Drug Policy. 2008; 19(4):311-6. [DOI:10.1016/j.drugpo.2007.08.007] [PMID]
13.Dargan PI, Wood DM. Recreational drug use in the Asia Pacific region: Improvement in our understanding of the problem through the UNODC programmes. Journal of Medical Toxicology. 2012; 8(3):295-9. [DOI:10.1007/s13181-012-0240-4] [PMID]
14.Kokane SS, Armant RJ, Bolaños-Guzmán CA, Perrotti LI. Overlap in the neural circuitry and molecular mechanisms underlying ketamine abuse and its use as an antidepressant. Behavioural Brain Research. 2020; 384:112548. [DOI:10.1016/j.bbr.2020.112548] [PMID]
15.Hashemnia M, Javedani M, Nikoosafat Z, Abdoli Jamoor S. [Study of hematological, biochemical and histopathological changes due to long-term Administration of Ketamine in Rat (Persian)]. Journal of Rafsanjan University of Medical Sciences. 2018; 17(7):639-56. [Link]
16.Cheek TG, Baird E. Anesthesia for nonobstetric surgery: Maternal and fetal considerations. Clinical Obstetrics and Gynecology. 2009; 52(4):535-45. [DOI:10.1097/GRF.0b013e3181c11f60] [PMID]
17.Natoli S. The multiple faces of ketamine in anaesthesia and analgesia. Drugs in Context. 2021; 10:2020-12-8. [DOI:10.7573/dic.2020-12-8] [PMID]
18.Delpire E, Gagnon KB. Water homeostasis and cell volume maintenance and regulation. Current Topics in Membranes. 2018; 81:3-52. [DOI:10.1016/bs.ctm.2018.08.001] [PMID]
19.Yahyaei B, Khojasteh L, Saeedmehr M. [The effects of ketamine on balance behavior and histology changes of cerebellum in short-and long-term anesthesia in rats (Persian)]. Journal Neyshabur University of Medical Sciences. 2018; 6(1):53-69. [Link]
20.Yahyaei B, Khojasteh L, Alamdari YJ. [The effect of ketamine anesthesia on balance behavior and histopathological changes of the cerebellum in rat neonates (Persian)]. Journal of North Khorasan University of Medical Sciences. 2023; 15(1):52-9. [DOI:10.32592/nkums.15.1.52]
21.Barrett W, Buxhoeveden M, Dhillon S. Ketamine: A versatile tool for anesthesia and analgesia. Current Opinion in Anesthesiology. 2020; 33(5):633-8. [DOI:10.1097/ACO.0000000000000916] [PMID]
22.Ritter P, Findeis H, Bauer M. Ketamine in the treatment of depressive episodes. Pharmacopsychiatry. 2020; 53(2):45-50. [DOI:10.1055/a-0991-0582] [PMID]
23.Zhao T, Li Y, Wei W, Savage S, Zhou L, Ma D. Ketamine administered to pregnant rats in the second trimester causes long-lasting behavioral disorders in offspring. Neurobiology of Disease. 2014; 68:145-55. [DOI:10.1016/j.nbd.2014.02.009] [PMID]
24.McCann ME, Soriano SG. Does general anesthesia affect neurodevelopment in infants and children? BMJ. 2019; 367:l6459. [DOI:10.1136/bmj.l6459] [PMID]
25.John Shung-Lai L, Wai-Kit M. Urological effects of ketamine abuse. In: Ane Claudia Fernandes N, editor. Biomarkers and bioanalysis overview. Rijeka: IntechOpen; 2020. [DOI:10.5772/intechopen.91283]
26.Jang MY, Shen JT, Geng JH, Wang HS, Chuang SM, Lee YC, et al. Ketamine induced renal fibrosis in a ketamine addition rat model. Urological Science. 2017; 28(3):123-7. [DOI:10.1016/j.urols.2016.12.004]
27.Ou SH, Wu LY, Chen HY, Huang CW, Hsu CY, Chen CL, et al. Risk of renal function decline in patients with ketamine-associated uropathy. International Journal of Environmental Research and Public Health. 2020; 17(19):7260. [DOI:10.3390/ijerph17197260] [PMID]
متن کامل: (790 مشاهده)
مقدمه
علم بیهوشی با کم کردن درد بیماران حین جراحی، کمک زیادی به پیشرفت علم پزشکی کرده و موجب شده است اعمال جراحی به سهولت انجام شود. بیهوشی به شیوه مدرن اولین بار در اکتبر سال 1846 میلادی بهوسیله اِتر صورت گرفت [1]. بیهوشی عمومی یک کمای القاشده مطابق قاعده طبی و از دست دادن رفلکسهای محافظتی درنتیجه تجویز یک یا تعداد بیشتری عامل بیهوشی است [2]. اصطلاح بیهوشی از کلمهای یونانی به معنای بیحسی گرفته شده است و بر حالتی دلالت میکند که در آن ارگانیسم دیگر مستعد درک محرکهای دنیای بیرون نیست [3]. در سال 1970 با پیشرفت مواد و شیوههای بیهوشی، پزشکان برای اولین بار از کتامین به منظور القای بیهوشی و بیدردی کوتاهمدت بالینی بهره بردند [4]. درواقع کتامین یک آنتاگونیست غیر رقابتی گیرنده گلوتامات است [5]. این دارو از فن سیکلیدین مشتق شده و بهعنوان یک داروی بیحسکننده تزریقی، بیهوشکننده انفکاکی، آرامبخش، ضدافسردگی و همچنین یک داروی تفریحی غیرقانونی استفاده میشود [6]. دفع کتامین از بدن توسط اندامهای کبد و کلیه صورت میگیرد [7].
در طول 50 سال گذشته، کتامین جایگاه خود را در پزشکی انسانی و دامپزشکی بهعنوان یک داروی بیهوشکننده مهم با کاربردهای فراوان در سطح جهان مستحکم کرده است [8]. استفاده از این دارو در بدن انسان میتواند همراه با عوارض خفیف یا حادی باشد. عوارض جانبی حاد مانند افزایش ترشح بزاق، افزایش ضربان قلب، فشار شریانی سیستماتیک و فشار داخل جمجمهای میباشد. بااینحال عارضه جانبی عمده تجویز کتامین ایجاد شرایط سایکومیمتیک و دلیریوم است [9]. کتامین ازجمله موادی است که علاوهبر خاصیت ضددردی در مهمانیهای غیرقانونی مورد سوء مصرف قرار میگیرد و مصرف بیش از اندازه آن میتواند حتی باعث مرگ شود [10, 11]. درواقع کتامین دارویی محبوب جهت سوءمصرف در جمعیتهای مختلف ازجمله در بین زنان باردار در غرب و جنوب آسیا است [12 ,13]. همچنین استفاده درمانی آن بهعنوان داروی ضدافسردگی درکنار استفاده تفریحی آن، باعث شیوع چشمگیر مصرف کتامین در سراسر جهان شده است [14].
چنانچه این دارو در مادران باردار یا حیوانات باردار مصرف شود، ممکن است عوارضی در جنین و نوزادان آنها بر جای بگذارد. بهطور مثال اخیراً مسمومیتها و عوارض بالقوه ایجادشده توسط کتامین، نگرانیهای جدی را در مورد استفاده غیرقانونی آن در دوران بارداری، نوزادی و دوران کودکی ایجاد کرده است. اثرات نامطلوب کتامین بهعنوان اختلالات رشدی و چند اندامی، مسمومیت قلبی، عصبی و اسکلتی شناخته شده است [5].
همانطورکه پیشتر اشاره شد کتامین میتواند ساختار و عملکرد ارگانهای مختلف بدن را تحت تأثیر قرار دهد؛ برای مثال این دارو در کلیه میتواند تغییراتی را در سطوح هیستولوژی و فیزیولوژی ایجاد کند [15].
ازآنجاییکه حدود 2 درصد از زنان باردار بهعلت مشکلات مربوط به حاملگی خود یا سایر بیماریها نیاز به عمل جراحی پیدا میکنند و کتامین یک انتخاب رایج جهت بیهوشی است [16, 17]. ازطرفی، هنوز اثرات بلندمدت این دارو بر بافتهای بدن ناشناخته مانده است [4]. همچنین سلامت و کارکرد صحیح اندام کلیه در بدن انسان و نوزادان تضمینکننده برقراری هموستاز بدن است [18]. به همین دلیل ضرورت انجام پژوهشهای این چنینی بیش از پیش احساس میشود و بررسی و پژوهش پیرامون عوارض جانبی استفاده آن بر بافت کلیه انسان، سایر مهرهداران و همچنین نوزادان حاصل از آنها حائز اهمیت است. بنابراین در این تحقیق به بررسی اثر این داروی بیهوشی بر بافت کلیه نوزادان موشهای صحرایی بهدنیاآمده از مادران دریافتکننده پرداخته میشود.
روشها
حیوانات
این پژوهش از نوع آزمایشی است که در آن از 15 سر موش صحرایی ماده از نژاد ویستار با وزن 2±200 گرم با رعایت تمام قوانین اخلاق پزشکی استفاده شد. ویژگیهای محل نگهداری برای تمامی حیوانات کاملاً یکسان و شامل درجه حرارت 2±22 درجه سانتیگراد و رطوبت نسبی 50-55 درصد بود و دوره 12 ساعت روشنایی و 12 ساعت تاریکی درنظر گرفته شد و تمامی موشها رژیم غذایی نرمال (خوراک مخصوص جوندگان شرکت مینوصباح) و آب شهری در ظرفی از جنس PVC دریافت کردند؛ در قفسهای مخصوص از جنس پلی ماکرولون شفاف نگهداری شدند که هر روز تمیز و ضدعفونی میشدند [19].
گروههای موردمطالعه
این موشها بهمدت 1 هفته در درجه حرارت اتاق و رطوبت 60 درصد با روزی 12 ساعت روشنایی و 12 ساعت تاریکی، جهت عادت و حذف عوامل تأثیرگذار محیطی نگهداری و پس از این مدت موشها بهطورجداگانه در قفس استاندارد جداگانه قرار داده شدند. پس از 1 هفته سازگاری با محیط، موشهای صحرایی بهصورت تصادفی به 3 گروه 5 تایی شامل گروه کنترل، گروه دریافتکننده دُز بلندمدت کتامین، گروه دریافتکننده دُز کوتاهمدت و مکرر کتامین تقسیم شدند [20].
برای تقسیمبندی تصادفی موشها، ابتدا 15 موش ماده وزنگیری شدند و میانگین وزنی آنها محاسبه شد. سپس موشهای صحرایی ماده جهت باردار شدن آماده میشدند. به منظور ایجاد بارداری در موشهای صحرایی در هر گروه از 2 موش صحرایی نر استفاده شد. تأیید بارداری پس از مشاهده پلاک واژنی انجام شد. هر موش مادر بهطور متوسط بین 4 الی 14 نوزاد در هر بارداری به دنیا میآورد [19].
بیهوشی
برای تنظیم دُز کتامین، در طول بارداری موشها که حدود 19 الی 21 روز طول کشید، بهصورت مرتب وزنکشی انجام شد و باتوجهبه وزن جدید موش میزان مختلفی از کتامین بهصورت داخل صفاقی تزریق میشد. در این پژوهش موشهای صحرایی ماده باردار در گروه بیهوشی بلندمدت با کتامین به تعداد دفعات 1 بار در هفته با دُز 75 میلیگرم بر کیلوگرم بیهوش میشدند و موشهای صحرایی ماده باردار در گروه بیهوشی کوتاهمدت و مکرر با کتامین به تعداد دفعات 3 بار در هفته و هر مرتبه با دُز 25 میلیگرم بر کیلوگرم بیهوش میشدند. تزریق کتامین از 1 هفته قبل از بارداری تا 1 هفته پس از بارداری بهصورت هفتگی و منظم بهصورت درون صفاقی انجام شد [20].
نمونهگیری و آمادهسازی بافتی
پس از زایمان و طی دوره شیردهی به منظور نمونهگیری بافتی 10 عدد نوزاد موش صحرایی از هر گروه بهصورت نمونهگیری تصادفی انتخاب شدند که جمعاً 30 نوزاد موش صحرایی برای نمونهگیری بافتی انتخاب شد. در ابتدا تمامی موشها شب قبل از قربانی شدن بهمدت 10 ساعت ناشتا بودند تا هم وزن خالص موشها بدون غذا را داشته باشیم و هم سیستم گوارش برای نمونهگیری خالی باشد [20].
سپس جهت بیهوش کردن از کتامین به میزان 7 واحد (0/7 میلیلیتر) و زایلازین به میزان 3 واحد (0/3 میلیلیتر) استفاده شد. همچنین به ازای هر 100 گرم وزن، 0/02 کتامین به میزان فوق اضافه شد که توسط سرنگ انسولین تزریق شد. در مرحله بعدی موشها مجدد وزنکشی و جهت نمونهبرداری روی تخته جراحی فیکس شدند. سپس با تیغ جراحی، ناحیه حفره شکمی آنها برش داده شد و ساختار کلیه توسط قیچی و پنس جدا و توسط ترازوی دیجیتالی وزن شد [19].
مطالعه و بافتشناسی
نمونههای جداشده از تمامی موشهای صحرایی بلافاصله درون ظروف حاوی محلول فرمالین 10 درصد جهت ثبوت بافت قرار داده شد و پس از 24 ساعت محلول فرمالین تعویض میشد. سپس به روی نمونههای دریافتشده جهت آمادهسازی اعمال آبگیری، شفافسازی، قالبگیر و برش زدن صورت گرفت. درنهایت نمونهها توسط هماتوکسیلین و ائوزین رنگآمیزی شدند و توسط میکروسکوپ نوری مورد ارزیابی با بزرگنماییهای 40، 100 و 400 قرار گرفتند [19].
یافتهها
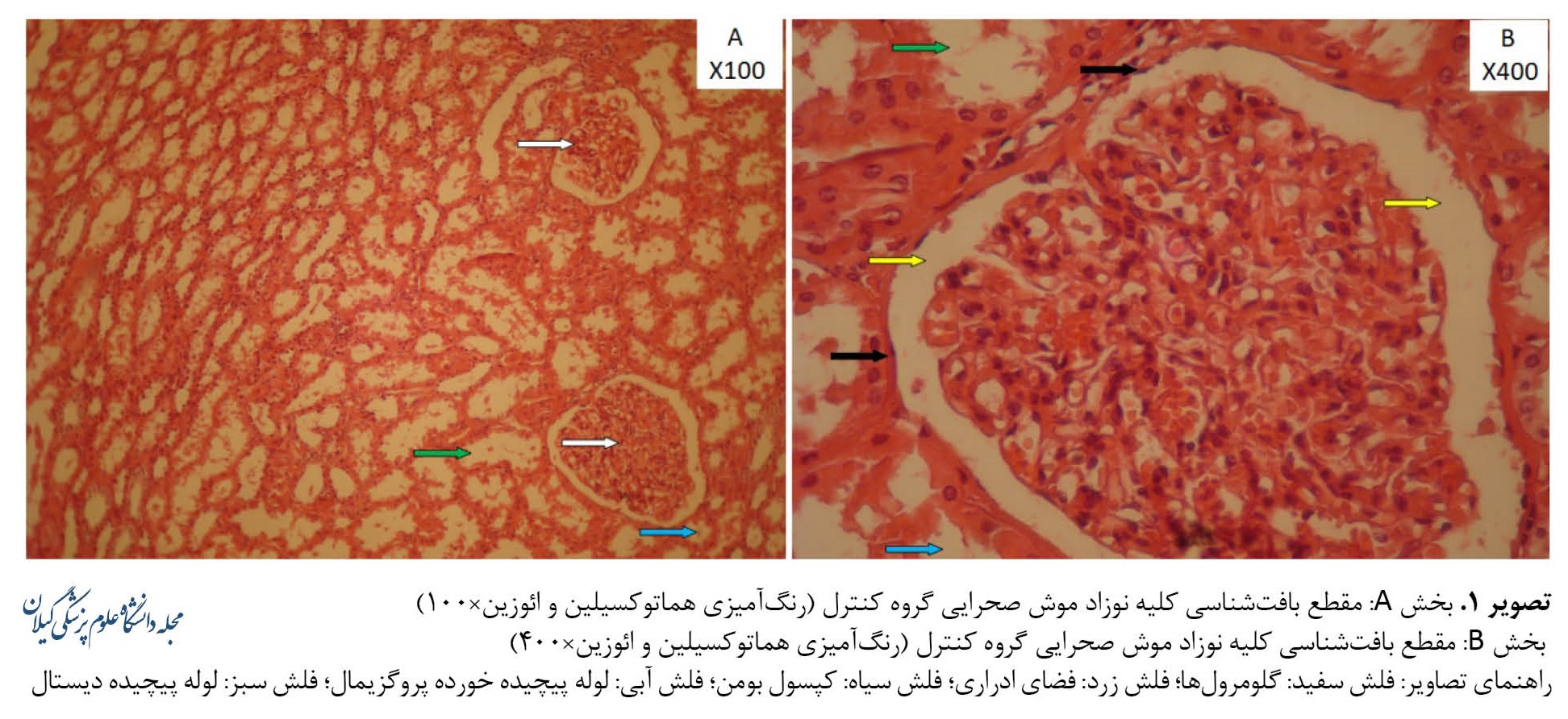
همانطورکه تصاویر A و B در تصویر شماره 1 نشان میدهند، نتایج بافتشناسی بهدستآمده از نمونههای کلیه نوزادان موشهای صحرایی در گروه کنترل در نواحی قشری و مرکزی طبیعی بودند.
علم بیهوشی با کم کردن درد بیماران حین جراحی، کمک زیادی به پیشرفت علم پزشکی کرده و موجب شده است اعمال جراحی به سهولت انجام شود. بیهوشی به شیوه مدرن اولین بار در اکتبر سال 1846 میلادی بهوسیله اِتر صورت گرفت [1]. بیهوشی عمومی یک کمای القاشده مطابق قاعده طبی و از دست دادن رفلکسهای محافظتی درنتیجه تجویز یک یا تعداد بیشتری عامل بیهوشی است [2]. اصطلاح بیهوشی از کلمهای یونانی به معنای بیحسی گرفته شده است و بر حالتی دلالت میکند که در آن ارگانیسم دیگر مستعد درک محرکهای دنیای بیرون نیست [3]. در سال 1970 با پیشرفت مواد و شیوههای بیهوشی، پزشکان برای اولین بار از کتامین به منظور القای بیهوشی و بیدردی کوتاهمدت بالینی بهره بردند [4]. درواقع کتامین یک آنتاگونیست غیر رقابتی گیرنده گلوتامات است [5]. این دارو از فن سیکلیدین مشتق شده و بهعنوان یک داروی بیحسکننده تزریقی، بیهوشکننده انفکاکی، آرامبخش، ضدافسردگی و همچنین یک داروی تفریحی غیرقانونی استفاده میشود [6]. دفع کتامین از بدن توسط اندامهای کبد و کلیه صورت میگیرد [7].
در طول 50 سال گذشته، کتامین جایگاه خود را در پزشکی انسانی و دامپزشکی بهعنوان یک داروی بیهوشکننده مهم با کاربردهای فراوان در سطح جهان مستحکم کرده است [8]. استفاده از این دارو در بدن انسان میتواند همراه با عوارض خفیف یا حادی باشد. عوارض جانبی حاد مانند افزایش ترشح بزاق، افزایش ضربان قلب، فشار شریانی سیستماتیک و فشار داخل جمجمهای میباشد. بااینحال عارضه جانبی عمده تجویز کتامین ایجاد شرایط سایکومیمتیک و دلیریوم است [9]. کتامین ازجمله موادی است که علاوهبر خاصیت ضددردی در مهمانیهای غیرقانونی مورد سوء مصرف قرار میگیرد و مصرف بیش از اندازه آن میتواند حتی باعث مرگ شود [10, 11]. درواقع کتامین دارویی محبوب جهت سوءمصرف در جمعیتهای مختلف ازجمله در بین زنان باردار در غرب و جنوب آسیا است [12 ,13]. همچنین استفاده درمانی آن بهعنوان داروی ضدافسردگی درکنار استفاده تفریحی آن، باعث شیوع چشمگیر مصرف کتامین در سراسر جهان شده است [14].
چنانچه این دارو در مادران باردار یا حیوانات باردار مصرف شود، ممکن است عوارضی در جنین و نوزادان آنها بر جای بگذارد. بهطور مثال اخیراً مسمومیتها و عوارض بالقوه ایجادشده توسط کتامین، نگرانیهای جدی را در مورد استفاده غیرقانونی آن در دوران بارداری، نوزادی و دوران کودکی ایجاد کرده است. اثرات نامطلوب کتامین بهعنوان اختلالات رشدی و چند اندامی، مسمومیت قلبی، عصبی و اسکلتی شناخته شده است [5].
همانطورکه پیشتر اشاره شد کتامین میتواند ساختار و عملکرد ارگانهای مختلف بدن را تحت تأثیر قرار دهد؛ برای مثال این دارو در کلیه میتواند تغییراتی را در سطوح هیستولوژی و فیزیولوژی ایجاد کند [15].
ازآنجاییکه حدود 2 درصد از زنان باردار بهعلت مشکلات مربوط به حاملگی خود یا سایر بیماریها نیاز به عمل جراحی پیدا میکنند و کتامین یک انتخاب رایج جهت بیهوشی است [16, 17]. ازطرفی، هنوز اثرات بلندمدت این دارو بر بافتهای بدن ناشناخته مانده است [4]. همچنین سلامت و کارکرد صحیح اندام کلیه در بدن انسان و نوزادان تضمینکننده برقراری هموستاز بدن است [18]. به همین دلیل ضرورت انجام پژوهشهای این چنینی بیش از پیش احساس میشود و بررسی و پژوهش پیرامون عوارض جانبی استفاده آن بر بافت کلیه انسان، سایر مهرهداران و همچنین نوزادان حاصل از آنها حائز اهمیت است. بنابراین در این تحقیق به بررسی اثر این داروی بیهوشی بر بافت کلیه نوزادان موشهای صحرایی بهدنیاآمده از مادران دریافتکننده پرداخته میشود.
روشها
حیوانات
این پژوهش از نوع آزمایشی است که در آن از 15 سر موش صحرایی ماده از نژاد ویستار با وزن 2±200 گرم با رعایت تمام قوانین اخلاق پزشکی استفاده شد. ویژگیهای محل نگهداری برای تمامی حیوانات کاملاً یکسان و شامل درجه حرارت 2±22 درجه سانتیگراد و رطوبت نسبی 50-55 درصد بود و دوره 12 ساعت روشنایی و 12 ساعت تاریکی درنظر گرفته شد و تمامی موشها رژیم غذایی نرمال (خوراک مخصوص جوندگان شرکت مینوصباح) و آب شهری در ظرفی از جنس PVC دریافت کردند؛ در قفسهای مخصوص از جنس پلی ماکرولون شفاف نگهداری شدند که هر روز تمیز و ضدعفونی میشدند [19].
گروههای موردمطالعه
این موشها بهمدت 1 هفته در درجه حرارت اتاق و رطوبت 60 درصد با روزی 12 ساعت روشنایی و 12 ساعت تاریکی، جهت عادت و حذف عوامل تأثیرگذار محیطی نگهداری و پس از این مدت موشها بهطورجداگانه در قفس استاندارد جداگانه قرار داده شدند. پس از 1 هفته سازگاری با محیط، موشهای صحرایی بهصورت تصادفی به 3 گروه 5 تایی شامل گروه کنترل، گروه دریافتکننده دُز بلندمدت کتامین، گروه دریافتکننده دُز کوتاهمدت و مکرر کتامین تقسیم شدند [20].
برای تقسیمبندی تصادفی موشها، ابتدا 15 موش ماده وزنگیری شدند و میانگین وزنی آنها محاسبه شد. سپس موشهای صحرایی ماده جهت باردار شدن آماده میشدند. به منظور ایجاد بارداری در موشهای صحرایی در هر گروه از 2 موش صحرایی نر استفاده شد. تأیید بارداری پس از مشاهده پلاک واژنی انجام شد. هر موش مادر بهطور متوسط بین 4 الی 14 نوزاد در هر بارداری به دنیا میآورد [19].
بیهوشی
برای تنظیم دُز کتامین، در طول بارداری موشها که حدود 19 الی 21 روز طول کشید، بهصورت مرتب وزنکشی انجام شد و باتوجهبه وزن جدید موش میزان مختلفی از کتامین بهصورت داخل صفاقی تزریق میشد. در این پژوهش موشهای صحرایی ماده باردار در گروه بیهوشی بلندمدت با کتامین به تعداد دفعات 1 بار در هفته با دُز 75 میلیگرم بر کیلوگرم بیهوش میشدند و موشهای صحرایی ماده باردار در گروه بیهوشی کوتاهمدت و مکرر با کتامین به تعداد دفعات 3 بار در هفته و هر مرتبه با دُز 25 میلیگرم بر کیلوگرم بیهوش میشدند. تزریق کتامین از 1 هفته قبل از بارداری تا 1 هفته پس از بارداری بهصورت هفتگی و منظم بهصورت درون صفاقی انجام شد [20].
نمونهگیری و آمادهسازی بافتی
پس از زایمان و طی دوره شیردهی به منظور نمونهگیری بافتی 10 عدد نوزاد موش صحرایی از هر گروه بهصورت نمونهگیری تصادفی انتخاب شدند که جمعاً 30 نوزاد موش صحرایی برای نمونهگیری بافتی انتخاب شد. در ابتدا تمامی موشها شب قبل از قربانی شدن بهمدت 10 ساعت ناشتا بودند تا هم وزن خالص موشها بدون غذا را داشته باشیم و هم سیستم گوارش برای نمونهگیری خالی باشد [20].
سپس جهت بیهوش کردن از کتامین به میزان 7 واحد (0/7 میلیلیتر) و زایلازین به میزان 3 واحد (0/3 میلیلیتر) استفاده شد. همچنین به ازای هر 100 گرم وزن، 0/02 کتامین به میزان فوق اضافه شد که توسط سرنگ انسولین تزریق شد. در مرحله بعدی موشها مجدد وزنکشی و جهت نمونهبرداری روی تخته جراحی فیکس شدند. سپس با تیغ جراحی، ناحیه حفره شکمی آنها برش داده شد و ساختار کلیه توسط قیچی و پنس جدا و توسط ترازوی دیجیتالی وزن شد [19].
مطالعه و بافتشناسی
نمونههای جداشده از تمامی موشهای صحرایی بلافاصله درون ظروف حاوی محلول فرمالین 10 درصد جهت ثبوت بافت قرار داده شد و پس از 24 ساعت محلول فرمالین تعویض میشد. سپس به روی نمونههای دریافتشده جهت آمادهسازی اعمال آبگیری، شفافسازی، قالبگیر و برش زدن صورت گرفت. درنهایت نمونهها توسط هماتوکسیلین و ائوزین رنگآمیزی شدند و توسط میکروسکوپ نوری مورد ارزیابی با بزرگنماییهای 40، 100 و 400 قرار گرفتند [19].
یافتهها
همانطورکه تصاویر A و B در تصویر شماره 1 نشان میدهند، نتایج بافتشناسی بهدستآمده از نمونههای کلیه نوزادان موشهای صحرایی در گروه کنترل در نواحی قشری و مرکزی طبیعی بودند.
گلومرولهای موجود در ناحیه قشری با تعداد مناسب و اندازه طبیعی همراه با مشخصات سلولی سالم رویت شده (فلش سفید) و کپسول بومن (فلش سیاه) در اطراف آنها نیز در لایه خارجی با سلولهای سنگفرشی شکل و طبیعی همراه است. در ناحیه داخلی و زیر کپسول، فضای ادراری (فلش زرد) دارای اندازه نرمال است. لولههای پیچیده پروگزیمال با سلولهای نسبتاً بزرگ و اسیدوفیل و هستههای طبیعی و فضای لومن کوچک (فلش آبی) و لولههای پیچیده دیستال (فلش سبز) با تعداد سلولی بیشتر در مقاطع عرضی و فضای لومن بزرگتر قابل رویت میباشند. در ناحیه مرکزی بافت، لولههای جمعکننده و نواحی مختلف قوس هنله سالم بودند و هیچگونه اثری از پرخونی، التهاب یا کست دیده نمیشد (تصویر شماره 1-A و B).
گروه دُز کوتاهمدت
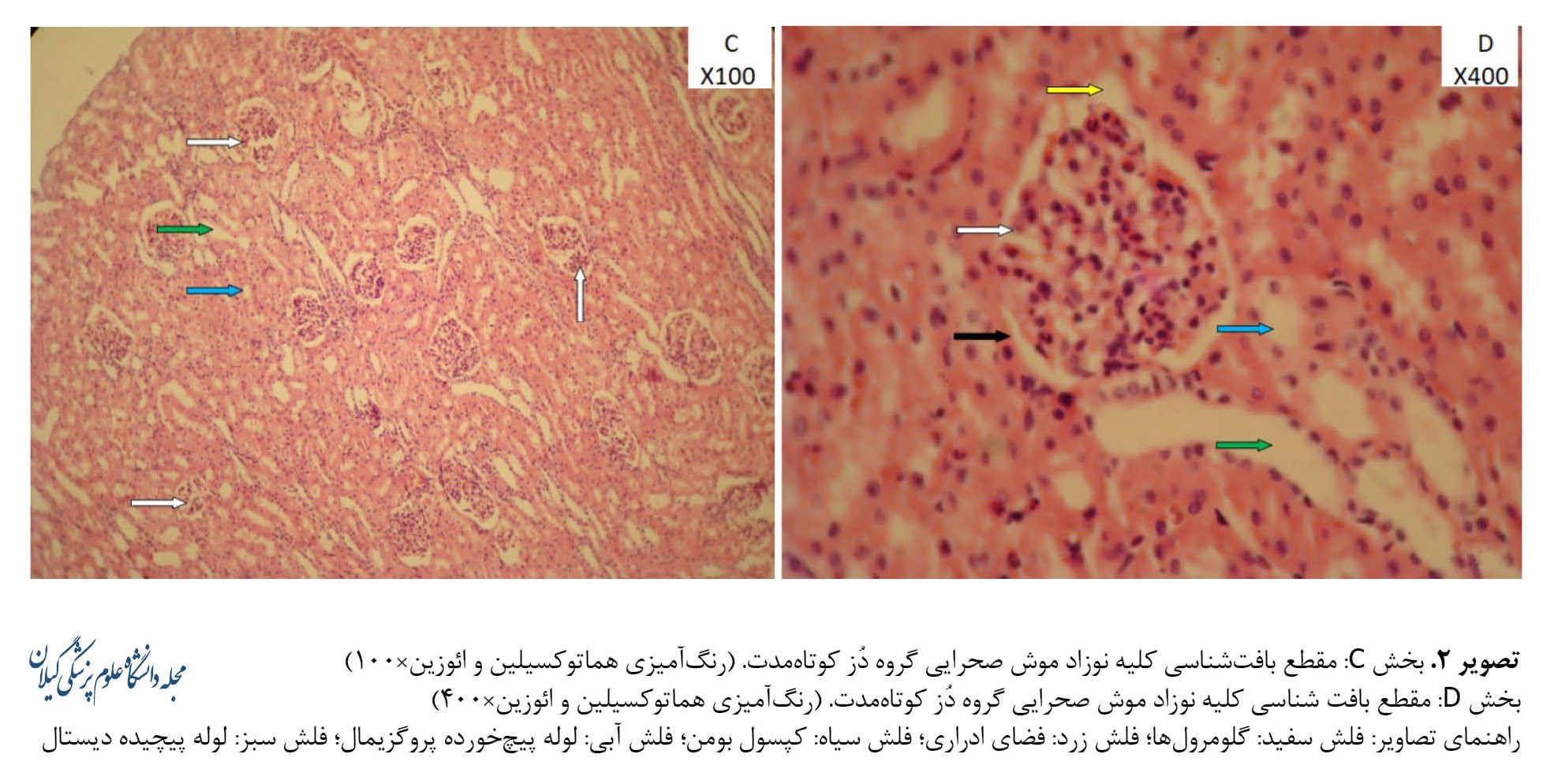
همانطورکه تصاویر C و D در تصویر شماره 2 نشان میدهند در مقاطع تهیهشده از گروه دُز کوتاهمدت در بافت کلیهها تعداد گلومرولها در فضای قشری مناسب بودند و اکثراً مشخصات بافتی نرمالی را نشان میدهند، اما تنها برخی از آنها دچار تحلیل و بینظمی (فلش سفید) شدند.
گروه دُز کوتاهمدت
همانطورکه تصاویر C و D در تصویر شماره 2 نشان میدهند در مقاطع تهیهشده از گروه دُز کوتاهمدت در بافت کلیهها تعداد گلومرولها در فضای قشری مناسب بودند و اکثراً مشخصات بافتی نرمالی را نشان میدهند، اما تنها برخی از آنها دچار تحلیل و بینظمی (فلش سفید) شدند.
همچنین در تعداد اندکی از آنها جمعشدگی مشاهده میشود و این امر سبب کاهش فضای ادراری شده است (فلش زرد). کپسول بومن با سلولهای طبیعی، فاصله سلولی مناسب و اندازههای مناسب قابل مشاهده است (فلش سیاه). لولههای پیچیده پروگزیمال (فلش آبی) و پیچیده دیستال (فلش سبز) دارای مشخصات لومن مناسب، سلولها و هستههای مشخص و طبیعی و ساختار نرمال هستند. لولههای ناحیه مرکز کلیه نیز طبیعی هستند (تصویر شماره 2-C و D).
گروه دُز بلندمدت
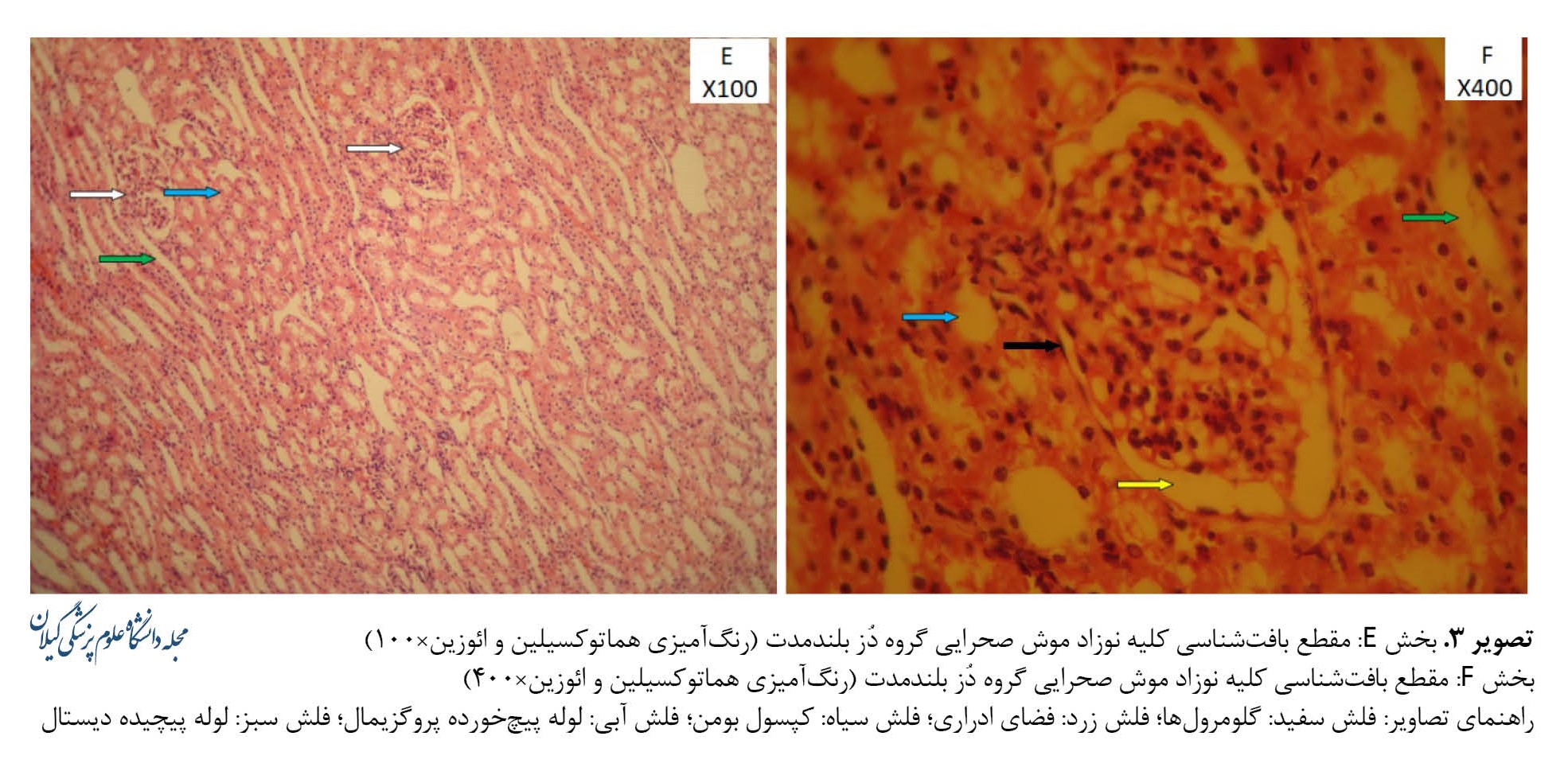
همانطورکه در تصویر شماره 3، تصاویر E و F نشان میدهند، در مقاطع تهیهشده از گروه دُز بلندمدت در بافت کلیه تعداد و پراکندگی گلومرولها نامناسب بودند و برخی از آنها دارای اندازه و شکل نامنظم هستند (فلش سفید).
گروه دُز بلندمدت
همانطورکه در تصویر شماره 3، تصاویر E و F نشان میدهند، در مقاطع تهیهشده از گروه دُز بلندمدت در بافت کلیه تعداد و پراکندگی گلومرولها نامناسب بودند و برخی از آنها دارای اندازه و شکل نامنظم هستند (فلش سفید).
فضای ادراری (فلش زرد) کاهش بسیار اندکی را نشان داده و بهطور کل اندازه طبیعی دارد. کپسول بومن نیز دارای سلولهای سنگفرشی و پهن با هسته مشخص و نرمال میباشد (فلش سیاه). لولههای پیچیده پروگزیمال (فلش آبی) و لولههای پیچیده دیستال (فلش سبز) نیز با تعداد سلولهای نرمال و شکل سلولی طبیعی و اندازه لومن مناسب در تمامی نواحی مشاهده میشوند. مشخصات لولههای ناحیه مرکزی کلیه نیز طبیعی گزارش میشود (تصویر شماره 3-E و F).
در جدول شماره 1، تغییرات کیفی پدیدآمده و مشاهدهشده از عدد صفر تا 3 درجهبندی شده است.
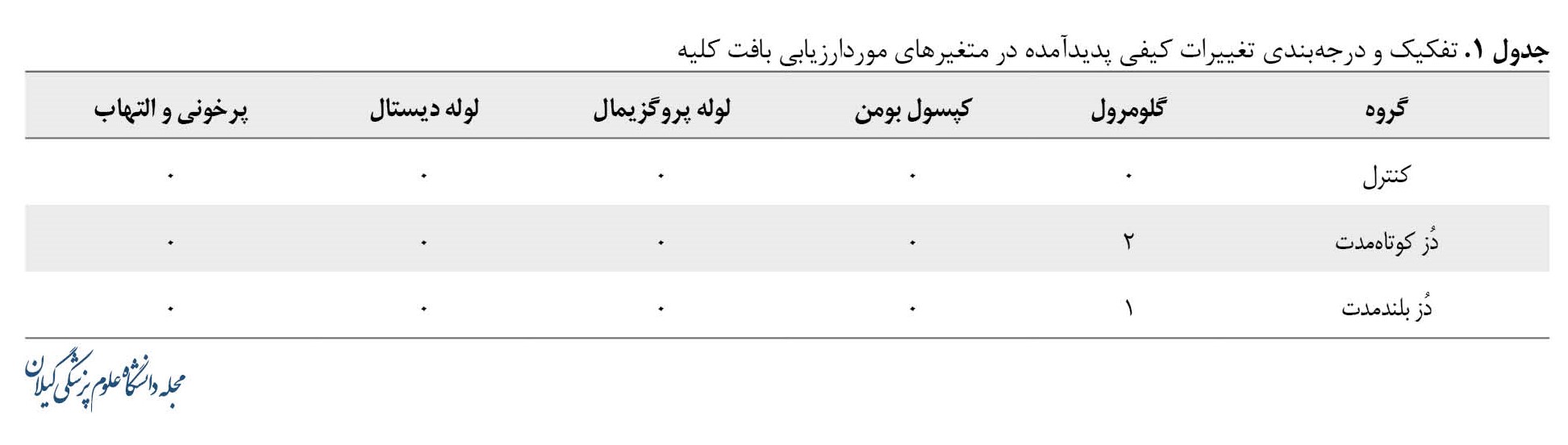
درجه صفر بیانگر عدم مشاهده تغییر، درجه 1 بیانگر تغییرات خفیف، درجه 2 بیانگر تغییرات متوسط و درجه 3 بیانگر تغییرات شدید میباشند.
بحث
باتوجهبه شیوع استفاده از کتامین در مصارف بیهوشی، افسردگی و سایر موارد درمانی دیگر طی دهههای اخیر در افراد مختلف ازجمله مادران باردار و تأثیر احتمالی داروهای بیهوشی بر بافتهای مختلف جنین، این پژوهش به بررسی و ارزیابی مقاطع بافتشناسی کلیه در نوزادان موشهای صحرایی مادران مواجههیافته با کتامین در دُزهای کوتاهمدت و بلندمدت میپردازد [21-23].
ازآنجاییکه داروهای بیهوشی ازجمله کتامین بر جنین مهرهداران و انسان میتواند اثر سمی داشته باشد [24 ]؛ باتوجهبه ارزیابیهای هماتولوژی، بیوشیمیایی و هیستوپاتولوژی ناشی از تجویز طولانیمدت کتامین بر بافت کلیه موشهای صحرایی دژنراسیون سلولهای اپیتلیال توبولها، نکروزسلول اپیتلیال توبولی، آتروفی گلومرولها و نفوذ سلولهای التهابی رویت شد [15]. همچنین با اهتمام به نتایج حاصل از مطالعه حاضر که در ارزیابی مقاطع بافتشناسی گروه دُز کوتاهمدت تنها برخی از گلومرولها دچار تحلیل و بینظمی شدهاند و همچنین در تعداد اندکی از آنها جمعشدگی مشاهده شد که این امر سبب کاهش فضای ادراری شده است.
در گروه دُز بلندمدت در بافت کلیه، تعداد و پراکندگی گلومرولها نامناسب بوده و برخی از آنها دارای اندازه و شکل نامنظم بوده است، درحالیکه در گروه کنترل مشخصات نواحی قشری، مرکزی و کپسول بومن، لولههای ادراری و فضاهای ادراری طبیعی بوده است. پس میتوان استنباط کرد که کتامین باعث تغییرات منفی در بافت کلیه جنین حاصل از مادر در مواجهه قرار گرفته میشود که این موضوع در مطالعات پیشگفت مطابق با پژوهش حال حاضر است، اما این تغییرات در مطالعه ما در هر دو گروه نسبت به گروه کنترل چشمگیر نبوده است.
تاکنون مطالعات انجامشده بیشتر به تأثیر کتامین بر عملکرد ارگانها پرداختند که میتوانند در راستای مطالعه ما و تأییدکننده آن باشند، بهطوریکه شواهد نوظهور نشان داده است که استفاده طولانیمدت و مزمن یا سوءمصرف کتامین میتواند منجر به آسیب در دستگاه ادراری شود و طیفی از تظاهرات بالینی از علائم تحریککننده خفیف دستگاه تحتانی تا هماچوری شدید دردناک و آسیبهای کلیوی را ایجاد کند [25]. همچنین در موشهای معتادشده به کتامین برخی از بخشهای بافت کلیه فیبروز شده و از کارکرد عادی خود خارج شده است [26]. اثرات استفاده بلندمدت از کتامین نیز بر روی کاهش عملکرد فیلتراسیون گلومرولها و هیدرونفروز کلیهها گزارش شد [27].
نتیجهگیری
در مطالعه ما تغییرات کیفی هیستوپاتولوژی در هر دو گروه دریافتکننده دُز کوتاهمدت و بلندمدت کتامین در مقایسه با گروه کنترل چشمگیر نبوده است.
هرچند تغییراتی در مورفولوژی و نظم بافتی در گروههای کوتاهمدت و بلندمدت نسبت به گروه کنترل مشاهده شد، اما این تغییرات چشمگیر نبوده است و موجب آسیب بافتی در نوزادان نمیشود. به همین منظور بهتر است برای بررسی بیشتر این موضوع تحقیق جامعتری انجام شود تا تأثیرات بافتشناسی کتامین که یک داروی پرکاربرد با مصارف متنوع است را بیش از پیش شناخته و در موارد پزشکی برای استفاده ایمنتر آن برنامهریزی شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه در کمیته اخلاق دانشکده علوم پزشکی دانشگاه آزاد اسلامی شاهرود (کد اخلاق: IR.IAU.SHAHROOD.REC.1398.049) تصویب شد.
حامی مالی
مطالعه حاضر با حمایت مالی کمیته تحقیقات دانشجویی دانشکده پزشکی دانشگاه آزاد اسلامی شاهرود انجام شده است.
مشارکت نویسندگان
مفهومسازی و طراحی مطالعه: بهروز یحیایی، لیلا خجسته؛ تحلیل و تفسیر دادهها: بهروز یحیایی، عارف آرمینفر و علی جرجانی؛ تهیه پیشنویس دستنوشته: عارف آرمینفر، حسامالدین بابایی، علیرضا عوضزاده و کیمیا جنتی توپکانلو؛ بازبینی نقادانه دستنوشته برای محتوای فکری مهم: حسامالدین بابایی و علی جرجانی؛ جذب منابع مالی: بهروز یحیایی و عارف آرمینفر؛ حمایت اداری، فنی یا موادی: کمیته تحقیقات دانشجویی دانشکده علوم پزشکی دانشگاه آزاد اسلامی شاهرود؛ نظارت بر مطالعه: بهروز یحیایی و لیلا خجسته.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان از حمایت کمیته تحقیقات دانشجویی دانشکده علومپزشکی دانشگاه آزاد اسلامی شاهرود و سایر بزرگوارانی که در این پژوهش ما را همراهی کردند، تشکر و قدردانی میکنند.
در جدول شماره 1، تغییرات کیفی پدیدآمده و مشاهدهشده از عدد صفر تا 3 درجهبندی شده است.

درجه صفر بیانگر عدم مشاهده تغییر، درجه 1 بیانگر تغییرات خفیف، درجه 2 بیانگر تغییرات متوسط و درجه 3 بیانگر تغییرات شدید میباشند.
بحث
باتوجهبه شیوع استفاده از کتامین در مصارف بیهوشی، افسردگی و سایر موارد درمانی دیگر طی دهههای اخیر در افراد مختلف ازجمله مادران باردار و تأثیر احتمالی داروهای بیهوشی بر بافتهای مختلف جنین، این پژوهش به بررسی و ارزیابی مقاطع بافتشناسی کلیه در نوزادان موشهای صحرایی مادران مواجههیافته با کتامین در دُزهای کوتاهمدت و بلندمدت میپردازد [21-23].
ازآنجاییکه داروهای بیهوشی ازجمله کتامین بر جنین مهرهداران و انسان میتواند اثر سمی داشته باشد [24 ]؛ باتوجهبه ارزیابیهای هماتولوژی، بیوشیمیایی و هیستوپاتولوژی ناشی از تجویز طولانیمدت کتامین بر بافت کلیه موشهای صحرایی دژنراسیون سلولهای اپیتلیال توبولها، نکروزسلول اپیتلیال توبولی، آتروفی گلومرولها و نفوذ سلولهای التهابی رویت شد [15]. همچنین با اهتمام به نتایج حاصل از مطالعه حاضر که در ارزیابی مقاطع بافتشناسی گروه دُز کوتاهمدت تنها برخی از گلومرولها دچار تحلیل و بینظمی شدهاند و همچنین در تعداد اندکی از آنها جمعشدگی مشاهده شد که این امر سبب کاهش فضای ادراری شده است.
در گروه دُز بلندمدت در بافت کلیه، تعداد و پراکندگی گلومرولها نامناسب بوده و برخی از آنها دارای اندازه و شکل نامنظم بوده است، درحالیکه در گروه کنترل مشخصات نواحی قشری، مرکزی و کپسول بومن، لولههای ادراری و فضاهای ادراری طبیعی بوده است. پس میتوان استنباط کرد که کتامین باعث تغییرات منفی در بافت کلیه جنین حاصل از مادر در مواجهه قرار گرفته میشود که این موضوع در مطالعات پیشگفت مطابق با پژوهش حال حاضر است، اما این تغییرات در مطالعه ما در هر دو گروه نسبت به گروه کنترل چشمگیر نبوده است.
تاکنون مطالعات انجامشده بیشتر به تأثیر کتامین بر عملکرد ارگانها پرداختند که میتوانند در راستای مطالعه ما و تأییدکننده آن باشند، بهطوریکه شواهد نوظهور نشان داده است که استفاده طولانیمدت و مزمن یا سوءمصرف کتامین میتواند منجر به آسیب در دستگاه ادراری شود و طیفی از تظاهرات بالینی از علائم تحریککننده خفیف دستگاه تحتانی تا هماچوری شدید دردناک و آسیبهای کلیوی را ایجاد کند [25]. همچنین در موشهای معتادشده به کتامین برخی از بخشهای بافت کلیه فیبروز شده و از کارکرد عادی خود خارج شده است [26]. اثرات استفاده بلندمدت از کتامین نیز بر روی کاهش عملکرد فیلتراسیون گلومرولها و هیدرونفروز کلیهها گزارش شد [27].
نتیجهگیری
در مطالعه ما تغییرات کیفی هیستوپاتولوژی در هر دو گروه دریافتکننده دُز کوتاهمدت و بلندمدت کتامین در مقایسه با گروه کنترل چشمگیر نبوده است.
هرچند تغییراتی در مورفولوژی و نظم بافتی در گروههای کوتاهمدت و بلندمدت نسبت به گروه کنترل مشاهده شد، اما این تغییرات چشمگیر نبوده است و موجب آسیب بافتی در نوزادان نمیشود. به همین منظور بهتر است برای بررسی بیشتر این موضوع تحقیق جامعتری انجام شود تا تأثیرات بافتشناسی کتامین که یک داروی پرکاربرد با مصارف متنوع است را بیش از پیش شناخته و در موارد پزشکی برای استفاده ایمنتر آن برنامهریزی شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه در کمیته اخلاق دانشکده علوم پزشکی دانشگاه آزاد اسلامی شاهرود (کد اخلاق: IR.IAU.SHAHROOD.REC.1398.049) تصویب شد.
حامی مالی
مطالعه حاضر با حمایت مالی کمیته تحقیقات دانشجویی دانشکده پزشکی دانشگاه آزاد اسلامی شاهرود انجام شده است.
مشارکت نویسندگان
مفهومسازی و طراحی مطالعه: بهروز یحیایی، لیلا خجسته؛ تحلیل و تفسیر دادهها: بهروز یحیایی، عارف آرمینفر و علی جرجانی؛ تهیه پیشنویس دستنوشته: عارف آرمینفر، حسامالدین بابایی، علیرضا عوضزاده و کیمیا جنتی توپکانلو؛ بازبینی نقادانه دستنوشته برای محتوای فکری مهم: حسامالدین بابایی و علی جرجانی؛ جذب منابع مالی: بهروز یحیایی و عارف آرمینفر؛ حمایت اداری، فنی یا موادی: کمیته تحقیقات دانشجویی دانشکده علوم پزشکی دانشگاه آزاد اسلامی شاهرود؛ نظارت بر مطالعه: بهروز یحیایی و لیلا خجسته.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان از حمایت کمیته تحقیقات دانشجویی دانشکده علومپزشکی دانشگاه آزاد اسلامی شاهرود و سایر بزرگوارانی که در این پژوهش ما را همراهی کردند، تشکر و قدردانی میکنند.
References
1.Hoggard A, Shienbaum R, Mokhtar M, Singh P. Gaseous anesthetics. 2023 Apr 17. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023. [PMID]
2.Roy K, Panigrahi M, Mukhopadhyay B, Bisak S, Kumar B. Efficacy of preoperative melatonin and ramelteon (melatonin agonist) therapy on dose requirement of propofol for induction of general anaesthesia: A comparative prospective study. Indian Journal of Clinical Anaesthesia. 2020; 7(1):172-6. [DOI:10.18231/j.ijca.2020.030]
3.Kelz MB, Mashour GA. The biology of general anesthesia from paramecium to primate. Current Biology. 2019; 29(22):R1199-R210. [DOI:10.1016/j.cub.2019.09.071] [PMID]
4.Iqbal SZ, Mathew SJ. Ketamine for depression clinical issues. Advances in Pharmacology (San Diego, Calif.). 2020; 89:131-62. [DOI:10.1016/bs.apha.2020.02.005] [PMID]
5.Huang W, Wu T, Wu K. Zebrafish (Danio rerio): A potential model to assess developmental toxicity of ketamine. Chemosphere. 2022; 291(Pt 3):133033. [DOI:10.1016/j.chemosphere.2021.133033] [PMID]
6.Le Daré B, Pelletier R, Morel I, Gicquel T. [History of Ketamine: An ancient molecule that is still popular today (French)]. Annales Pharmaceutiques Francaises. 2022; 80(1):1-8. [DOI:10.1016/j.pharma.2021.04.005] [PMID]
7.Tarwade P, Smischney NJ. Endotracheal intubation sedation in the intensive care unit. World Journal of Critical Care Medicine. 2022; 11(1):33-9. [DOI:10.5492/wjccm.v11.i1.33] [PMID]
8.Kohtala S. Ketamine-50 years in use: From anesthesia to rapid antidepressant effects and neurobiological mechanisms. Pharmacological Reports. 2021; 73(2):323-45. [DOI:10.1007/s43440-021-00232-4] [PMID]
9.Mihaljević S, Pavlović M, Reiner K, Ćaćić M. Therapeutic mechanisms of ketamine. Psychiatria Danubina. 2020; 32(3-4):325-33. [Link]
10.Jonkman K, Dahan A, van de Donk T, Aarts L, Niesters M, van Velzen M. Ketamine for pain. F1000Research. 2017; 6:F1000 Faculty Rev-1711. [DOI:10.12688/f1000research.11372.1] [PMID]
11.Bokor G, Anderson PD. Ketamine: An update on its abuse. Journal of Pharmacy Practice. 2014; 27(6):582-6. [DOI:10.1177/0897190014525754] [PMID]
12.Degenhardt L, Dunn M. The epidemiology of GHB and ketamine use in an Australian household survey. International Journal of Drug Policy. 2008; 19(4):311-6. [DOI:10.1016/j.drugpo.2007.08.007] [PMID]
13.Dargan PI, Wood DM. Recreational drug use in the Asia Pacific region: Improvement in our understanding of the problem through the UNODC programmes. Journal of Medical Toxicology. 2012; 8(3):295-9. [DOI:10.1007/s13181-012-0240-4] [PMID]
14.Kokane SS, Armant RJ, Bolaños-Guzmán CA, Perrotti LI. Overlap in the neural circuitry and molecular mechanisms underlying ketamine abuse and its use as an antidepressant. Behavioural Brain Research. 2020; 384:112548. [DOI:10.1016/j.bbr.2020.112548] [PMID]
15.Hashemnia M, Javedani M, Nikoosafat Z, Abdoli Jamoor S. [Study of hematological, biochemical and histopathological changes due to long-term Administration of Ketamine in Rat (Persian)]. Journal of Rafsanjan University of Medical Sciences. 2018; 17(7):639-56. [Link]
16.Cheek TG, Baird E. Anesthesia for nonobstetric surgery: Maternal and fetal considerations. Clinical Obstetrics and Gynecology. 2009; 52(4):535-45. [DOI:10.1097/GRF.0b013e3181c11f60] [PMID]
17.Natoli S. The multiple faces of ketamine in anaesthesia and analgesia. Drugs in Context. 2021; 10:2020-12-8. [DOI:10.7573/dic.2020-12-8] [PMID]
18.Delpire E, Gagnon KB. Water homeostasis and cell volume maintenance and regulation. Current Topics in Membranes. 2018; 81:3-52. [DOI:10.1016/bs.ctm.2018.08.001] [PMID]
19.Yahyaei B, Khojasteh L, Saeedmehr M. [The effects of ketamine on balance behavior and histology changes of cerebellum in short-and long-term anesthesia in rats (Persian)]. Journal Neyshabur University of Medical Sciences. 2018; 6(1):53-69. [Link]
20.Yahyaei B, Khojasteh L, Alamdari YJ. [The effect of ketamine anesthesia on balance behavior and histopathological changes of the cerebellum in rat neonates (Persian)]. Journal of North Khorasan University of Medical Sciences. 2023; 15(1):52-9. [DOI:10.32592/nkums.15.1.52]
21.Barrett W, Buxhoeveden M, Dhillon S. Ketamine: A versatile tool for anesthesia and analgesia. Current Opinion in Anesthesiology. 2020; 33(5):633-8. [DOI:10.1097/ACO.0000000000000916] [PMID]
22.Ritter P, Findeis H, Bauer M. Ketamine in the treatment of depressive episodes. Pharmacopsychiatry. 2020; 53(2):45-50. [DOI:10.1055/a-0991-0582] [PMID]
23.Zhao T, Li Y, Wei W, Savage S, Zhou L, Ma D. Ketamine administered to pregnant rats in the second trimester causes long-lasting behavioral disorders in offspring. Neurobiology of Disease. 2014; 68:145-55. [DOI:10.1016/j.nbd.2014.02.009] [PMID]
24.McCann ME, Soriano SG. Does general anesthesia affect neurodevelopment in infants and children? BMJ. 2019; 367:l6459. [DOI:10.1136/bmj.l6459] [PMID]
25.John Shung-Lai L, Wai-Kit M. Urological effects of ketamine abuse. In: Ane Claudia Fernandes N, editor. Biomarkers and bioanalysis overview. Rijeka: IntechOpen; 2020. [DOI:10.5772/intechopen.91283]
26.Jang MY, Shen JT, Geng JH, Wang HS, Chuang SM, Lee YC, et al. Ketamine induced renal fibrosis in a ketamine addition rat model. Urological Science. 2017; 28(3):123-7. [DOI:10.1016/j.urols.2016.12.004]
27.Ou SH, Wu LY, Chen HY, Huang CW, Hsu CY, Chen CL, et al. Risk of renal function decline in patients with ketamine-associated uropathy. International Journal of Environmental Research and Public Health. 2020; 17(19):7260. [DOI:10.3390/ijerph17197260] [PMID]
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |