دوره 32، شماره 4 - ( 10-1402 )
جلد 32 شماره 4 صفحات 281-266 |
برگشت به فهرست نسخه ها
Research code: IR.KUMS.REC.1400.162
Ethics code: IR.KUMS.REC.1400.162
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Rezakhani L, Khazaei M R, Faramarzi A, Khazaei M. Molecular Factors Affecting Embryo Implantation: A Narrative Review. JGUMS 2024; 32 (4) :266-281
URL: http://journal.gums.ac.ir/article-1-2591-fa.html
URL: http://journal.gums.ac.ir/article-1-2591-fa.html
رضاخانی لیلا، خزاعی محمدرسول، فرامرزی آزیتا، خزاعی مظفر. فاکتورهای مولکولی مؤثر بر لانهگزینی جنین: مرور روایی. مجله علوم پزشکی گیلان. 1402; 32 (4) :266-281
لیلا رضاخانی1 

 ، محمدرسول خزاعی2
، محمدرسول خزاعی2 

 ، آزیتا فرامرزی1
، آزیتا فرامرزی1 

 ، مظفر خزاعی*2
، مظفر خزاعی*2 




 ، محمدرسول خزاعی2
، محمدرسول خزاعی2 

 ، آزیتا فرامرزی1
، آزیتا فرامرزی1 

 ، مظفر خزاعی*2
، مظفر خزاعی*2 


1- مرکز تحقیقات باروری و ناباروری، دانشگاه علوم پزشکی کرمانشاه، کرمانشاه، ایران
2- گروه مهندسی بافت، دانشکده پزشکی، دانشگاه علوم پزشکی کرمانشا، کرمانشاه، ایران
2- گروه مهندسی بافت، دانشکده پزشکی، دانشگاه علوم پزشکی کرمانشا، کرمانشاه، ایران
متن کامل [PDF 7485 kb]
(795 دریافت)
| چکیده (HTML) (2223 مشاهده)
فاکتورهای مؤثر بر لانهگزینی رویان
هورمونهای تخمدان
هورمونهای اصلی مؤثر بر پذیرش رحم، پروژسترون و استروژن تخمدان هستند. پروژسترون برای لانهگزینی و نگهداری بارداری در تمام پستانداران ضروری است، درحالیکه استروژن برای گونههای خاصی مورد نیاز است. در لانهگزینی موش، پروژسترون و استروژن تخمدانی ضروری هستند، اما در خوکها، خوکچه هندی، خرگوش و هامستر، استروژن تخمدانی ضروری نیست. بااینحال در چهار گونه آخر، استروژنی که توسط رویان تولید میشود برای لانهگزینی مهم در نظر گرفته میشود. درحالیکه استروژن تخمدان یا رویان شرکتکننده در لانهگزینی انسان بهطور کامل شناخته نشده است، اما میدانیم که اثرات رحمی استروژن و پروژسترون بهطور اولیه توسط رسپتورهای هستهای استروژن (ER) و پروژسترون (PR) ایجاد میشوند [18]. در موش، تغییرات مکانی و زمانی در بیان استروژن و پروژسترون در رحم، حوالی مرحله لانهگزینی رخ میدهد [15].
در روزهای 1 تا 2 لانهگزینی در موش، استروژن در اپیتلیوم مجرایی و غددی آندومتر بیان و در روزهای 3 تا 4، استروژن در استروما، اپیتلیوم مجرا و غدد بیان میشود. در روز 5، استروژن در اپیتلیوم مجرای رحم و اپیتلیوم غدد بیان شده است، اما بیان آن در استرومای قشر، پایین است. پروژسترون در اپیتلیوم مجرا و غدد در روز 1 لانهگزینی با سطوح پایین و روز 2 در سطح متوسط بیان میشود. در روز 3 تا 4، پروژسترون در اپیتلیوم مجرا، غدد و سلولهای استروما بیان شده است، اما طی روزهای 5 تا 8، پروژسترون در اپیتلیوم مجرا وجود ندارد و محدود به سلولهای استرومایی بهویژه در دسیدوا میشود [3، 22].
در بیولوژی رحم و لانهگزینی هریک از ایزوفرمهای
استروژنERα) و ERβ) و پروژسترون PRA) و PRB) دارای عملکرد خاص هستند که با مطالعات مختلف بر روی اثرات حذف انتخابی آنها در فعالیتهای تولیدمثل تأیید شده است. این تحقیقات نشان داد در موشهایی که ERα-/- هستند، رحم آنها دچار هیپوپلازی میشود و درنتیجه لانهگزینی با شکست مواجه میشود، اما این فرایند در موشهایی با ERβ-/- بهطور معمول رخ میدهد [18]. درحالیکه ناباروری بهعلت نقص در عملکرد تخمدان و رحم در موشهایی با فقدان هر دو ایزوفرم پروژسترون مشاهده شد، موشهایی که فقط PRβ نداشتند، طبیعی بودند [23, 24].
سیتوکینها
سیتوکینها پروتئینهای کوچک چند منظوره هستند که اقدامات زیستی آنها با واسطه گیرندههای سطح سلولی انجام میشود. آنها بهعنوان پیامرسانهای قوی، عملکرد سلولهای آندومتر و واکنشهای مادر-رویان را تنظیم میکنند. ورود بلاستوسیست به رحم پذیرا برای تولید سیتوکینهای تروفوبلاستی و اپیتلیوم رحم، بسیار مهم است که پذیرش اندومتر را با تنظیم بیان مولکولهای مختلف مرحله اتصال، تعدیل میکند [25, 26]. در پستانداران نقص در تنظیم بیان و پیامرسانی سیتوکینها، منجر به شکست کامل و یا ناقص لانهگزینی و همچنین تشکیل غیرطبیعی جفت میشود [27, 28].
فاکتور مهارکننده لوکمی ( Leukemia inhibitory factor/LIF)
فاکتورهای رشد متعددی در تعاملات جنین و مادر طی لانهگزینی درگیر هستند. فاکتور مهارکننده لوکمی عضوی از خانواده اینرلوکین-6 و سیتوکین پلیوتروپیک میباشد. نقش فاکتور مهارکننده لوکمی برای لانهگزینی در انسان مهم است. در موش نیز بیان فاکتور مهارکننده لوکمی در رحم در روز 4 بارداری، همزمان با لانهگزینی افزایش مییابد. فاکتور مهارکننده لوکمی برای اولین بار در غدد رحمی در روز 4 بعد از لقاح بیان میشود. این الگو نشان میدهد که فاکتور مهارکننده لوکمی نقش مهمی در مرحله اتصال و همچنین در آمادهسازی رحم برای لانهگزینی ایفا میکند. موشهای فاقد فاکتور مهارکننده لوکمی با شکست لانهگزینی بلاستوسیست مواجه میشوند [29].
فاکتور مهارکننده لوکمی از رحم ترشح و بهعنوان عاملی مهم در لانهگزینی رویان محسوب میشود. اثرات پلیوتروپیک فاکتور مهارکننده لوکمی توسط اتصال به رسپتورش که متشکل از دو پروتئین غشایی گیرنده فاکتور مهارکننده لوکمی و گلیگوپروتئین-130 است، انجام میشود. چنانکه گیرنده فاکتور مهارکننده لوکمی چندین مسیر پیامرسان ازجمله مسیرهای JAK/STAT ،MAPK و PI3 از PIPK را در انواع سلولها فعال میکند. جنین فاقد گیرنده فاکتور مهارکننده لوکمی و یا گلیگوپروتئین-130 لانهگزینی طبیعی دارد، اما قبل از زایمان میمیرد [30].
مطالعات اخیر نشان دادهاند که فاکتور مهارکننده لوکمی در هر دو فاز اتصال و نفوذ لانهگزینی نقش دارد که بهعلت اتصال محکم آن با تروفوبلاست است. این یافتهها اهمیت فاکتور مهارکننده لوکمی را در لانهگزینی رویان در جوندگان و پستانداران ثابت میکند. درمورد انسان، بیوپسی اندومتر بهدستآمده از زنان بارور، بیان فاکتور مهارکننده لوکمی را در اواسط و اواخر فاز ترشحی نشان دادهاند. زنان با بیان فاکتور مهارکننده لوکمی قویتر در طی پنجره لانهگزینی، احتمال باردار شدن بیشتری نسبت به افرادی که بیان ضعیفتری در آنها دیده میشود را گزارش کردند. این نتایج حاکی از اهمیت فاکتور مهارکننده لوکمی در لقاح آزمایشگاهی میباشد [31، 32].
اینترلوکین-1 (Interleukin-1/IL-1)
لانهگزینی بهعنوان نوعی پاسخ التهابی محسوب میشود. تعدادی از سیتوکینها در محل لانهگزینی شناسایی شدهاند که بسیاری از این مولکولها منشأ جنینی دارند. اینترلوکین-1 یکی از این عوامل پاراکرین، تعدیلکننده ارتباطات بین آندومتر و رویان است و کلید تنظیمکننده پاسخ التهابی بوده و در حال حاضر بهعنوان سیتوکین، قادر به طیف گستردهای از اثرات در انواع سلولها میباشد [33].
دو شکل از آگونیست اینترلوکین-1 IL-1β) و IL-1α) به گیرنده اینترلوکین-1 یکسانی (IL-1RI) متصل میشوند. لانهگزینی موفق رویان انسان پس از لقاح آزمایشگاهی در محیط کشت، مربوط به غلظت بالایی از IL-1β و IL-1α است. بااینحال، نقش IL-1α در آندومتر انسان و پستانداران غیرانسانی مانند IL-1β به وضوح مشخص نیست و بهعنوان یکی از عوامل واسطه در ارتباط متقابل بین بلاستوسیست و آندومتر فرض شده است. اینترلوکین-1 توسط ماکروفاژها، تروفوبلاست و سلولهای استروما تولید میشود. بیان IL-1RI در طول چرخه قاعدگی انسان، از یک الگوی سه بخشی در هر دو سلول اپیتلیال و استرومایی پیروی میکند. بیان پروتئین در فاز تکثیری پایین، طی تخمکگذاری و مراحل لانهگزینی متوسط و در پایان لانهگزینی شدید است [34].
اینترلوکین-6
اینترلوکین-6 یک سیتوکین پلیوتروپیک میباشد که در موش، بیان آن در روز 5 و 6 بارداری افزایش مییابد. در انسان، اینترلوکین-6 و گیرنده آن در طی پنجره لانهگزینی آندومتر بیان افزایشی دارند. در زنانی با تجربه سقط در مقایسه با افرادی که بارداری طبیعی دارند، سطوح اینترلوکین-6 در پلاسما کاهش یافته است. موشهای فاقد اینترلوکین-6، لانهگزینی طبیعی نشان دادهاند. بااینحال، رشد بلاستوسیست میتواند به خطر افتد و تعداد مکانهای لانهگزینی و اندازه آن کاهش یابد. بنابراین، اینترلوکین-6 میتواند نقش مهمی در لانهگزینی بازی کند، اما این نقش ضروری نیست. اینترلوکین-6 میتواند هر دو پاسخ التهابی و ضدالتهابی را از طریق گلیگوپروتئین-130 اعمال کند. بیان اینترلوکین-6 در اواسط فاز ترشحی و بیشتر بهصورت موضعی در سلولهای غدد اپیتلیال تعیین شده است [3].
نقش حیاتی اینترلوکین-6 طی لانهگزینی با استفاده از موش با کمبود اینترلوکین-6، کاهش نواحی لانهگزینی و کاهش باروری را نشان داد. علاوهبراین، وجود رسپتور در اندومتر و بلاستوسیست، نقش پاراکرین/اتوکرین را برای اینترلوکین-6 طی این فرایند در موش مطرح میکند. بنابراین اینترلوکین-6 ممکن است بهعنوان پیشگوییکننده کیفیت بلاستوسیست مفید باشد. بااینحال، بیان غیرطبیعی اینترلوکین-6 در اواسط فاز ترشحی در بیمار با سابقه سقط گزارش شده است. عمدتاً اینترلوکین-6 در آندومتر اواسط تا اواخر فاز ترشحی، زمانی که اندومتر در معرض بالاترین غلظت پروژسترون و استرادیول است، بیان میشود و این نشان میدهد که هورمونهای استروئیدی ممکن است در تنظیم بیاناینترلوکین-6 نقش داشته باشند [35].
اینترلوکین-11
اینترلوکین-11 یک سیتوکین است که عملکرد پلیوتروپیک در بافتها و سلولهای مختلف دارد. اینترلوکین-11 و گیرنده آن(IL-11Ra) در آندومتر وجود دارند. بیان اینترلوکین-11 در موش و انسان مشخص شده است. همراه با فاکتور مهارکننده لوکمی، اینترلوکین-6 و اینترلوکین-11 متعلق به سیتوکینهای گلیگوپروتئین-130 میباشد. انواع سلولهای عمده در آندومتر، اینترلوکین-11 را با دورههای متغیر بیان میکنند. برجستهترین واکنش ایمنی و بیان mRNA در سلولهای استرومایی دسیدواییشده، در اواخر چرخه قاعدگی است. باوجوداین، هنوز هم عدم قطعیت برای تولید حداکثر اینترلوکین-11 در سلولهای اپیتلیال وجود دارد که احتمالاً بهدلیل پروتکلهای متفاوت برای مطالعات ایمونوهیستوشیمی در این زمینه است. حضور IL-11 mRNA و گلیگوپروتئین-130 طی دسیدوایی شدن در سلولهای استروما و سلولهای اپیتلیال غدد، حاکی از اهمیت IL-11 در دسیدوایی شدن سلولهای استرومایی است [3].
در زمان دسیدوایی شدن در موش، 5/5 الی 7/5 روز پس از لقاح، اینترلوکین-11 به مقدار زیادی بیان میشود. بیان قوی اینترلوکین-11 در سلول دسیدوایی در حال توسعه و بیان کم آن در سیکل رحمی وجود دارد. بااینحال، هیچ تغییری در بیان IL-11Rα در رحم آبستن و سیکل رحمی مشاهده نشد. موش ماده فاقد گیرنده IL-11 α باتوجهبه نقص در دسیدوایی شدن، نابارور است، بنابراین، اینترلوکین-11 در موش برای لانهگزینی بسیار مهم تلقی میشود [36].
بیان اینترلوکین-11 در بافت اندومتر انسان نیز در طی دسیدوایی شدن بسیار مهم است. مطالعه برون تنی نشان داد که فاکتور مهارکننده لوکمی و اینترلوکین-11 در تنظیم اتصال سلولهای اپیتلیال آندومتر نقش دارند. در مطالعات بالینی مشاهده شده است که اینترلوکین-11 پلاسما در زنان مبتلا به سقط جنین 3 ماهه اول بارداری در مقایسه با زنان با حاملگی طبیعی کاهش دارد [37]. علاوهبراین، پروتئین اینترلوکین-11 و اینترلوکین11Rα-، در حوالی لانهگزینی، در زنان مبتلا به سقط مکرر نسبت به زنان طبیعی در سطوح پایینتر در سلولهای اپیتلیال اندومتر دیده میشود. جالب توجه است، اگرچه تولید کم اینترلوکین-11 از اندومتر با ناباروری اولیه در ارتباط است، سطح اینترلوکین11Rα- در سلول استرومای مشتق از زنان بارور و نابارور مشابه است [38].
در مورد انسان، شواهد زیادی نشان میدهد که اینترلوکین-11 دارای عملکرد مهمی در کاشت رویان میباشد. مطالعات، بیان اینترلوکین-11 و اینترلوکین11Rα- را در بیوپسی زنان بارور نرمال و زنان با سقط مکرر گزارش کردند. محققان نشان دادند بیان اینترلوکین-11 در سلولهای اپیتلیال در اندومتر زنان با سابقه سقط مکرر در مقایسه با زنان بارور نرمال، کمتر بود که پیشنهاد میدهند مصرف اینترلوکین-11 ممکن است احتمال سقط را کاهش بدهد. بنابراین اینترلوکین-11 میتواند در ایجاد حاملگی موفق، مهم باشد [39].
فاکتور محرک کلونی-1 (Colony stimulating factor-1/ CSF-1)
فاکتور محرک کلونی-1 یک عامل رشد هماتوپویتیک است که تکثیر، تمایز و بقای فاگوسیتهای تک هستهای و پیشسازهای آنها را تعدیل میکند. در موش، بیان محرک کلونی- در اندومتر در روز 3 پس از لقاح شروع میشود و طی بارداری افزایش مییابد. ماگزیمم بیان محرک کلونی-1 در 20 تا 30 روز پس از حاملگی رخ میدهد و این سطح بالا تا زمان تولد حفظ میشود. در گاو، محرک کلونی-1 بهطور چشمگیری بین روزهای 14 و 17 تغییر میکند. دیده میشود که محرک کلونی-1 در اولین مرحله از لانهگزینی در گاو نقش دارد. این دوره تقریباً زمان شناخت مادر از بارداری است. محرک کلونی-1 در بافت اندومتر انسان، طی سیکل عادی بیان میشود. در فاز ترشحی، سطح محرک کلونی-1 بالاتر از فاز تکثیری است. علاوهبراین، سطح محرک کلونی-1 در 3 ماهه اول بارداری در بافت دسیدوا بالاتر از بافت غیرباردار است. همچنین بیان غیرطبیعی محرک کلونی-1 با ناباوری مرتبط است [40، 41].
موشهای فاقد محرک کلونی-1 بسیاری از اختلالات تولیدمثل از جمله میزان پایین تخمکگذاری و کاهش لانهگزینی و بقا جنین را نشان میدهند. حتی درمان این موشها با محرک کلونی-1 نوترکیب انسانی برای نجات فنوتیپ باروری با شکست مواجه شد. بنابراین اهمیت برجسته سنتز موضعی محرک کلونی-1 برای عملکرد رحم مشخص میشود. غلظت محرک کلونی-1 در رحم توسط عملکرد سینرژیک استرادیول-17 بتا و پروژسترون تنظیم میشود. این یافتهها نشان میدهد که محرک کلونی-1 مادری تحت تأثیر هورمونهای جنسی، نقش مهمی را در فرایند لانهگزینی بازی میکند [3، 42].
خانواده فاکتور رشد اپیدرمی (Epidermal growth factor family/EGF)
خانواده فاکتور رشد اپیدرمی شامل فاکتور رشد تبدیلکننده آلفا، فاکتور رشد اپیدرمی متصل به هپارین و امفی رگولین میباشد. شواهد نشان میدهد که در گونههای مختلف، این خانواده نقش مهمی در لانهگزینی بازی میکند [43].
اعضای این خانواده تنظیم عملکردهای مختلف تکثیر، بقا، اتصال، مهاجرت و تمایز سلولی را تنظیم میکنند. در طی لانهگزینی رویان موش، فاکتور رشد تبدیلکننده آلفا، فاکتور رشد اپیدرمی متصل به هپارین و امفی رگولین در رحم بیان میشوند. بهطور خاص، ظهور فاکتور رشد اپیدرمی متصل به هپارین به میزان زیادی مربوط به دوره لانهگزینی میباشد که آن را بهعنوان مارکر مولکولی اولیه اتصال رویانی-رحمی در نظر گرفتهاند. فاکتور رشد اپیدرمی متصل به هپارین در اپیتلیوم مجرایی، 6 تا 7 ساعت قبل از آغاز اتصال در اطراف بلاستوسیست تولید میشود و البته فقط مربوط به بلاستوسیستهای فعال است. این الگو نشان میدهد که با سیگنال بلاستوسیست، سلولهای اپیتلیال مجرا در محل اتصال، فاکتور رشد اپیدرمی متصل به هپارین را بیان میکنند.
فاکتور رشد تبدیلکننده آلفا، فاکتور رشد اپیدرمی متصل به هپارین، فاکتور رشد اپیدرمی و امفی رگولین نیز در رحم موش در زمان لانهگزینی بیان میشوند. فاکتور رشد اپیدرمی و گیرنده آن، سطح mRNA را در لانهگزینی به پیک میرساند. سپس بیان آن به تدریج کاهش مییابد. فاکتور رشد تبدیلکننده آلفا و فاکتور رشد اپیدرمی متصل به هپارین در روزهای 3 و 4 بارداری بیان میشود و امفی رگولین نیز به مقدار زیادی در زمان لانهگزینی بیان میشود [44]. فاکتور رشد اپیدرمی متصل به هپارین در بافت آندومتر انسان در مرحله ترشحی چرخه قاعدگی بیان میشود و بیشترین بیان آن مربوط به بلافاصله قبل از پنجره لانهگزینی است. تصور میشود فاکتور رشد اپیدرمی متصل به هپارین نقش مهمی در اتصال و نفوذ، طی لانهگزینی در انسان داشته باشد. در موارد ناباروری با علت ناشناخته، طی اواسط فاز ترشحی، بیان پایینتری از فاکتور رشد اپیدرمی متصل به هپارین در آندومتر، در مقایسه با آندومتر نرمال مشاهده شد [45].
فاکتور رشد شبه انسولینی (Insulin-like growth factor/IGF)
فاکتور رشد تغییردهنده بتا عوامل رشد پلی پپتیدی قبل و بعد از تولد میباشند و شامل شبکه پیچیدهای از لیگاند (IGF-I و IGF-II)، گیرنده (IGF-IR و IGF-IIR) و پروتئین با میل اتصالی بالا (فاکتور رشد شبه انسولینی-1) و همچنین پروتئازهای خاص مؤثر بر فعالیتهای خود هستند. آنها با اتصال به گیرندههای فاکتور رشد شبه انسولینی، سوختوساز بدن و تمایز انواع مختلف سلولها را تحت تأثیر قرار میدهند. IGFBPs، فراهمی زیستی و اثرات فاکتور رشد شبه انسولینی را تعدیل میکنند. فاکتور رشد شبه انسولینی رشد و تمایز سلولی را تنظیم میکنند و بهطور گستردهای در دستگاه تناسلی زن، بهویژه در لوله رحمی هنگامی که رویان در حرکت است، بیان میشوند [46].
در انسان سیستم فاکتور رشد شبه انسولینی نقش مهمی در رشد اولیه رویان دارد و بیان کم برخی از اعضای سیستم فاکتور رشد شبه انسولینی، ممکن است یکی از علل ناباروری ناشناخته در زنان باشد. پروتئین اتصالی فاکتور رشد شبه انسولینی-1 و پروتئین اتصالی فاکتور رشد شبه انسولینی-3 در آندومتر میش بیان میشوند. درحالیکه در آندومتر گاو، تنها بیان پروتئین اتصالی فاکتور رشد شبه انسولینی-1 افزایش مییابد. سطح IGFBP1 mRNA، در آندومتر میش، بین روز 12 تا 16 بارداری، در مقایسه با سیکل استروس، 5 تا 29 برابر افزایش مییابد. در گاو، بیان پروتئین اتصالی فاکتور رشد شبه انسولینی-1 در روز 16 بارداری در رحم، نسبت به یک گاو غیرآبستن بالاتر است. بنابراین پروتئین اتصالی فاکتور رشد شبه انسولینی-1 در گوسفند و گاو به مقدار زیادی لانهگزینی جنین را با تحریک مهاجرت و اتصال تروفوبلاست، تنظیم میکند. مطالعات دیگری نشان داد، پروتئین اتصالی فاکتور رشد شبه انسولینی-1 نقشی در سلولهای استرومای آندومتر دسیدوایی دارد که مستقل از اتصال به IGF-I است. درمجموع، اعضای این خانواده برای یک لانهگزینی موفق، حیاتی هستند [47, 48].
فاکتور رشد تغییردهنده β (TGF-β Transforming growth factor-β/)
TGF-β از خانواده فاکتور رشد اپیدرمی، در سه ایزوفرم مختلف (TGF-β1، TGF-β2، TGF-β3) است و اثرات عمیقی بر تولید ECM و تخریب آنزیمها دارند. علاوهبراین، ایزوفرمهای TGF-β در محل ارتباط رویان-مادر یافت میشود، درنتیجه نقش مهمی در فرآیند لانهگزینی دارند. اعضای خانواده TGF در آندومتر بیان میشوند و نقش فعالی در تعدیل وقایع سلولی شامل تنظیم تکثیر سلول، دسیدوایی شدن و فرایند لانهگزینی دارند [49].
در طی لانهگزینی بیان بالایی از TGF-β1 و β2 وجود دارد. به تازگی مسیر پیامرسان TGF-β که نقش مهمی در بازسازی آندومتر موش با تعدیل فعالیت مسیر PI3-K/AKT، همراه با مهار پروتئین ضدآپوپتوز مهارکننده پروتئین آپوپتوز مرتبط باX نشان داده شده است که درنتیجه، القای آپوپتوز در سلولهای دسیدوایی رخ میدهد. در بافت آندومتر انسانی، پروتئین TGF-β و mRNA در استرومای آندومتر، اپیتلیوم و سلولهای دسیدوا لوکالیزه میشوند. پیش از این نشان داده شد که TGF-β2 به مقدار زیاد در سلولهای استروما بیان میشود، درحالیکه شدت بیان TGF-β1 و TGF-β3 در سلولهای استروما و اپیتلیال برابر هستند [50].
طی چرخه قاعدگی، تنها بیان TGF-β3 متفاوت است که در اواخر فاز ترشحی در اپیتلیوم غدد، شدیدتر بیان میشود. بنابراین، آندومتر لانهگزینی در مرحله ترشحی، از طریق تولید و ترشح ایزوفرم TGF-β توسط سلولهای اپیتلیال آماده میشود. علاوهبراین، TGF-βS ممکن است در لانهگزینی انسان از طریق تحریک فیبرونکتین و یا تولید فاکتور رشد آندوتلیال عروقی و با توسعه اتصال سلولهای تروفوبلاست به زمینه خارج سلولی نقش بازی کنند [35].
فاکتور رشد اپیدرمی متصل به هپارین (Heparin binding-epidermal growth factor/HB-EGF)
فاکتور رشد اپیدرمی متصل به هپارین یک پروتئین عرض غشایی میباشد که به گیرندههای خود به شیوه ژوکستاکرین متصل میشود و آبشار پیامرسانی را فعال میکند. فاکتور رشد اپیدرمی متصل به هپارین با فاکتور رشداپیدرمی و فاکتور رشد تبدیلکننده آلفا دارای گیرنده مشترک است. فاکتور رشد اپیدرمی متصل به هپارین نیاز به پروتئوگلیکان هپاران سولفات بهعنوان کوفاکتور برای اتصال به گیرندههایش دارد. اولین شواهد گزارش دادند که فاکتور رشد اپیدرمی متصل به هپارین نقش مهمی در لانهگزینی رویان موش بازی میکند و شبیه به دیگر عوامل درگیر در فرایند لانهگزینی توسط هورمونهای استروئیدی استروژن و پروژسترون تنظیم میشود. فاکتور رشد اپیدرمی متصل به هپارین در استرومای آندومتر و سلولهای اپیتلیال بیان میشود و برای تنظیم تکثیر سلولی آندومتر، ترشح غددی و تحول دسیدوا دیده میشود. فاکتور رشد اپیدرمی متصل به هپارین در بافت آندومتر انسان، طی لانهگزینی بیان شده و عوامل مختلفی مانند IGF1 همراه با فاکتور رشد اپیدرمی متصل به هپارین، بهطور مؤثری در تظاهرات لانهگزینی موضعی، مانند افزایش نفوذپذیری عروق، دسیدوایی شدن و بیان مارکرهای مخصوص کاشت رویان نقش دارند [51].
بیان بالای HB-EGF mRNA ، قبل از پنجره لانهگزینی نشان میدهد که این فاکتور رشد بهطور مستقیم میتواند لانهگزینی بلاستوسیست را کنترل کند. مطالعات نشان دادند که در موشهای ماده با HB-EGF¯/¯، کاهش باروری دیده شده و همچنین فاکتور رشد اپیدرمی متصل به هپارین میتواند عملکرد تخمدان و رحم را تنظیم کند. ژنهای فاکتور رشد اپیدرمی متصل به هپارین در اپیتلیوم رحم موش، در محل اتصال بلاستوسیست قبل از این فاز، بیان شده که قویاً نقش آن را در لانهگزینی رویان نشان میدهد. بیان فاکتور رشد اپیدرمی متصل به هپارین در اپیتلیوم مجرا و غدد، زمانی که گنبدهای رحمی بهطور کامل توسعه یافتهاند در بالاترین سطح است. بنابراین به نقش فاکتور رشد اپیدرمی متصل بر هپارین در اتصال و نفوذ فرآیندهای لانهگزینی انسانی تأکید میشود. سطوح بالاتر فاکتور رشد اپیدرمی متصل به هپارین در سطح راسی اپیتلیوم مجرا قبل از لانهگزینی در انسان دیده میشود [52-54].
ژنهای هموباکس
ژنهای هموباکس تنظیمکننده رونویسی هستند که نقش اساسی در تعیین هویت بافتها، طی رشد جنین بازی میکنند. همچنین در توسعه سیستمهای مولری (لولههای اولیه تناسلی جنس مؤنث) درگیر است و سپس در رحم بزرگسالان بیان آن ادامه مییابد. این ژنها به احتمال زیاد، تنظیمکنندههای اصلی لانهگزینی انسان هستند. ژنهای هموباکس بهعنوان تنظیمکنندههای مورفوژنز و تمایزی جنینی نیز عمل میکنند. دو ژن هموباکس برای باروری در موش لازم است. موشهای ماده با اختلال هدفمند در ژنهای هموباکس 10 و 11 زنده هستند، اما بارور نیستند [55].
اختلال هدفمند هموباکس11 میتواند توسعه غدد آندومتری استروما را کاهش دهد و نیز بیان فاکتور مهارکننده لوکمی را بکاهد. این احتمال وجود دارد که ژن هموباکس، توسعه آندومتر بزرگسالان را جهت لانهگزینی، هدایت کند. بیان هموباکس در آندومتر مادر میتواند باروری را تنظیم کند. تنظیم این ژن توسط هورمونهای جنسی، مکانیسمی را ارائه میدهد تا بیان افتراقی ژنهای هموباکس در دستگاه تناسلی اتفاق افتد. این تنظیمات در رحم بزرگسال رخ میدهد. هموباکس10 توسط استروژن و پروژسترون در رحم انسان بالغ تنظیم میشود. هریک از این دو هورمون بیان هموباکس10 را افزایش میدهند. استروئیدهای جنسی الگوی بیانی را تنظیم میکنند که با نقش ژن هموباکس در لانهگزینی انسان سازگار است. ژنهای هموباکس 10 و 11 در غدد آندومتر و استرومای رحم انسان از طریق چرخه قاعدگی بیان میشوند. در اواسط فاز ترشحی در زمان لانهگزینی، بیان هر دو ژن هموباکس به شکل قابل ملاحظهای افزایش یافته است و در سراسر مابقی این فاز، افزایش همچنان ادامه دارد [56].
الگوی بیان ژن هموباکس در آندومتر بزرگسالان نشان میدهد که ژن هموباکس نه تنها منجر به رشدونمو صحیح جنین در رحم شده، بلکه با فعال کردن ژنهای هدف پایین دست آندومتر در هر چرخه قاعدگی برای لانهگزینی لازم هستند. استروژن و پروژسترون و شاید دیگر مولکولها، بیان هموباکس را تنظیم میکنند. بهنوبه خود، هموباکس10 و 11، سایر ژنها را در مسیری که منجر به توسعه مولکولی مناسب آندومتر، جهت پذیرش و لانهگزینی میشوند را تنظیم میکنند. عدم عملکرد هموباکس 13 باتوجهبه علل جهش، ناهنجاریهای دستگاه تناسلی در زنان را باعث میشود. تغییرات بیان ژن هموباکس با نقص در لانهگزینی جنین در انسان مرتبط هستند. وجود نقص در بیان ژن هموباکس در افراد مبتلا به آندومتریوز، نقش عملکردی این ژنها را در لانهگزینی انسان تأیید میکند [57].
مورفوژنها
مولکولهای مورفوژن یا ریختزا بهصورت وابسته به غلظت، سبب تمایز و الگویابی سلولها میشوند. مسئلهای که کمتر مورد بررسی قرار گرفته است، نقش مورفوژنها در پذیرش رحم و لانهگزینی است. تعاملات رویان-رحم طی لانهگزینی، بسیاری از ویژگیهای تعاملات متقابل مزانشیمی-اپیتلیالی را طی رشد جنین به اشتراک میگذارند و هر دو مسیرهای پیامرسانی تکاملی را حفظ میکنند. اهمیت پیامهای hedgehog (HH)، Wnt و BMP در پذیرش رحم کشف شده است [15].
بیان Indian hedgehog (IHH) وابسته به پروژسترون است و در روز 4 بارداری در سلولهای اپیتلیال به سطح بالایی میرسد، درحالیکه PTC، Gli1 و Gli2 در استروما بیان افزایشی دارند. یافتهها نشان میدهد که عملکرد IHH اپیتلیالی بهعنوان یک فاکتور رشد پاراکرین برای سلولهای استروما است و این پیامرسانی اپیتلیالی-مزانشیمی برای پذیرش رحم مهم است. Sfrp4، (آنتاگونیست Wnt) و Noggin) آنتی (BMP، در طول فاز پذیرش در استرومای رحم بیان میشوند. Wnt4 و BMP2 در این زمان بیان نشده است، اما در استروما با شروع اتصال بلاستوسیست و پس از آن با ناپدید شدن بیان آنتاگونیست القاء میشوند. این یافتهها نشان میدهند که پیامرسانی HH در پذیرش رحم مؤثر است و Wnt4 و BMP2 درگیر واکنش اتصال و وقایع بعد از لانهگزینی میشوند. تنظیم کاهشی Sfrp4 در -/-LIF رحم نشان میدهد که پیامرسانی Wnt در آمادهسازی رحم مهم است [58].
متناوباً این تنظیم کاهشی ممکن است نتیجهای از به خطر افتادن عملکرد رحم در غیاب فاکتور مهارکننده لوکمی باشد. از خانواده Wnt، Wnt7a در اپیتلیوم مجرای رحم زنان بزرگسال بیان میشود، زنان با -/-Wnt7a نابارور هستند، رحم آنها فاقد غدد میباشد، میومتر نیز سازماندهی مشخصی ندارد، این موارد نشان میدهد که Wnt7a میتواند برای معماری سلولی رحم نرمال، بسیار مهم باشد. از ژنهای BMP که مطالعه شدهاند، BMP4-7 الگوی بیان بسیار موضعی بالایی را مانند BMP2 طی فاز اتصال نشان نمیدهد [59].
نتیجهگیری
لانهگزینی فرآیند پیچیدهای است که مولکولهای پیامرسان مختلفی مانند سیتوکینها، فاکتورهای رشد و هورمونهای تخمدان بهطور اختصاصی در میزان پذیرش رحم نقش دارند. سیتوکینها (فاکتور رشد اپیدرمی و فاکتور محرک کلونی-1)، اینترلوکین-11، اینتر لوکین-6، اینتر لوکین-1، فاکتور مهارکننده لوکمی و سیستم فاکتور رشد شبه انسولینی نقش مهمی در تعاملات رویان و مادر طی فرآیند لانهگزینی ایفا میکند. ژنهای هموباکس تنظیمکننده رونویسی طی رشد جنین هستند. بیان هموباکس در آندومتر مادر میتواند باروری را تنظیم کند. ژن هموباکس10 توسط استروژن و پروژسترون در رحم انسان بالغ تنظیم میشود. هریک از این دو هورمون بیان ژن هموباکس10 را افزایش میدهند. بااینحال، هنوز بخش مهمی از عملکرد وابسته یا مستقل آنها مشخص نیست. بنابراین، تلاشها در این زمینه ضروری به نظر میرسد و دستیابی به این مهم به درک بهتر فرآیند لانهگزینی و رفع علت شکست لانهگزینی و ناباروری کمک خواهد کرد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه در کمیته اخلاق دانشگاه علوم پزشکی کرمانشاه با (کد اخلاق: IR.KUMS.REC.1400.162) تصویب شد.
حامی مالی
این تحقیق هیچگونه کمک مالی از سازمانهای تأمین مالی در بخشهای عمومی، تجاری یا غیرانتفاعی دریافت نکرد.
مشارکت نویسندگان
مفهومسازی و طراحی مطالعه: لیلا رضاخانی؛ دریافت، تحلیل و تفسیر دادهها و تهیه پیشنویس دستنوشته: لیلا رضاخانی، محمدرسول خزاعی و آزیتا فرامرزی؛ بازبینی نقادانه دستنوشته برای محتوای فکری مهم: لیلا رضاخانی، مظفرخزاعی و آزیتا فرامرزی؛ حمایت اداری، فنی یا موادی و نظارت: مظفر خزاعی.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان از مرکز تحقیقات باروری و ناباروری و گروه مهندسی بافت دانشگاه علوم پزشکی کرمانشاه تقدیر و تشکر میکنند.
References
1.Haghighi H, Vaziri H R, Zahiri Z. [Analysis of association of FSHR 1255G>A polymorphism with infertility in women (Persian)]. Journal of Guilan University of Medical Sciences. 2016; 25(99):26-33. [Link]
2.Sehring J, Beltsos A, Jeelani R. Human implantation: The complex interplay between endometrial receptivity, inflammation, and the microbiome. Placenta. 2022; 117:179-86. [DOI:10.1016/j.placenta.2021.12.015] [PMID]
3.Hamid HY, Zakaria MZ. Embryo implantation: Shedding light on the roles of ovarian hormones, cytokines and growth factors in the implantation process. African Journal of Biotechnology. 2012; 11(97):16297-304. [Link]
4.Evazalipour M, Aghajani Torshkooh F, Jafari-Shakib R, Gholampour S, Zamani E. [In vitro evaluation of protective effect of rutin on acrylamide-induced cellular senescence in NIH3T3 Cells (Persian)]. Journal of Guilan University of Medical Sciences. 2022; 30(4):276-89. [Link]
5.Sharma A, Kumar P. Understanding implantation window, a crucial phenomenon. Journal of Human Reproductive Sciences. 2012; 5(1):2-6. [DOI:10.4103/0974-1208.97777] [PMID]
6.Yoshinaga K. A historical review of blastocyst implantation research. Biology of Reproduction. 2018; 99(1):175-95. [DOI:10.1093/biolre/ioy093] [PMID]
7.Paulson EE, Comizzoli P. Endometrial receptivity and embryo implantation in carnivores-commonalities and differences with other mammalian species. Biology of Reproduction. 2021; 104(4):771-83. [DOI:10.1093/biolre/ioab001] [PMID]
8.Omidi M, Khalili MA, Agha- Rahimi A, Nottola S, Anbari F, Faramarzi A, et al. Efficacy of the in vitro splitting of human preimplantation embryos from ART programs. Turkish Journal of Medical Sciences. 2021; 51(1):68-75. [DOI:10.3906/sag-1710-194] [PMID]
9.Fazleabas AT, Kim JJ, Strakova Z. Implantation: Embryonic signals and the modulation of the uterine environment-a review. Placenta. 2004; 25(Suppl A):S26-31. [DOI:10.1016/j.placenta.2004.01.014] [PMID]
10.Faramarzi A, Khalili MA, Mangoli E. Correlations between embryo morphokinetic development and maternal age: Results from an intracytoplasmic sperm injection program. Clinical and Experimental Reproductive Medicine. 2019; 46(3):119-24. [DOI:10.5653/cerm.2019.02838] [PMID]
11.Ramathal CY, Bagchi IC, Taylor RN, Bagchi MK. Endometrial decidualization: of mice and men. Seminars in Reproductive Medicine. 2010; 28(1):17-26. [DOI:10.1055/s-0029-1242989] [PMID]
12.Kim JJ, Fazleabas AT. Uterine receptivity and implantation: The regulation and action of insulin-like growth factor binding protein-1 (IGFBP-1), HOXA10 and forkhead transcription factor-1 (FOXO-1) in the baboon endometrium. Reproductive Biology and Endocrinology. 2004; 2:34. [PMID]
13.Altmäe S, Reimand J, Hovatta O, Zhang P, Kere J, Laisk T, et al. Research resource: Interactome of human embryo implantation: identification of gene expression pathways, regulation, and integrated regulatory networks. Molecular Endocrinology. 2012; 26(1):203-17. [DOI:10.1210/me.2011-1196] [PMID]
14.Wu HM, Chen LH, Hsu LT, Sung YJ, Chiu WJ, Tsai CL. Leukaemia inhibitory factor-STAT signaling and adhesion molecules in human decidual stromal cells: possible role on embryo implantation and early pregnancy. Reproductive BioMedicine Online. 2023. [DOI:10.1016/j.rbmo.2023.03.012]
15.Wang H, Dey SK. Roadmap to embryo implantation: Clues from mouse models. Nature Reviews Genetics. 2006; 7(3):185-99. [DOI:10.1038/nrg1808] [PMID]
16.Iwamoto R, Yamazaki S, Asakura M, Takashima S, Hasuwa H, Miyado K, et al. Heparin-binding EGF-like growth factor and ErbB signaling is essential for heart function. Proceedings of the National Academy of Sciences. 2003; 100(6):3221-6. [DOI:10.1073/pnas.0537588100] [PMID]
17.Faramarzi A, Khalili MA, Ashourzadeh S. Oocyte morphology and embryo morphokinetics in an intra-cytoplasmic sperm injection programme. Is there a relationship? Zygote. 2017; 25(2):190-6. [DOI:10.1017/S0967199417000041] [PMID]
18.Dey SK, Lim H, Das SK, Reese J, Paria BC, Daikoku T, et al. Molecular cues to implantation. Endocrine Reviews. 2004; 25(3):341-73. [DOI:10.1210/er.2003-0020] [PMID]
19.Fouladi-Nashta AA, Jones CJ, Nijjar N, Mohamet L, Smith A, Chambers I, et al. Characterization of the uterine phenotype during the peri-implantation period for LIF-null, MF1 strain mice. Developmental Biology. 2005; 281(1):1-21. [DOI:10.1016/j.ydbio.2005.01.033] [PMID]
20.Khazaei M, Aghaz F. Reactive oxygen species generation and use of antioxidants during in vitro maturation of oocytes. International Journal of Fertility & Sterility. 2017; 11(2):63-70. [PMID]
21.Song H, Lim H, Paria BC, Matsumoto H, Swift LL, Morrow J, et al. Cytosolic phospholipase A2alpha is crucial [correction of A2alpha deficiency is crucial] for 'on-time' embryo implantation that directs subsequent development. Development. 2002; 129(12):2879-89. [DOI:10.1242/dev.129.12.2879] [PMID]
22.Wetendorf M, DeMayo FJ. The progesterone receptor regulates implantation, decidualization, and glandular development via a complex paracrine signaling network. Molecular and Cellular Endocrinology. 2012; 357(1-2):108-18. [DOI:10.1016/j.mce.2011.10.028] [PMID]
23.Lee JH, Kim TH, Oh SJ, Yoo JY, Akira S, Ku BJ, et al. Signal transducer and activator of transcription-3 (Stat3) plays a critical role in implantation via progesterone receptor in uterus. The FASEB Journal. 2013; 27(7):2553-63. [DOI:10.1096/fj.12-225664] [PMID]
24.Ghanbari E, Khazaei MR, Khazaei M, Nejati V. Royal jelly promotes ovarian follicles growth and increases steroid hormones in immature rats. International Journal of Fertility & Sterility. 2018; 11(4):263-69. [PMID]
25.Simón C, Martín JC, Pellicer A. Paracrine regulators of implantation. Bailliere's Best Practice & Research. Clinical Obstetrics & Gynaecology. 2000; 14(5):815-26. [DOI:10.1053/beog.2000.0121] [PMID]
26.Esfandiari N, Khazaei M, Ai J, Bielecki R, Gotlieb L, Ryan E, et al. Effect of a statin on an in vitro model of endometriosis. Fertility and Sterility. 2007; 87(2):257-62. [DOI:10.1016/j.fertnstert.2006.06.040] [PMID]
27.Guzeloglu-Kayisli O, Kayisli UA, Taylor HS. The role of growth factors and cytokines during implantation: Endocrine and paracrine interactions. Seminars in Reproductive Medicine. 2009; 27(1):62–79. [DOI:10.1055/s-0028-1108011] [PMID]
28.Wang Q, Sun Y, Fan R, Wang M, Ren C, Jiang A, et al. Role of inflammatory factors in the etiology and treatment of recurrent implantation failure. Reproductive Biology. 2022; 22(4):100698. [DOI:10.1016/j.repbio.2022.100698] [PMID]
29.Salleh N, Giribabu N. Leukemia inhibitory factor: Roles in embryo implantation and in nonhormonal contraception. The Scientific World Journal. 2014; 2014:201514. [DOI:10.1155/2014/201514] [PMID]
30.Nicola NA, Babon JJ. Leukemia inhibitory factor (LIF). Cytokine & Growth Factor Reviews. 2015; 26(5):533-44. [DOI:10.1016/j.cytogfr.2015.07.001] [PMID]
31.Aghajanova L. Update on the role of leukemia inhibitory factor in assisted reproduction. Current Opinion in Obstetrics and Gynecology. 2010; 22(3):213-9. [DOI:10.1097/GCO.0b013e32833848e5] [PMID]
32.Steck T, Giess R, Suetterlin MW, Bolland M, Wiest S, Poehls UG, et al. Leukaemia inhibitory factor (LIF) gene mutations in women with unexplained infertility and recurrent failure of implantation after IVF and embryo transfer. European Journal of Obstetrics & Gynecology and Reproductive Biology. 2004; 112(1):69-73. [DOI:10.1016/S0301-2115(03)00315-4] [PMID]
33.Bourdiec A, Akoum A. [Embryo implantation: Role of interleukin 1 family members (French)]. Medecine Sciences. 2014; 30(6-7):644-50. [DOI:10.1051/medsci/20143006014] [PMID]
34.Bigonnesse F, Labelle Y, Akoum A. Triphasic expression of interleukin-1 receptor type I in human endometrium throughout the menstrual cycle of fertile women and women with unexplained infertility. Fertility and Sterility. 2001; ;75(1):79-87.[DOI:10.1016/S0015-0282(00)01634-4] [PMID]
35.Singh M, Chaudhry P, Asselin E. Bridging endometrial receptivity and implantation: Network of hormones, cytokines, and growth factors. Journal of Endocrinology. 2011; 210(1):5-14. [DOI:10.1530/JOE-10-0461] [PMID]
36.Dimitriadis E, Menkhorst E, Salamonsen LA, Paiva P. LIF and IL11 in trophoblast-endometrial interactions during the establishment of pregnancy. Placenta. 2010; 31 Suppl:S99-104.[DOI:10.1016/j.placenta.2009.12.027] [PMID]
37.Marwood M, Visser K, Salamonsen LA, Dimitriadis E. Interleukin-11 and leukemia inhibitory factor regulate the adhesion of endometrial epithelial cells: Implications in fertility regulation. Endocrinology. 2009; 150(6):2915-23. [DOI:10.1210/en.2008-1538] [PMID]
38.Karpovich N, Klemmt P, Hwang JH, McVeigh JE, Heath JK, Barlow DH, et al. The production of interleukin-11 and decidualization are compromised in endometrial stromal cells derived from patients with infertility. The Journal of Clinical Endocrinology & Metabolism. 2005. 90(3):1607-12. [DOI:10.1210/jc.2004-0868] [PMID]
39.von Rango U, Alfer J, Kertschanska S, Kemp B, Müller-Newen G, Heinrich PC, et al. Interleukin-11 expression: Its significance in eutopic and ectopic human implantation. Molecular Human Reproduction. 2004; 10(11):783-92. [DOI:10.1093/molehr/gah107] [PMID]
40.Lee RS, Li N, Ledgard AM, Pollard JW. Dynamic regulation of expression of colony-stimulating factor 1 in the reproductive tract of cattle during the estrous cycle and in pregnancy. Biology of Reproduction. 2003; 69(2):518-28. [DOI:10.1095/biolreprod.102.013748] [PMID]
41.Lee KY, DeMayo FJ. Animal models of implantation. Reproduction. 2004; 128(6):679-95. [DOI:10.1530/rep.1.00340] [PMID]
42.Kim SM, Kim JS. A review of mechanisms of implantation. Development & Reproduction. 2017; 21(4):351-9. [DOI:10.12717/DR.2017.21.4.351] [PMID]
43.Wieduwilt MJ, Moasser MM. The epidermal growth factor receptor family: Biology driving targeted therapeutics. Cellular and Molecular Life Sciences. 2008; 65(10):1566-84. [DOI:10.1007/s00018-008-7440-8] [PMID]
44.Byun HS, Lee GS, Lee BM, Hyun SH, Choi KC, Jeung EB. Implantation-related expression of epidermal growth factor family molecules and their regulation by progesterone in the pregnant rat. Reproductive Sciences. 2008; 15(7):678-89. [DOI:10.1177/1933719108317581] [PMID]
45.Aghajanova L, Bjuresten K, Altmäe S, Landgren BM, Stavreus-Evers A. HB-EGF but not amphiregulin or their receptors HER1 and HER4 is altered in endometrium of women with unexplained infertility. Reproductive Sciences. 2008; 15(5):484-92. [DOI:10.1177/1933719108314624] [PMID]
46.Sferruzzi-Perri AN, Owens JA, Pringle KG, Roberts CT. The neglected role of insulin-like growth factors in the maternal circulation regulating fetal growth. The Journal of Physiology. 2011; 589(Pt 1):7-20. [DOI:10.1113/jphysiol.2010.198622] [PMID]
47.Simmons RM, Erikson DW, Kim J, Burghardt RC, Bazer FW, Johnson GA, et al. Insulin-like growth factor binding protein-1 in the ruminant uterus: Potential endometrial marker and regulator of conceptus elongation. Endocrinology. 2009; 150(9):4295-305. [DOI:10.1210/en.2009-0060] [PMID]
48.Wu RJ, Zhou FZ. [Insulin-like growth factor II and its receptor gene expression in the endometrium of women with unexplained infertility (Chinese)]. Zhonghua Fu Chan Ke Za Zhi. 2004; 39(4):242-5. [PMID]
49.Jones RL, Stoikos C, Findlay JK, Salamonsen LA. TGF-β superfamily expression and actions in the endometrium and placenta. Reproduction. 2006; 132(2):217-32. [DOI:10.1530/rep.1.01076] [PMID]
50.Caron PL, Fréchette-Frigon G, Shooner C, Leblanc V, Asselin E. Transforming growth factor beta isoforms regulation of Akt activity and XIAP levels in rat endometrium during estrous cycle, in a model of pseudopregnancy and in cultured decidual cells. Reproductive Biology and Endocrinology. 2009; 7:80. [DOI:10.1186/1477-7827-7-80] [PMID]
51.Lessey BA, Gui Y, Apparao KB, Young SL, Mulholland J. Regulated expression of heparin-binding EGF-like growth factor (HB-EGF) in the human endometrium: A potential paracrine role during implantation. Molecular Reproduction and Development. 2002; 62(4):446-55. [DOI:10.1002/mrd.10129] [PMID]
52.Stavreus-Evers A, Aghajanova L, Brismar H, Eriksson H, Landgren BM, Hovatta O. Co-existence of heparin-binding epidermal growth factor-like growth factor and pinopodes in human endometrium at the time of implantation. Molecular Human Reproduction. 2002; 8(8):765-9. [DOI:10.1093/molehr/8.8.765] [PMID]
53.Xie H, Wang H, Tranguch S, Iwamoto R, Mekada E, Demayo FJ, et al. Maternal heparin-binding-EGF deficiency limits pregnancy success in mice. Proceedings of the National Academy of Sciences. 2007; 104(46):18315-20. [DOI:10.1073/pnas.0707909104] [PMID]
54.Moghani-Ghoroghi F, Moshkdanian G, Sehat M, Nematollahi-Mahani SN, Ragerdi-Kashani I, Pasbakhsh P. Melatonin pretreated blastocysts along with Calcitonin Administration improved implantation by upregulation of heparin binding-epidermal growth factor expression in murine endometrium. Cell Journal. 2018; 19(4):599-606. [PMID]
55.Vitiello D, Kodaman PH, Taylor HS. HOX genes in implantation. Seminars in Reproductive Medicine. 2007; 25(6):431-6. [DOI:10.1055/s-2007-991040] [PMID]
56.Zanatta A, Rocha AM, Carvalho FM, Pereira RM, Taylor HS, Motta EL, et al. The role of the Hoxa10/HOXA10 gene in the etiology of endometriosis and its related infertility: A review. Journal of Assisted Reproduction and Genetics. 2010; 27(12):701-10. [DOI:10.1007/s10815-010-9471-y] [PMID]
57.Fischer CP, Kayisili U, Taylor HS. HOXA10 expression is decreased in endometrium of women with adenomyosis. Fertility and Sterility. 2011; 95(3):1133-6. [DOI:10.1016/j.fertnstert.2010.09.060] [PMID]
58.Graham SJ, Wicher KB, Jedrusik A, Guo G, Herath W, Robson P, et al. BMP signalling regulates the pre-implantation development of extra-embryonic cell lineages in the mouse embryo. Nature Communications. 2014; 5:5667. [DOI:10.1038/ncomms6667] [PMID]
59.Sozen B, Demir N, Zernicka-Goetz M. BMP signalling is required for extra-embryonic ectoderm development during pre-to-post-implantation transition of the mouse embryo. Developmental Biology. 2021; 470:84-94. [DOI:10.1016/j.ydbio.2020.11.005] [PMID]
متن کامل: (2411 مشاهده)
مقدمه
لانهگزینی یک گام بسیار مهم در تولیدمثل پستانداران است و بهعنوان دروازه ورود رویان به رشد و نمو و حاملگی موفق بیان میشود. کاشت موفقیتآمیز رویان به تعامل هماهنگ و دقیق آن با رحم نیاز دارد. این فعلوانفعالات متقابل بین رویان-آندومتر رحم در یک مدت زمان محدود بهعنوان «پنجره لانه گزینی» یا «پنجره پذیرش» شناخته میشود [1, 2]. هرگونه نقص در ارتباطات بین آندومتر و رویان، منجر به شکست لانهگزینی رویان میشود که یک مشکل بزرگ در طب تولیدمثل و از علل مهم ناباروری است. پذیرش رحم برای رویان توسط هورمونهای تخمدانی استروژن و پروژسترون تنظیم میشود و تحت تأثیر آنها، برخی سایتوکینها و فاکتورهای رشد نیز نقش مهمی در تعامل رویان-رحم در لانهگزینی بازی میکنند. آگاهی از عملکرد این مولکولها در طی این فرایند، به شناخت علل شکست لانهگزینی جنین و ناباروری کمک خواهد کرد [3 ,4].
لانهگزینی به سه مرحله تقابل، اتصال و نفوذ تقسیم میشود. در جوندگان و برخی از پستانداران ازجمله انسان، رویان (بلاستوسیست) پس از ورود به رحم، از ناحیه شفاف خارج میشود و با اپیتلیوم مجرا تقابل پیدا میکند [5]. سلولهای توده خارجی بلاستوسیست (تروفوبلاست) به اپیتلیوم آندومتر متصل میشود و توده سلولی داخلی (امبریوبلاست)، مجاور آن قرار میگیرد. سلولهای اپیتلیال مقابل بلاستوسیست، دچار مرگ برنامهریزیشده میشوند و توسط سلولهای سن سیتیوتروفوبلاست (سلولهای سطحی دیواره بلاستوسیست) فاگوسیتوز میشوند که این مسئله باعث تسهیل نفوذ رویان به اپیتلیوم خواهد شد [6].
لانهگزینی میتواند براساس نوع تعامل بلاستوسیست-رحم به 3 دسته مرکزی، خارج از مرکز و بینابینی تقسیم شود. لانهگزینی مرکزی در حیواناتی مانند گاو، گوسفند و خوک رخ میدهد. بلاستوسیست به اپیتلیوم آندومتر متصل میشود، بدون اینکه به آن نفوذ کند. لانهگزینی در موش، رت و هامستر خارج از مرکز است که اپیتلیوم مجرا، یک اینواژیناسیون در اطراف تروفوبلاست تشکیل میدهد. انسان و خوکچه هندی لانهگزینی بینابینی دارند که در آن تروفوبلاست از طریق اپیتلیوم مجرا به استرومای آندومتر و دیواره رحم نفوذ میکند. هدف از لانهگزینی صرفنظر از تقسیمبندی فوق، عرضه خون مادری به عروق خونی رویان در حال رشد است. در طی نفوذ تروفوبلاست به استرومای آندومتر، سلولهای فیبروبلاست استرومایی، به سلول درشت و چند وجهی دسیدوا تمایز مییابند. دسیدوایی شدن سلولهای استروما در همه گونهها صرفنظر از نوع جفت مشابه است، اما میزان آن متغیر میباشد و با عمق نفوذ تروفوبلاست در طی لانهگزینی ارتباط دارد [7, 8].
وقایع اتصال رویان به اپیتلیوم آندومتر و نفوذ پس از آن به استروما هنوز بهطور کامل شناخته نشده است. برای محافظت مادر از نفوذ تروفوبلاست به شریانهای مارپیچی رحم، سلولهای استرومای آندومتر به یک ساختار سلولی متراکم به نام دسیدوا تغییر میکنند. دسیدوا با تشکیل یک مانع فیزیکی از حرکت و نفوذ تروفوبلاست جلوگیری میکند که باعث افزایش اتصال تروفوبلاست بهجای نفوذ میشود [9, 10].
دسیدوایی شدن سلولهای مزانشیمی فیبروبلاستی در انسان تحت تأثیر هورمونهای استروئیدی، پروژسترون و استرادیول رخ میدهد که برای یک بارداری موفق، ضروری است. از نقشهای مهم دسیدوا، احاطه کردن جنین در حال رشد و تسهیل انتقال مواد مغذی به تروفوبلاست میباشد. بنابراین، دسیدوایی شدن یک پیشنیاز برای لانهگزینی رویان است و اولین نشانه آن، افزایش نفوذپذیری عروق رحم در محل تقابل با بلاستوسیست است [11]. تعامل بین آندومتر مادر و رویان طی لانهگزینی با واسطه مولکولهای متعدد و آبشار پیامرسانی (سیگنالینگ) اتفاق می افتد که هنوز بهطور کامل شناخته نشدهاند. این وقایع پیچیده منجر به تغییرات مورفولوژیک و بیوشیمیایی سلول استرومایی به دسیدوایی میشود که با بیان تعدادی از ژنها، در تثبیت یک حاملگی موفق مشارکت میکنند [9].
مطالعات فراساختاری سلولهای دسیدوای انسانی نشان داد که آنها دارای تمام ویژگیهای یک سلول ترشحی مانند هستههای یوکروماتیک، سیسترنهای گلژی متعدد، شبکه اندوپلاسمی خشن توسعهیافته و گرانولهای ترشحی متراکم هستند. سلولهای استرومای دسیدوایی، پروتئینهای جدیدی مانند پرولاکتین و پروتئین اتصالی فاکتور رشد شبه انسولینی-1 را بیان میکنند [12].
موفقیت لانهگزینی به ارتباط دو طرفه بین جنین و رحم بستگی دارد. طبق مطالعهای که بر لانهگزینی جنین انسانی انجام شد، فعلوانفعالات پروتئین-پروتئین به منظور شناسایی شبکههای مولکولی سلولهای آندومتر و جنین و برهمکنشهای بالقوه آنها بررسی شدند. در مرحله پذیرش اندومتر، چندین ژن و مسیرهای سیگنالینگ، ازجمله مسیرهای التهابی JAK-STAT شناسایی شدند. شبکه اصلی تعامل جنین-اندومتر اهمیت مولکولهای چسبندگی سلولی را در فرایند لانهگزینی برجسته کرد. همچنین تعاملات گیرنده سیتوکین-سیتوکین در مسیرهای استئوپونتین، فاکتور مهارکننده لوکمی و لپتین شناسایی شدند. در این تعاملات دوطرفه جنین-اندومتر انسانی، فاکتورهای رشدی مانند فاکتور رشد فیبروبلاست7 و گاسترین نقش داشتند [13]. همچنین وزیکولهای خارج سلولی خالصشده از سلولهای استرومایی دسیدوایی انسانی، بیان LIF-STAT و مولکولهای چسبندگی را در سلولهای استرومایی دسیدوال فعال میکنند که درنتیجه آن فرایند لانهگزینی به نحو مؤثری انجام خواهد شد [14].
شکست لانهگزینی یکی از دلایل ناباروری محسوب میشود و توجه به عوامل ترشحی طی این مرحله ضروری به نظر میرسد. باتوجهبه اهمیت لانهگزینی رویان و ناشناخته بودن بخشی از مکانسیم و وقایع آن، هدف از مطالعه حاضر بررسی فاکتورهای مؤثر بر لانهگزینی رویان میباشد. امروزه درمان با کاربرد هریک از این فاکتورها میتواند منجر به بهبود باروری شود که این مسئله اهمیت شناخت هرچه بیشتر این عوامل را توجیه میکند. در این مطالعه ابتدا به فرایند لانهگزینی رویان پرداخته میشود و سپس فاکتورهای مؤثر بر آن بیان میشوند.
روشها
در این مطالعه مروری برای شناسایی عوامل مؤثر بر لانه گزینی، مطالعات داخلی و خارجی بین سالهای 2000 تا 2023 از پایگاههای اطلاعاتی مانند پابمد، اسکوپوس، ساینسدایرکت، گوگلاسکالر و مگیرانبا استفاده از کلیدواژههای لانهگزینی رویان، فاکتورهای مؤثر بر لانهگزینی و ناباروری بهصورت تنها و ترکیبی بررسی شد. تمام مقالات بهدستآمده انگلیسی و فارسی مورد توجه قرار گرفتند. مقالاتی که بهصورت گزارش موردی، نامه به سردبیر، مطالعات آزمایشی و فرضیات، مطالعاتی که فقط بهصورت چکیده دردسترس بودند و مطالعات با روششناسی نامشخص از مطالعه حاضر حذف شدند. برای شناسایی منابعی که در جستوجوی مقالات ممکن است از دست رفته باشد، فهرستهای منابع از مطالعات مرتبط اصلی نیز بررسی شدند. سپس مقالات برای شناسایی مطالعات مرتبط توسط دو نفر بهطور جداگانه ارزیابی شدند. سرانجام، نتایج مطالعه متون به شیوه روایتی و تحلیلی ارائه شد.
یافتهها
پذیرندگی رحم برای لانهگزینی رویان توسط هورمونهای استروژن و پروژسترون تنظیم میشود. نقص در تنظیم بیان سیتوکینها، منجر به شکست لانهگزینی خواهد شد. نقش بالقوه فاکتورهای رشد مانند فاکتور مهارکننده لوکمی، اینترلوکینهای 1، 6 و 11، فاکتور تحریککننده کلونی-1، خانواده فاکتورهای رشد اپیدرمی و فاکتور رشد شبه انسولینی در فرآیند لانهگزینی مهم توصیف شدهاند. اینترگرینها هم در فرایند لانهگزینی نقش مهمی دارند و بیان نابجای آن با ناباروری و سقط همراه خواهد بود. ژنهای هموباکس تنظیمکننده رونویسی هستند که نقش اساسی در رشد جنین دارند، همچنین بیان آن در توسعه لولههای اولیه تناسلی جنس مؤنث و بعد در رحم بزرگسالان ادامه مییابد. نقش مورفوژنها در لانهگزینی اثبات شده است و در تعاملات رویان-رحم در طی لانهگزینی مؤثر هستند.
بحث
مراحل لانهگزینی رویان
تقابل
در جوندگان، یک ادم استرومایی موضعی، منجر به بسته شدن مجرای رحم و درنتیجه اتصال میکروویلیهای تروفواکتودرم و اپیتلیوم مجرایی خواهد شد. بسته شدن مجرا در رحم باردار و یا حاملگی کاذب نیز رخ میدهد و به همین دلیل برای مطالعه این مرحله از لانهگرینی، حضور بلاستوسیست نیاز نیست. بااینحال بیان پروژسترون برای بسته شدن مجرا ضروری است. بیان Fkbp52 با رسپتور پروژسترون در استروما قبل از اتصال رویان به رحم، همپوشانی دارد و زنان با -/-Fkbp52 شکست در لانهگزینی دارند. بااینحال، اگرچه پوشش پروژسترونی ازطریق رسپتور پروژسترون برای بسته شدن مجرا و تقابل ضروری است، اتصال بلاستوسیست نمیتواند رخ دهد مگر اینکه رحم بهطور اولیه در معرض استروژن قرار گیرد. همچنین مسیر پیامرسانی که توسط فاکتور رشد اپیدرمی متصل به هپارین آغاز میشود، بهطورگستردهای طی تقابل و اتصال مورد مطالعه قرار گرفته است، زیرا فاکتور رشد اپیدرمی متصل به هپارین یک نشانگر مولکولی اولیه در تداخل رویان–رحم میباشد [15].
چند ساعت قبل از اتصال، Hegf1 (از ژنهای دخیل در مرحله قبل از لانهگزینی) در محل تقابل اپیتلیوم رحمی موش با بلاستوسیست بیان میشود و این ترشح همچنان تا اوایل فاز اتصال ادامه دارد. اغلب موشها با -/-Hegf1 طی دوران بارداری و اوایل زندگی بعد از تولد بهعلت نقص قلبی میمیرند که مانع بررسی فنوتیپ لانهگزینی میشود [16, 17].
اتصال
مهمترین مولکولهایی که در فرایند اتصال نقش دارند اینتگرین، سلکتین، گالکتین، هپاران سولفات، موسین-1، کادهرین و کمپلکس تروفینین-تاستین-بیستین هستند. اینتگرین و سلکتین ویژگیهای منحصربهفرد عملکردی دارند. در رحم انسان طی فاز پذیرش، اینتگرین αvβ3 به اپیتلیوم رحمی ترشح میشود و بیان نابجای آن، با ناباروری و سقط مکرر همراه است [18]. این یافتهها نشان میدهد که سیستم اتصال سلکتین به منزله گام اولیه در لانهگزینی انسان است. فاکتور مهارکننده لوکمی نیز برای فرایند اتصال مهم به نظر میرسد. به این دلیل که موش با -/-LIF، فقدان فاکتور رشد اپیدرمی متصل به هپارین و بیان نابجای سیکلواکسیژناز2 را در بلاستوسیست طی زمان پیشبینیشده اتصال، نشان میدهد [19].
نفوذ
یک رویداد مهم در لانهگزینی رویان، افزایش نفوذپذیری عروق آندومتر در محل اتصال بلاستوسیست است. این فرایند مستلزم فعالیت پروستاگلاندین است و سیکلواکسیژناز1 و سیکلواکسیژناز2 واسطه سنتز پروستاگلاندین هستند که بهترتیب توسط پروستاگلاندین-اندوپروکساید سنتاز1 و پروستاگلاندین-اندوپروکساید سنتاز2 کدگذاری میشوند. بیانپروستاگلاندین-اندوپروکساید سنتاز2 در رحم موش پدیدهای منحصربهفرد است که در اپیتلیوم مجرایی و سلولهای لایه زیرین استروما، در محل اتصال بلاستوسیست وجود دارد. این باور وجود دارد که فاکتور رشد اپیدرمی متصل به هپارین تولیدشده در رحم و رویان باعث بیانپروستاگلاندین-اندوپروکساید سنتاز2 در رحم میشود. زنان با -/-Ptgs2، اغلب نابارور هستند، آنها تخمکگذاری، لقاح، لانهگزینی و دسیدوایی شدن معیوبی دارند [15، 20].
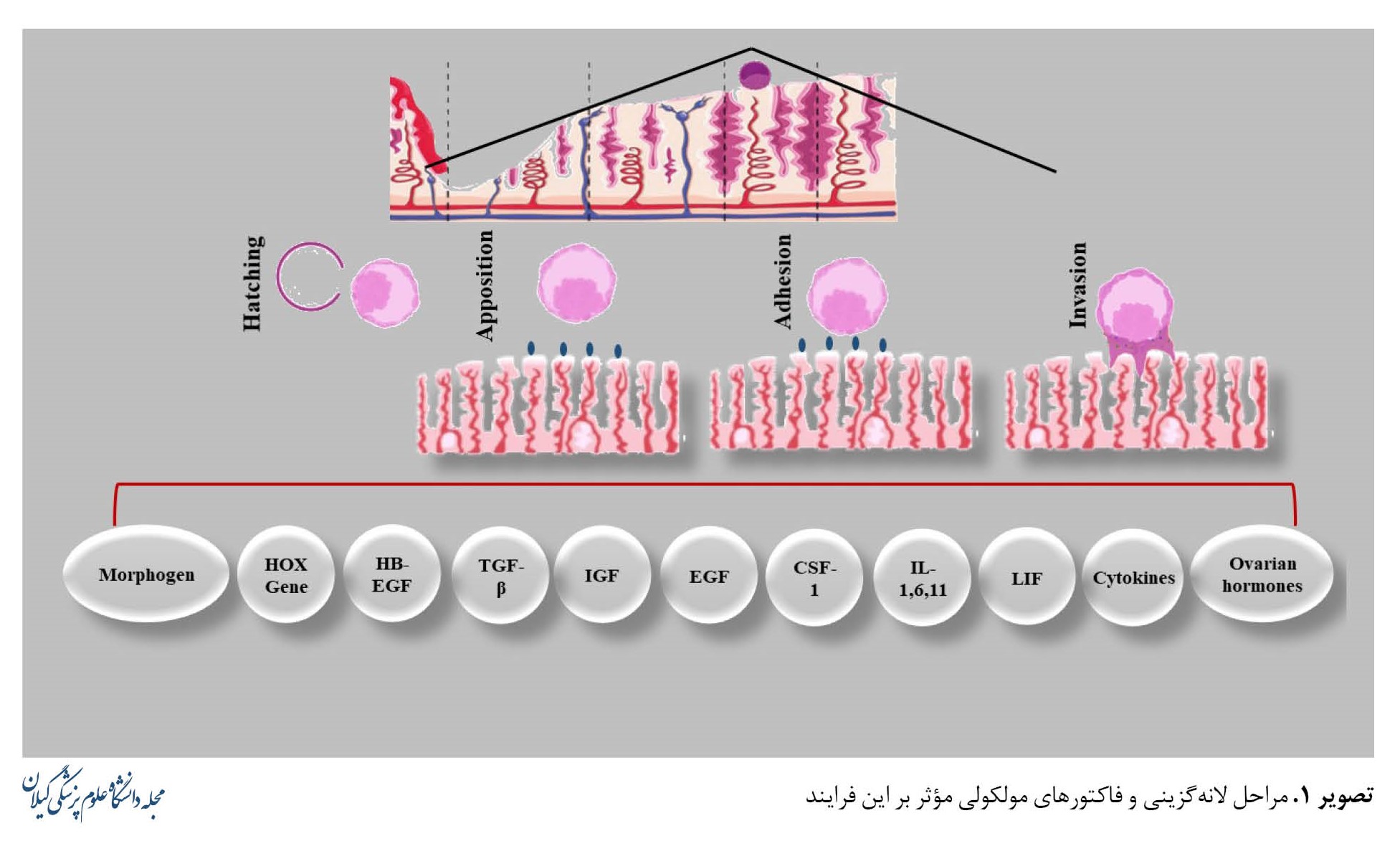
طی لانهگزینی گونههای مختلف، ازجمله پستانداران، سیکلواکسیژناز2 در رحم و یا بلاستوسیست بیان میشود که نشاندهنده عملکرد حفاظتی آن در این فرایند میباشد. در موشهایی که فاقد فسفولیپاز سیتوپلاسمی A2α (تولیدکننده پیشساز برای سنتز پروستاگلاندین) هستند، کاهش باروری دیده شده است. این نتایج نشان میدهد که محور پیامرسانی cPLA2α-COX2 جهت لانهگزینی بسیار مهم است [21]. تصویر شماره 1 نمایی از لانهگزینی و فاکتورهای مؤثر بر آن را نشان میدهد.
لانهگزینی یک گام بسیار مهم در تولیدمثل پستانداران است و بهعنوان دروازه ورود رویان به رشد و نمو و حاملگی موفق بیان میشود. کاشت موفقیتآمیز رویان به تعامل هماهنگ و دقیق آن با رحم نیاز دارد. این فعلوانفعالات متقابل بین رویان-آندومتر رحم در یک مدت زمان محدود بهعنوان «پنجره لانه گزینی» یا «پنجره پذیرش» شناخته میشود [1, 2]. هرگونه نقص در ارتباطات بین آندومتر و رویان، منجر به شکست لانهگزینی رویان میشود که یک مشکل بزرگ در طب تولیدمثل و از علل مهم ناباروری است. پذیرش رحم برای رویان توسط هورمونهای تخمدانی استروژن و پروژسترون تنظیم میشود و تحت تأثیر آنها، برخی سایتوکینها و فاکتورهای رشد نیز نقش مهمی در تعامل رویان-رحم در لانهگزینی بازی میکنند. آگاهی از عملکرد این مولکولها در طی این فرایند، به شناخت علل شکست لانهگزینی جنین و ناباروری کمک خواهد کرد [3 ,4].
لانهگزینی به سه مرحله تقابل، اتصال و نفوذ تقسیم میشود. در جوندگان و برخی از پستانداران ازجمله انسان، رویان (بلاستوسیست) پس از ورود به رحم، از ناحیه شفاف خارج میشود و با اپیتلیوم مجرا تقابل پیدا میکند [5]. سلولهای توده خارجی بلاستوسیست (تروفوبلاست) به اپیتلیوم آندومتر متصل میشود و توده سلولی داخلی (امبریوبلاست)، مجاور آن قرار میگیرد. سلولهای اپیتلیال مقابل بلاستوسیست، دچار مرگ برنامهریزیشده میشوند و توسط سلولهای سن سیتیوتروفوبلاست (سلولهای سطحی دیواره بلاستوسیست) فاگوسیتوز میشوند که این مسئله باعث تسهیل نفوذ رویان به اپیتلیوم خواهد شد [6].
لانهگزینی میتواند براساس نوع تعامل بلاستوسیست-رحم به 3 دسته مرکزی، خارج از مرکز و بینابینی تقسیم شود. لانهگزینی مرکزی در حیواناتی مانند گاو، گوسفند و خوک رخ میدهد. بلاستوسیست به اپیتلیوم آندومتر متصل میشود، بدون اینکه به آن نفوذ کند. لانهگزینی در موش، رت و هامستر خارج از مرکز است که اپیتلیوم مجرا، یک اینواژیناسیون در اطراف تروفوبلاست تشکیل میدهد. انسان و خوکچه هندی لانهگزینی بینابینی دارند که در آن تروفوبلاست از طریق اپیتلیوم مجرا به استرومای آندومتر و دیواره رحم نفوذ میکند. هدف از لانهگزینی صرفنظر از تقسیمبندی فوق، عرضه خون مادری به عروق خونی رویان در حال رشد است. در طی نفوذ تروفوبلاست به استرومای آندومتر، سلولهای فیبروبلاست استرومایی، به سلول درشت و چند وجهی دسیدوا تمایز مییابند. دسیدوایی شدن سلولهای استروما در همه گونهها صرفنظر از نوع جفت مشابه است، اما میزان آن متغیر میباشد و با عمق نفوذ تروفوبلاست در طی لانهگزینی ارتباط دارد [7, 8].
وقایع اتصال رویان به اپیتلیوم آندومتر و نفوذ پس از آن به استروما هنوز بهطور کامل شناخته نشده است. برای محافظت مادر از نفوذ تروفوبلاست به شریانهای مارپیچی رحم، سلولهای استرومای آندومتر به یک ساختار سلولی متراکم به نام دسیدوا تغییر میکنند. دسیدوا با تشکیل یک مانع فیزیکی از حرکت و نفوذ تروفوبلاست جلوگیری میکند که باعث افزایش اتصال تروفوبلاست بهجای نفوذ میشود [9, 10].
دسیدوایی شدن سلولهای مزانشیمی فیبروبلاستی در انسان تحت تأثیر هورمونهای استروئیدی، پروژسترون و استرادیول رخ میدهد که برای یک بارداری موفق، ضروری است. از نقشهای مهم دسیدوا، احاطه کردن جنین در حال رشد و تسهیل انتقال مواد مغذی به تروفوبلاست میباشد. بنابراین، دسیدوایی شدن یک پیشنیاز برای لانهگزینی رویان است و اولین نشانه آن، افزایش نفوذپذیری عروق رحم در محل تقابل با بلاستوسیست است [11]. تعامل بین آندومتر مادر و رویان طی لانهگزینی با واسطه مولکولهای متعدد و آبشار پیامرسانی (سیگنالینگ) اتفاق می افتد که هنوز بهطور کامل شناخته نشدهاند. این وقایع پیچیده منجر به تغییرات مورفولوژیک و بیوشیمیایی سلول استرومایی به دسیدوایی میشود که با بیان تعدادی از ژنها، در تثبیت یک حاملگی موفق مشارکت میکنند [9].
مطالعات فراساختاری سلولهای دسیدوای انسانی نشان داد که آنها دارای تمام ویژگیهای یک سلول ترشحی مانند هستههای یوکروماتیک، سیسترنهای گلژی متعدد، شبکه اندوپلاسمی خشن توسعهیافته و گرانولهای ترشحی متراکم هستند. سلولهای استرومای دسیدوایی، پروتئینهای جدیدی مانند پرولاکتین و پروتئین اتصالی فاکتور رشد شبه انسولینی-1 را بیان میکنند [12].
موفقیت لانهگزینی به ارتباط دو طرفه بین جنین و رحم بستگی دارد. طبق مطالعهای که بر لانهگزینی جنین انسانی انجام شد، فعلوانفعالات پروتئین-پروتئین به منظور شناسایی شبکههای مولکولی سلولهای آندومتر و جنین و برهمکنشهای بالقوه آنها بررسی شدند. در مرحله پذیرش اندومتر، چندین ژن و مسیرهای سیگنالینگ، ازجمله مسیرهای التهابی JAK-STAT شناسایی شدند. شبکه اصلی تعامل جنین-اندومتر اهمیت مولکولهای چسبندگی سلولی را در فرایند لانهگزینی برجسته کرد. همچنین تعاملات گیرنده سیتوکین-سیتوکین در مسیرهای استئوپونتین، فاکتور مهارکننده لوکمی و لپتین شناسایی شدند. در این تعاملات دوطرفه جنین-اندومتر انسانی، فاکتورهای رشدی مانند فاکتور رشد فیبروبلاست7 و گاسترین نقش داشتند [13]. همچنین وزیکولهای خارج سلولی خالصشده از سلولهای استرومایی دسیدوایی انسانی، بیان LIF-STAT و مولکولهای چسبندگی را در سلولهای استرومایی دسیدوال فعال میکنند که درنتیجه آن فرایند لانهگزینی به نحو مؤثری انجام خواهد شد [14].
شکست لانهگزینی یکی از دلایل ناباروری محسوب میشود و توجه به عوامل ترشحی طی این مرحله ضروری به نظر میرسد. باتوجهبه اهمیت لانهگزینی رویان و ناشناخته بودن بخشی از مکانسیم و وقایع آن، هدف از مطالعه حاضر بررسی فاکتورهای مؤثر بر لانهگزینی رویان میباشد. امروزه درمان با کاربرد هریک از این فاکتورها میتواند منجر به بهبود باروری شود که این مسئله اهمیت شناخت هرچه بیشتر این عوامل را توجیه میکند. در این مطالعه ابتدا به فرایند لانهگزینی رویان پرداخته میشود و سپس فاکتورهای مؤثر بر آن بیان میشوند.
روشها
در این مطالعه مروری برای شناسایی عوامل مؤثر بر لانه گزینی، مطالعات داخلی و خارجی بین سالهای 2000 تا 2023 از پایگاههای اطلاعاتی مانند پابمد، اسکوپوس، ساینسدایرکت، گوگلاسکالر و مگیرانبا استفاده از کلیدواژههای لانهگزینی رویان، فاکتورهای مؤثر بر لانهگزینی و ناباروری بهصورت تنها و ترکیبی بررسی شد. تمام مقالات بهدستآمده انگلیسی و فارسی مورد توجه قرار گرفتند. مقالاتی که بهصورت گزارش موردی، نامه به سردبیر، مطالعات آزمایشی و فرضیات، مطالعاتی که فقط بهصورت چکیده دردسترس بودند و مطالعات با روششناسی نامشخص از مطالعه حاضر حذف شدند. برای شناسایی منابعی که در جستوجوی مقالات ممکن است از دست رفته باشد، فهرستهای منابع از مطالعات مرتبط اصلی نیز بررسی شدند. سپس مقالات برای شناسایی مطالعات مرتبط توسط دو نفر بهطور جداگانه ارزیابی شدند. سرانجام، نتایج مطالعه متون به شیوه روایتی و تحلیلی ارائه شد.
یافتهها
پذیرندگی رحم برای لانهگزینی رویان توسط هورمونهای استروژن و پروژسترون تنظیم میشود. نقص در تنظیم بیان سیتوکینها، منجر به شکست لانهگزینی خواهد شد. نقش بالقوه فاکتورهای رشد مانند فاکتور مهارکننده لوکمی، اینترلوکینهای 1، 6 و 11، فاکتور تحریککننده کلونی-1، خانواده فاکتورهای رشد اپیدرمی و فاکتور رشد شبه انسولینی در فرآیند لانهگزینی مهم توصیف شدهاند. اینترگرینها هم در فرایند لانهگزینی نقش مهمی دارند و بیان نابجای آن با ناباروری و سقط همراه خواهد بود. ژنهای هموباکس تنظیمکننده رونویسی هستند که نقش اساسی در رشد جنین دارند، همچنین بیان آن در توسعه لولههای اولیه تناسلی جنس مؤنث و بعد در رحم بزرگسالان ادامه مییابد. نقش مورفوژنها در لانهگزینی اثبات شده است و در تعاملات رویان-رحم در طی لانهگزینی مؤثر هستند.
بحث
مراحل لانهگزینی رویان
تقابل
در جوندگان، یک ادم استرومایی موضعی، منجر به بسته شدن مجرای رحم و درنتیجه اتصال میکروویلیهای تروفواکتودرم و اپیتلیوم مجرایی خواهد شد. بسته شدن مجرا در رحم باردار و یا حاملگی کاذب نیز رخ میدهد و به همین دلیل برای مطالعه این مرحله از لانهگرینی، حضور بلاستوسیست نیاز نیست. بااینحال بیان پروژسترون برای بسته شدن مجرا ضروری است. بیان Fkbp52 با رسپتور پروژسترون در استروما قبل از اتصال رویان به رحم، همپوشانی دارد و زنان با -/-Fkbp52 شکست در لانهگزینی دارند. بااینحال، اگرچه پوشش پروژسترونی ازطریق رسپتور پروژسترون برای بسته شدن مجرا و تقابل ضروری است، اتصال بلاستوسیست نمیتواند رخ دهد مگر اینکه رحم بهطور اولیه در معرض استروژن قرار گیرد. همچنین مسیر پیامرسانی که توسط فاکتور رشد اپیدرمی متصل به هپارین آغاز میشود، بهطورگستردهای طی تقابل و اتصال مورد مطالعه قرار گرفته است، زیرا فاکتور رشد اپیدرمی متصل به هپارین یک نشانگر مولکولی اولیه در تداخل رویان–رحم میباشد [15].
چند ساعت قبل از اتصال، Hegf1 (از ژنهای دخیل در مرحله قبل از لانهگزینی) در محل تقابل اپیتلیوم رحمی موش با بلاستوسیست بیان میشود و این ترشح همچنان تا اوایل فاز اتصال ادامه دارد. اغلب موشها با -/-Hegf1 طی دوران بارداری و اوایل زندگی بعد از تولد بهعلت نقص قلبی میمیرند که مانع بررسی فنوتیپ لانهگزینی میشود [16, 17].
اتصال
مهمترین مولکولهایی که در فرایند اتصال نقش دارند اینتگرین، سلکتین، گالکتین، هپاران سولفات، موسین-1، کادهرین و کمپلکس تروفینین-تاستین-بیستین هستند. اینتگرین و سلکتین ویژگیهای منحصربهفرد عملکردی دارند. در رحم انسان طی فاز پذیرش، اینتگرین αvβ3 به اپیتلیوم رحمی ترشح میشود و بیان نابجای آن، با ناباروری و سقط مکرر همراه است [18]. این یافتهها نشان میدهد که سیستم اتصال سلکتین به منزله گام اولیه در لانهگزینی انسان است. فاکتور مهارکننده لوکمی نیز برای فرایند اتصال مهم به نظر میرسد. به این دلیل که موش با -/-LIF، فقدان فاکتور رشد اپیدرمی متصل به هپارین و بیان نابجای سیکلواکسیژناز2 را در بلاستوسیست طی زمان پیشبینیشده اتصال، نشان میدهد [19].
نفوذ
یک رویداد مهم در لانهگزینی رویان، افزایش نفوذپذیری عروق آندومتر در محل اتصال بلاستوسیست است. این فرایند مستلزم فعالیت پروستاگلاندین است و سیکلواکسیژناز1 و سیکلواکسیژناز2 واسطه سنتز پروستاگلاندین هستند که بهترتیب توسط پروستاگلاندین-اندوپروکساید سنتاز1 و پروستاگلاندین-اندوپروکساید سنتاز2 کدگذاری میشوند. بیانپروستاگلاندین-اندوپروکساید سنتاز2 در رحم موش پدیدهای منحصربهفرد است که در اپیتلیوم مجرایی و سلولهای لایه زیرین استروما، در محل اتصال بلاستوسیست وجود دارد. این باور وجود دارد که فاکتور رشد اپیدرمی متصل به هپارین تولیدشده در رحم و رویان باعث بیانپروستاگلاندین-اندوپروکساید سنتاز2 در رحم میشود. زنان با -/-Ptgs2، اغلب نابارور هستند، آنها تخمکگذاری، لقاح، لانهگزینی و دسیدوایی شدن معیوبی دارند [15، 20].
طی لانهگزینی گونههای مختلف، ازجمله پستانداران، سیکلواکسیژناز2 در رحم و یا بلاستوسیست بیان میشود که نشاندهنده عملکرد حفاظتی آن در این فرایند میباشد. در موشهایی که فاقد فسفولیپاز سیتوپلاسمی A2α (تولیدکننده پیشساز برای سنتز پروستاگلاندین) هستند، کاهش باروری دیده شده است. این نتایج نشان میدهد که محور پیامرسانی cPLA2α-COX2 جهت لانهگزینی بسیار مهم است [21]. تصویر شماره 1 نمایی از لانهگزینی و فاکتورهای مؤثر بر آن را نشان میدهد.
فاکتورهای مؤثر بر لانهگزینی رویان
هورمونهای تخمدان
هورمونهای اصلی مؤثر بر پذیرش رحم، پروژسترون و استروژن تخمدان هستند. پروژسترون برای لانهگزینی و نگهداری بارداری در تمام پستانداران ضروری است، درحالیکه استروژن برای گونههای خاصی مورد نیاز است. در لانهگزینی موش، پروژسترون و استروژن تخمدانی ضروری هستند، اما در خوکها، خوکچه هندی، خرگوش و هامستر، استروژن تخمدانی ضروری نیست. بااینحال در چهار گونه آخر، استروژنی که توسط رویان تولید میشود برای لانهگزینی مهم در نظر گرفته میشود. درحالیکه استروژن تخمدان یا رویان شرکتکننده در لانهگزینی انسان بهطور کامل شناخته نشده است، اما میدانیم که اثرات رحمی استروژن و پروژسترون بهطور اولیه توسط رسپتورهای هستهای استروژن (ER) و پروژسترون (PR) ایجاد میشوند [18]. در موش، تغییرات مکانی و زمانی در بیان استروژن و پروژسترون در رحم، حوالی مرحله لانهگزینی رخ میدهد [15].
در روزهای 1 تا 2 لانهگزینی در موش، استروژن در اپیتلیوم مجرایی و غددی آندومتر بیان و در روزهای 3 تا 4، استروژن در استروما، اپیتلیوم مجرا و غدد بیان میشود. در روز 5، استروژن در اپیتلیوم مجرای رحم و اپیتلیوم غدد بیان شده است، اما بیان آن در استرومای قشر، پایین است. پروژسترون در اپیتلیوم مجرا و غدد در روز 1 لانهگزینی با سطوح پایین و روز 2 در سطح متوسط بیان میشود. در روز 3 تا 4، پروژسترون در اپیتلیوم مجرا، غدد و سلولهای استروما بیان شده است، اما طی روزهای 5 تا 8، پروژسترون در اپیتلیوم مجرا وجود ندارد و محدود به سلولهای استرومایی بهویژه در دسیدوا میشود [3، 22].
در بیولوژی رحم و لانهگزینی هریک از ایزوفرمهای
استروژنERα) و ERβ) و پروژسترون PRA) و PRB) دارای عملکرد خاص هستند که با مطالعات مختلف بر روی اثرات حذف انتخابی آنها در فعالیتهای تولیدمثل تأیید شده است. این تحقیقات نشان داد در موشهایی که ERα-/- هستند، رحم آنها دچار هیپوپلازی میشود و درنتیجه لانهگزینی با شکست مواجه میشود، اما این فرایند در موشهایی با ERβ-/- بهطور معمول رخ میدهد [18]. درحالیکه ناباروری بهعلت نقص در عملکرد تخمدان و رحم در موشهایی با فقدان هر دو ایزوفرم پروژسترون مشاهده شد، موشهایی که فقط PRβ نداشتند، طبیعی بودند [23, 24].
سیتوکینها
سیتوکینها پروتئینهای کوچک چند منظوره هستند که اقدامات زیستی آنها با واسطه گیرندههای سطح سلولی انجام میشود. آنها بهعنوان پیامرسانهای قوی، عملکرد سلولهای آندومتر و واکنشهای مادر-رویان را تنظیم میکنند. ورود بلاستوسیست به رحم پذیرا برای تولید سیتوکینهای تروفوبلاستی و اپیتلیوم رحم، بسیار مهم است که پذیرش اندومتر را با تنظیم بیان مولکولهای مختلف مرحله اتصال، تعدیل میکند [25, 26]. در پستانداران نقص در تنظیم بیان و پیامرسانی سیتوکینها، منجر به شکست کامل و یا ناقص لانهگزینی و همچنین تشکیل غیرطبیعی جفت میشود [27, 28].
فاکتور مهارکننده لوکمی ( Leukemia inhibitory factor/LIF)
فاکتورهای رشد متعددی در تعاملات جنین و مادر طی لانهگزینی درگیر هستند. فاکتور مهارکننده لوکمی عضوی از خانواده اینرلوکین-6 و سیتوکین پلیوتروپیک میباشد. نقش فاکتور مهارکننده لوکمی برای لانهگزینی در انسان مهم است. در موش نیز بیان فاکتور مهارکننده لوکمی در رحم در روز 4 بارداری، همزمان با لانهگزینی افزایش مییابد. فاکتور مهارکننده لوکمی برای اولین بار در غدد رحمی در روز 4 بعد از لقاح بیان میشود. این الگو نشان میدهد که فاکتور مهارکننده لوکمی نقش مهمی در مرحله اتصال و همچنین در آمادهسازی رحم برای لانهگزینی ایفا میکند. موشهای فاقد فاکتور مهارکننده لوکمی با شکست لانهگزینی بلاستوسیست مواجه میشوند [29].
فاکتور مهارکننده لوکمی از رحم ترشح و بهعنوان عاملی مهم در لانهگزینی رویان محسوب میشود. اثرات پلیوتروپیک فاکتور مهارکننده لوکمی توسط اتصال به رسپتورش که متشکل از دو پروتئین غشایی گیرنده فاکتور مهارکننده لوکمی و گلیگوپروتئین-130 است، انجام میشود. چنانکه گیرنده فاکتور مهارکننده لوکمی چندین مسیر پیامرسان ازجمله مسیرهای JAK/STAT ،MAPK و PI3 از PIPK را در انواع سلولها فعال میکند. جنین فاقد گیرنده فاکتور مهارکننده لوکمی و یا گلیگوپروتئین-130 لانهگزینی طبیعی دارد، اما قبل از زایمان میمیرد [30].
مطالعات اخیر نشان دادهاند که فاکتور مهارکننده لوکمی در هر دو فاز اتصال و نفوذ لانهگزینی نقش دارد که بهعلت اتصال محکم آن با تروفوبلاست است. این یافتهها اهمیت فاکتور مهارکننده لوکمی را در لانهگزینی رویان در جوندگان و پستانداران ثابت میکند. درمورد انسان، بیوپسی اندومتر بهدستآمده از زنان بارور، بیان فاکتور مهارکننده لوکمی را در اواسط و اواخر فاز ترشحی نشان دادهاند. زنان با بیان فاکتور مهارکننده لوکمی قویتر در طی پنجره لانهگزینی، احتمال باردار شدن بیشتری نسبت به افرادی که بیان ضعیفتری در آنها دیده میشود را گزارش کردند. این نتایج حاکی از اهمیت فاکتور مهارکننده لوکمی در لقاح آزمایشگاهی میباشد [31، 32].
اینترلوکین-1 (Interleukin-1/IL-1)
لانهگزینی بهعنوان نوعی پاسخ التهابی محسوب میشود. تعدادی از سیتوکینها در محل لانهگزینی شناسایی شدهاند که بسیاری از این مولکولها منشأ جنینی دارند. اینترلوکین-1 یکی از این عوامل پاراکرین، تعدیلکننده ارتباطات بین آندومتر و رویان است و کلید تنظیمکننده پاسخ التهابی بوده و در حال حاضر بهعنوان سیتوکین، قادر به طیف گستردهای از اثرات در انواع سلولها میباشد [33].
دو شکل از آگونیست اینترلوکین-1 IL-1β) و IL-1α) به گیرنده اینترلوکین-1 یکسانی (IL-1RI) متصل میشوند. لانهگزینی موفق رویان انسان پس از لقاح آزمایشگاهی در محیط کشت، مربوط به غلظت بالایی از IL-1β و IL-1α است. بااینحال، نقش IL-1α در آندومتر انسان و پستانداران غیرانسانی مانند IL-1β به وضوح مشخص نیست و بهعنوان یکی از عوامل واسطه در ارتباط متقابل بین بلاستوسیست و آندومتر فرض شده است. اینترلوکین-1 توسط ماکروفاژها، تروفوبلاست و سلولهای استروما تولید میشود. بیان IL-1RI در طول چرخه قاعدگی انسان، از یک الگوی سه بخشی در هر دو سلول اپیتلیال و استرومایی پیروی میکند. بیان پروتئین در فاز تکثیری پایین، طی تخمکگذاری و مراحل لانهگزینی متوسط و در پایان لانهگزینی شدید است [34].
اینترلوکین-6
اینترلوکین-6 یک سیتوکین پلیوتروپیک میباشد که در موش، بیان آن در روز 5 و 6 بارداری افزایش مییابد. در انسان، اینترلوکین-6 و گیرنده آن در طی پنجره لانهگزینی آندومتر بیان افزایشی دارند. در زنانی با تجربه سقط در مقایسه با افرادی که بارداری طبیعی دارند، سطوح اینترلوکین-6 در پلاسما کاهش یافته است. موشهای فاقد اینترلوکین-6، لانهگزینی طبیعی نشان دادهاند. بااینحال، رشد بلاستوسیست میتواند به خطر افتد و تعداد مکانهای لانهگزینی و اندازه آن کاهش یابد. بنابراین، اینترلوکین-6 میتواند نقش مهمی در لانهگزینی بازی کند، اما این نقش ضروری نیست. اینترلوکین-6 میتواند هر دو پاسخ التهابی و ضدالتهابی را از طریق گلیگوپروتئین-130 اعمال کند. بیان اینترلوکین-6 در اواسط فاز ترشحی و بیشتر بهصورت موضعی در سلولهای غدد اپیتلیال تعیین شده است [3].
نقش حیاتی اینترلوکین-6 طی لانهگزینی با استفاده از موش با کمبود اینترلوکین-6، کاهش نواحی لانهگزینی و کاهش باروری را نشان داد. علاوهبراین، وجود رسپتور در اندومتر و بلاستوسیست، نقش پاراکرین/اتوکرین را برای اینترلوکین-6 طی این فرایند در موش مطرح میکند. بنابراین اینترلوکین-6 ممکن است بهعنوان پیشگوییکننده کیفیت بلاستوسیست مفید باشد. بااینحال، بیان غیرطبیعی اینترلوکین-6 در اواسط فاز ترشحی در بیمار با سابقه سقط گزارش شده است. عمدتاً اینترلوکین-6 در آندومتر اواسط تا اواخر فاز ترشحی، زمانی که اندومتر در معرض بالاترین غلظت پروژسترون و استرادیول است، بیان میشود و این نشان میدهد که هورمونهای استروئیدی ممکن است در تنظیم بیاناینترلوکین-6 نقش داشته باشند [35].
اینترلوکین-11
اینترلوکین-11 یک سیتوکین است که عملکرد پلیوتروپیک در بافتها و سلولهای مختلف دارد. اینترلوکین-11 و گیرنده آن(IL-11Ra) در آندومتر وجود دارند. بیان اینترلوکین-11 در موش و انسان مشخص شده است. همراه با فاکتور مهارکننده لوکمی، اینترلوکین-6 و اینترلوکین-11 متعلق به سیتوکینهای گلیگوپروتئین-130 میباشد. انواع سلولهای عمده در آندومتر، اینترلوکین-11 را با دورههای متغیر بیان میکنند. برجستهترین واکنش ایمنی و بیان mRNA در سلولهای استرومایی دسیدواییشده، در اواخر چرخه قاعدگی است. باوجوداین، هنوز هم عدم قطعیت برای تولید حداکثر اینترلوکین-11 در سلولهای اپیتلیال وجود دارد که احتمالاً بهدلیل پروتکلهای متفاوت برای مطالعات ایمونوهیستوشیمی در این زمینه است. حضور IL-11 mRNA و گلیگوپروتئین-130 طی دسیدوایی شدن در سلولهای استروما و سلولهای اپیتلیال غدد، حاکی از اهمیت IL-11 در دسیدوایی شدن سلولهای استرومایی است [3].
در زمان دسیدوایی شدن در موش، 5/5 الی 7/5 روز پس از لقاح، اینترلوکین-11 به مقدار زیادی بیان میشود. بیان قوی اینترلوکین-11 در سلول دسیدوایی در حال توسعه و بیان کم آن در سیکل رحمی وجود دارد. بااینحال، هیچ تغییری در بیان IL-11Rα در رحم آبستن و سیکل رحمی مشاهده نشد. موش ماده فاقد گیرنده IL-11 α باتوجهبه نقص در دسیدوایی شدن، نابارور است، بنابراین، اینترلوکین-11 در موش برای لانهگزینی بسیار مهم تلقی میشود [36].
بیان اینترلوکین-11 در بافت اندومتر انسان نیز در طی دسیدوایی شدن بسیار مهم است. مطالعه برون تنی نشان داد که فاکتور مهارکننده لوکمی و اینترلوکین-11 در تنظیم اتصال سلولهای اپیتلیال آندومتر نقش دارند. در مطالعات بالینی مشاهده شده است که اینترلوکین-11 پلاسما در زنان مبتلا به سقط جنین 3 ماهه اول بارداری در مقایسه با زنان با حاملگی طبیعی کاهش دارد [37]. علاوهبراین، پروتئین اینترلوکین-11 و اینترلوکین11Rα-، در حوالی لانهگزینی، در زنان مبتلا به سقط مکرر نسبت به زنان طبیعی در سطوح پایینتر در سلولهای اپیتلیال اندومتر دیده میشود. جالب توجه است، اگرچه تولید کم اینترلوکین-11 از اندومتر با ناباروری اولیه در ارتباط است، سطح اینترلوکین11Rα- در سلول استرومای مشتق از زنان بارور و نابارور مشابه است [38].
در مورد انسان، شواهد زیادی نشان میدهد که اینترلوکین-11 دارای عملکرد مهمی در کاشت رویان میباشد. مطالعات، بیان اینترلوکین-11 و اینترلوکین11Rα- را در بیوپسی زنان بارور نرمال و زنان با سقط مکرر گزارش کردند. محققان نشان دادند بیان اینترلوکین-11 در سلولهای اپیتلیال در اندومتر زنان با سابقه سقط مکرر در مقایسه با زنان بارور نرمال، کمتر بود که پیشنهاد میدهند مصرف اینترلوکین-11 ممکن است احتمال سقط را کاهش بدهد. بنابراین اینترلوکین-11 میتواند در ایجاد حاملگی موفق، مهم باشد [39].
فاکتور محرک کلونی-1 (Colony stimulating factor-1/ CSF-1)
فاکتور محرک کلونی-1 یک عامل رشد هماتوپویتیک است که تکثیر، تمایز و بقای فاگوسیتهای تک هستهای و پیشسازهای آنها را تعدیل میکند. در موش، بیان محرک کلونی- در اندومتر در روز 3 پس از لقاح شروع میشود و طی بارداری افزایش مییابد. ماگزیمم بیان محرک کلونی-1 در 20 تا 30 روز پس از حاملگی رخ میدهد و این سطح بالا تا زمان تولد حفظ میشود. در گاو، محرک کلونی-1 بهطور چشمگیری بین روزهای 14 و 17 تغییر میکند. دیده میشود که محرک کلونی-1 در اولین مرحله از لانهگزینی در گاو نقش دارد. این دوره تقریباً زمان شناخت مادر از بارداری است. محرک کلونی-1 در بافت اندومتر انسان، طی سیکل عادی بیان میشود. در فاز ترشحی، سطح محرک کلونی-1 بالاتر از فاز تکثیری است. علاوهبراین، سطح محرک کلونی-1 در 3 ماهه اول بارداری در بافت دسیدوا بالاتر از بافت غیرباردار است. همچنین بیان غیرطبیعی محرک کلونی-1 با ناباوری مرتبط است [40، 41].
موشهای فاقد محرک کلونی-1 بسیاری از اختلالات تولیدمثل از جمله میزان پایین تخمکگذاری و کاهش لانهگزینی و بقا جنین را نشان میدهند. حتی درمان این موشها با محرک کلونی-1 نوترکیب انسانی برای نجات فنوتیپ باروری با شکست مواجه شد. بنابراین اهمیت برجسته سنتز موضعی محرک کلونی-1 برای عملکرد رحم مشخص میشود. غلظت محرک کلونی-1 در رحم توسط عملکرد سینرژیک استرادیول-17 بتا و پروژسترون تنظیم میشود. این یافتهها نشان میدهد که محرک کلونی-1 مادری تحت تأثیر هورمونهای جنسی، نقش مهمی را در فرایند لانهگزینی بازی میکند [3، 42].
خانواده فاکتور رشد اپیدرمی (Epidermal growth factor family/EGF)
خانواده فاکتور رشد اپیدرمی شامل فاکتور رشد تبدیلکننده آلفا، فاکتور رشد اپیدرمی متصل به هپارین و امفی رگولین میباشد. شواهد نشان میدهد که در گونههای مختلف، این خانواده نقش مهمی در لانهگزینی بازی میکند [43].
اعضای این خانواده تنظیم عملکردهای مختلف تکثیر، بقا، اتصال، مهاجرت و تمایز سلولی را تنظیم میکنند. در طی لانهگزینی رویان موش، فاکتور رشد تبدیلکننده آلفا، فاکتور رشد اپیدرمی متصل به هپارین و امفی رگولین در رحم بیان میشوند. بهطور خاص، ظهور فاکتور رشد اپیدرمی متصل به هپارین به میزان زیادی مربوط به دوره لانهگزینی میباشد که آن را بهعنوان مارکر مولکولی اولیه اتصال رویانی-رحمی در نظر گرفتهاند. فاکتور رشد اپیدرمی متصل به هپارین در اپیتلیوم مجرایی، 6 تا 7 ساعت قبل از آغاز اتصال در اطراف بلاستوسیست تولید میشود و البته فقط مربوط به بلاستوسیستهای فعال است. این الگو نشان میدهد که با سیگنال بلاستوسیست، سلولهای اپیتلیال مجرا در محل اتصال، فاکتور رشد اپیدرمی متصل به هپارین را بیان میکنند.
فاکتور رشد تبدیلکننده آلفا، فاکتور رشد اپیدرمی متصل به هپارین، فاکتور رشد اپیدرمی و امفی رگولین نیز در رحم موش در زمان لانهگزینی بیان میشوند. فاکتور رشد اپیدرمی و گیرنده آن، سطح mRNA را در لانهگزینی به پیک میرساند. سپس بیان آن به تدریج کاهش مییابد. فاکتور رشد تبدیلکننده آلفا و فاکتور رشد اپیدرمی متصل به هپارین در روزهای 3 و 4 بارداری بیان میشود و امفی رگولین نیز به مقدار زیادی در زمان لانهگزینی بیان میشود [44]. فاکتور رشد اپیدرمی متصل به هپارین در بافت آندومتر انسان در مرحله ترشحی چرخه قاعدگی بیان میشود و بیشترین بیان آن مربوط به بلافاصله قبل از پنجره لانهگزینی است. تصور میشود فاکتور رشد اپیدرمی متصل به هپارین نقش مهمی در اتصال و نفوذ، طی لانهگزینی در انسان داشته باشد. در موارد ناباروری با علت ناشناخته، طی اواسط فاز ترشحی، بیان پایینتری از فاکتور رشد اپیدرمی متصل به هپارین در آندومتر، در مقایسه با آندومتر نرمال مشاهده شد [45].
فاکتور رشد شبه انسولینی (Insulin-like growth factor/IGF)
فاکتور رشد تغییردهنده بتا عوامل رشد پلی پپتیدی قبل و بعد از تولد میباشند و شامل شبکه پیچیدهای از لیگاند (IGF-I و IGF-II)، گیرنده (IGF-IR و IGF-IIR) و پروتئین با میل اتصالی بالا (فاکتور رشد شبه انسولینی-1) و همچنین پروتئازهای خاص مؤثر بر فعالیتهای خود هستند. آنها با اتصال به گیرندههای فاکتور رشد شبه انسولینی، سوختوساز بدن و تمایز انواع مختلف سلولها را تحت تأثیر قرار میدهند. IGFBPs، فراهمی زیستی و اثرات فاکتور رشد شبه انسولینی را تعدیل میکنند. فاکتور رشد شبه انسولینی رشد و تمایز سلولی را تنظیم میکنند و بهطور گستردهای در دستگاه تناسلی زن، بهویژه در لوله رحمی هنگامی که رویان در حرکت است، بیان میشوند [46].
در انسان سیستم فاکتور رشد شبه انسولینی نقش مهمی در رشد اولیه رویان دارد و بیان کم برخی از اعضای سیستم فاکتور رشد شبه انسولینی، ممکن است یکی از علل ناباروری ناشناخته در زنان باشد. پروتئین اتصالی فاکتور رشد شبه انسولینی-1 و پروتئین اتصالی فاکتور رشد شبه انسولینی-3 در آندومتر میش بیان میشوند. درحالیکه در آندومتر گاو، تنها بیان پروتئین اتصالی فاکتور رشد شبه انسولینی-1 افزایش مییابد. سطح IGFBP1 mRNA، در آندومتر میش، بین روز 12 تا 16 بارداری، در مقایسه با سیکل استروس، 5 تا 29 برابر افزایش مییابد. در گاو، بیان پروتئین اتصالی فاکتور رشد شبه انسولینی-1 در روز 16 بارداری در رحم، نسبت به یک گاو غیرآبستن بالاتر است. بنابراین پروتئین اتصالی فاکتور رشد شبه انسولینی-1 در گوسفند و گاو به مقدار زیادی لانهگزینی جنین را با تحریک مهاجرت و اتصال تروفوبلاست، تنظیم میکند. مطالعات دیگری نشان داد، پروتئین اتصالی فاکتور رشد شبه انسولینی-1 نقشی در سلولهای استرومای آندومتر دسیدوایی دارد که مستقل از اتصال به IGF-I است. درمجموع، اعضای این خانواده برای یک لانهگزینی موفق، حیاتی هستند [47, 48].
فاکتور رشد تغییردهنده β (TGF-β Transforming growth factor-β/)
TGF-β از خانواده فاکتور رشد اپیدرمی، در سه ایزوفرم مختلف (TGF-β1، TGF-β2، TGF-β3) است و اثرات عمیقی بر تولید ECM و تخریب آنزیمها دارند. علاوهبراین، ایزوفرمهای TGF-β در محل ارتباط رویان-مادر یافت میشود، درنتیجه نقش مهمی در فرآیند لانهگزینی دارند. اعضای خانواده TGF در آندومتر بیان میشوند و نقش فعالی در تعدیل وقایع سلولی شامل تنظیم تکثیر سلول، دسیدوایی شدن و فرایند لانهگزینی دارند [49].
در طی لانهگزینی بیان بالایی از TGF-β1 و β2 وجود دارد. به تازگی مسیر پیامرسان TGF-β که نقش مهمی در بازسازی آندومتر موش با تعدیل فعالیت مسیر PI3-K/AKT، همراه با مهار پروتئین ضدآپوپتوز مهارکننده پروتئین آپوپتوز مرتبط باX نشان داده شده است که درنتیجه، القای آپوپتوز در سلولهای دسیدوایی رخ میدهد. در بافت آندومتر انسانی، پروتئین TGF-β و mRNA در استرومای آندومتر، اپیتلیوم و سلولهای دسیدوا لوکالیزه میشوند. پیش از این نشان داده شد که TGF-β2 به مقدار زیاد در سلولهای استروما بیان میشود، درحالیکه شدت بیان TGF-β1 و TGF-β3 در سلولهای استروما و اپیتلیال برابر هستند [50].
طی چرخه قاعدگی، تنها بیان TGF-β3 متفاوت است که در اواخر فاز ترشحی در اپیتلیوم غدد، شدیدتر بیان میشود. بنابراین، آندومتر لانهگزینی در مرحله ترشحی، از طریق تولید و ترشح ایزوفرم TGF-β توسط سلولهای اپیتلیال آماده میشود. علاوهبراین، TGF-βS ممکن است در لانهگزینی انسان از طریق تحریک فیبرونکتین و یا تولید فاکتور رشد آندوتلیال عروقی و با توسعه اتصال سلولهای تروفوبلاست به زمینه خارج سلولی نقش بازی کنند [35].
فاکتور رشد اپیدرمی متصل به هپارین (Heparin binding-epidermal growth factor/HB-EGF)
فاکتور رشد اپیدرمی متصل به هپارین یک پروتئین عرض غشایی میباشد که به گیرندههای خود به شیوه ژوکستاکرین متصل میشود و آبشار پیامرسانی را فعال میکند. فاکتور رشد اپیدرمی متصل به هپارین با فاکتور رشداپیدرمی و فاکتور رشد تبدیلکننده آلفا دارای گیرنده مشترک است. فاکتور رشد اپیدرمی متصل به هپارین نیاز به پروتئوگلیکان هپاران سولفات بهعنوان کوفاکتور برای اتصال به گیرندههایش دارد. اولین شواهد گزارش دادند که فاکتور رشد اپیدرمی متصل به هپارین نقش مهمی در لانهگزینی رویان موش بازی میکند و شبیه به دیگر عوامل درگیر در فرایند لانهگزینی توسط هورمونهای استروئیدی استروژن و پروژسترون تنظیم میشود. فاکتور رشد اپیدرمی متصل به هپارین در استرومای آندومتر و سلولهای اپیتلیال بیان میشود و برای تنظیم تکثیر سلولی آندومتر، ترشح غددی و تحول دسیدوا دیده میشود. فاکتور رشد اپیدرمی متصل به هپارین در بافت آندومتر انسان، طی لانهگزینی بیان شده و عوامل مختلفی مانند IGF1 همراه با فاکتور رشد اپیدرمی متصل به هپارین، بهطور مؤثری در تظاهرات لانهگزینی موضعی، مانند افزایش نفوذپذیری عروق، دسیدوایی شدن و بیان مارکرهای مخصوص کاشت رویان نقش دارند [51].
بیان بالای HB-EGF mRNA ، قبل از پنجره لانهگزینی نشان میدهد که این فاکتور رشد بهطور مستقیم میتواند لانهگزینی بلاستوسیست را کنترل کند. مطالعات نشان دادند که در موشهای ماده با HB-EGF¯/¯، کاهش باروری دیده شده و همچنین فاکتور رشد اپیدرمی متصل به هپارین میتواند عملکرد تخمدان و رحم را تنظیم کند. ژنهای فاکتور رشد اپیدرمی متصل به هپارین در اپیتلیوم رحم موش، در محل اتصال بلاستوسیست قبل از این فاز، بیان شده که قویاً نقش آن را در لانهگزینی رویان نشان میدهد. بیان فاکتور رشد اپیدرمی متصل به هپارین در اپیتلیوم مجرا و غدد، زمانی که گنبدهای رحمی بهطور کامل توسعه یافتهاند در بالاترین سطح است. بنابراین به نقش فاکتور رشد اپیدرمی متصل بر هپارین در اتصال و نفوذ فرآیندهای لانهگزینی انسانی تأکید میشود. سطوح بالاتر فاکتور رشد اپیدرمی متصل به هپارین در سطح راسی اپیتلیوم مجرا قبل از لانهگزینی در انسان دیده میشود [52-54].
ژنهای هموباکس
ژنهای هموباکس تنظیمکننده رونویسی هستند که نقش اساسی در تعیین هویت بافتها، طی رشد جنین بازی میکنند. همچنین در توسعه سیستمهای مولری (لولههای اولیه تناسلی جنس مؤنث) درگیر است و سپس در رحم بزرگسالان بیان آن ادامه مییابد. این ژنها به احتمال زیاد، تنظیمکنندههای اصلی لانهگزینی انسان هستند. ژنهای هموباکس بهعنوان تنظیمکنندههای مورفوژنز و تمایزی جنینی نیز عمل میکنند. دو ژن هموباکس برای باروری در موش لازم است. موشهای ماده با اختلال هدفمند در ژنهای هموباکس 10 و 11 زنده هستند، اما بارور نیستند [55].
اختلال هدفمند هموباکس11 میتواند توسعه غدد آندومتری استروما را کاهش دهد و نیز بیان فاکتور مهارکننده لوکمی را بکاهد. این احتمال وجود دارد که ژن هموباکس، توسعه آندومتر بزرگسالان را جهت لانهگزینی، هدایت کند. بیان هموباکس در آندومتر مادر میتواند باروری را تنظیم کند. تنظیم این ژن توسط هورمونهای جنسی، مکانیسمی را ارائه میدهد تا بیان افتراقی ژنهای هموباکس در دستگاه تناسلی اتفاق افتد. این تنظیمات در رحم بزرگسال رخ میدهد. هموباکس10 توسط استروژن و پروژسترون در رحم انسان بالغ تنظیم میشود. هریک از این دو هورمون بیان هموباکس10 را افزایش میدهند. استروئیدهای جنسی الگوی بیانی را تنظیم میکنند که با نقش ژن هموباکس در لانهگزینی انسان سازگار است. ژنهای هموباکس 10 و 11 در غدد آندومتر و استرومای رحم انسان از طریق چرخه قاعدگی بیان میشوند. در اواسط فاز ترشحی در زمان لانهگزینی، بیان هر دو ژن هموباکس به شکل قابل ملاحظهای افزایش یافته است و در سراسر مابقی این فاز، افزایش همچنان ادامه دارد [56].
الگوی بیان ژن هموباکس در آندومتر بزرگسالان نشان میدهد که ژن هموباکس نه تنها منجر به رشدونمو صحیح جنین در رحم شده، بلکه با فعال کردن ژنهای هدف پایین دست آندومتر در هر چرخه قاعدگی برای لانهگزینی لازم هستند. استروژن و پروژسترون و شاید دیگر مولکولها، بیان هموباکس را تنظیم میکنند. بهنوبه خود، هموباکس10 و 11، سایر ژنها را در مسیری که منجر به توسعه مولکولی مناسب آندومتر، جهت پذیرش و لانهگزینی میشوند را تنظیم میکنند. عدم عملکرد هموباکس 13 باتوجهبه علل جهش، ناهنجاریهای دستگاه تناسلی در زنان را باعث میشود. تغییرات بیان ژن هموباکس با نقص در لانهگزینی جنین در انسان مرتبط هستند. وجود نقص در بیان ژن هموباکس در افراد مبتلا به آندومتریوز، نقش عملکردی این ژنها را در لانهگزینی انسان تأیید میکند [57].
مورفوژنها
مولکولهای مورفوژن یا ریختزا بهصورت وابسته به غلظت، سبب تمایز و الگویابی سلولها میشوند. مسئلهای که کمتر مورد بررسی قرار گرفته است، نقش مورفوژنها در پذیرش رحم و لانهگزینی است. تعاملات رویان-رحم طی لانهگزینی، بسیاری از ویژگیهای تعاملات متقابل مزانشیمی-اپیتلیالی را طی رشد جنین به اشتراک میگذارند و هر دو مسیرهای پیامرسانی تکاملی را حفظ میکنند. اهمیت پیامهای hedgehog (HH)، Wnt و BMP در پذیرش رحم کشف شده است [15].
بیان Indian hedgehog (IHH) وابسته به پروژسترون است و در روز 4 بارداری در سلولهای اپیتلیال به سطح بالایی میرسد، درحالیکه PTC، Gli1 و Gli2 در استروما بیان افزایشی دارند. یافتهها نشان میدهد که عملکرد IHH اپیتلیالی بهعنوان یک فاکتور رشد پاراکرین برای سلولهای استروما است و این پیامرسانی اپیتلیالی-مزانشیمی برای پذیرش رحم مهم است. Sfrp4، (آنتاگونیست Wnt) و Noggin) آنتی (BMP، در طول فاز پذیرش در استرومای رحم بیان میشوند. Wnt4 و BMP2 در این زمان بیان نشده است، اما در استروما با شروع اتصال بلاستوسیست و پس از آن با ناپدید شدن بیان آنتاگونیست القاء میشوند. این یافتهها نشان میدهند که پیامرسانی HH در پذیرش رحم مؤثر است و Wnt4 و BMP2 درگیر واکنش اتصال و وقایع بعد از لانهگزینی میشوند. تنظیم کاهشی Sfrp4 در -/-LIF رحم نشان میدهد که پیامرسانی Wnt در آمادهسازی رحم مهم است [58].
متناوباً این تنظیم کاهشی ممکن است نتیجهای از به خطر افتادن عملکرد رحم در غیاب فاکتور مهارکننده لوکمی باشد. از خانواده Wnt، Wnt7a در اپیتلیوم مجرای رحم زنان بزرگسال بیان میشود، زنان با -/-Wnt7a نابارور هستند، رحم آنها فاقد غدد میباشد، میومتر نیز سازماندهی مشخصی ندارد، این موارد نشان میدهد که Wnt7a میتواند برای معماری سلولی رحم نرمال، بسیار مهم باشد. از ژنهای BMP که مطالعه شدهاند، BMP4-7 الگوی بیان بسیار موضعی بالایی را مانند BMP2 طی فاز اتصال نشان نمیدهد [59].
نتیجهگیری
لانهگزینی فرآیند پیچیدهای است که مولکولهای پیامرسان مختلفی مانند سیتوکینها، فاکتورهای رشد و هورمونهای تخمدان بهطور اختصاصی در میزان پذیرش رحم نقش دارند. سیتوکینها (فاکتور رشد اپیدرمی و فاکتور محرک کلونی-1)، اینترلوکین-11، اینتر لوکین-6، اینتر لوکین-1، فاکتور مهارکننده لوکمی و سیستم فاکتور رشد شبه انسولینی نقش مهمی در تعاملات رویان و مادر طی فرآیند لانهگزینی ایفا میکند. ژنهای هموباکس تنظیمکننده رونویسی طی رشد جنین هستند. بیان هموباکس در آندومتر مادر میتواند باروری را تنظیم کند. ژن هموباکس10 توسط استروژن و پروژسترون در رحم انسان بالغ تنظیم میشود. هریک از این دو هورمون بیان ژن هموباکس10 را افزایش میدهند. بااینحال، هنوز بخش مهمی از عملکرد وابسته یا مستقل آنها مشخص نیست. بنابراین، تلاشها در این زمینه ضروری به نظر میرسد و دستیابی به این مهم به درک بهتر فرآیند لانهگزینی و رفع علت شکست لانهگزینی و ناباروری کمک خواهد کرد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه در کمیته اخلاق دانشگاه علوم پزشکی کرمانشاه با (کد اخلاق: IR.KUMS.REC.1400.162) تصویب شد.
حامی مالی
این تحقیق هیچگونه کمک مالی از سازمانهای تأمین مالی در بخشهای عمومی، تجاری یا غیرانتفاعی دریافت نکرد.
مشارکت نویسندگان
مفهومسازی و طراحی مطالعه: لیلا رضاخانی؛ دریافت، تحلیل و تفسیر دادهها و تهیه پیشنویس دستنوشته: لیلا رضاخانی، محمدرسول خزاعی و آزیتا فرامرزی؛ بازبینی نقادانه دستنوشته برای محتوای فکری مهم: لیلا رضاخانی، مظفرخزاعی و آزیتا فرامرزی؛ حمایت اداری، فنی یا موادی و نظارت: مظفر خزاعی.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان از مرکز تحقیقات باروری و ناباروری و گروه مهندسی بافت دانشگاه علوم پزشکی کرمانشاه تقدیر و تشکر میکنند.
References
1.Haghighi H, Vaziri H R, Zahiri Z. [Analysis of association of FSHR 1255G>A polymorphism with infertility in women (Persian)]. Journal of Guilan University of Medical Sciences. 2016; 25(99):26-33. [Link]
2.Sehring J, Beltsos A, Jeelani R. Human implantation: The complex interplay between endometrial receptivity, inflammation, and the microbiome. Placenta. 2022; 117:179-86. [DOI:10.1016/j.placenta.2021.12.015] [PMID]
3.Hamid HY, Zakaria MZ. Embryo implantation: Shedding light on the roles of ovarian hormones, cytokines and growth factors in the implantation process. African Journal of Biotechnology. 2012; 11(97):16297-304. [Link]
4.Evazalipour M, Aghajani Torshkooh F, Jafari-Shakib R, Gholampour S, Zamani E. [In vitro evaluation of protective effect of rutin on acrylamide-induced cellular senescence in NIH3T3 Cells (Persian)]. Journal of Guilan University of Medical Sciences. 2022; 30(4):276-89. [Link]
5.Sharma A, Kumar P. Understanding implantation window, a crucial phenomenon. Journal of Human Reproductive Sciences. 2012; 5(1):2-6. [DOI:10.4103/0974-1208.97777] [PMID]
6.Yoshinaga K. A historical review of blastocyst implantation research. Biology of Reproduction. 2018; 99(1):175-95. [DOI:10.1093/biolre/ioy093] [PMID]
7.Paulson EE, Comizzoli P. Endometrial receptivity and embryo implantation in carnivores-commonalities and differences with other mammalian species. Biology of Reproduction. 2021; 104(4):771-83. [DOI:10.1093/biolre/ioab001] [PMID]
8.Omidi M, Khalili MA, Agha- Rahimi A, Nottola S, Anbari F, Faramarzi A, et al. Efficacy of the in vitro splitting of human preimplantation embryos from ART programs. Turkish Journal of Medical Sciences. 2021; 51(1):68-75. [DOI:10.3906/sag-1710-194] [PMID]
9.Fazleabas AT, Kim JJ, Strakova Z. Implantation: Embryonic signals and the modulation of the uterine environment-a review. Placenta. 2004; 25(Suppl A):S26-31. [DOI:10.1016/j.placenta.2004.01.014] [PMID]
10.Faramarzi A, Khalili MA, Mangoli E. Correlations between embryo morphokinetic development and maternal age: Results from an intracytoplasmic sperm injection program. Clinical and Experimental Reproductive Medicine. 2019; 46(3):119-24. [DOI:10.5653/cerm.2019.02838] [PMID]
11.Ramathal CY, Bagchi IC, Taylor RN, Bagchi MK. Endometrial decidualization: of mice and men. Seminars in Reproductive Medicine. 2010; 28(1):17-26. [DOI:10.1055/s-0029-1242989] [PMID]
12.Kim JJ, Fazleabas AT. Uterine receptivity and implantation: The regulation and action of insulin-like growth factor binding protein-1 (IGFBP-1), HOXA10 and forkhead transcription factor-1 (FOXO-1) in the baboon endometrium. Reproductive Biology and Endocrinology. 2004; 2:34. [PMID]
13.Altmäe S, Reimand J, Hovatta O, Zhang P, Kere J, Laisk T, et al. Research resource: Interactome of human embryo implantation: identification of gene expression pathways, regulation, and integrated regulatory networks. Molecular Endocrinology. 2012; 26(1):203-17. [DOI:10.1210/me.2011-1196] [PMID]
14.Wu HM, Chen LH, Hsu LT, Sung YJ, Chiu WJ, Tsai CL. Leukaemia inhibitory factor-STAT signaling and adhesion molecules in human decidual stromal cells: possible role on embryo implantation and early pregnancy. Reproductive BioMedicine Online. 2023. [DOI:10.1016/j.rbmo.2023.03.012]
15.Wang H, Dey SK. Roadmap to embryo implantation: Clues from mouse models. Nature Reviews Genetics. 2006; 7(3):185-99. [DOI:10.1038/nrg1808] [PMID]
16.Iwamoto R, Yamazaki S, Asakura M, Takashima S, Hasuwa H, Miyado K, et al. Heparin-binding EGF-like growth factor and ErbB signaling is essential for heart function. Proceedings of the National Academy of Sciences. 2003; 100(6):3221-6. [DOI:10.1073/pnas.0537588100] [PMID]
17.Faramarzi A, Khalili MA, Ashourzadeh S. Oocyte morphology and embryo morphokinetics in an intra-cytoplasmic sperm injection programme. Is there a relationship? Zygote. 2017; 25(2):190-6. [DOI:10.1017/S0967199417000041] [PMID]
18.Dey SK, Lim H, Das SK, Reese J, Paria BC, Daikoku T, et al. Molecular cues to implantation. Endocrine Reviews. 2004; 25(3):341-73. [DOI:10.1210/er.2003-0020] [PMID]
19.Fouladi-Nashta AA, Jones CJ, Nijjar N, Mohamet L, Smith A, Chambers I, et al. Characterization of the uterine phenotype during the peri-implantation period for LIF-null, MF1 strain mice. Developmental Biology. 2005; 281(1):1-21. [DOI:10.1016/j.ydbio.2005.01.033] [PMID]
20.Khazaei M, Aghaz F. Reactive oxygen species generation and use of antioxidants during in vitro maturation of oocytes. International Journal of Fertility & Sterility. 2017; 11(2):63-70. [PMID]
21.Song H, Lim H, Paria BC, Matsumoto H, Swift LL, Morrow J, et al. Cytosolic phospholipase A2alpha is crucial [correction of A2alpha deficiency is crucial] for 'on-time' embryo implantation that directs subsequent development. Development. 2002; 129(12):2879-89. [DOI:10.1242/dev.129.12.2879] [PMID]
22.Wetendorf M, DeMayo FJ. The progesterone receptor regulates implantation, decidualization, and glandular development via a complex paracrine signaling network. Molecular and Cellular Endocrinology. 2012; 357(1-2):108-18. [DOI:10.1016/j.mce.2011.10.028] [PMID]
23.Lee JH, Kim TH, Oh SJ, Yoo JY, Akira S, Ku BJ, et al. Signal transducer and activator of transcription-3 (Stat3) plays a critical role in implantation via progesterone receptor in uterus. The FASEB Journal. 2013; 27(7):2553-63. [DOI:10.1096/fj.12-225664] [PMID]
24.Ghanbari E, Khazaei MR, Khazaei M, Nejati V. Royal jelly promotes ovarian follicles growth and increases steroid hormones in immature rats. International Journal of Fertility & Sterility. 2018; 11(4):263-69. [PMID]
25.Simón C, Martín JC, Pellicer A. Paracrine regulators of implantation. Bailliere's Best Practice & Research. Clinical Obstetrics & Gynaecology. 2000; 14(5):815-26. [DOI:10.1053/beog.2000.0121] [PMID]
26.Esfandiari N, Khazaei M, Ai J, Bielecki R, Gotlieb L, Ryan E, et al. Effect of a statin on an in vitro model of endometriosis. Fertility and Sterility. 2007; 87(2):257-62. [DOI:10.1016/j.fertnstert.2006.06.040] [PMID]
27.Guzeloglu-Kayisli O, Kayisli UA, Taylor HS. The role of growth factors and cytokines during implantation: Endocrine and paracrine interactions. Seminars in Reproductive Medicine. 2009; 27(1):62–79. [DOI:10.1055/s-0028-1108011] [PMID]
28.Wang Q, Sun Y, Fan R, Wang M, Ren C, Jiang A, et al. Role of inflammatory factors in the etiology and treatment of recurrent implantation failure. Reproductive Biology. 2022; 22(4):100698. [DOI:10.1016/j.repbio.2022.100698] [PMID]
29.Salleh N, Giribabu N. Leukemia inhibitory factor: Roles in embryo implantation and in nonhormonal contraception. The Scientific World Journal. 2014; 2014:201514. [DOI:10.1155/2014/201514] [PMID]
30.Nicola NA, Babon JJ. Leukemia inhibitory factor (LIF). Cytokine & Growth Factor Reviews. 2015; 26(5):533-44. [DOI:10.1016/j.cytogfr.2015.07.001] [PMID]
31.Aghajanova L. Update on the role of leukemia inhibitory factor in assisted reproduction. Current Opinion in Obstetrics and Gynecology. 2010; 22(3):213-9. [DOI:10.1097/GCO.0b013e32833848e5] [PMID]
32.Steck T, Giess R, Suetterlin MW, Bolland M, Wiest S, Poehls UG, et al. Leukaemia inhibitory factor (LIF) gene mutations in women with unexplained infertility and recurrent failure of implantation after IVF and embryo transfer. European Journal of Obstetrics & Gynecology and Reproductive Biology. 2004; 112(1):69-73. [DOI:10.1016/S0301-2115(03)00315-4] [PMID]
33.Bourdiec A, Akoum A. [Embryo implantation: Role of interleukin 1 family members (French)]. Medecine Sciences. 2014; 30(6-7):644-50. [DOI:10.1051/medsci/20143006014] [PMID]
34.Bigonnesse F, Labelle Y, Akoum A. Triphasic expression of interleukin-1 receptor type I in human endometrium throughout the menstrual cycle of fertile women and women with unexplained infertility. Fertility and Sterility. 2001; ;75(1):79-87.[DOI:10.1016/S0015-0282(00)01634-4] [PMID]
35.Singh M, Chaudhry P, Asselin E. Bridging endometrial receptivity and implantation: Network of hormones, cytokines, and growth factors. Journal of Endocrinology. 2011; 210(1):5-14. [DOI:10.1530/JOE-10-0461] [PMID]
36.Dimitriadis E, Menkhorst E, Salamonsen LA, Paiva P. LIF and IL11 in trophoblast-endometrial interactions during the establishment of pregnancy. Placenta. 2010; 31 Suppl:S99-104.[DOI:10.1016/j.placenta.2009.12.027] [PMID]
37.Marwood M, Visser K, Salamonsen LA, Dimitriadis E. Interleukin-11 and leukemia inhibitory factor regulate the adhesion of endometrial epithelial cells: Implications in fertility regulation. Endocrinology. 2009; 150(6):2915-23. [DOI:10.1210/en.2008-1538] [PMID]
38.Karpovich N, Klemmt P, Hwang JH, McVeigh JE, Heath JK, Barlow DH, et al. The production of interleukin-11 and decidualization are compromised in endometrial stromal cells derived from patients with infertility. The Journal of Clinical Endocrinology & Metabolism. 2005. 90(3):1607-12. [DOI:10.1210/jc.2004-0868] [PMID]
39.von Rango U, Alfer J, Kertschanska S, Kemp B, Müller-Newen G, Heinrich PC, et al. Interleukin-11 expression: Its significance in eutopic and ectopic human implantation. Molecular Human Reproduction. 2004; 10(11):783-92. [DOI:10.1093/molehr/gah107] [PMID]
40.Lee RS, Li N, Ledgard AM, Pollard JW. Dynamic regulation of expression of colony-stimulating factor 1 in the reproductive tract of cattle during the estrous cycle and in pregnancy. Biology of Reproduction. 2003; 69(2):518-28. [DOI:10.1095/biolreprod.102.013748] [PMID]
41.Lee KY, DeMayo FJ. Animal models of implantation. Reproduction. 2004; 128(6):679-95. [DOI:10.1530/rep.1.00340] [PMID]
42.Kim SM, Kim JS. A review of mechanisms of implantation. Development & Reproduction. 2017; 21(4):351-9. [DOI:10.12717/DR.2017.21.4.351] [PMID]
43.Wieduwilt MJ, Moasser MM. The epidermal growth factor receptor family: Biology driving targeted therapeutics. Cellular and Molecular Life Sciences. 2008; 65(10):1566-84. [DOI:10.1007/s00018-008-7440-8] [PMID]
44.Byun HS, Lee GS, Lee BM, Hyun SH, Choi KC, Jeung EB. Implantation-related expression of epidermal growth factor family molecules and their regulation by progesterone in the pregnant rat. Reproductive Sciences. 2008; 15(7):678-89. [DOI:10.1177/1933719108317581] [PMID]
45.Aghajanova L, Bjuresten K, Altmäe S, Landgren BM, Stavreus-Evers A. HB-EGF but not amphiregulin or their receptors HER1 and HER4 is altered in endometrium of women with unexplained infertility. Reproductive Sciences. 2008; 15(5):484-92. [DOI:10.1177/1933719108314624] [PMID]
46.Sferruzzi-Perri AN, Owens JA, Pringle KG, Roberts CT. The neglected role of insulin-like growth factors in the maternal circulation regulating fetal growth. The Journal of Physiology. 2011; 589(Pt 1):7-20. [DOI:10.1113/jphysiol.2010.198622] [PMID]
47.Simmons RM, Erikson DW, Kim J, Burghardt RC, Bazer FW, Johnson GA, et al. Insulin-like growth factor binding protein-1 in the ruminant uterus: Potential endometrial marker and regulator of conceptus elongation. Endocrinology. 2009; 150(9):4295-305. [DOI:10.1210/en.2009-0060] [PMID]
48.Wu RJ, Zhou FZ. [Insulin-like growth factor II and its receptor gene expression in the endometrium of women with unexplained infertility (Chinese)]. Zhonghua Fu Chan Ke Za Zhi. 2004; 39(4):242-5. [PMID]
49.Jones RL, Stoikos C, Findlay JK, Salamonsen LA. TGF-β superfamily expression and actions in the endometrium and placenta. Reproduction. 2006; 132(2):217-32. [DOI:10.1530/rep.1.01076] [PMID]
50.Caron PL, Fréchette-Frigon G, Shooner C, Leblanc V, Asselin E. Transforming growth factor beta isoforms regulation of Akt activity and XIAP levels in rat endometrium during estrous cycle, in a model of pseudopregnancy and in cultured decidual cells. Reproductive Biology and Endocrinology. 2009; 7:80. [DOI:10.1186/1477-7827-7-80] [PMID]
51.Lessey BA, Gui Y, Apparao KB, Young SL, Mulholland J. Regulated expression of heparin-binding EGF-like growth factor (HB-EGF) in the human endometrium: A potential paracrine role during implantation. Molecular Reproduction and Development. 2002; 62(4):446-55. [DOI:10.1002/mrd.10129] [PMID]
52.Stavreus-Evers A, Aghajanova L, Brismar H, Eriksson H, Landgren BM, Hovatta O. Co-existence of heparin-binding epidermal growth factor-like growth factor and pinopodes in human endometrium at the time of implantation. Molecular Human Reproduction. 2002; 8(8):765-9. [DOI:10.1093/molehr/8.8.765] [PMID]
53.Xie H, Wang H, Tranguch S, Iwamoto R, Mekada E, Demayo FJ, et al. Maternal heparin-binding-EGF deficiency limits pregnancy success in mice. Proceedings of the National Academy of Sciences. 2007; 104(46):18315-20. [DOI:10.1073/pnas.0707909104] [PMID]
54.Moghani-Ghoroghi F, Moshkdanian G, Sehat M, Nematollahi-Mahani SN, Ragerdi-Kashani I, Pasbakhsh P. Melatonin pretreated blastocysts along with Calcitonin Administration improved implantation by upregulation of heparin binding-epidermal growth factor expression in murine endometrium. Cell Journal. 2018; 19(4):599-606. [PMID]
55.Vitiello D, Kodaman PH, Taylor HS. HOX genes in implantation. Seminars in Reproductive Medicine. 2007; 25(6):431-6. [DOI:10.1055/s-2007-991040] [PMID]
56.Zanatta A, Rocha AM, Carvalho FM, Pereira RM, Taylor HS, Motta EL, et al. The role of the Hoxa10/HOXA10 gene in the etiology of endometriosis and its related infertility: A review. Journal of Assisted Reproduction and Genetics. 2010; 27(12):701-10. [DOI:10.1007/s10815-010-9471-y] [PMID]
57.Fischer CP, Kayisili U, Taylor HS. HOXA10 expression is decreased in endometrium of women with adenomyosis. Fertility and Sterility. 2011; 95(3):1133-6. [DOI:10.1016/j.fertnstert.2010.09.060] [PMID]
58.Graham SJ, Wicher KB, Jedrusik A, Guo G, Herath W, Robson P, et al. BMP signalling regulates the pre-implantation development of extra-embryonic cell lineages in the mouse embryo. Nature Communications. 2014; 5:5667. [DOI:10.1038/ncomms6667] [PMID]
59.Sozen B, Demir N, Zernicka-Goetz M. BMP signalling is required for extra-embryonic ectoderm development during pre-to-post-implantation transition of the mouse embryo. Developmental Biology. 2021; 470:84-94. [DOI:10.1016/j.ydbio.2020.11.005] [PMID]
مقاله مروری: پژوهشي |
موضوع مقاله:
عمومى
دریافت: 1401/11/17 | پذیرش: 1401/11/10 | انتشار: 1402/10/10
دریافت: 1401/11/17 | پذیرش: 1401/11/10 | انتشار: 1402/10/10
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |