دوره 33، شماره 1 - ( 1-1403 )
جلد 33 شماره 1 صفحات 93-84 |
برگشت به فهرست نسخه ها
Research code: 0
Ethics code: IR.GUMS.REC.1399.511
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Ghasemi S, Sabour Z, Moazen M, Manoochehri S. Preparation, Investigation of Physicochemical Properties and Stability of Azelaic Acid Gel Formulation. JGUMS 2024; 33 (1) :84-93
URL: http://journal.gums.ac.ir/article-1-2630-fa.html
URL: http://journal.gums.ac.ir/article-1-2630-fa.html
قاسمی سعید، صبور زهرا، مؤذن محمد، منوچهری سعید. ساخت، بررسی خصوصیات فیزیکوشیمیایی و مطالعات پایداری فرمولاسیون ژل آزلائیک اسید. مجله علوم پزشکی گیلان. 1403; 33 (1) :84-93
سعید قاسمی1 

 ، زهرا صبور2
، زهرا صبور2 

 ، محمد مؤذن2
، محمد مؤذن2 

 ، سعید منوچهری*
، سعید منوچهری* 

 3
3


 ، زهرا صبور2
، زهرا صبور2 

 ، محمد مؤذن2
، محمد مؤذن2 

 ، سعید منوچهری*
، سعید منوچهری* 

 3
3
1- گروه شیمی دارویی، دانشکده داروسازی، دانشگاه علومپزشکی گیلان، رشت، ایران.
2- گروه فارماسیوتیکس، دانشکده داروسازی، دانشگاه علومپزشکی گیلان، رشت، ایران.
3- گروه فارماسیوتیکس، دانشکده داروسازی، دانشگاه علومپزشکی گیلان، رشت، ایران. ،manoochehri@gums.ac.ir
2- گروه فارماسیوتیکس، دانشکده داروسازی، دانشگاه علومپزشکی گیلان، رشت، ایران.
3- گروه فارماسیوتیکس، دانشکده داروسازی، دانشگاه علومپزشکی گیلان، رشت، ایران. ،
متن کامل [PDF 4239 kb]
(150 دریافت)
| چکیده (HTML) (425 مشاهده)

نتایج تعیین مقدار آزلائیک اسید فرمولاسیونهای F3، F4 و F5 در روز ساخت در محدوده 100 تا 104 درصد قرار داشت.
نتایج تعیین مقدار آزلائیک اسید در فرمولاسیونهای مختلف در پایان ماههای اول، دوم و سوم نشان داد (جدول شماره 4) مقدار آزلائیک اسید در فرمولاسیون F3، در ماه اول 99/72 درصد، در ماه دوم 96/25 درصد و در ماه سوم 100/5 درصد بود. مقدار آزلائیک اسید در فرمولاسیون F4 در ماههای اول، دوم و سوم به ترتیب 100/39 درصد، 97/85 درصد و 98/76 درصد محاسبه شد. همچنین مقدار آزلائیک اسید موجود در فرمولاسیون F5 در ماه اول 100/25 درصد، در ماه دوم 102/9 درصد و در ماه سوم 99/5 درصد شد. میزان آزلائیک اسید در فرمولاسیون ژلF5 در طول مدت 3 ماه بیشتر از 99 درصد تعیین مقدار شد. نتایج بهدستآمده از تعیین مقدار آزلائیک اسید در زمانهای مختلف با روش تیتست در نرمافزار SPSS نسخه 17 ارزیابی شد.
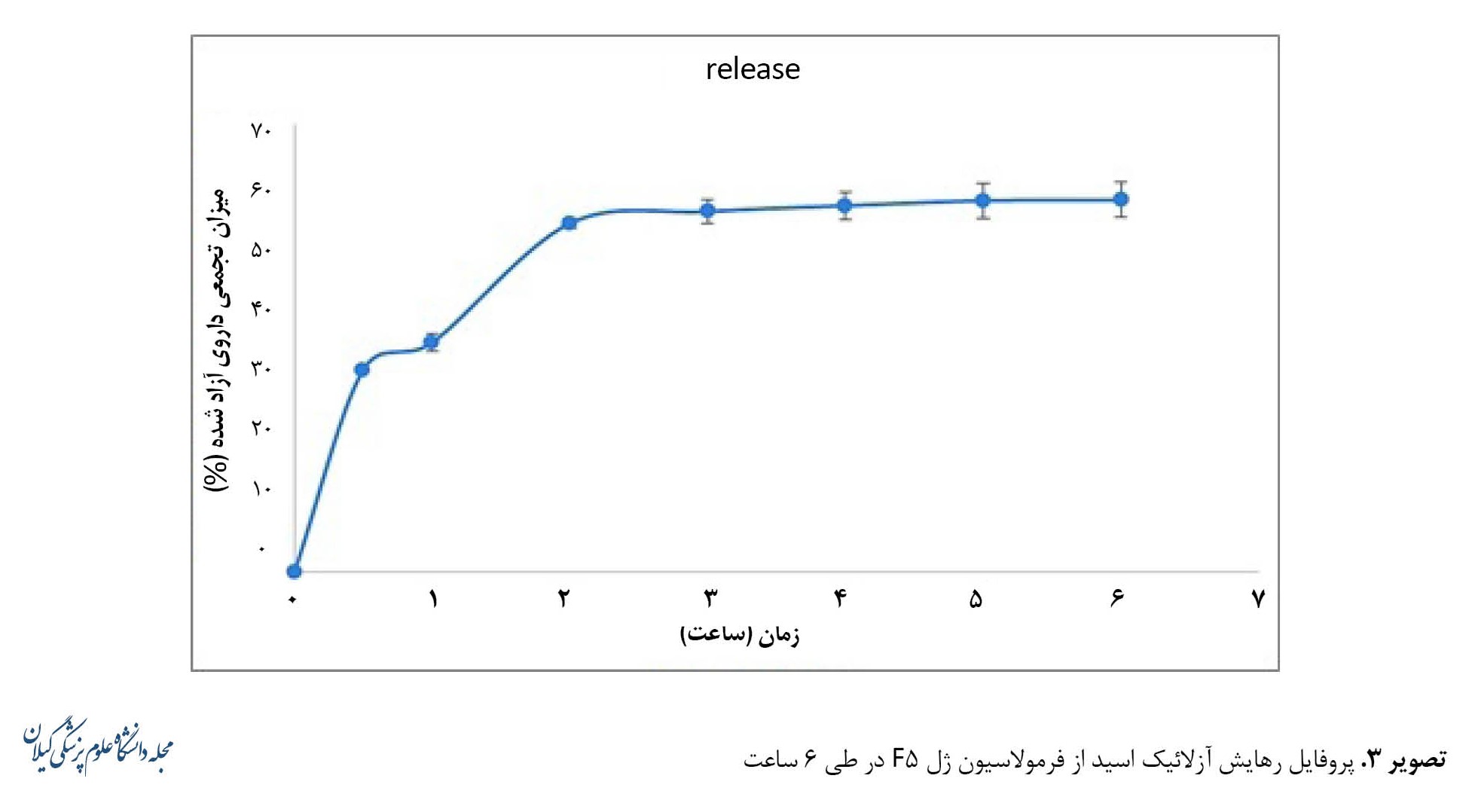
همانطور که ذکر شد برای بررسی رهایش آزلائیک اسید از ژل، منحنی استاندارد آزلائیک اسید در محیط حاوی محلول بافر فسفات مونوبازیک با pH 4/8 و اتانول 96 درصد با نسبت 1:1 رسم شد، سپس پروفایل رهش آزلائیک اسید از فرمولاسیون ژل F5 در طی 6 ساعت در این محیط بررسی شد. همانطور که در تصویر شماره 3 مشاهده میشود در ساعت اول حدود 30 درصد از دارو آزاد شد و پس از 2 ساعت میزان آزادسازی آزلائیک اسید به حدود 50 درصد رسید و رهش تا مدت زمان 6 ساعت، افزایش معناداری نداشت.
بحث
آزلائیک اسید یک دی کربوکسیلیک اسید طبیعی است و با کاهش ضایعات التهابی و اریتم در افراد مبتلا به آکنه روزاسه سبب درمان بیماری آکنه میشود [18]. شیوع این بیماری بین جمعیت با پوستهای رنگی در آمریکا، آفریقا و آسیا تا 10 درصد گزارش شده است [19]. اگرچه تأثیرات آکنه روزاسه بر سلامت جسمی فرد محدود است، اما تأثیرات عمیق روحی بر فرد مبتلا میگذارد؛ بنابراین درمان این بیماری تا حد زیادی باعث بهبود کیفیت زندگی فرد میشود [6].
با توجه به اینکه فرمولاسیون ژل موضعی آزلائیک اسید در بازار دارویی ایران موجود نیست، در این تحقیق ساخت و بررسی خصوصیات فیزیکوشیمیایی و پایداری کوتاهمدت فرمولاسیون ژل موضعی 15 درصد آزلائیک اسید بررسی شد. با توجه به اینکه میزان انحلالپذیری آزلائیک اسید در آب کم است، بهطوری که میزان انحلالپذیری آن در دمای 60 درجه سانتیگراد 2/8 میلیگرم بر میلیلیتر است؛ بنابراین انتخاب غلظت مناسب کمک حلال از اهمیت بسزایی برخوردار است.
در این مطالعه از پروپیلن گلیکول با 2 نسبت 12 و 18 درصد وزنی / وزنی به عنوان کمک حلال در فرمولاسیون ژل استفاده شد، نتایج نشان داد افزایش میزان پروپیلن گلیکول همزمان با افزایش غلظت لسیتین موجب تهیه فرمولاسیون ژل با قوام مناسب میشود. برای بررسی نقش دستگاه هموژنایزر و همزن اورهد در مراحل ساخت، نتایج انحرافمعیار تعیین مقدار روز ساخت فرمولاسیونهای F3، F4 و F5 بررسی شد. آزلائیک اسید موجود در این فرمولاسیونهای F4 و F5 که توسط دستگاه هموژنایزر به خوبی هموژن شده بودند، به شکل مناسبتری در فرمولاسیون ژل پراکنده شدند و انحرافمعیار کمتری نسبت به فرمولاسیون F3 که توسط همزن اورهد تهیه شده بود، داشتند.
تعیین مقدار فرمولاسیون ژل F5 در بازه زمانی 3 ماهه، میزان آزلائیک اسید بیشتر از 99 درصد را نشان داد، اما نتایج تعیین مقدار فرمولاسیون F3 که فرایند ساخت آن توسط همزن مغناطیسی و همزن اورهد انجام شده بود، نشان داد مقدار آزلائیک اسید در مدت زمان 3 ماه کاهش داشته و این کاهش نسبی با افزایش انحرافمعیار همراه بود.
به نظر میرسد با وجود شرایط نگهداری مشابه هر 3 فرمولاسیون در طی 3 ماه، استفاده از همزنهای مغناطیسی و اورهد در فرمولاسیون F3 سبب شده میزان همگن بودن آزلائیک اسید در این فرمولاسیون کمتر باشد، اما مقدار آزلائیک اسید در این فرمولاسیون نسبت به فرمولاسیون F5 در طی مدت 3 ماه افت کمتری داشت؛ این نتایج میتواند نشاندهنده اهمیت استفاده از نوع دستگاه در فرایند ساخت فرمولاسیون ژل برای حفظ یکپارچگی و همگنی فرمولاسیون در مدت طولانی باشد.
مطالعه آزمون تیتست نشان داد 3 فرمولاسیون در مدت زمان مطالعهشده تفاوت معناداری با یکدیگر نداشتند؛ بنابراین برای نتیجهگیری مناسبتر بهتر است مطالعه پایداری در زمانهای طولانیتری انجام شود یا نوع مطالعه پایداری به مطالعه تسریعشده تغییر یابد.
مقدار pH اندازهگیریشده در هر 3 فرمولاسیونهای F3، F4 و F5 در ماههای مختلف مطالعه نشان داد pH ژل در محدوده مناسب پوست قرار داشت و تغییر چندانی نکرد [20, 21]. ویسکوزیته ژل موضعی ساختهشده در مطالعه اوسیتومیوا و همکاران در دمای 25 درجه سانتیگراد در بازه mPa.s5000 تا mPa.s9000 قرار داشت. نتایج ویسکوزیته مطالعه حاضر نیز در محدوده mPa.s5000 تاmPa.s 9100 قرار داشت که با مطالعه فوق در یک راستا بود [22].
بررسی نتایج حاصل از تست رهش فرمولاسیون F5 نشان داد آزادسازی دارو در ساعت اول 35/8 درصد بود و سپس تا ساعت دوم، آزادسازی به 54/4 درصد رسید. در ساعت سوم، افزایش معناداری در آزادسازی مشاهده نشد و تا پایان ساعت ششم، آزادسازی به 58/1 درصد رسید. المرابح و همکاران، آزمایشی برای افزایش میزان رهایش پیشداروی آزلائیک اسید انجام دادند و میزان درصد تجمعی آزلائیک اسید را بعد از 6 ساعت حدود 40 درصد محاسبه کردند [17].
همچنین کاررِر و همکاران در سال 2020 در پژوهش خود نشان دادند پروپیلن گلیکول در فرمولاسیونهای موضعی میتواند به عنوان حلال کمکی و همچنین عاملی برای افزایش نفوذ دارو به پوست عمل کند [23]. در نتیجه، به نظر میرسد افزایش مقدار پروپیلن گلیکول به میزان 18 درصد وزنی / وزنی در فرمولاسیون F5 علاوه بر نقش کمک حلالی، میتواند سبب افزایش میزان رهش آزلائیک اسید شود.
نتیجهگیری
با توجه به نتایج بهدستآمده، در فرمولاسیون ژل F5 که از 3 مرحله هموژنایزر در فرایند ساخت آن استفاده شد و فرمولاسیون به خوبی یکنواخت شده بود، مقدار آزلائیک اسید در مدت زمان نگهداری تغییر محسوسی نداشته و انحرافمعیار کمتری نسبت به سایر فرمولاسیونها مشاهده شد. میتوان چنین نتیجهگیری کرد که استفاده از دستگاه هموژنایزر هنگام ساخت فرمولاسیون ژل آزلائیک اسید در همگن شدن بیشتر ژل مؤثر است و فرمولاسیون F5 همگنتر از سایر فرمولاسیونها بوده و به عنوان فرمولاسیون بهینه انتخاب شد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
مقاله حاضر برگرفته از پایاننامه دکترای عمومی داروسازی به شماره ثبت د/150 است. این مطالعه توسط کمیته اخلاق دانشگاه علومپزشکی گیلان با کد اخلاق IR.GUMS.REC.1399.511. تصویب شد.
حامی مالی
این تحقیق هیچگونه کمک مالی از سازمانهای دولتی، خصوصی و غیرانتفاعی دریافت نکرده است.
مشارکت نویسندگان
مفهومسازی و طراحی مطالعه: سعید منوچهری؛ کسب، تحلیل و تفسیر دادهها: سعید منوچهری، محمد مؤذن و سعید قاسمی؛ تهیه پیشنویس دستنوشته و تحلیل آماری: سعید قاسمی و سعید منوچهری؛ انجام مطالعه: زهرا صبور.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان بر خود لازم میدانند از زحمات گیتا الکن صابری، کارشناس آزمایشگاه فارماسیوتیکس که در این پژوهش ما را همراهی کردند، تشکر و قدردانی کنند.
متن کامل: (181 مشاهده)
مقدمه
آکنه یک بیماری التهابی پوستی بسیار شایع است که به عنوان جوش نیز شناخته میشود. جوشها معمولاً در صورت، قفسه سینه، بالای کمر و گردن یافت میشوند. پروپیونی باکتریوم و استافیلوکوکوس اورئوس از باکتریهای ایجادکننده آکنه هستند [1]. بروز آکنه با بسیاری از عوامل، از جمله ترشح سبوم، سطح هورمونها، عفونت باکتریایی و واکنشهای التهابی ارتباط نزدیک دارد که در این میان تغییرات ترشح سبوم یکی از عوامل مهم بروز آکنه به شمار میآید [2].
فعالیت اصلی غدد چربی بالغ، تولید و ترشح سبوم است که حاوی مخلوط پیچیدهای از لیپیدهاست. ترکیب سبوم بین گونهها متفاوت است که این تفاوت احتمالاً به علت عملکرد متنوع سبوم است [3]. افزایش دفع سبوم عامل اصلی ایجاد آکنه است. سایر عملکردهای غدد چربی، از جمله ترشح لیپیدهای پیشالتهابی چربی، سیتوکینهای مختلف تولیدشده در محل، پپتیدها و نوروپپتیدهای اطراف غدد چربی با ایجاد آکنه مرتبط هستند [2].
آکنه روزاسه یک بیماری التهابی و مزمن پوستی است که اغلب گونهها، بینی، چانه و پیشانی را درگیر میکند. تظاهرات این بیماری شامل اریتم مداوم صورت، پاپول، جوش، تلانژکتازی و گُرگرفتگی مکرر است [4]. شیوع روزاسه در جمعیتهای روشن پوست بین 2 تا 22 درصد متغیر است [5]. بیماری روزاسه اپیزودهای تشدید و بهبود دارد و در افراد با سنین بین30 تا 50 سال دیده میشود. خانمها بیشتر از آقایان درگیر این بیماری میشوند [4].
درمان آکنه روزاسه شامل مراقبتهای پوستی و دارودرمانی است. از درمانهای غیردارویی میتوان به مراقبتهای پوستی نظیر خودداری از قرار گرفتن در معرض آفتاب و استفاده از کرمهای ضد آفتاب و مرطوبکنندهها اشاره کرد.
درمانهای دارویی موضعی مورد تأیید سازمان غذا و داروی آمریکا برای درمان بیماری آکنه روزاسه شامل فرمولاسیونهای موضعی سولفات استامید سدیم، مترونیدازول و آزلائیک اسید است [6].
آزلائیک اسید یک دی کربوکسیلیک اسید با زنجیره مستقیم دو pKa 4/53 و 5/33 و حلالیت محدودی در آب دارد. آزلائیک اسید، فعالیت ضد میکروبی علیه پروپیونی باکتریوم آکنه و استافیلوکوکوس اپیدرمیدیس دارد. این عملکرد ضد میکروبی ممکن است به دلیل مهار سنتز پروتئینهای سلول میکروبی باشد. با این سازوکار، آزلائیک اسید سبب کاهش جمعیت باکتریایی پروپیونی باکتریوم در سطح پوست و فولیکولهای سباسه میشود. همچنین آزلائیک اسید فعالیتهای ضد آنزیم تیروزیناز و ضد میتوکندریایی دارد و با کاهش رادیکالهای آزاد، باعث کاهش فعالیت ملانوسیتها و رشد آنها در ملاسما میشود و هایپرپیگمنتاسیون موضعی ماکولا در پوست را متوقف میکند [7]. سنتز دیانای باکتری در سیتوپلاسم این باکتری رخ میدهد، از این جهت آزلائیک اسید برای رسیدن به این قسمت، باید از طریق لایه شاخی پوست در لایه درم عبور کند و سپس با عبور از چربی پپتیدوگلیکانهای ضخیم باکتری پروپیونی باکتریوم به داخل سیتوپلاسم باکتری نفوذ کند [8].
مطالعات متعددی روی فرمولاسیونهای میکروامولسیون، لیپوزوم، ژل، کریستال مایع و فوم حاوی آزلائیک اسید با هدف افزایش حلالیت در حامل و نفوذپذیری بیشتر از طریق پوست انجام شده است [9]. فرمولاسیون ژل آزلائیک اسید 15 درصد در سال 2002 برای درمان آکنه روزاسه توسط سازمان غذا و داروی آمریکا تأیید شد [9].
فرمولاسیونهای موضعی ژل 15 درصد و کرم 20 درصد آزلائیک اسید در بازار دارویی دنیا موجود است که فرمولاسیون ژل برای درمان آکنه روزاسه و فرمولاسیون کرم برای درمان آکنه وولگاریس توسط سازمان غذا و داروی آمریکا تأیید شدهاند. در بسیاری از کشورهای اروپایی فرمولاسیون ژل به صورت استفاده خارج از دستور (Off Label) برای درمان آکنه وولگاریس نیز استفاده میشود [10].
فرمولاسیون ژل آزلائیک اسید مزایایی نسبت به فرمولاسیون کرم دارد. از جمله این مزایا میتوان به بارگیری دُز کمتر آزلائیک اسید و ماندگاری بیشتر روی پوست که سبب افزایش آزادسازی دارو و فراهمی زیستی میشود، اشاره کرد. علاوه بر این، فرمولاسیون ژل بدون آسیب به پوست یا کاهش محتوای آب اپیدرمی میتواند به درون پوست نفوذ کند و به همین دلیل یک گزینه درمانی مناسب در درمان آکنه روزاسه پاپولوپوسچولار التهابی است [11].
در سالهای گذشته مطالعاتی [12 ,13] در خصوص فرمولاسیون کرم آزلائیک اسید انجام شده و این فرمولاسیون در حال حاضر در بازار دارویی ایران موجود است، اما فرمولاسیون ژل تاکنون به بازار دارویی ایران ارائه نشده است؛ بنابراین هدف از مطالعه حاضر تهیه و بررسی خصوصیات فیزیکوشیمیایی فرمولاسیون ژل آزلائیک اسید و مطالعات پایداری مقدماتی فرمولاسیون است.
روشها
آزلائیک اسید، سدیم هیدروکساید، پتاسیم دی هیدروژن فسفات، پلی سوربات، بنزوئیک اسید، پروپیلن گلیکول، اتیلن دی آمین تترا استیک اسید و اتانول 96 درصد از شرکت مرک آلمان، کربومر P940 از شرکت کورل فارما کم هند، لسیتین از شرکت داکسان کره جنوبی، تری گلیسیرید از شرکت نوتریشیا هلند و متانول از شرکت دکتر مجللی ایران خریداری شدند.
فرمولاسیون ژل آزلائیک اسید
فرمولاسیون ژل آزلائیک اسید طی چند مرحله و با استفاده از روش ارائهشده در مطالعات در چند مرحله تهیه شد [14]. ابتدا در یک بشر، اتیلن دی آمین تترا استیک اسید و بنزوئیک اسید در آب مقطر حل شدند (مرحله 1). سپس در بشر دیگری مخلوطی همگن حاوی 1/5 گرم پلی سوربات 80 و 2 گرم تری گلیسیرید تهیه شد. مخلوط تهیهشده تا دمای 50 درجه سانتیگراد حرارت داده شد و در همین دما به بشر اول اضافه شد، محتوای بشر توسط همزن مغناطیسی یکنواخت شد (مرحله 2). در ادامه در بشر جداگانهای مخلوط یکنواختی از پروپیلن گلیکول و لسیتین تهیه شد و طی هم زدن به مخلوط قبلی افزوده شد (مرحله 3).
برای تشکیل ژل از کربومرP940 استفاده شد. ابتدا مقدار 1 گرم کربومر در مجاورت 10 میلیلیتر آب قرار گرفت تا خیس شود. سپس کربومر خیسشده به مخلوط تهیهشده قبلی در دمای 50 سانتیگراد اضافه شد. پس از پخش شدن کامل کربومر، سود به صورت قطره قطره به ترکیب تهیهشده اضافه شد تا در pH 5 ژل کربومر تشکیل شود (مرحله 4). سپس 15 گرم آزلائیک اسید در پروپیلن گلیکول حل شد و به ژل تهیهشده افزوده شد. در نهایت، فرمولاسیون ژل حاوی آزلائیک اسید به مدت 15 دقیقه با دستگاه همزن اورهد یکنواخت شد (مرحله 5).
پس از ساخت فرمولاسیونهای مقدماتی و انتخاب مقدار مواد تشکیلدهنده فرمولاسیون ژل (جدول شماره 1)، به منظور بررسی تأثیر دستگاههای مختلف بر میزان یکنواختی آزلائیک اسید در فرمولاسیون ژل، از ترکیبی از دستگاههای هموژنایزر، همزن اورهد و همزن مغناطیسی در مراحل مختلف ساخت فرمولاسیون ژل استفاده شد (جدول شماره 2).


اجزای فرمولاسیونهای F3، F4 و F5 مشابه هستند.
تعیین مقدار آزلائیک اسید در ژل به روش HPLC
در ابتدا برای رسم منحنی استاندارد آزلائیک اسید، غلظتهای 10، 20، 40، 60، 80 و 100 میکروگرم بر میلیلیتر از آزلائیک اسید در متانول تهیه شد و با توجه به λmax بهدستآمده از آشکارساز آرایه دیودی (PDA)، سطح زیرمنحنی (AUC) در طول موج 212 نانومتر خوانده شد [15].
سپس 1 گرم ژل توزین شد و به بشر 100 میلیلیتری انتقال داده شد. 60 میلیلیتر متانول به بشر افزوده شد. مخلوط تهیهشده در داخل حمام آب در دمای 60 درجه سانتیگراد به مدت 15 دقیقه حرارت داده شد تا محلول یکنواختی تشکیل شود. سپس محلول تازه تهیهشده با متانول به حجم 100 میلیلیتر رسانده شد. 2 میلیلیتر از محلول تهیهشده با فیلتر سرسرنگی 0/22 میکرومتر صاف شد. نمونه فیلترشده داخل ویال برای تعیین مقدار توسط HPLC ریخته شد.
برای تعیین مقدار آزلائیک اسید از ستون 18C و متانول گریدHPLC -بافر فسفات (20:80) به عنوان فاز متحرک استفاده شد. بافر فسفات با pH 4/8 و مولاریته 0/05 تهیه شد. به منظور ثابت شدن فشار دستگاه، ستون به مدت 60 دقیقه توسط فاز متحرک شستوشو داده شد. در ادامه، مقدار سطح زیر نمودار پیک در طول موج 212 نانومتر اندازهگیری شد. این آزمایش روی فرمولاسیونهای F3، F4 و F5 (هر کدام 3 مرتبه) تکرار شد.
تعیین pH فراورده
برای تعیین pH فراورده از دستگاه pH متر Metrohm استفاده شد. 5 گرم از هر یک از فرمولاسیونهای F3، F4 و F5 توزین و با آب مقطر به حجم 50 میلیلیتر رسانده شد. pH نمونه در دمای 25 درجه سانتیگراد توسط دستگاه pH متر اندازهگیری شد.
اندازهگیری ویسکوزیته
برای تعیین ویسکوزیته فرمولاسیون ژل از دستگاه ویسکومتر Brookfield مدل DV-II با اسپیندل 5 (در 2 سرعت برشی 30 و 50 rpm) استفاده شد. این آزمایش روی فرمولاسیونهای F4 و F5 که مقادیر فرمولاسیون یکسان و شرایط ساخت متفاوتی داشتند، انجام شد. نحوه اندازهگیری ویسکوزیته به این صورت بود که با اضافه کردن ۵۰ میلیلیتر از فرمولاسیونهای F4 و F5 به داخل بشر و قرار دادن آن در دستگاه ویسکومتر، ویسکوزیته ژلها اندازهگیری شد. این تست در دمای 23 درجه سانتیگراد انجام شد.
تست رهش دارو
برای اندازهگیری رهش آزلائیک اسید در فرمولاسیون ژل از روش سل فرانس استفاده شد. سل انتشار فرانتس از 2 قسمتدهنده و گیرنده تشکیل شده که توسط غشایی از هم جدا شدهاند [16]. با توجه به اینکه محیط گیرنده باید قابلیت ایجاد شرایط سینک برای آزلائیک اسید را داشته باشد، محیطی حاوی محلول بافر فسفات مونوبازیک با pH 4/8 و اتانول 96 درصد با نسبت 1:1 برای آزمون رهش آزلائیک اسید در فرمولاسیون ژل در نظر گرفته شد [15، 17]. برای رسم منحنی استاندارد، غلظتهای 1، 2، 4، 6، 8 و 10 میکروگرم در میلیلیتر از آزلائیک اسید در محلول حاوی بافر فسفات pH 4/8 و اتانول 96 درصد با نسبت 1:1 تهیه شد و سطح زیر نمودار پیک در طول موج 212 نانومتر توسط آشکارساز آرایه دیودی خوانده شد.
پس از آمادهسازی، کیسه دیالیز 30 دقیقه در محیط گیرنده قرار گرفت تا توسط محیط اشباع شود. برای انجام آزمایش رهش، 350 میلیگرم فرمولاسیون F5 توزین و روی کیسه دیالیز پخش شد. قسمت خروجی محفظه گیرنده با پارافیلم پوشانده شد تا از تبخیر احتمالی اتانول و کاهش حجم محیط گیرنده جلوگیری شود. سل فرانس در دستگاه انکوباتور شیکردار در شرایط معین (دمای 32 درجه سانتیگراد و سرعت rpm 100) قرار داده شد. سپس در زمانهای 0/5، 1، 2، 3، 4، 5 و 6 ساعت از محیط گیرنده نمونهگیری شد. به این صورت که در هر یک از زمانهای ذکرشده، 1 میلی لیتر نمونه برداری انجام شد. در ادامه برای ثابت ماندن حجم محیط گیرنده، 1 میلیلیتر از محیط تازه تهیهشده به محفظه گیرنده اضافه و مجدداً با پارافیلم پوشانده شد. برای انجام آنالیز، محتوای میکروتیوبها از فیلتر سرسرنگی 0/22 میکرومتر عبور داده و به داخل ویال HPLC انتقال داده شد. پس از تزریق به دستگاه HPLC، مقدار سطح زیر نمودار خوانده شد. این تست 3 مرتبه برای فرمولاسیون F5 تکرار شد.
بررسی تعیین مقدار آزلائیک اسید در مطالعه پایداری طولانیمدت در بازه زمانی 3 ماهه
بررسی تعیین مقدار آزلائیک اسید در فرمولاسیون ژل که پیشتر درباره آن صحبت شد، مربوط به زمان ساخت فرمولاسیون بود. در ادامه برای بررسی پایداری طولانیمدت آزلائیک اسید در فرمولاسیون ژل در بازه زمانی 3 ماهه از روز ساخت، تعیین مقدار آزلائیک اسید در فرمولاسیون ژل F5 در این بازه زمانی بررسی شد. با توجه به محدوده جغرافیایی کشور ایران، مطالعه پایداری طولانیمدت به مدت 3 ماه در دمای 25 درجه سانتیگراد و رطوبت 60 درجه سانتیگراد انجام شد. دما و رطوبت مورد نیاز توسط دستگاه محفظه پایداری شرکت Memmert تأمین شد.
یافتهها
از نظر ظاهری فرمولاسیون F1 ظاهر مناسبی نداشت و پس از قرار گرفتن ژل در دست حالت شنی احساس میشد. در فرمولاسیون F2 حالت شنی برطرف شد، اما فرمولاسیون ژل بسیار روان بود. در فرمولاسیون F3 که با افزایش غلظت لسیتین و توسط دستگاه همزن اورهد ساخته شد، شکل ظاهری فرمولاسیون مناسب بود. همچنین فرمولاسیونهای F4 و F5 نیز ظاهر مناسبی داشتند.
نتایج ویسکوزیته برای فرمولاسیونهای F4، F5 با اسپندل 5 در دمای 23 درجه سانتیگراد در جدول شماره 3 ذکر شده است.

همچنین نتایجpH فرمولاسیونها در دمای 25 درجه سانتیگراد در روز ساخت بین 4/9 تا 5/1 بود. نتایج نشان داد pH فرمولاسیونها در طی 3 ماه حدود 5 بود (جدول شماره 3).
تعیین مقدار آزلائیک اسید در ژل در روز ساخت و پایداری طولانیمدت 1، 2 و 3 ماهه
بر اساس منحنی استاندارد (تصویر شماره 1) و پیک HPLC (تصویر شماره 2) نتایج میانگین غلظت آزلائیک اسید در فرمولاسیون ژل در روز ساخت، ماههای اول، دوم و سوم در جدول شماره 4 ذکر شده است.
آکنه یک بیماری التهابی پوستی بسیار شایع است که به عنوان جوش نیز شناخته میشود. جوشها معمولاً در صورت، قفسه سینه، بالای کمر و گردن یافت میشوند. پروپیونی باکتریوم و استافیلوکوکوس اورئوس از باکتریهای ایجادکننده آکنه هستند [1]. بروز آکنه با بسیاری از عوامل، از جمله ترشح سبوم، سطح هورمونها، عفونت باکتریایی و واکنشهای التهابی ارتباط نزدیک دارد که در این میان تغییرات ترشح سبوم یکی از عوامل مهم بروز آکنه به شمار میآید [2].
فعالیت اصلی غدد چربی بالغ، تولید و ترشح سبوم است که حاوی مخلوط پیچیدهای از لیپیدهاست. ترکیب سبوم بین گونهها متفاوت است که این تفاوت احتمالاً به علت عملکرد متنوع سبوم است [3]. افزایش دفع سبوم عامل اصلی ایجاد آکنه است. سایر عملکردهای غدد چربی، از جمله ترشح لیپیدهای پیشالتهابی چربی، سیتوکینهای مختلف تولیدشده در محل، پپتیدها و نوروپپتیدهای اطراف غدد چربی با ایجاد آکنه مرتبط هستند [2].
آکنه روزاسه یک بیماری التهابی و مزمن پوستی است که اغلب گونهها، بینی، چانه و پیشانی را درگیر میکند. تظاهرات این بیماری شامل اریتم مداوم صورت، پاپول، جوش، تلانژکتازی و گُرگرفتگی مکرر است [4]. شیوع روزاسه در جمعیتهای روشن پوست بین 2 تا 22 درصد متغیر است [5]. بیماری روزاسه اپیزودهای تشدید و بهبود دارد و در افراد با سنین بین30 تا 50 سال دیده میشود. خانمها بیشتر از آقایان درگیر این بیماری میشوند [4].
درمان آکنه روزاسه شامل مراقبتهای پوستی و دارودرمانی است. از درمانهای غیردارویی میتوان به مراقبتهای پوستی نظیر خودداری از قرار گرفتن در معرض آفتاب و استفاده از کرمهای ضد آفتاب و مرطوبکنندهها اشاره کرد.
درمانهای دارویی موضعی مورد تأیید سازمان غذا و داروی آمریکا برای درمان بیماری آکنه روزاسه شامل فرمولاسیونهای موضعی سولفات استامید سدیم، مترونیدازول و آزلائیک اسید است [6].
آزلائیک اسید یک دی کربوکسیلیک اسید با زنجیره مستقیم دو pKa 4/53 و 5/33 و حلالیت محدودی در آب دارد. آزلائیک اسید، فعالیت ضد میکروبی علیه پروپیونی باکتریوم آکنه و استافیلوکوکوس اپیدرمیدیس دارد. این عملکرد ضد میکروبی ممکن است به دلیل مهار سنتز پروتئینهای سلول میکروبی باشد. با این سازوکار، آزلائیک اسید سبب کاهش جمعیت باکتریایی پروپیونی باکتریوم در سطح پوست و فولیکولهای سباسه میشود. همچنین آزلائیک اسید فعالیتهای ضد آنزیم تیروزیناز و ضد میتوکندریایی دارد و با کاهش رادیکالهای آزاد، باعث کاهش فعالیت ملانوسیتها و رشد آنها در ملاسما میشود و هایپرپیگمنتاسیون موضعی ماکولا در پوست را متوقف میکند [7]. سنتز دیانای باکتری در سیتوپلاسم این باکتری رخ میدهد، از این جهت آزلائیک اسید برای رسیدن به این قسمت، باید از طریق لایه شاخی پوست در لایه درم عبور کند و سپس با عبور از چربی پپتیدوگلیکانهای ضخیم باکتری پروپیونی باکتریوم به داخل سیتوپلاسم باکتری نفوذ کند [8].
مطالعات متعددی روی فرمولاسیونهای میکروامولسیون، لیپوزوم، ژل، کریستال مایع و فوم حاوی آزلائیک اسید با هدف افزایش حلالیت در حامل و نفوذپذیری بیشتر از طریق پوست انجام شده است [9]. فرمولاسیون ژل آزلائیک اسید 15 درصد در سال 2002 برای درمان آکنه روزاسه توسط سازمان غذا و داروی آمریکا تأیید شد [9].
فرمولاسیونهای موضعی ژل 15 درصد و کرم 20 درصد آزلائیک اسید در بازار دارویی دنیا موجود است که فرمولاسیون ژل برای درمان آکنه روزاسه و فرمولاسیون کرم برای درمان آکنه وولگاریس توسط سازمان غذا و داروی آمریکا تأیید شدهاند. در بسیاری از کشورهای اروپایی فرمولاسیون ژل به صورت استفاده خارج از دستور (Off Label) برای درمان آکنه وولگاریس نیز استفاده میشود [10].
فرمولاسیون ژل آزلائیک اسید مزایایی نسبت به فرمولاسیون کرم دارد. از جمله این مزایا میتوان به بارگیری دُز کمتر آزلائیک اسید و ماندگاری بیشتر روی پوست که سبب افزایش آزادسازی دارو و فراهمی زیستی میشود، اشاره کرد. علاوه بر این، فرمولاسیون ژل بدون آسیب به پوست یا کاهش محتوای آب اپیدرمی میتواند به درون پوست نفوذ کند و به همین دلیل یک گزینه درمانی مناسب در درمان آکنه روزاسه پاپولوپوسچولار التهابی است [11].
در سالهای گذشته مطالعاتی [12 ,13] در خصوص فرمولاسیون کرم آزلائیک اسید انجام شده و این فرمولاسیون در حال حاضر در بازار دارویی ایران موجود است، اما فرمولاسیون ژل تاکنون به بازار دارویی ایران ارائه نشده است؛ بنابراین هدف از مطالعه حاضر تهیه و بررسی خصوصیات فیزیکوشیمیایی فرمولاسیون ژل آزلائیک اسید و مطالعات پایداری مقدماتی فرمولاسیون است.
روشها
آزلائیک اسید، سدیم هیدروکساید، پتاسیم دی هیدروژن فسفات، پلی سوربات، بنزوئیک اسید، پروپیلن گلیکول، اتیلن دی آمین تترا استیک اسید و اتانول 96 درصد از شرکت مرک آلمان، کربومر P940 از شرکت کورل فارما کم هند، لسیتین از شرکت داکسان کره جنوبی، تری گلیسیرید از شرکت نوتریشیا هلند و متانول از شرکت دکتر مجللی ایران خریداری شدند.
فرمولاسیون ژل آزلائیک اسید
فرمولاسیون ژل آزلائیک اسید طی چند مرحله و با استفاده از روش ارائهشده در مطالعات در چند مرحله تهیه شد [14]. ابتدا در یک بشر، اتیلن دی آمین تترا استیک اسید و بنزوئیک اسید در آب مقطر حل شدند (مرحله 1). سپس در بشر دیگری مخلوطی همگن حاوی 1/5 گرم پلی سوربات 80 و 2 گرم تری گلیسیرید تهیه شد. مخلوط تهیهشده تا دمای 50 درجه سانتیگراد حرارت داده شد و در همین دما به بشر اول اضافه شد، محتوای بشر توسط همزن مغناطیسی یکنواخت شد (مرحله 2). در ادامه در بشر جداگانهای مخلوط یکنواختی از پروپیلن گلیکول و لسیتین تهیه شد و طی هم زدن به مخلوط قبلی افزوده شد (مرحله 3).
برای تشکیل ژل از کربومرP940 استفاده شد. ابتدا مقدار 1 گرم کربومر در مجاورت 10 میلیلیتر آب قرار گرفت تا خیس شود. سپس کربومر خیسشده به مخلوط تهیهشده قبلی در دمای 50 سانتیگراد اضافه شد. پس از پخش شدن کامل کربومر، سود به صورت قطره قطره به ترکیب تهیهشده اضافه شد تا در pH 5 ژل کربومر تشکیل شود (مرحله 4). سپس 15 گرم آزلائیک اسید در پروپیلن گلیکول حل شد و به ژل تهیهشده افزوده شد. در نهایت، فرمولاسیون ژل حاوی آزلائیک اسید به مدت 15 دقیقه با دستگاه همزن اورهد یکنواخت شد (مرحله 5).
پس از ساخت فرمولاسیونهای مقدماتی و انتخاب مقدار مواد تشکیلدهنده فرمولاسیون ژل (جدول شماره 1)، به منظور بررسی تأثیر دستگاههای مختلف بر میزان یکنواختی آزلائیک اسید در فرمولاسیون ژل، از ترکیبی از دستگاههای هموژنایزر، همزن اورهد و همزن مغناطیسی در مراحل مختلف ساخت فرمولاسیون ژل استفاده شد (جدول شماره 2).


اجزای فرمولاسیونهای F3، F4 و F5 مشابه هستند.
تعیین مقدار آزلائیک اسید در ژل به روش HPLC
در ابتدا برای رسم منحنی استاندارد آزلائیک اسید، غلظتهای 10، 20، 40، 60، 80 و 100 میکروگرم بر میلیلیتر از آزلائیک اسید در متانول تهیه شد و با توجه به λmax بهدستآمده از آشکارساز آرایه دیودی (PDA)، سطح زیرمنحنی (AUC) در طول موج 212 نانومتر خوانده شد [15].
سپس 1 گرم ژل توزین شد و به بشر 100 میلیلیتری انتقال داده شد. 60 میلیلیتر متانول به بشر افزوده شد. مخلوط تهیهشده در داخل حمام آب در دمای 60 درجه سانتیگراد به مدت 15 دقیقه حرارت داده شد تا محلول یکنواختی تشکیل شود. سپس محلول تازه تهیهشده با متانول به حجم 100 میلیلیتر رسانده شد. 2 میلیلیتر از محلول تهیهشده با فیلتر سرسرنگی 0/22 میکرومتر صاف شد. نمونه فیلترشده داخل ویال برای تعیین مقدار توسط HPLC ریخته شد.
برای تعیین مقدار آزلائیک اسید از ستون 18C و متانول گریدHPLC -بافر فسفات (20:80) به عنوان فاز متحرک استفاده شد. بافر فسفات با pH 4/8 و مولاریته 0/05 تهیه شد. به منظور ثابت شدن فشار دستگاه، ستون به مدت 60 دقیقه توسط فاز متحرک شستوشو داده شد. در ادامه، مقدار سطح زیر نمودار پیک در طول موج 212 نانومتر اندازهگیری شد. این آزمایش روی فرمولاسیونهای F3، F4 و F5 (هر کدام 3 مرتبه) تکرار شد.
تعیین pH فراورده
برای تعیین pH فراورده از دستگاه pH متر Metrohm استفاده شد. 5 گرم از هر یک از فرمولاسیونهای F3، F4 و F5 توزین و با آب مقطر به حجم 50 میلیلیتر رسانده شد. pH نمونه در دمای 25 درجه سانتیگراد توسط دستگاه pH متر اندازهگیری شد.
اندازهگیری ویسکوزیته
برای تعیین ویسکوزیته فرمولاسیون ژل از دستگاه ویسکومتر Brookfield مدل DV-II با اسپیندل 5 (در 2 سرعت برشی 30 و 50 rpm) استفاده شد. این آزمایش روی فرمولاسیونهای F4 و F5 که مقادیر فرمولاسیون یکسان و شرایط ساخت متفاوتی داشتند، انجام شد. نحوه اندازهگیری ویسکوزیته به این صورت بود که با اضافه کردن ۵۰ میلیلیتر از فرمولاسیونهای F4 و F5 به داخل بشر و قرار دادن آن در دستگاه ویسکومتر، ویسکوزیته ژلها اندازهگیری شد. این تست در دمای 23 درجه سانتیگراد انجام شد.
تست رهش دارو
برای اندازهگیری رهش آزلائیک اسید در فرمولاسیون ژل از روش سل فرانس استفاده شد. سل انتشار فرانتس از 2 قسمتدهنده و گیرنده تشکیل شده که توسط غشایی از هم جدا شدهاند [16]. با توجه به اینکه محیط گیرنده باید قابلیت ایجاد شرایط سینک برای آزلائیک اسید را داشته باشد، محیطی حاوی محلول بافر فسفات مونوبازیک با pH 4/8 و اتانول 96 درصد با نسبت 1:1 برای آزمون رهش آزلائیک اسید در فرمولاسیون ژل در نظر گرفته شد [15، 17]. برای رسم منحنی استاندارد، غلظتهای 1، 2، 4، 6، 8 و 10 میکروگرم در میلیلیتر از آزلائیک اسید در محلول حاوی بافر فسفات pH 4/8 و اتانول 96 درصد با نسبت 1:1 تهیه شد و سطح زیر نمودار پیک در طول موج 212 نانومتر توسط آشکارساز آرایه دیودی خوانده شد.
پس از آمادهسازی، کیسه دیالیز 30 دقیقه در محیط گیرنده قرار گرفت تا توسط محیط اشباع شود. برای انجام آزمایش رهش، 350 میلیگرم فرمولاسیون F5 توزین و روی کیسه دیالیز پخش شد. قسمت خروجی محفظه گیرنده با پارافیلم پوشانده شد تا از تبخیر احتمالی اتانول و کاهش حجم محیط گیرنده جلوگیری شود. سل فرانس در دستگاه انکوباتور شیکردار در شرایط معین (دمای 32 درجه سانتیگراد و سرعت rpm 100) قرار داده شد. سپس در زمانهای 0/5، 1، 2، 3، 4، 5 و 6 ساعت از محیط گیرنده نمونهگیری شد. به این صورت که در هر یک از زمانهای ذکرشده، 1 میلی لیتر نمونه برداری انجام شد. در ادامه برای ثابت ماندن حجم محیط گیرنده، 1 میلیلیتر از محیط تازه تهیهشده به محفظه گیرنده اضافه و مجدداً با پارافیلم پوشانده شد. برای انجام آنالیز، محتوای میکروتیوبها از فیلتر سرسرنگی 0/22 میکرومتر عبور داده و به داخل ویال HPLC انتقال داده شد. پس از تزریق به دستگاه HPLC، مقدار سطح زیر نمودار خوانده شد. این تست 3 مرتبه برای فرمولاسیون F5 تکرار شد.
بررسی تعیین مقدار آزلائیک اسید در مطالعه پایداری طولانیمدت در بازه زمانی 3 ماهه
بررسی تعیین مقدار آزلائیک اسید در فرمولاسیون ژل که پیشتر درباره آن صحبت شد، مربوط به زمان ساخت فرمولاسیون بود. در ادامه برای بررسی پایداری طولانیمدت آزلائیک اسید در فرمولاسیون ژل در بازه زمانی 3 ماهه از روز ساخت، تعیین مقدار آزلائیک اسید در فرمولاسیون ژل F5 در این بازه زمانی بررسی شد. با توجه به محدوده جغرافیایی کشور ایران، مطالعه پایداری طولانیمدت به مدت 3 ماه در دمای 25 درجه سانتیگراد و رطوبت 60 درجه سانتیگراد انجام شد. دما و رطوبت مورد نیاز توسط دستگاه محفظه پایداری شرکت Memmert تأمین شد.
یافتهها
از نظر ظاهری فرمولاسیون F1 ظاهر مناسبی نداشت و پس از قرار گرفتن ژل در دست حالت شنی احساس میشد. در فرمولاسیون F2 حالت شنی برطرف شد، اما فرمولاسیون ژل بسیار روان بود. در فرمولاسیون F3 که با افزایش غلظت لسیتین و توسط دستگاه همزن اورهد ساخته شد، شکل ظاهری فرمولاسیون مناسب بود. همچنین فرمولاسیونهای F4 و F5 نیز ظاهر مناسبی داشتند.
نتایج ویسکوزیته برای فرمولاسیونهای F4، F5 با اسپندل 5 در دمای 23 درجه سانتیگراد در جدول شماره 3 ذکر شده است.

همچنین نتایجpH فرمولاسیونها در دمای 25 درجه سانتیگراد در روز ساخت بین 4/9 تا 5/1 بود. نتایج نشان داد pH فرمولاسیونها در طی 3 ماه حدود 5 بود (جدول شماره 3).
تعیین مقدار آزلائیک اسید در ژل در روز ساخت و پایداری طولانیمدت 1، 2 و 3 ماهه
بر اساس منحنی استاندارد (تصویر شماره 1) و پیک HPLC (تصویر شماره 2) نتایج میانگین غلظت آزلائیک اسید در فرمولاسیون ژل در روز ساخت، ماههای اول، دوم و سوم در جدول شماره 4 ذکر شده است.

نتایج تعیین مقدار آزلائیک اسید فرمولاسیونهای F3، F4 و F5 در روز ساخت در محدوده 100 تا 104 درصد قرار داشت.
نتایج تعیین مقدار آزلائیک اسید در فرمولاسیونهای مختلف در پایان ماههای اول، دوم و سوم نشان داد (جدول شماره 4) مقدار آزلائیک اسید در فرمولاسیون F3، در ماه اول 99/72 درصد، در ماه دوم 96/25 درصد و در ماه سوم 100/5 درصد بود. مقدار آزلائیک اسید در فرمولاسیون F4 در ماههای اول، دوم و سوم به ترتیب 100/39 درصد، 97/85 درصد و 98/76 درصد محاسبه شد. همچنین مقدار آزلائیک اسید موجود در فرمولاسیون F5 در ماه اول 100/25 درصد، در ماه دوم 102/9 درصد و در ماه سوم 99/5 درصد شد. میزان آزلائیک اسید در فرمولاسیون ژلF5 در طول مدت 3 ماه بیشتر از 99 درصد تعیین مقدار شد. نتایج بهدستآمده از تعیین مقدار آزلائیک اسید در زمانهای مختلف با روش تیتست در نرمافزار SPSS نسخه 17 ارزیابی شد.
همانطور که ذکر شد برای بررسی رهایش آزلائیک اسید از ژل، منحنی استاندارد آزلائیک اسید در محیط حاوی محلول بافر فسفات مونوبازیک با pH 4/8 و اتانول 96 درصد با نسبت 1:1 رسم شد، سپس پروفایل رهش آزلائیک اسید از فرمولاسیون ژل F5 در طی 6 ساعت در این محیط بررسی شد. همانطور که در تصویر شماره 3 مشاهده میشود در ساعت اول حدود 30 درصد از دارو آزاد شد و پس از 2 ساعت میزان آزادسازی آزلائیک اسید به حدود 50 درصد رسید و رهش تا مدت زمان 6 ساعت، افزایش معناداری نداشت.
بحث
آزلائیک اسید یک دی کربوکسیلیک اسید طبیعی است و با کاهش ضایعات التهابی و اریتم در افراد مبتلا به آکنه روزاسه سبب درمان بیماری آکنه میشود [18]. شیوع این بیماری بین جمعیت با پوستهای رنگی در آمریکا، آفریقا و آسیا تا 10 درصد گزارش شده است [19]. اگرچه تأثیرات آکنه روزاسه بر سلامت جسمی فرد محدود است، اما تأثیرات عمیق روحی بر فرد مبتلا میگذارد؛ بنابراین درمان این بیماری تا حد زیادی باعث بهبود کیفیت زندگی فرد میشود [6].
با توجه به اینکه فرمولاسیون ژل موضعی آزلائیک اسید در بازار دارویی ایران موجود نیست، در این تحقیق ساخت و بررسی خصوصیات فیزیکوشیمیایی و پایداری کوتاهمدت فرمولاسیون ژل موضعی 15 درصد آزلائیک اسید بررسی شد. با توجه به اینکه میزان انحلالپذیری آزلائیک اسید در آب کم است، بهطوری که میزان انحلالپذیری آن در دمای 60 درجه سانتیگراد 2/8 میلیگرم بر میلیلیتر است؛ بنابراین انتخاب غلظت مناسب کمک حلال از اهمیت بسزایی برخوردار است.
در این مطالعه از پروپیلن گلیکول با 2 نسبت 12 و 18 درصد وزنی / وزنی به عنوان کمک حلال در فرمولاسیون ژل استفاده شد، نتایج نشان داد افزایش میزان پروپیلن گلیکول همزمان با افزایش غلظت لسیتین موجب تهیه فرمولاسیون ژل با قوام مناسب میشود. برای بررسی نقش دستگاه هموژنایزر و همزن اورهد در مراحل ساخت، نتایج انحرافمعیار تعیین مقدار روز ساخت فرمولاسیونهای F3، F4 و F5 بررسی شد. آزلائیک اسید موجود در این فرمولاسیونهای F4 و F5 که توسط دستگاه هموژنایزر به خوبی هموژن شده بودند، به شکل مناسبتری در فرمولاسیون ژل پراکنده شدند و انحرافمعیار کمتری نسبت به فرمولاسیون F3 که توسط همزن اورهد تهیه شده بود، داشتند.
تعیین مقدار فرمولاسیون ژل F5 در بازه زمانی 3 ماهه، میزان آزلائیک اسید بیشتر از 99 درصد را نشان داد، اما نتایج تعیین مقدار فرمولاسیون F3 که فرایند ساخت آن توسط همزن مغناطیسی و همزن اورهد انجام شده بود، نشان داد مقدار آزلائیک اسید در مدت زمان 3 ماه کاهش داشته و این کاهش نسبی با افزایش انحرافمعیار همراه بود.
به نظر میرسد با وجود شرایط نگهداری مشابه هر 3 فرمولاسیون در طی 3 ماه، استفاده از همزنهای مغناطیسی و اورهد در فرمولاسیون F3 سبب شده میزان همگن بودن آزلائیک اسید در این فرمولاسیون کمتر باشد، اما مقدار آزلائیک اسید در این فرمولاسیون نسبت به فرمولاسیون F5 در طی مدت 3 ماه افت کمتری داشت؛ این نتایج میتواند نشاندهنده اهمیت استفاده از نوع دستگاه در فرایند ساخت فرمولاسیون ژل برای حفظ یکپارچگی و همگنی فرمولاسیون در مدت طولانی باشد.
مطالعه آزمون تیتست نشان داد 3 فرمولاسیون در مدت زمان مطالعهشده تفاوت معناداری با یکدیگر نداشتند؛ بنابراین برای نتیجهگیری مناسبتر بهتر است مطالعه پایداری در زمانهای طولانیتری انجام شود یا نوع مطالعه پایداری به مطالعه تسریعشده تغییر یابد.
مقدار pH اندازهگیریشده در هر 3 فرمولاسیونهای F3، F4 و F5 در ماههای مختلف مطالعه نشان داد pH ژل در محدوده مناسب پوست قرار داشت و تغییر چندانی نکرد [20, 21]. ویسکوزیته ژل موضعی ساختهشده در مطالعه اوسیتومیوا و همکاران در دمای 25 درجه سانتیگراد در بازه mPa.s5000 تا mPa.s9000 قرار داشت. نتایج ویسکوزیته مطالعه حاضر نیز در محدوده mPa.s5000 تاmPa.s 9100 قرار داشت که با مطالعه فوق در یک راستا بود [22].
بررسی نتایج حاصل از تست رهش فرمولاسیون F5 نشان داد آزادسازی دارو در ساعت اول 35/8 درصد بود و سپس تا ساعت دوم، آزادسازی به 54/4 درصد رسید. در ساعت سوم، افزایش معناداری در آزادسازی مشاهده نشد و تا پایان ساعت ششم، آزادسازی به 58/1 درصد رسید. المرابح و همکاران، آزمایشی برای افزایش میزان رهایش پیشداروی آزلائیک اسید انجام دادند و میزان درصد تجمعی آزلائیک اسید را بعد از 6 ساعت حدود 40 درصد محاسبه کردند [17].
همچنین کاررِر و همکاران در سال 2020 در پژوهش خود نشان دادند پروپیلن گلیکول در فرمولاسیونهای موضعی میتواند به عنوان حلال کمکی و همچنین عاملی برای افزایش نفوذ دارو به پوست عمل کند [23]. در نتیجه، به نظر میرسد افزایش مقدار پروپیلن گلیکول به میزان 18 درصد وزنی / وزنی در فرمولاسیون F5 علاوه بر نقش کمک حلالی، میتواند سبب افزایش میزان رهش آزلائیک اسید شود.
نتیجهگیری
با توجه به نتایج بهدستآمده، در فرمولاسیون ژل F5 که از 3 مرحله هموژنایزر در فرایند ساخت آن استفاده شد و فرمولاسیون به خوبی یکنواخت شده بود، مقدار آزلائیک اسید در مدت زمان نگهداری تغییر محسوسی نداشته و انحرافمعیار کمتری نسبت به سایر فرمولاسیونها مشاهده شد. میتوان چنین نتیجهگیری کرد که استفاده از دستگاه هموژنایزر هنگام ساخت فرمولاسیون ژل آزلائیک اسید در همگن شدن بیشتر ژل مؤثر است و فرمولاسیون F5 همگنتر از سایر فرمولاسیونها بوده و به عنوان فرمولاسیون بهینه انتخاب شد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
مقاله حاضر برگرفته از پایاننامه دکترای عمومی داروسازی به شماره ثبت د/150 است. این مطالعه توسط کمیته اخلاق دانشگاه علومپزشکی گیلان با کد اخلاق IR.GUMS.REC.1399.511. تصویب شد.
حامی مالی
این تحقیق هیچگونه کمک مالی از سازمانهای دولتی، خصوصی و غیرانتفاعی دریافت نکرده است.
مشارکت نویسندگان
مفهومسازی و طراحی مطالعه: سعید منوچهری؛ کسب، تحلیل و تفسیر دادهها: سعید منوچهری، محمد مؤذن و سعید قاسمی؛ تهیه پیشنویس دستنوشته و تحلیل آماری: سعید قاسمی و سعید منوچهری؛ انجام مطالعه: زهرا صبور.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان بر خود لازم میدانند از زحمات گیتا الکن صابری، کارشناس آزمایشگاه فارماسیوتیکس که در این پژوهش ما را همراهی کردند، تشکر و قدردانی کنند.
References
1.Amrutbhai HH, Jaykumar PA, Narkhede SB. A review on azelaic acid emulgel for acne and hyperpigmentation. Journal of Innovation in Pharmaceutical Sciences. 2019; 3(1):16-21. [Link]
2.Li X, He C, Chen Z, Zhou C, Gan Y, Jia Y. A review of the role of sebum in the mechanism of acne pathogenesis. Journal of Cosmetic Dermatology. 2017; 16(2):168-73. [DOI:10.1111/jocd.12345] [PMID]
3.Picardo M, Ottaviani M, Camera E, Mastrofrancesco A. Sebaceous gland lipids. Dermato-Endocrinology. 2009; 1(2):68-71. [DOI:10.4161/derm.1.2.8472] [PMID]
4.van Zuuren EJ. Rosacea. New England Journal of Medicine. 2017; 377(18):1754-64. [DOI:10.1056/NEJMcp1506630] [PMID]
5.Culp B, Scheinfeld N. Rosacea: A review. Pharmacy and Therapeutics. 2009; 34(1):38-45. [PMID]
6.Two AM, Wu W, Gallo RL, Hata TR. Rosacea: Part II. Topical and systemic therapies in the treatment of rosacea. Journal of the American Academy of Dermatology. 2015; 72(5):761-70. [DOI:10.1016/j.jaad.2014.08.027] [PMID]
7.Liu RH, Smith MK, Basta SA, Farmer ER. Azelaic acid in the treatment of papulopustular rosacea: A systematic review of randomized controlled trials. Archives of Dermatology. 2006; 142(8):1047-52. [DOI:10.1001/archderm.142.8.1047] [PMID]
8.Apriani EF, Rosana Y, Iskandarsyah I. Formulation, characterization, and in vitro testing of azelaic acid ethosome-based cream against Propionibacterium acnes for the treatment of acne. Journal of Advanced Pharmaceutical Technology & Research. 2019; 10(2):75-80. [DOI:10.4103/japtr.JAPTR_289_18] [PMID]
9.Hung WH, Chen PK, Fang CW, Lin YC, Wu PC. Preparation and evaluation of azelaic acid topical microemulsion formulation: In vitro and in vivo study. Pharmaceutics. 2021; 13(3):410. [DOI:10.3390/pharmaceutics13030410] [PMID]
10.Bergman D, Luke J. Azelaic acid. Journal of the Dermatology Nurses' Association. 2017; 9(3):157-60. [DOI:10.1097/JDN.0000000000000309]
11.Gupta AK, Gover MD. Azelaic acid (15% gel) in the treatment of acne rosacea. International Journal of Dermatology. 2007; 46(5):533-8. [DOI:10.1111/j.1365-4632.2005.02769.x] [PMID]
12.Cunliffe WJ, Holland KT. Clinical and laboratory studies on treatment with 20% azelaic acid cream for acne. Supplementum. 1989; 143:31-34. [PMID]
13.Maddin S. A comparison of topical azelaic acid 20% cream and topical metronidazole 0.75% cream in the treatment of patients with papulopustular rosacea. Journal of the American Academy of Dermatology. 1999; 40(6 Pt 1):961-5. [DOI:10.1016/S0190-9622(99)70085-X] [PMID]
14.Franke P, Günther C, Riedl J. Composition with azelaic acid. Washington, DC: U.S. Patent and Trademark Office; 2003. [Link]
15.Sharma A, Mishra A, Sharma S. Stability indicating simultaneous validation of azelaic acid, minoxidil and tretinoin with forced degradation behavior study. By Rp-Hplc in Pharmaceutical Dosage Form. European Journal of Biomedical and Pharmaceutical Sciences. 2016; 3. [Link]
16.Klimundová J, Satinský D, Sklenárová H, Solich P. Automation of simultaneous release tests of two substances by sequential injection chromatography coupled with Franz cell. Talanta. 2006; 69(3):730-5. [DOI:10.1016/j.talanta.2005.11.011] [PMID]
17.Al-Marabeh S, Khalil E, Khanfar M, Al-Bakri AG, Alzweiri M. A prodrug approach to enhance azelaic acid percutaneous availability. Pharmaceutical Development and Technology. 2017; 22(4):578-86. [DOI:10.1080/10837450.2016.1200614] [PMID]
18.Jones DA. Rosacea, reactive oxygen species, and azelaic acid. The Journal of Clinical and Aesthetic Dermatology. 2009; 2(1):26. [PMID]
19.Alexis AF, Callender VD, Baldwin HE, Desai SR, Rendon MI, Taylor SC. Global epidemiology and clinical spectrum of rosacea, highlighting skin of color: Review and clinical practice experience. Journal of the American Academy of Dermatology. 2019; 80(6):1722-9. e7. [DOI:10.1016/j.jaad.2018.08.049] [PMID]
20.Bandier J, Johansen JD, Petersen LJ, Carlsen BC. Skin pH, atopic dermatitis, and filaggrin mutations. Dermatitis. 2014; 25(3):127-9. [DOI:10.1097/DER.0000000000000045] [PMID]
21.Schmidt T, Zollner T, Friedrich M. Azelaic acid-comprising formulation with added pigment. United States patent application. 2012; Application No. 13/116,791. [Link]
22.Osipitan OO, Shi Y, Di Pasqua AJ. Phenethyl isothiocyanate-containing carbomer gel for use against squamous cell carcinoma. Pharmaceutics. 2021; 13(1):106. [DOI:10.3390/pharmaceutics13010106] [PMID]
23.Carrer V, Alonso C, Pont M, Zanuy M, Córdoba M, Espinosa S, et al. Effect of propylene glycol on the skin penetration of drugs. Archives of Dermatological Research. 2020; 312(5):337-52. [DOI:10.1007/s00403-019-02017-5] [PMID]
2.Li X, He C, Chen Z, Zhou C, Gan Y, Jia Y. A review of the role of sebum in the mechanism of acne pathogenesis. Journal of Cosmetic Dermatology. 2017; 16(2):168-73. [DOI:10.1111/jocd.12345] [PMID]
3.Picardo M, Ottaviani M, Camera E, Mastrofrancesco A. Sebaceous gland lipids. Dermato-Endocrinology. 2009; 1(2):68-71. [DOI:10.4161/derm.1.2.8472] [PMID]
4.van Zuuren EJ. Rosacea. New England Journal of Medicine. 2017; 377(18):1754-64. [DOI:10.1056/NEJMcp1506630] [PMID]
5.Culp B, Scheinfeld N. Rosacea: A review. Pharmacy and Therapeutics. 2009; 34(1):38-45. [PMID]
6.Two AM, Wu W, Gallo RL, Hata TR. Rosacea: Part II. Topical and systemic therapies in the treatment of rosacea. Journal of the American Academy of Dermatology. 2015; 72(5):761-70. [DOI:10.1016/j.jaad.2014.08.027] [PMID]
7.Liu RH, Smith MK, Basta SA, Farmer ER. Azelaic acid in the treatment of papulopustular rosacea: A systematic review of randomized controlled trials. Archives of Dermatology. 2006; 142(8):1047-52. [DOI:10.1001/archderm.142.8.1047] [PMID]
8.Apriani EF, Rosana Y, Iskandarsyah I. Formulation, characterization, and in vitro testing of azelaic acid ethosome-based cream against Propionibacterium acnes for the treatment of acne. Journal of Advanced Pharmaceutical Technology & Research. 2019; 10(2):75-80. [DOI:10.4103/japtr.JAPTR_289_18] [PMID]
9.Hung WH, Chen PK, Fang CW, Lin YC, Wu PC. Preparation and evaluation of azelaic acid topical microemulsion formulation: In vitro and in vivo study. Pharmaceutics. 2021; 13(3):410. [DOI:10.3390/pharmaceutics13030410] [PMID]
10.Bergman D, Luke J. Azelaic acid. Journal of the Dermatology Nurses' Association. 2017; 9(3):157-60. [DOI:10.1097/JDN.0000000000000309]
11.Gupta AK, Gover MD. Azelaic acid (15% gel) in the treatment of acne rosacea. International Journal of Dermatology. 2007; 46(5):533-8. [DOI:10.1111/j.1365-4632.2005.02769.x] [PMID]
12.Cunliffe WJ, Holland KT. Clinical and laboratory studies on treatment with 20% azelaic acid cream for acne. Supplementum. 1989; 143:31-34. [PMID]
13.Maddin S. A comparison of topical azelaic acid 20% cream and topical metronidazole 0.75% cream in the treatment of patients with papulopustular rosacea. Journal of the American Academy of Dermatology. 1999; 40(6 Pt 1):961-5. [DOI:10.1016/S0190-9622(99)70085-X] [PMID]
14.Franke P, Günther C, Riedl J. Composition with azelaic acid. Washington, DC: U.S. Patent and Trademark Office; 2003. [Link]
15.Sharma A, Mishra A, Sharma S. Stability indicating simultaneous validation of azelaic acid, minoxidil and tretinoin with forced degradation behavior study. By Rp-Hplc in Pharmaceutical Dosage Form. European Journal of Biomedical and Pharmaceutical Sciences. 2016; 3. [Link]
16.Klimundová J, Satinský D, Sklenárová H, Solich P. Automation of simultaneous release tests of two substances by sequential injection chromatography coupled with Franz cell. Talanta. 2006; 69(3):730-5. [DOI:10.1016/j.talanta.2005.11.011] [PMID]
17.Al-Marabeh S, Khalil E, Khanfar M, Al-Bakri AG, Alzweiri M. A prodrug approach to enhance azelaic acid percutaneous availability. Pharmaceutical Development and Technology. 2017; 22(4):578-86. [DOI:10.1080/10837450.2016.1200614] [PMID]
18.Jones DA. Rosacea, reactive oxygen species, and azelaic acid. The Journal of Clinical and Aesthetic Dermatology. 2009; 2(1):26. [PMID]
19.Alexis AF, Callender VD, Baldwin HE, Desai SR, Rendon MI, Taylor SC. Global epidemiology and clinical spectrum of rosacea, highlighting skin of color: Review and clinical practice experience. Journal of the American Academy of Dermatology. 2019; 80(6):1722-9. e7. [DOI:10.1016/j.jaad.2018.08.049] [PMID]
20.Bandier J, Johansen JD, Petersen LJ, Carlsen BC. Skin pH, atopic dermatitis, and filaggrin mutations. Dermatitis. 2014; 25(3):127-9. [DOI:10.1097/DER.0000000000000045] [PMID]
21.Schmidt T, Zollner T, Friedrich M. Azelaic acid-comprising formulation with added pigment. United States patent application. 2012; Application No. 13/116,791. [Link]
22.Osipitan OO, Shi Y, Di Pasqua AJ. Phenethyl isothiocyanate-containing carbomer gel for use against squamous cell carcinoma. Pharmaceutics. 2021; 13(1):106. [DOI:10.3390/pharmaceutics13010106] [PMID]
23.Carrer V, Alonso C, Pont M, Zanuy M, Córdoba M, Espinosa S, et al. Effect of propylene glycol on the skin penetration of drugs. Archives of Dermatological Research. 2020; 312(5):337-52. [DOI:10.1007/s00403-019-02017-5] [PMID]
| بازنشر اطلاعات | |
 | این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |