دوره 33، شماره 4 - ( 10-1403 )
جلد 33 شماره 4 صفحات 361-344 |
برگشت به فهرست نسخه ها
Research code: 0
Ethics code: 0
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Rezakhani L, Tabatabaei T S, Alizadeh M. Biomedical applications (chitin - chitosan) in tissue engineering. JGUMS 2024; 33 (4) :344-361
URL: http://journal.gums.ac.ir/article-1-2669-fa.html
URL: http://journal.gums.ac.ir/article-1-2669-fa.html
رضاخانی لیلا، طباطبایی طیبه سادات، علی زاده مرتضی. کاربرد کیتوزان در مهندسی بافت: یک مرور روایتی. مجله علوم پزشکی گیلان. 1403; 33 (4) :344-361
1- گروه مهندسی بافت، دانشکده پزشکی، دانشگاه علوم پزشکی کرمانشاه، ایران
2- کمیته تحقیقات دانشجویی، دانشکده پزشکی، دانشگاه علوم پزشکی شاهرود، ایران
3- گروه مهندسی بافت و زیست واد دارویی، دانشکده فناوری های نوین، دانشگاه علوم پزشکی همدان، ایران
2- کمیته تحقیقات دانشجویی، دانشکده پزشکی، دانشگاه علوم پزشکی شاهرود، ایران
3- گروه مهندسی بافت و زیست واد دارویی، دانشکده فناوری های نوین، دانشگاه علوم پزشکی همدان، ایران
متن کامل [PDF 7746 kb]
(645 دریافت)
| چکیده (HTML) (1513 مشاهده)
فعالیتهای ضدمیکروبی
عفونتهای باکتریایی همیشه یک مشکل جدی برای سلامت عمومی است. کیتین و کیتوزان به دلیل ماهیت کاتیونی خود دارای خواص ضد باکتریایی هستند [39]. اخیراً فعالیت ضدباکتریایی کیتین / کیتوزان و مشتقات آنها توجه زیادی را به خود جلب کرده است. بهویژه، کیتوزان و مشتقات آن برای کاربردهای ضدمیکروبی متعددی مورد بررسی قرار گرفتهاند [40]. اثر ضدباکتریایی کیتوزان بیشتر از کیتین بوده که به دلیل تعدادی آمین با بار مثبت است که با لیپیدها، پروتئینها و کربوهیدراتهای دارای بار منفی موجود در سطح سلول باکتری، پیوند الکترواستاتیکی ساخته و از رشد باکتریها جلوگیری میکند. علاوهبراین، کیتوزان نسبت به کیتین محلولتر است (مقدار pH زیر 6) و فعالیت ضدباکتریایی بهتری نسبت به کیتین دارد [41].
بهطور کل فعالیت ضد باکتریایی کیتوزان به درجه استیلزدایی، وزن مولکولی، pH محیط، ویژگی آبدوست / آبگریز، حلالیت، دما و غیره بستگی دارد [42]. 2 مکانیسم اصلی برای خواص ضدباکتریایی کیتوزان در نظر گرفته شده است. مورد اول به دلیل نفوذ کیتوزان به داخل سلول باکتری و مهار سنتز RNA و پروتئین است و مورد دوم به دلیل تعامل گروههای کاتیونی کیتوزان با گروههای آنیونی غشای سلولی باکتری است که افزایش تعداد بار مثبت کیتوزان به شکل NH3+ باعث میشود که آن را قویتر به دیواره سلولی باکتری متصل کرده و این واکنشها باعث تشکیل یک لایه غیرقابلنفوذ در اطراف سلول شده و از انتقال املاح حیاتی جلوگیری کند [43]. مطالعات آنتیباکتریالی بر روی چند نوع باکتری از داربست حاوی کیتوزان بر روی باکتریهای اشرشیاکلی کلبسیلا پنومونیه، باسیلوس سابتلیس و استافیلوکوکوس اورئوس با روش انتشار انجام شده است. وجود کیتوزان درون داربست بر میزان رشد تمامی این باکتریها تأثیر ضدباکتریایی داشته و رشد آنها را بهطور قابلتوجهی کم کرده است [44]. همانطور که گفته شد کیتوزان ازطریق برهمکنشهای الکتروتروستاتیک با فسفولیپیدهای دارای بار منفی، بر غشای سلولی تأثیر میگذارد و درنتیجه تغییر نفوذپذیری در غشای سلول موجب تغییر در بیان RNA و کاهش فعالیت DNA میشود [45]. بااینحال برای قارچهای مقاوم به کیتوزان، به نظر میرسد کیتوزان قادر به نفوذپذیری غشای سلولی نیست و در سطح بیرونی باقی میماند و موارد ذکرشده درمورد این نوع از میکرو ارگانیسمها صدق نمیکند [46]. به دلیل تفاوت در سیالیت غشای سلولی قارچهای مقاوم به کیتوزان، اجازه نفوذ کیتوزان به غشای سلولی را نداده و این ماده نمیتواند فعالیت این نوع قارچها را برهم زند و درنتیجه مقاومت به کیتوزان در این نوع از میکروارگانیسمها دیده میشود. مطالعه ترکیب اسیدهای چرب فسفولیپید غشای سلولی قارچهای حساس و مقاوم به کیتوزان نشان داده است افزایش فعالیت کیتوزان به اسیدهای چرب غیراشباع در غشای سلولی مرتبط است و مطالعات نشان دادهاند فعالیت ضدمیکروبی کیتوزان در برابر گونه جهشیافته N. crassa با کاهش مقدار اسیدهای چرب غیراشباع منجر به کاهش فعالیت ضدمیکروبی کیتوزان در مقایسه با نوع وحشی N. crassa میشود [45]. به این ترتیب سیالیت غشا بر فعالیت کیتوزان تأثیر میگذارد و نحوه عملکرد تا حد زیادی به نوع قارچ بستگی دارد.
ظاهراً قارچهای مقاوم به کیتوزان و حساس به کیتوزان از خانواده متفاوتی هستند [45]. طبقهبندی براساس ترکیب اسیدهای چرب ثابت کرده است که ابزاری قوی برای طبقهبندی این نوع از میکروارگانیسمها وجود دارد [47]. همچنین نشان داده شده که جذب کیتوزان توسط سلول برای قارچهای حساس به کیتوزان به ATP وابسته است. به این منظور مصرف کیتوزان در دمای 4 درجه سانتیگراد و یا در حضور آزید بررسی و ثابت شده است که در هر دو گروه، تولید ATP مهار شده و در هر دو مورد کیتوزان قادر به عبور از غشای پلاسمایی نبود و در دمای اتاق و در غیاب آزید، جذب کیتوزان در کمتر از 30 دقیقه قابلمشاهده شده است [48].
در باکتریهای گرم مثبت، کیتوزان بهصورت غیر کووالانسی با اسید تیکوئیک موجود در لایه پپتیدوگلیکان اتصال برقرار میکند [49]. اسیدهای تیکوئیک قرار گرفته در سطح غشای سلول برای تقسیم سلولی و دیگر جنبههای اساسی فیزیولوژی باکتریایی گرم مثبت مهم هستند [50]. با وجود این، در بین دانشمندان اختلاف نظراتی نیز وجود دارد و تأثیر کیتوزان بر غشای سلولی هنوز نامشخص است. برخی از گروههای تحقیقاتی معتقدند بعید است کیتوزان بر غشای سلولی تأثیر بگذارد، زیرا قطر هیدرودینامیکی کیتوزان بزرگتر از منافذ مورد انتظار در ساختار پپتیدوگلیکان است [49]. بااینحال کیتوزان با وزن مولکولی کمتر از 5 کیلو دالتون، با مسدود کردن سنتز DNA فعالیت خود رانشان میدهد [51]. باتوجهبه این موضوع وزن مولکولی عامل مهمی است که میتواند بر نحوه عملکرد کیتوزان و نفوذپذیری آن ازطریق غشای سلولی تأثیر بگذارد. تیکوئیک اسید نسبت به فعالیت کیتوزان با آزمایش گونههای جهشیافته استافیلوکوکوس اورئوس که فاقد یک یا چند ژن دخیل در بیوسنتز اسید تیکوئیک هستند، در گونههای جهشیافته استافیلوکوکوس اورئوس نسبت به نوع وحشی مقاومت بیشتری دارد که نشان میدهد تیکوئیک اسیدهای پلی آنیونی برای بهبود فعالیت ضدباکتریایی کیتوزان نسبت به باکتریهای گرم مثبت موردنیاز است [49]. درمورد باکتریهای گرم منفی 2 مکانیسم در غشای باکتری مد نظر است که اولی مرتبط با درجه شیلاته شدن کیتوزان بوده و به میزان اختلاف PH با PKa بستگی دارد [52، 53]. بنابراین، این موضوع میتواند منجر به اختلال در یکپارچگی دیواره سلولی شده و جذب مواد مغذی مهم (Ca ،Mg و غیره) را مختل کند [53، 54]. دومی به برهمکنش الکترواستاتیک کیتوزان و بخشهای آنیونی لیپوپلیساکارید در غشای خارجی مرتبط است [55، 56]. مطالعات اخیر نشان داد کیتوزان غشای داخلی را مختل میکند و منجر به نشت مواد داخل سلولی میشود و همچنین دیده شده که کیتوزان میتواند از غشای سلولی باکتریهای گرم منفی عبور کند [57]. ممکن است کیتوزان با سنتز DNA/RNA تداخل داشته باشد و باعث ایجاد پاسخهای درونسلولی در داخل سلول شود. بهطورکلی کیتوزان میتواند بهعنوان یک عامل ضدمیکروبی در برابر انواع مختلف قارچها و باکتریها استفاده شود. بااینحال، فعالیت کیتوزان تحت تأثیر عوامل بسیاری است و نحوه عملکرد آن نیز میتواند تحت تأثیر این عوامل قرار گیرد. بهطورکلی، کیتوزان بیشتر در سطح سلول فعال است. بسته به نوع میکروارگانیسم و وزن مولکولی، فعالیتهای ضدمیکروبی دیگری، مانند مهار سنتز DNA/RNA یا اختلال در سنتز پروتئین را میتواند ایجاد کند.
فعالیتهای ضدتوموری
مشتقات بهدستآمده از منابع دریایی دارای انواع فعالیتهای بیولوژیکی، ازجمله خاصیت آنتیاکسیدانی و ضدتوموری هستند [58]. بااینحال استفاده کیتوزان به دلیل حلالیت ضعیف در آب، ویسکوزیته بالا و سایر مشکلات با محدودیت مواجه شده است. برای حل این معضل، محققان به استفاده از الیگوساکاریدهای کیتوزان که ازنظر عملکردی ویژگیهای بهتری از خود نشان دادهاند، روی آوردند. الیگوساکاریدهای کیتوزان با 2 گروه فعال آمینو و هیدروکسیل میتوانند مشتقات مختلفی را تشکیل داده و در فعالیتهای ضدتوموری نقش مؤثری ایفا کنند. در حال حاضر، تحقیقات مربوط به ویژگیهای ضدتوموری الیگوساکاریدهای کیتوزان عمدتاً بر اصلاح شیمیایی الیگوساکاریدهای کیتوزان برای بهبود فعالیت ضدتوموری آنها و استفاده از مشتقاتشان بهعنوان حاملهای دارویی برای حملونقل هدفمند داروهای ضدتومور متمرکز است. فعالیت ضدتوموری الیگوساکاریدهای کیتوزان به خواص فیزیکی و شیمیایی آنها ازجمله وزن مولکولی، درجه پلیمریزاسیون، درجه استیلاسیون، توزیع بار و اصلاح شیمیایی مربوط میشود. برای بررسی فعالیت ضد توموری الیگوساکاریدهای کیتوزان، علاوه بر گروههای عاملی روی حلقه پیرانوز، ازجمله گروههای آمینو و استیل آمینو، باید تأثیر وزن مولکولی نیز در نظر گرفته شود [59]. رونگ هوا هوانگ و همکاران گزارش کردند که مشتقات الیگوساکاریدهای کیتوزان با بار بالا، بهطور قابلتوجهی توانایی بقای سلولهای تومور را کاهش میدهند و با القای نکروز در سلولهای تومور در این فرایند نقش دارند. بنابراین فعالیت ضدتوموری الیگوساکاریدی کیتوزان ارتباط نزدیکی با شدت بار مثبت دارد. هنگامی که DD از الیگوساکاریدهای کیتوزان در زنجیره قند افزایش مییابد، بار مثبت هم افزایش یافته و به دنبال آن تعامل با سلولهای توموری زیاد میشود. بهعبارتدیگر، هنگامی که چگالی بار مثبت روی حلقه پیرانوز تغییر میکند، فعالیت ضدتوموری الیگوساکاریدهای کیتوزان بهبود مییابد [60]. کربوکسی متیل الیگوساکاریدهای کیتوزان نیز فعالیت ضدتوموری را بر روی سلولهای BEL-7402 (کارسینومای کبد) در شرایط آزمایشگاهی و سلولهای H22 (سارکوما) در داخل بدن ازطریق مکانیسمهای متعدد، ازجمله مهار تکثیر، افزایش شاخص ایمنی، القای آپوپتوز و نکروز سلولی اعمال کردند، درحالیکه این ترکیبات هیچ اثر سمی بر سلولهای L-02 در کبد طبیعی و سایر اندامها نداشتند [61].
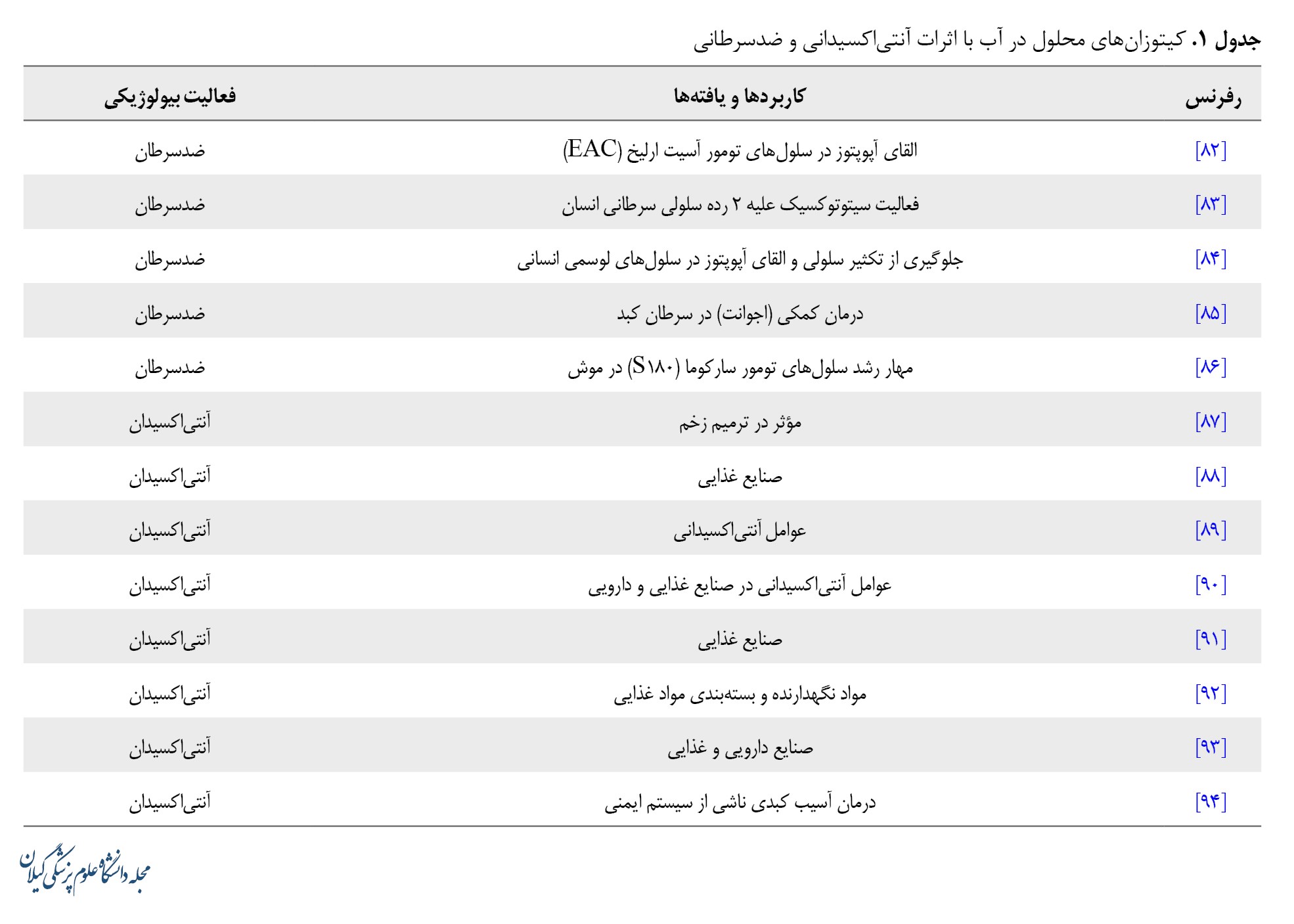
حلالیت کیتوزان محلول در آب و انواع مشتقات آن، باعث شده است این ترکیبات با خاصیت آنتیاکسیدانی بهعنوان کاندیدای بالقوهای در مطالعات ضدتوموری معرفی شوند. گونههای فعال اکسیژن میتوانند با اتمهای هیدروژن فعال موجود در هیدروکسیل یا آمینو کیتوزان واکنش دهند تا یک رادیکال ماکرومولکولی کاملاً قوی تشکیل دهند. کیتوزان با کاربرد در برنامههای غذایی هم توانسته در این صنعت موفقیتآمیز عمل کند. کیتوزان برای افزایش ماندگاری نان با استفاده از به تعویق انداختن تخریب نشاسته و یا ازطریق مهار افزایش میکروبی نقش دارد. سطح خمیر با کیتوزان 0/5، 1 و 1/5 درصد در اسید استیک 1 درصد با استفاده از قلممو آستر شد. باگت پوشش دادهشده با کیتوزان، بهویژه با 1 درصد، کاهش وزن، سختی و تخریب کمتری را نسبت به نمونه شاهد در دوره نگهداری به مدت 36 ساعت در دمای 25 درجه سانتیگراد نشان داد [62]. مشکلات متعددی در برخی از مراحل نگهداری تخممرغها رخ میدهد، ازجمله کاهش وزن، خرابی و عفونت میکروبی. کیتوزان با خاصیت تشکیل فیلم میتواند یک سد محافظ برای انتقال رطوبت و سوخت از آلبومین ازطریق پوسته تخم مرغ ایجاد کند و درنتیجه ماندگاری تخمها را افزایش میدهد [63]. تلفات اساسی میوه پس از برداشت به دلیل آلودگی قارچی، مسائل فیزیولوژیکی و حوادث فیزیکی است. یکی از تاکتیکها برای افزایش قابلیت نگهداری این مواد فاسدشدنی، استفاده از پوششهای ایمن همراه با استفاده از انبار سرد است. پوشش کیتوزان برای تنظیم محیط داخلی بدون ایجاد تنفس بیهوازی امکان پذیر است، زیرا لایههای کیتوزان بهطور انتخابی به O2 نفوذپذیرتر از CO2 هستند. بنابراین پوشش کیتوزان با توانایی خود در تغییر اکوسیستم درون بافت و متعلقات قارچی، پتانسیل افزایش عمر ذخیرهسازی و مدیریت پوسیدگی را دارد [64]. جدول شماره 1 به این ویژگیها اشاره دارد.
نانوذرات مبتنی بر کیتوزان به دلیل ساختار خاص و خصوصیات فیزیکوشیمیایی بسیار مورد توجه قرار گرفته اند. کربوکسی متیل کیتوزان همچنین میتواند در درمان بیشتر سرطانها استفاده شود. تأثیر ضد توموری نانوذرات N ـ سوکسینیل کیتوزان بر روی سلولهای K562 (لوکمی) مورد بررسی قرار گرفت. نانوذرات از تکثیر سلولهای K562 با IC50 26/ 14 میکروگرم بر میلیلیتر جلوگیری کردند. تحقیقات سیتومورفولوژی شامل میکروسکوپ الکترونی عبوری، سنجش فلورسانس و تجزیهوتحلیل قطعهقطعه شدن DNA، نشان داد کیتوزان با القای آپوپتوز و نکروز بر سلولهای مذکور اثر ضدتوموری دارد [65].
مهندسی بافت
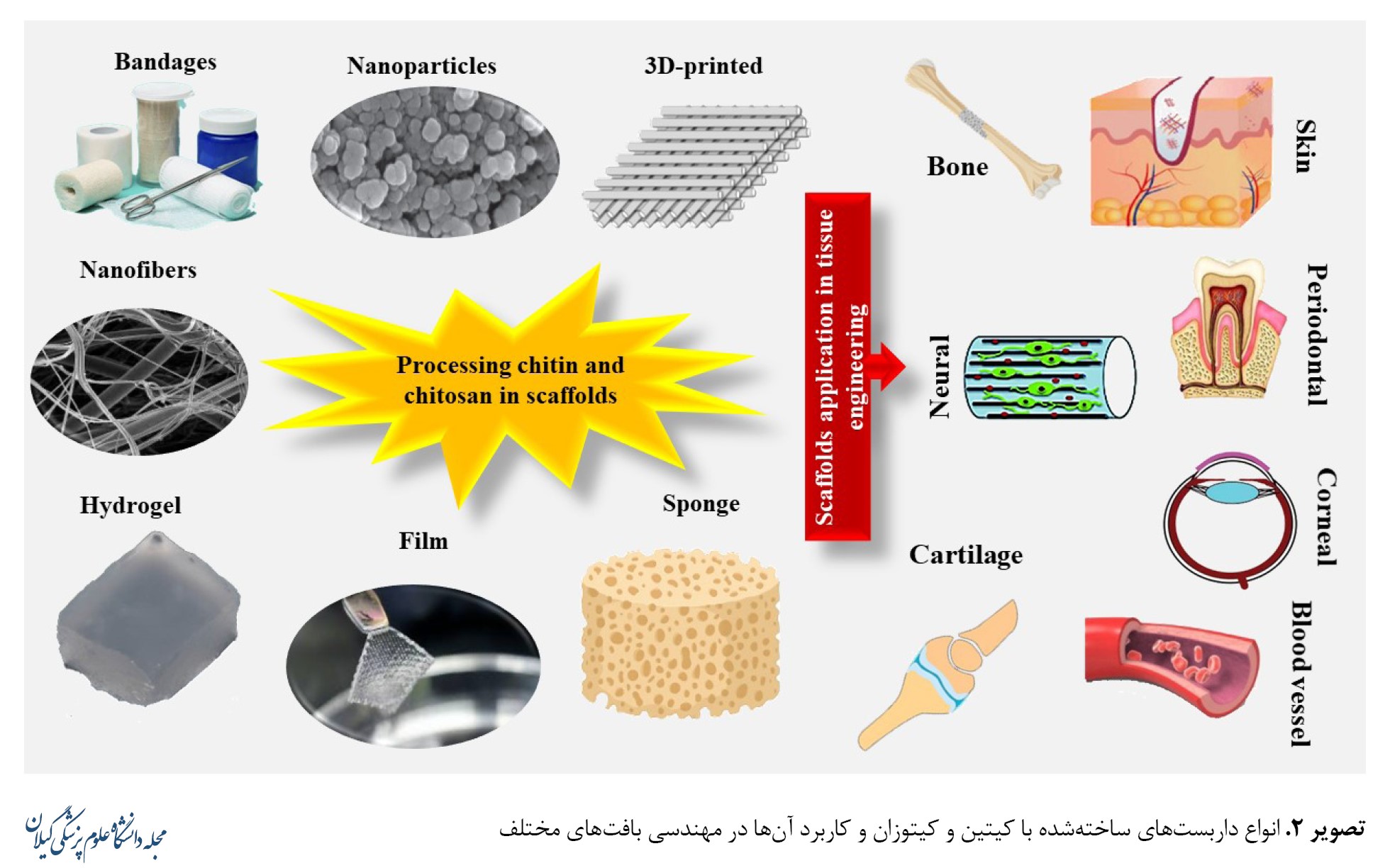
مهندسی بافت حوزهای پیشرفته از پزشکی ترمیمی و بازساختی است که از زمینه بیومواد پدید آمده است. اساساً این تکنیک با ترکیب سلولها، مولکولهای فعال بیولوژیکی و داربستها، عملکرد بافت یا اندام آسیبدیده را بهبود میبخشد ترمیم و حفظ میکند. هدف مهندسی بافت گرد هم آوردن ساختارهای عملکردی است که حمایت بیولوژیکی از بافت / اندام آسیبدیده برای ترمیم و بازسازی مناسب آن را فراهم میکند [66، 67]. استفاده از کامپوزیتهای پلیمری در درمان آسیبهای بافتی توجه زیادی را در بالین به خود جلب کرده است که دانشمندان را وادار به بهبود روشهای طراحی پلیمرهای زیستی بهمنظور دستیابی به سیستمی کارآمد برای ترمیم کامل بافت آسیبدیده کرده است. در مهندسی بافت، بیومتریال بهعنوان یک ماتریکس خارجسلولی برای سلول عمل میکند و به اتصال، تکثیر و تمایز سلولهای زنده کشت دادهشده کمک میکند [68]. بنابراین یکی از راههای مهم انتخاب بیومواد برای مهندسی بافت نهتنها باید انتقال فعال جمعیت سلولی و عوامل درمانی باشد و بازسازی را ارتقا بخشد، بلکه باید داربستی باشد که استحکام مکانیکی کافی برای بافت هدف را فراهم کند. علاوهبراین در حالت ایدئال، ماده باید در محل پیوند با سرعت قابلقبولی در مقایسه با رشد بافت تخریب شود [69]. کیتوزان یک ماده بیولوژیکی است و دومین پلیمر فراوان پس از سلولز است. این ماده پلیمر کاتیونی است که از کیتین با فرایند استیلزدایی نسبی به دست آمده و کاندیدی مناسب برای کاربردهای مهندسی بافت براساس ویژگیهایی مانند زیستسازگاری، غیرسمی و زیستتخریبپذیری همراه با فعالیت هموستاتیک و خونسازگار است که خواص بیولوژیکی آن مانند ضدمیکروبی، آنتیاکسیدانی، ضدسرطانی و ضدالتهابی بودن ثابت شده است [70]. در مطالعات مختلف گزارش شده که کیتوزان، به دلیل گروههای عملکردی آن، میتواند بهراحتی با سایر مولکولهای زیستفعال اصلاح شود تا خواص بیشتری به ساختار بافت بدهد. علاوهبراین مولکولهای کیتوزان رشد و تکثیر سلولهای سهبعدی را تسهیل کرده و همچنین رسوب کلاژن را سازماندهی میکنند و درنتیجه بهبودی سریع را تضمین میکند [71]. تا به امروز معمولاً از غشاها / فیلم، هیدروژل، اسفنج و اشکال رشتهمانند کیتوزان برای ترمیم زخم و یا سایر کاربردهای مهندسی بافت استفاده شده است (تصویر شماره 2) [72، 73].
References
متن کامل: (1012 مشاهده)
مقدمه
کیتین پلیمری با زنجیره بلند N-acetylglucosamine مشتق از گلوکز است. کیتین یک موکو پلیساکارید طبیعی با فرمول شیمیایی C8H13NO5 است که به وفور در اسکلت خارجی بندپایان مانند میگو، خرچنگ، کوتیکول حشرات و همچنین گیاهان پست، از قبیل مخمرها یافت میشود. کیتین پلیساکارید نیتروژندار است که سفیدرنگ، سخت، غیرالاستیک و نامحلول در آب، محلولهای غلیظ و محلولهای قلیایی است. کیتین همچنین دارای خواص درمانی اثباتشده و کاربردهای صنعتی است. کیتوزان با فرمول شیمیایی C6H11NO4 به دلیل غیرسمی بودن، امکان تجزیه در طبیعت، سازگاری با محیط زیست، مقرونبهصرفه بودن ازنظر اقتصادی، توانایی حذف محدوده وسیعی از رنگها و فلزات، ساخت سریع و درنهایت امکان تهیه مشتقات فراوان از آن، بسیار مورد توجه است [1]. کیتوزان یک بیوپلیمر طبیعی است که بهعنوان اسکفولد در مهندسی بافت استخوان عمل میکند [2]. کیتوزان شکل deacetylated کیتین [3-6]، عنصر ساختاری است که در اگزواسکلتون سختپوستانی مانند میگو، خرچنگ، کوتیکولهای حشرات و دیواره سلولی قارچها یافت میشود. کیتوزان یک پلیمر طبیعی با ساختار خطی است که از واحدهای تکرارشونده D ـ گلوکز آمین و N ـ استیل ـ D ـ گلوکز آمین تشکیل شده است که این واحدها توسط پیوندهای (1-4)β گلوکوزیدی به هم متصل شدهاند [3، 7، 8] . لیزوزیم آنزیمی است که ازطریق هیدرولیز باندهای گلوکزآمین ـ گلوکزآمین، گلوکزآمین ـ NAG و NAG ـ NAG، کیتوزان را در شرایط برونتنی و درونتنی تخریب میکند [3، 7]. لیزوزیمی که باعث تخریب کیتوزان میشود، در بدن انسان فراگیر است. این آنزیم در غده اشکی، گوش میانی، بینی، برونش و برونشیولها، مغز استخوان و دستگاه گوارش یافت میشود. لیزوزیم نقش مهمی در پاسخ التهابی دارد که توسط ماکروفاژها، مونوسیتها و گرانولوسیتها ترشح میشود [7]. درجه تخریب و وزن مولکولی کیتوزان بهطور معکوس با درجه deacetylation مرتبط است. اگر درجه deacetylation بالا باشد، میزان تخریب پایین است. کیتوزان با همراهی با آنیونها در دیوارههای سلول باکتریایی، دارای خواص ضدمیکروبی است و بنابراین بیوسنتز دیواره سلولی را سرکوب میکند که درنهایت باکتریها را از بین میبرد [3، 7]. کیتوزان به دلیل ماهیت کاتیونی که دارد در تسریع بهبود زخم [3، 4، 7، 8] و فعالیت ضدمیکروبی بسیار مورد استفاده قرار میگیرد. این پلیمر در مهندسی بافت برای تمایز یا ترمیم بافتهای متفاوتی، مانند پوست، استخوان، غضروف، عصب، کبد و ماهیچهها مورد استفاده قرار میگیرد [6]. کیتوزان با فعالسازی و تعدیل سلولهای التهابی، رشد بافت granular را تسهیل میکند و به همین دلیل آن را بهعنوان یک تسریعکننده ترمیم زخم نیز نامیدهاند. کیتوزان همچنین نقش حمایتکنندگی در تکثیر سلولی، تمایز استئوبلاست و مینرالیزاسیون دارد [3]. علت ارجحیت کیتوزان نسبت به کیتین این است که کیتین در محلولهای اسیدی، نامحلول است، اما کیتوزان محلول است [8]. منافذ اسکفولدهای کیتوزان به پارامترهای مختلفی، ازجمله غلظت پلیمر، اتصال متقابل، دمای انجماد و مقدار میکرو یا نانوذرات بستگی دارد [3]. کیتوزان دارای خواص مکانیکی کم تا متوسط است که استفاده از آن را در کاربردهای مختلف محدود میکند. با وجود این، افزودن پلیمرها یا نانوذرات مختلف به آن، باعث افزایش خاصیت مکانیکی آن میشود [3، 7]. کیتوزان به دلیل ماهیت چسبندگی مخاطی و افزایش نفوذ، ماده مناسبی برای تهیه فرمهای تحویلدهنده دهانی، بینی، واژینال و زیرجلدی است و بهعنوان یک افزودنی واکسن برای افزایش bioavailability و immunogenicity آنتیژنها مورد استفاده قرار میگیرد. ژلهای مبتنی بر کیتوزان همچنین دارای ویسکوزیته برای تزریق در پریودنتال هستند. از همه مهمتر، میتوان آنها را بهعنوان یک حامل برای آزادسازی داروهای فعال در محل بیماری استفاده کرد [9]. در مطالعه حاضر بره کاربرد کیتین و کیتوزان در حوزه زیست پزشکی با تأکید بر مهندسی بافت پرداخته خواهد شد.
روشها
گام اول
در این مطالعه جستوجوی مقالات برای یافتن مستندات مرتبط با نگارش مقاله مروری درباره کیتوزان و کاربردهای گسترده آن در پایگاههای داده اسکوپوس، گوگل اسکالر، پابمد، وبآوساینس، ساینس دایرکت انجام شد. از کلیدواژههای chitin و chitosan ،tissue engineering برای این جستوجو استفاده شد. همچنین از سرفصلهای موضوعی پزشکی و عبارتهای همنظیر مناسب با این موضوعـ که توسط 2 پژوهشگر مسلط به روش جستوجوی علمی مشخص شدند ـ بهره گرفته شد. در خصوص کتابها، معیار انتخاب، در دسترس بودن ارتباط موضوعی بود.
گام دوم
مقالات پس از بررسی عنوان، ازنظر ارتباط چکیده با هدف موردنظر ارزیابی شدند و موارد منتخب بهطور کامل مطالعه و نهایی شدند. برای انتخاب مستندات مورداستفاده ابتدا عناوین یافتشده توسط موتور جستوجو ازنظر ارتباط موضوعی بررسی شدند و مطالب یافتشده در 3 گروه درگاه اینترنتی، کتاب و مقاله تقسیم شدند. پس از بررسی این درگاهها، مواردی که کاملتر از بقیه بودند بهعنوان مرجع مورداستفاده، انتخاب شدند.
گام سوم
مقالات چکیده و مقالاتی که روششناسی و تحلیل نامشخص داشتند مورد ارزیابی و مطالعه قرار گرفتند و نتایج بهصورت تحلیلی و روایتی در بخش یافتهها ارائه شد.
جمعآوری اطلاعات
استراتژی جستوجو در پایگاه پابمد: در ابتدا واژههای مورد نظر وارد پایگاه مش شدند و پس از یافتن subheadingهای مربوطه با استفاده از عملگرهای AND و OR ،NOTکلیدواژهها با یکدیگر در فیلد PubMed Search Builder ادغام و جستوجو شدند. پس از آن در صفحه جستوجوی پابمد مطالعات clinical traial و مروری سیستماتیک نیز از فهرست مقالات خارج شدند.
استراتژی جستوجو در پایگاه اسکوپوس: پس ورود به پایگاه اسکوپوس، از قسمت جستوجوی منابع فیلد Documents انتخاب شد و کلیدواژههای بهدستآمده از پایگاه مش در قسمت key word وارد شد و از قسمت مربوطه از عملگرهای AND, OR, AND NOT استفاده شد. کلیدواژههای مذکور در Article title, Abstract, Keywords در جستوجو شدند. جهت محدودسازی جستوجو از فیلد limit، مطالعات clinical traial و مروری سیستماتیک از فهرست جستوجو خارج شدند.
استراتژی جستوجو در پایگاه وب آو سانیس: پس از ورود به پایگاه وب آو سانیس، فیلد جستوجوی مقالات و Advance search انتخاب شد. سپس جهت محدودسازی جستوجو از قسمت Select a database گزینه Web of Science Core Collection انتخاب شد. فیلد جستوجو بر روی Topic گذاشته شد و زبان انگلیسی انتخاب شد. با استفاده از عملگرهای AND و OR ،NOT واژگان ترکیب و مقالات جستوجو شدند.
استراتژی جستوجو در پایگاه ساینس دایرکت: پس از وارد پایگاه ساینس دایرکت از قسمت Refine publications by نوع فیلد جستوجو و از قسمت Publication type فیلد journal انتخاب شد. درنهایت کلیدواژههای انتخابشده جستوجو شدند. همچنین از قسمت advanced search نوع روش مطالعه و جستوجو در عنوان و چکیده مقالات انتخاب شد.
استراتژی جستوجو در پایگاه گوگل اسکالر: پس از ورود به پایگاه گوگل اسکالر کلید واژههای موردنظر با استفاده از عملگرهای AND و OR ،NOTادغام شدند و از قسمت Advanced search فیلد with all of the words انتخاب و از فیلدwhere my words occur گزینه anywhere in the article انتخاب و جستوجو انجام شد.
یافتهها
کاربردهای کیتین و کیتوزان
همانطور که ذکر شد کیتوزان یک آمینوپلیساکارید و دومین پلیمر طبیعی پرمصرف است. در مطالعات گستردهای به خواص غیرسمی، زیستسازگاری و زیستتخریبپذیری آن اشاره شده است [10]. این مزایا آن را به مادهای ایدئال برای تهیه هیدروژلهای کاربردی تبدیل میکند که میتواند بهعنوان پانسمان زخم عمل کند. علاوهبراین کیتوزان به دلیل دارا بودن گروههای آمینه و هیدروکسیل دارای خواص ذاتی مهمی، مانند چسبندگی مخاطی، خاصیت ضدمیکروبی، ضدقارچی، خاصیت رهایش کنترلشده دارو همراه با خواص مکانیکی و حرارتی عالی، آبدوستی، سهولت اصلاح سطح، میل ترکیبی زیاد برای فلزات، رنگها و پروتئینها همراه با توانایی ایجاد پلی کاتیون در محیط اسیدی و توانایی تشکیل فیلم و غیره است. این ویژگیها آنها را برای استفاده در پزشکی و داروسازی در صنایع مختلف در حفاظت محیط زیست، فرایندهای تصفیه آب و انواع مختلف فرایندهای جداسازی و غیره ممکن کرده است [11، 12]. نامحلول بودن کیتوزان در آب و اکثر حلالهای شیمیایی استفاده از آن را در بسیاری از زمینهها محدود کرده است. اصلاح شیمیایی کیتوزان منجر به افزایش خواص فیزیکوشیمیایی آن شده و کاربردهای متنوع آن را گسترش میدهد [13، 14]. با وجود این، خواص مذکور به وزن مولکولی و درجه استیلاسیون کیتوزان بستگی دارد. مطالعات حاکی از این است که حضور گروه آمینه پروتونپذیر در D ـ گلوکزامین امکان بیشتری را به خواص کیتوزان اضافه میکند. بهعنوان مثال، چسبندگی مخاطی کیتوزان را میتوان با وجود باقی ماندههای دارای بار منفی (اسید سیالیک) در موسین ـ گلیکوپروتئینی که موجب تشکیل موکوس میشود، توضیح داد. در محیط اسیدی، گروههای آمینه کیتوزان دارای بار مثبت هستند و بنابراین میتوانند با موسین تعامل و ارتباط برقرار کنند. چسبندگی موکوس مستقیماً با D کیتوزان مرتبط است: درواقع، اگر کیتوزان D افزایش یابد، تعداد بارهای مثبت نیز افزایش مییابد که منجر به بهبود خواص موکوسی میشود [15، 16]. فعالیت هموستاتیک کیتوزان به دلیل به وجود بارهای مثبت بر روی کیتوزان است. درواقع، غشای گلبولهای قرمز خون دارای بار منفی هستند و بنابراین میتوانند با کیتوزان با بار مثبت تعامل کنند. علاوهبراین کیتین فعالیت هموستاتیک کمتری نسبت به کیتوزان نشان میدهد که این توضیح را تأیید میکند [17-19]. به دلیل بارهای مثبت، کیتوزان بخش منفی غشای سلولی میتواند با این ماده تعامل داشته باشد، که این مورد میتواند منجر به سازماندهی مجدد و باز شدن اتصالات محکم پروتئینی غشای سلولی و افزایش نفوذ این پلیساکارید شود. درمورد چسبندگی موکوسی، اگر D کیتوزان افزایش یابد، توانایی نفوذ نیز افزایش مییابد [20]. ویژگی چند کاتیونی کیتوزان، امکان توضیح اثرات ضددرد کیتوزان را به وجود میآورد. درواقع، گروههای آمینه D ـ گلوکزامین میتوانند در حضور یونهای پروتونی که در ناحیه التهابی آزاد میشوند، واکنش داده و پروتونه شوند و درنتیجه اثر ضددردی ایجاد کنند [21]. در طول ساخت داربستهای قابلکاشت باید توجه ویژهای به سازگاری بدن، خواص مکانیکی، مورفولوژی و تخلخل داربست و همچنین ظرفیت ترمیم و جایگزینی بافت شود. باتوجهبه خواص قابلتوجه مذکور، کیتوزان بهعنوان یک ماده مناسب برای تهیه چنین بیوموادهایی به نظر میرسد که میتواند جایگزین بافت و اندام ازدسترفته یا آسیبدیده شود و به سلول اجازه اتصال و تکثیر را بدهد [22، 23]. کیتوزان بهعنوان هیدروژل بیوماده جالبی است، زیرا میتواند آب بالایی را در خود نگه دارد. محتوای آب بالای آن باعث سازگاری با اکثر بافتهای زنده میشود و علاوهبراین، نرم و قابل خم شدن است که آسیب به بافت اطراف را در حین و پس از پیوند در بیمار به حداقل میرساند. همچنین خواص مکانیکی هیدروژلی کیتوزان شبیه به بافتهای نرم بدن است که اجازه میدهد ویژگیهای عملکردی و مورفولوژیکی بافتی که باید ترمیم شود را تأمین کند [24]. به همین دلیل است که کیتوزانها اغلب بهعنوان داربستهای زیست پزشکی برای جایگزینی بافت و همچنین برای سایر کاربردهای زیست پزشکی، مانند انتقال دارو و فاکتور رشد و غیره استفاده میشوند [25-27]. در ادامه به تفصیل به کاربردهای کیتوزان اشاره شده است.
مواد آرایشی و بهداشتی
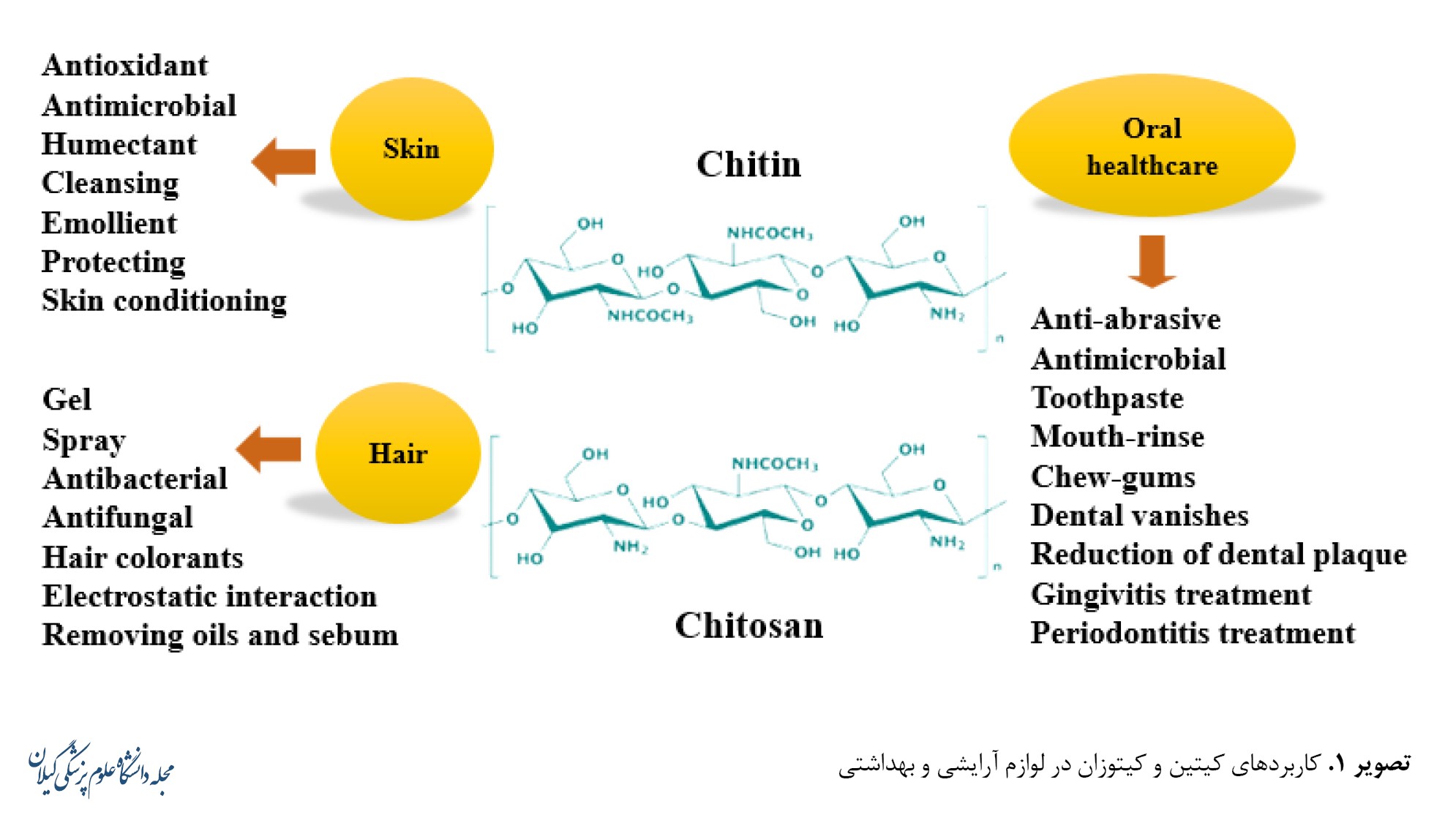
لوازم آرایشی و بهداشتی به موادی گفته میشود که قرار است در تماس با بخشهای مختلف خارجی بدن انسان مانند اپیدرم، مو، ناخن، لب و یا دندانها و غشاهای مخاطی حفره دهان قرار گیرد. این مواد منحصراً یا عمدتاً جهت تمیز کردن، خوشبو کردن، تغییر ظاهر و یا اصلاح و محافظت به کار گرفته میشوند. این لوازم برای استفاده در خارج از بدن در نظر گرفته شدهاند و نمیتوان بهعنوان درمان برای بیماری خاصی آنها را پیشنهاد کرد. کیتین حلالیت کمی دارد و کار کردن با آن دشوار است. برعکس، کیتوزان در محلولهای آبی اسیدی محلول است و بهراحتی میتواند ترکیبات مختلفی مانند ذرات میکرو، نانو، میلی، لایهها، داربستها و الیاف را تولید کند. الیگوساکاریدها و برخی از مشتقات کیتین و کیتوزان در pH فیزیولوژیکی محلول در آب هستند و خواص بهبودیافته یا حتی جدیدی از خود نشان میدهند. هنگام در نظر گرفتن استفاده از کیتین، کیتوزان و مشتقات آن در لوازم آرایشی باید در نظر داشت که این پلیمرها به دلیل خواص خود میتوانند بهعنوان مواد تشکیلدهنده و یا به دلیل ویژگیهای فنی خود بهعنوان حامل سایر مواد عمل کنند [28].
پوست
پیری پوست معمولاً نتیجه پیری ذاتی است که با افزایش سن اتفاق میافتد، همچنین پیری با منشأ بیرونی ناشی از عوامل خارجی، مانند سیگار، اشعه ماورای بنفش، آلودگی هوا و غیره است. خشکی، زبری و شلی بافت پوست، ویژگیهای اصلی پیری پوست و ارتباط آن با قرار گرفتن در معرض اشعه ماورای بنفش یکی از مستندترین دلایل هیپرپیگمانتاسیون است. اخیراً محققان نشان دادهاند چگونه کیتوزان، بهویژه با وزن مولکولی بالا، دارای ویژگیهای ساختن فیلم است که میتواند باعث کاهش از دست دادن آب پوست و افزایش خاصیت ارتجاعی و صافی پوست شود و بنابراین در کاربردهای آرایشی بهعنوان مرطوبکننده به کار گرفته شود [29].
در مطالعهای اثرات ضدپیری ژل مبتنی بر کلاژن، کیتوزان و آلوئهورا، بهعنوان جایگزینی برای پلیمرهای شیمیایی رایج بررسی شد.کیتوزان توانایی القای تکثیر سلولی موضعی و پایداری را بهبود بخشید و در ترکیب با کلاژن باعث افزایش زیستسازگاری، چسبندگی و تکثیر فیبروبلاست پوستی شد که درنهایت جوانسازی و بازسازی پوست را در پی دارد. تمیز کردن پوست به معنای از بین بردن مواد خارجی آلودهکننده از سطح آن است که طی قرار گرفتن در معرض هوای ساده یا استفاده از محصولات آرایشی حاصل میشود. کیتوزان و مشتقات آن، به دلیل ماهیت کاتیونی خود، میتوانند بهعنوان حامل دارای بار مثبت در محصولات برای پاکسازی پوست، استفاده شوند. آنها درواقع میتوانند از جاذبه یونی بین بار خود و ماهیت آنیونی سطح پوست استفاده کنند [30].
مرطوبکنندهها مواد آرایشی هستند که برای افزایش محتوای آب در لایههای بالایی پوست طراحی شدهاند. کیتین و دیگر مشتقات کیتوزان بهعنوان مرطوبکنندههای کاتیونی در محصولات آرایشی بهداشتی به کار گرفته شدهاند. فعالیت این پلیمرهای مرطوبکننده به بار کاتیونی، وزن مولکولی و آبگریزی پلیمر بستگی دارد که درمورد کیتوزان، نمونههای با درجه استیلاسیون و وزن مولکولی پایین، خواص مرطوبکننده بهتری از خود نشان دهند [31].
مو
ساختار پروتئینی در موهای آسیبدیده غیرطبیعی میشود. استفاده از پلیمرهای کاتیونی میتواند به درمان آنها کمک کند. کیتوزان و مشتقات آن در انواع زیادی از محصولات مو مانند شامپوها، فرکنندههای دائمی، رنگکنندهها، لوسیونهای حالتدهنده و اسپریهای مو گنجانده شدهاند. کیتوزان و مشتقات کاتیونی آن توانایی تعامل با کراتین را دارند و لایههای شفاف و الاستیک را روی الیاف مو تشکیل میدهند. این لایهها باعث افزایش نرمی، استحکام و جلوگیری از آسیب مو میشود. ترکیب کیتوزان با اسید هیالورونیک و کلاژن، فیلمهایی تولید کرد که منجر به افزایش ضخامت و بهبود خواص مکانیکی مو با بهبود ظاهر کلی و حالتدهنده مو شد [32].
آلوپسی یک اختلال ژنتیکی و بیماری بسیار شایع است که هم مردان و هم زنان را درگیر میکند. درمان استاندارد آلوپسی ماینوکسیدیل سولفات بهصورت درمان موضعی است. حلالیت ماینوکسیدیل در آب کم است و فرمولاسیونهای موجود در بازار شامل مقادیر زیادی اتانول یا پروپیلن گلیکول است که در استفاده مداوم بسیار تحریککننده هستند. علاوهبراین به دلیل فعالیت ضدفشار خون قوی آن، باید از قرار گرفتن در معرض پوست و اثرات سیستمیک متعاقب آن برای به حداقل رساندن عوارض جانبی آن (مانند لایهلایه شدن پوست، افزایش ضربان قلب، بیحسی یا سوزش دست و پاها و غیره) اجتناب شود. نانوذرات کیتوزان بارگذاریشده با ماینوکسیدیل در مقایسه با یک محلول دارویی، رهایش پایدار و کنترلشده و اجتناب از قرار گرفتن در معرض مستقیم پوست را ایجاد کرد [33].
دهان و دندان
اندامهای داخل حفره دهان، مانند دندانها و لثه باید تحت مراقبت بهداشتی قرار گیرند. از بیماریهای مختلف دندانی میتوان به آنودنتیا (اختلال ژنتیکی عدم وجود مادرزادی دندان)، پوسیدگی دندان (بیماری تحلیلبرنده بافتهای دندان)، ضایعات دندانی (از بین رفتن مواد دندانی به شکلی غیر از پوسیدگی دندان یا ترومای دندان)، بیماری پریودنتال (التهاب بافت دندان) و دندان قروچه (مالیدن دندان در هنگام خواب) و از بیماریهای مربوط به لثه، ژنژیویت (افزایش ضخامت لثه آزاد) و پریودنتیت (عفونت شامل بافتهای نگهدارنده دندان که منجر به از دست دادن چسبندگی لثه میشود) اشاره کرد. از کیتوزان و مشتقات آن در درمان مشکلات دهان ازطریق فرمولاسیون ژلها، خمیر دندان، اسپریها، آدامسها، دهانشویهها و میکروسفرها برای پیشگیری از بیماریهایی مانند موکوزیت دهان، تشکیل پلاک، مشکلات پریودنتال و کنترل رشد باکتریها استفاده میشود [34، 35]. از بین رفتن مواد دندانی ناشی از فرایندهای شیمیایی و مکانیکی که شامل باکتری نمیشود متعلق به فرایند فرسایشی دندان است. در مطالعهای وجود کیتوزان بهعنوان یک غلیظکننده در خمیردندان ضد فرسایش AmF-NaF-SnCl2 برای دندانهای شیری امکان عملکرد پیشگیرانه بهتری را در پوسیدگی فراهم کرد [36]. اندازهگیری اثرات ضدفرسایشی محلولهای کیتوزان فسفریلهشده در عاج گاو در شرایط آزمایشگاهی، با تستهای از دست دادن سطح عاج، سختی سطح و مدول الاستیسیته توسط پروفیلومتری، نانو سختی و میکروسکوپ الکترونی روبشی انجام شد که نشاندهنده عملکرد پیشگیرانه و درمانی کیتوزان در درمان فرسایش دندانی است [37]. پریودنتیت، که با تجمع باکتریها شروع میشود، تخریب ساختارهای دندانی را به دنبال دارد که میتواند منجر به از دست دادن واقعی دندانها شود. این بیماری که با التهاب همراه است، با تجویز داروهای استاتینی، مانند آتورواستاتین قابلدرمان است. برای افزایش کارایی دارو، یک سیستم انتقال بیوچسب مبتنی بر کیتوزان برای تجویز موضعی آتورواستاتین پیشنهاد شد. ویسکوزیته و خواص چسبندگی زیستی مناسب به کاربرد آسان در سطح کیسه پریودنتال و انتشار پایدار دارو کمک میکند. مطالعه آزمایشگاهی با استفاده از سلولهای فیبروبلاست لثه انسان نشان داد انتشار سیتوکین با آتورواستاتین کاهش و در حضور کیتوزان فعالیت ضدالتهابی افزایش مییابد. پس از تجویز، ترمیم استخوان دندان و کاهش سطح سیتوکینهای پیشالتهابی مانند اینترلوکینهای(IL-1β) ،IL-6 IL-8; IL-10 و ضدالتهابی فاکتور رشد تبدیلکننده (TGF) مانندTGF-1 ،TGF-2 و TGF-3در مقایسه با گروه کنترل دیده شد [38]. تصویر شماره 1 به برخی کاربردهای کیتین و کیتوزان در لوازم آرایشی و بهداشتی اشاره دارد.
کیتین پلیمری با زنجیره بلند N-acetylglucosamine مشتق از گلوکز است. کیتین یک موکو پلیساکارید طبیعی با فرمول شیمیایی C8H13NO5 است که به وفور در اسکلت خارجی بندپایان مانند میگو، خرچنگ، کوتیکول حشرات و همچنین گیاهان پست، از قبیل مخمرها یافت میشود. کیتین پلیساکارید نیتروژندار است که سفیدرنگ، سخت، غیرالاستیک و نامحلول در آب، محلولهای غلیظ و محلولهای قلیایی است. کیتین همچنین دارای خواص درمانی اثباتشده و کاربردهای صنعتی است. کیتوزان با فرمول شیمیایی C6H11NO4 به دلیل غیرسمی بودن، امکان تجزیه در طبیعت، سازگاری با محیط زیست، مقرونبهصرفه بودن ازنظر اقتصادی، توانایی حذف محدوده وسیعی از رنگها و فلزات، ساخت سریع و درنهایت امکان تهیه مشتقات فراوان از آن، بسیار مورد توجه است [1]. کیتوزان یک بیوپلیمر طبیعی است که بهعنوان اسکفولد در مهندسی بافت استخوان عمل میکند [2]. کیتوزان شکل deacetylated کیتین [3-6]، عنصر ساختاری است که در اگزواسکلتون سختپوستانی مانند میگو، خرچنگ، کوتیکولهای حشرات و دیواره سلولی قارچها یافت میشود. کیتوزان یک پلیمر طبیعی با ساختار خطی است که از واحدهای تکرارشونده D ـ گلوکز آمین و N ـ استیل ـ D ـ گلوکز آمین تشکیل شده است که این واحدها توسط پیوندهای (1-4)β گلوکوزیدی به هم متصل شدهاند [3، 7، 8] . لیزوزیم آنزیمی است که ازطریق هیدرولیز باندهای گلوکزآمین ـ گلوکزآمین، گلوکزآمین ـ NAG و NAG ـ NAG، کیتوزان را در شرایط برونتنی و درونتنی تخریب میکند [3، 7]. لیزوزیمی که باعث تخریب کیتوزان میشود، در بدن انسان فراگیر است. این آنزیم در غده اشکی، گوش میانی، بینی، برونش و برونشیولها، مغز استخوان و دستگاه گوارش یافت میشود. لیزوزیم نقش مهمی در پاسخ التهابی دارد که توسط ماکروفاژها، مونوسیتها و گرانولوسیتها ترشح میشود [7]. درجه تخریب و وزن مولکولی کیتوزان بهطور معکوس با درجه deacetylation مرتبط است. اگر درجه deacetylation بالا باشد، میزان تخریب پایین است. کیتوزان با همراهی با آنیونها در دیوارههای سلول باکتریایی، دارای خواص ضدمیکروبی است و بنابراین بیوسنتز دیواره سلولی را سرکوب میکند که درنهایت باکتریها را از بین میبرد [3، 7]. کیتوزان به دلیل ماهیت کاتیونی که دارد در تسریع بهبود زخم [3، 4، 7، 8] و فعالیت ضدمیکروبی بسیار مورد استفاده قرار میگیرد. این پلیمر در مهندسی بافت برای تمایز یا ترمیم بافتهای متفاوتی، مانند پوست، استخوان، غضروف، عصب، کبد و ماهیچهها مورد استفاده قرار میگیرد [6]. کیتوزان با فعالسازی و تعدیل سلولهای التهابی، رشد بافت granular را تسهیل میکند و به همین دلیل آن را بهعنوان یک تسریعکننده ترمیم زخم نیز نامیدهاند. کیتوزان همچنین نقش حمایتکنندگی در تکثیر سلولی، تمایز استئوبلاست و مینرالیزاسیون دارد [3]. علت ارجحیت کیتوزان نسبت به کیتین این است که کیتین در محلولهای اسیدی، نامحلول است، اما کیتوزان محلول است [8]. منافذ اسکفولدهای کیتوزان به پارامترهای مختلفی، ازجمله غلظت پلیمر، اتصال متقابل، دمای انجماد و مقدار میکرو یا نانوذرات بستگی دارد [3]. کیتوزان دارای خواص مکانیکی کم تا متوسط است که استفاده از آن را در کاربردهای مختلف محدود میکند. با وجود این، افزودن پلیمرها یا نانوذرات مختلف به آن، باعث افزایش خاصیت مکانیکی آن میشود [3، 7]. کیتوزان به دلیل ماهیت چسبندگی مخاطی و افزایش نفوذ، ماده مناسبی برای تهیه فرمهای تحویلدهنده دهانی، بینی، واژینال و زیرجلدی است و بهعنوان یک افزودنی واکسن برای افزایش bioavailability و immunogenicity آنتیژنها مورد استفاده قرار میگیرد. ژلهای مبتنی بر کیتوزان همچنین دارای ویسکوزیته برای تزریق در پریودنتال هستند. از همه مهمتر، میتوان آنها را بهعنوان یک حامل برای آزادسازی داروهای فعال در محل بیماری استفاده کرد [9]. در مطالعه حاضر بره کاربرد کیتین و کیتوزان در حوزه زیست پزشکی با تأکید بر مهندسی بافت پرداخته خواهد شد.
روشها
گام اول
در این مطالعه جستوجوی مقالات برای یافتن مستندات مرتبط با نگارش مقاله مروری درباره کیتوزان و کاربردهای گسترده آن در پایگاههای داده اسکوپوس، گوگل اسکالر، پابمد، وبآوساینس، ساینس دایرکت انجام شد. از کلیدواژههای chitin و chitosan ،tissue engineering برای این جستوجو استفاده شد. همچنین از سرفصلهای موضوعی پزشکی و عبارتهای همنظیر مناسب با این موضوعـ که توسط 2 پژوهشگر مسلط به روش جستوجوی علمی مشخص شدند ـ بهره گرفته شد. در خصوص کتابها، معیار انتخاب، در دسترس بودن ارتباط موضوعی بود.
گام دوم
مقالات پس از بررسی عنوان، ازنظر ارتباط چکیده با هدف موردنظر ارزیابی شدند و موارد منتخب بهطور کامل مطالعه و نهایی شدند. برای انتخاب مستندات مورداستفاده ابتدا عناوین یافتشده توسط موتور جستوجو ازنظر ارتباط موضوعی بررسی شدند و مطالب یافتشده در 3 گروه درگاه اینترنتی، کتاب و مقاله تقسیم شدند. پس از بررسی این درگاهها، مواردی که کاملتر از بقیه بودند بهعنوان مرجع مورداستفاده، انتخاب شدند.
گام سوم
مقالات چکیده و مقالاتی که روششناسی و تحلیل نامشخص داشتند مورد ارزیابی و مطالعه قرار گرفتند و نتایج بهصورت تحلیلی و روایتی در بخش یافتهها ارائه شد.
جمعآوری اطلاعات
استراتژی جستوجو در پایگاه پابمد: در ابتدا واژههای مورد نظر وارد پایگاه مش شدند و پس از یافتن subheadingهای مربوطه با استفاده از عملگرهای AND و OR ،NOTکلیدواژهها با یکدیگر در فیلد PubMed Search Builder ادغام و جستوجو شدند. پس از آن در صفحه جستوجوی پابمد مطالعات clinical traial و مروری سیستماتیک نیز از فهرست مقالات خارج شدند.
استراتژی جستوجو در پایگاه اسکوپوس: پس ورود به پایگاه اسکوپوس، از قسمت جستوجوی منابع فیلد Documents انتخاب شد و کلیدواژههای بهدستآمده از پایگاه مش در قسمت key word وارد شد و از قسمت مربوطه از عملگرهای AND, OR, AND NOT استفاده شد. کلیدواژههای مذکور در Article title, Abstract, Keywords در جستوجو شدند. جهت محدودسازی جستوجو از فیلد limit، مطالعات clinical traial و مروری سیستماتیک از فهرست جستوجو خارج شدند.
استراتژی جستوجو در پایگاه وب آو سانیس: پس از ورود به پایگاه وب آو سانیس، فیلد جستوجوی مقالات و Advance search انتخاب شد. سپس جهت محدودسازی جستوجو از قسمت Select a database گزینه Web of Science Core Collection انتخاب شد. فیلد جستوجو بر روی Topic گذاشته شد و زبان انگلیسی انتخاب شد. با استفاده از عملگرهای AND و OR ،NOT واژگان ترکیب و مقالات جستوجو شدند.
استراتژی جستوجو در پایگاه ساینس دایرکت: پس از وارد پایگاه ساینس دایرکت از قسمت Refine publications by نوع فیلد جستوجو و از قسمت Publication type فیلد journal انتخاب شد. درنهایت کلیدواژههای انتخابشده جستوجو شدند. همچنین از قسمت advanced search نوع روش مطالعه و جستوجو در عنوان و چکیده مقالات انتخاب شد.
استراتژی جستوجو در پایگاه گوگل اسکالر: پس از ورود به پایگاه گوگل اسکالر کلید واژههای موردنظر با استفاده از عملگرهای AND و OR ،NOTادغام شدند و از قسمت Advanced search فیلد with all of the words انتخاب و از فیلدwhere my words occur گزینه anywhere in the article انتخاب و جستوجو انجام شد.
یافتهها
کاربردهای کیتین و کیتوزان
همانطور که ذکر شد کیتوزان یک آمینوپلیساکارید و دومین پلیمر طبیعی پرمصرف است. در مطالعات گستردهای به خواص غیرسمی، زیستسازگاری و زیستتخریبپذیری آن اشاره شده است [10]. این مزایا آن را به مادهای ایدئال برای تهیه هیدروژلهای کاربردی تبدیل میکند که میتواند بهعنوان پانسمان زخم عمل کند. علاوهبراین کیتوزان به دلیل دارا بودن گروههای آمینه و هیدروکسیل دارای خواص ذاتی مهمی، مانند چسبندگی مخاطی، خاصیت ضدمیکروبی، ضدقارچی، خاصیت رهایش کنترلشده دارو همراه با خواص مکانیکی و حرارتی عالی، آبدوستی، سهولت اصلاح سطح، میل ترکیبی زیاد برای فلزات، رنگها و پروتئینها همراه با توانایی ایجاد پلی کاتیون در محیط اسیدی و توانایی تشکیل فیلم و غیره است. این ویژگیها آنها را برای استفاده در پزشکی و داروسازی در صنایع مختلف در حفاظت محیط زیست، فرایندهای تصفیه آب و انواع مختلف فرایندهای جداسازی و غیره ممکن کرده است [11، 12]. نامحلول بودن کیتوزان در آب و اکثر حلالهای شیمیایی استفاده از آن را در بسیاری از زمینهها محدود کرده است. اصلاح شیمیایی کیتوزان منجر به افزایش خواص فیزیکوشیمیایی آن شده و کاربردهای متنوع آن را گسترش میدهد [13، 14]. با وجود این، خواص مذکور به وزن مولکولی و درجه استیلاسیون کیتوزان بستگی دارد. مطالعات حاکی از این است که حضور گروه آمینه پروتونپذیر در D ـ گلوکزامین امکان بیشتری را به خواص کیتوزان اضافه میکند. بهعنوان مثال، چسبندگی مخاطی کیتوزان را میتوان با وجود باقی ماندههای دارای بار منفی (اسید سیالیک) در موسین ـ گلیکوپروتئینی که موجب تشکیل موکوس میشود، توضیح داد. در محیط اسیدی، گروههای آمینه کیتوزان دارای بار مثبت هستند و بنابراین میتوانند با موسین تعامل و ارتباط برقرار کنند. چسبندگی موکوس مستقیماً با D کیتوزان مرتبط است: درواقع، اگر کیتوزان D افزایش یابد، تعداد بارهای مثبت نیز افزایش مییابد که منجر به بهبود خواص موکوسی میشود [15، 16]. فعالیت هموستاتیک کیتوزان به دلیل به وجود بارهای مثبت بر روی کیتوزان است. درواقع، غشای گلبولهای قرمز خون دارای بار منفی هستند و بنابراین میتوانند با کیتوزان با بار مثبت تعامل کنند. علاوهبراین کیتین فعالیت هموستاتیک کمتری نسبت به کیتوزان نشان میدهد که این توضیح را تأیید میکند [17-19]. به دلیل بارهای مثبت، کیتوزان بخش منفی غشای سلولی میتواند با این ماده تعامل داشته باشد، که این مورد میتواند منجر به سازماندهی مجدد و باز شدن اتصالات محکم پروتئینی غشای سلولی و افزایش نفوذ این پلیساکارید شود. درمورد چسبندگی موکوسی، اگر D کیتوزان افزایش یابد، توانایی نفوذ نیز افزایش مییابد [20]. ویژگی چند کاتیونی کیتوزان، امکان توضیح اثرات ضددرد کیتوزان را به وجود میآورد. درواقع، گروههای آمینه D ـ گلوکزامین میتوانند در حضور یونهای پروتونی که در ناحیه التهابی آزاد میشوند، واکنش داده و پروتونه شوند و درنتیجه اثر ضددردی ایجاد کنند [21]. در طول ساخت داربستهای قابلکاشت باید توجه ویژهای به سازگاری بدن، خواص مکانیکی، مورفولوژی و تخلخل داربست و همچنین ظرفیت ترمیم و جایگزینی بافت شود. باتوجهبه خواص قابلتوجه مذکور، کیتوزان بهعنوان یک ماده مناسب برای تهیه چنین بیوموادهایی به نظر میرسد که میتواند جایگزین بافت و اندام ازدسترفته یا آسیبدیده شود و به سلول اجازه اتصال و تکثیر را بدهد [22، 23]. کیتوزان بهعنوان هیدروژل بیوماده جالبی است، زیرا میتواند آب بالایی را در خود نگه دارد. محتوای آب بالای آن باعث سازگاری با اکثر بافتهای زنده میشود و علاوهبراین، نرم و قابل خم شدن است که آسیب به بافت اطراف را در حین و پس از پیوند در بیمار به حداقل میرساند. همچنین خواص مکانیکی هیدروژلی کیتوزان شبیه به بافتهای نرم بدن است که اجازه میدهد ویژگیهای عملکردی و مورفولوژیکی بافتی که باید ترمیم شود را تأمین کند [24]. به همین دلیل است که کیتوزانها اغلب بهعنوان داربستهای زیست پزشکی برای جایگزینی بافت و همچنین برای سایر کاربردهای زیست پزشکی، مانند انتقال دارو و فاکتور رشد و غیره استفاده میشوند [25-27]. در ادامه به تفصیل به کاربردهای کیتوزان اشاره شده است.
مواد آرایشی و بهداشتی
لوازم آرایشی و بهداشتی به موادی گفته میشود که قرار است در تماس با بخشهای مختلف خارجی بدن انسان مانند اپیدرم، مو، ناخن، لب و یا دندانها و غشاهای مخاطی حفره دهان قرار گیرد. این مواد منحصراً یا عمدتاً جهت تمیز کردن، خوشبو کردن، تغییر ظاهر و یا اصلاح و محافظت به کار گرفته میشوند. این لوازم برای استفاده در خارج از بدن در نظر گرفته شدهاند و نمیتوان بهعنوان درمان برای بیماری خاصی آنها را پیشنهاد کرد. کیتین حلالیت کمی دارد و کار کردن با آن دشوار است. برعکس، کیتوزان در محلولهای آبی اسیدی محلول است و بهراحتی میتواند ترکیبات مختلفی مانند ذرات میکرو، نانو، میلی، لایهها، داربستها و الیاف را تولید کند. الیگوساکاریدها و برخی از مشتقات کیتین و کیتوزان در pH فیزیولوژیکی محلول در آب هستند و خواص بهبودیافته یا حتی جدیدی از خود نشان میدهند. هنگام در نظر گرفتن استفاده از کیتین، کیتوزان و مشتقات آن در لوازم آرایشی باید در نظر داشت که این پلیمرها به دلیل خواص خود میتوانند بهعنوان مواد تشکیلدهنده و یا به دلیل ویژگیهای فنی خود بهعنوان حامل سایر مواد عمل کنند [28].
پوست
پیری پوست معمولاً نتیجه پیری ذاتی است که با افزایش سن اتفاق میافتد، همچنین پیری با منشأ بیرونی ناشی از عوامل خارجی، مانند سیگار، اشعه ماورای بنفش، آلودگی هوا و غیره است. خشکی، زبری و شلی بافت پوست، ویژگیهای اصلی پیری پوست و ارتباط آن با قرار گرفتن در معرض اشعه ماورای بنفش یکی از مستندترین دلایل هیپرپیگمانتاسیون است. اخیراً محققان نشان دادهاند چگونه کیتوزان، بهویژه با وزن مولکولی بالا، دارای ویژگیهای ساختن فیلم است که میتواند باعث کاهش از دست دادن آب پوست و افزایش خاصیت ارتجاعی و صافی پوست شود و بنابراین در کاربردهای آرایشی بهعنوان مرطوبکننده به کار گرفته شود [29].
در مطالعهای اثرات ضدپیری ژل مبتنی بر کلاژن، کیتوزان و آلوئهورا، بهعنوان جایگزینی برای پلیمرهای شیمیایی رایج بررسی شد.کیتوزان توانایی القای تکثیر سلولی موضعی و پایداری را بهبود بخشید و در ترکیب با کلاژن باعث افزایش زیستسازگاری، چسبندگی و تکثیر فیبروبلاست پوستی شد که درنهایت جوانسازی و بازسازی پوست را در پی دارد. تمیز کردن پوست به معنای از بین بردن مواد خارجی آلودهکننده از سطح آن است که طی قرار گرفتن در معرض هوای ساده یا استفاده از محصولات آرایشی حاصل میشود. کیتوزان و مشتقات آن، به دلیل ماهیت کاتیونی خود، میتوانند بهعنوان حامل دارای بار مثبت در محصولات برای پاکسازی پوست، استفاده شوند. آنها درواقع میتوانند از جاذبه یونی بین بار خود و ماهیت آنیونی سطح پوست استفاده کنند [30].
مرطوبکنندهها مواد آرایشی هستند که برای افزایش محتوای آب در لایههای بالایی پوست طراحی شدهاند. کیتین و دیگر مشتقات کیتوزان بهعنوان مرطوبکنندههای کاتیونی در محصولات آرایشی بهداشتی به کار گرفته شدهاند. فعالیت این پلیمرهای مرطوبکننده به بار کاتیونی، وزن مولکولی و آبگریزی پلیمر بستگی دارد که درمورد کیتوزان، نمونههای با درجه استیلاسیون و وزن مولکولی پایین، خواص مرطوبکننده بهتری از خود نشان دهند [31].
مو
ساختار پروتئینی در موهای آسیبدیده غیرطبیعی میشود. استفاده از پلیمرهای کاتیونی میتواند به درمان آنها کمک کند. کیتوزان و مشتقات آن در انواع زیادی از محصولات مو مانند شامپوها، فرکنندههای دائمی، رنگکنندهها، لوسیونهای حالتدهنده و اسپریهای مو گنجانده شدهاند. کیتوزان و مشتقات کاتیونی آن توانایی تعامل با کراتین را دارند و لایههای شفاف و الاستیک را روی الیاف مو تشکیل میدهند. این لایهها باعث افزایش نرمی، استحکام و جلوگیری از آسیب مو میشود. ترکیب کیتوزان با اسید هیالورونیک و کلاژن، فیلمهایی تولید کرد که منجر به افزایش ضخامت و بهبود خواص مکانیکی مو با بهبود ظاهر کلی و حالتدهنده مو شد [32].
آلوپسی یک اختلال ژنتیکی و بیماری بسیار شایع است که هم مردان و هم زنان را درگیر میکند. درمان استاندارد آلوپسی ماینوکسیدیل سولفات بهصورت درمان موضعی است. حلالیت ماینوکسیدیل در آب کم است و فرمولاسیونهای موجود در بازار شامل مقادیر زیادی اتانول یا پروپیلن گلیکول است که در استفاده مداوم بسیار تحریککننده هستند. علاوهبراین به دلیل فعالیت ضدفشار خون قوی آن، باید از قرار گرفتن در معرض پوست و اثرات سیستمیک متعاقب آن برای به حداقل رساندن عوارض جانبی آن (مانند لایهلایه شدن پوست، افزایش ضربان قلب، بیحسی یا سوزش دست و پاها و غیره) اجتناب شود. نانوذرات کیتوزان بارگذاریشده با ماینوکسیدیل در مقایسه با یک محلول دارویی، رهایش پایدار و کنترلشده و اجتناب از قرار گرفتن در معرض مستقیم پوست را ایجاد کرد [33].
دهان و دندان
اندامهای داخل حفره دهان، مانند دندانها و لثه باید تحت مراقبت بهداشتی قرار گیرند. از بیماریهای مختلف دندانی میتوان به آنودنتیا (اختلال ژنتیکی عدم وجود مادرزادی دندان)، پوسیدگی دندان (بیماری تحلیلبرنده بافتهای دندان)، ضایعات دندانی (از بین رفتن مواد دندانی به شکلی غیر از پوسیدگی دندان یا ترومای دندان)، بیماری پریودنتال (التهاب بافت دندان) و دندان قروچه (مالیدن دندان در هنگام خواب) و از بیماریهای مربوط به لثه، ژنژیویت (افزایش ضخامت لثه آزاد) و پریودنتیت (عفونت شامل بافتهای نگهدارنده دندان که منجر به از دست دادن چسبندگی لثه میشود) اشاره کرد. از کیتوزان و مشتقات آن در درمان مشکلات دهان ازطریق فرمولاسیون ژلها، خمیر دندان، اسپریها، آدامسها، دهانشویهها و میکروسفرها برای پیشگیری از بیماریهایی مانند موکوزیت دهان، تشکیل پلاک، مشکلات پریودنتال و کنترل رشد باکتریها استفاده میشود [34، 35]. از بین رفتن مواد دندانی ناشی از فرایندهای شیمیایی و مکانیکی که شامل باکتری نمیشود متعلق به فرایند فرسایشی دندان است. در مطالعهای وجود کیتوزان بهعنوان یک غلیظکننده در خمیردندان ضد فرسایش AmF-NaF-SnCl2 برای دندانهای شیری امکان عملکرد پیشگیرانه بهتری را در پوسیدگی فراهم کرد [36]. اندازهگیری اثرات ضدفرسایشی محلولهای کیتوزان فسفریلهشده در عاج گاو در شرایط آزمایشگاهی، با تستهای از دست دادن سطح عاج، سختی سطح و مدول الاستیسیته توسط پروفیلومتری، نانو سختی و میکروسکوپ الکترونی روبشی انجام شد که نشاندهنده عملکرد پیشگیرانه و درمانی کیتوزان در درمان فرسایش دندانی است [37]. پریودنتیت، که با تجمع باکتریها شروع میشود، تخریب ساختارهای دندانی را به دنبال دارد که میتواند منجر به از دست دادن واقعی دندانها شود. این بیماری که با التهاب همراه است، با تجویز داروهای استاتینی، مانند آتورواستاتین قابلدرمان است. برای افزایش کارایی دارو، یک سیستم انتقال بیوچسب مبتنی بر کیتوزان برای تجویز موضعی آتورواستاتین پیشنهاد شد. ویسکوزیته و خواص چسبندگی زیستی مناسب به کاربرد آسان در سطح کیسه پریودنتال و انتشار پایدار دارو کمک میکند. مطالعه آزمایشگاهی با استفاده از سلولهای فیبروبلاست لثه انسان نشان داد انتشار سیتوکین با آتورواستاتین کاهش و در حضور کیتوزان فعالیت ضدالتهابی افزایش مییابد. پس از تجویز، ترمیم استخوان دندان و کاهش سطح سیتوکینهای پیشالتهابی مانند اینترلوکینهای(IL-1β) ،IL-6 IL-8; IL-10 و ضدالتهابی فاکتور رشد تبدیلکننده (TGF) مانندTGF-1 ،TGF-2 و TGF-3در مقایسه با گروه کنترل دیده شد [38]. تصویر شماره 1 به برخی کاربردهای کیتین و کیتوزان در لوازم آرایشی و بهداشتی اشاره دارد.
فعالیتهای ضدمیکروبی
عفونتهای باکتریایی همیشه یک مشکل جدی برای سلامت عمومی است. کیتین و کیتوزان به دلیل ماهیت کاتیونی خود دارای خواص ضد باکتریایی هستند [39]. اخیراً فعالیت ضدباکتریایی کیتین / کیتوزان و مشتقات آنها توجه زیادی را به خود جلب کرده است. بهویژه، کیتوزان و مشتقات آن برای کاربردهای ضدمیکروبی متعددی مورد بررسی قرار گرفتهاند [40]. اثر ضدباکتریایی کیتوزان بیشتر از کیتین بوده که به دلیل تعدادی آمین با بار مثبت است که با لیپیدها، پروتئینها و کربوهیدراتهای دارای بار منفی موجود در سطح سلول باکتری، پیوند الکترواستاتیکی ساخته و از رشد باکتریها جلوگیری میکند. علاوهبراین، کیتوزان نسبت به کیتین محلولتر است (مقدار pH زیر 6) و فعالیت ضدباکتریایی بهتری نسبت به کیتین دارد [41].
بهطور کل فعالیت ضد باکتریایی کیتوزان به درجه استیلزدایی، وزن مولکولی، pH محیط، ویژگی آبدوست / آبگریز، حلالیت، دما و غیره بستگی دارد [42]. 2 مکانیسم اصلی برای خواص ضدباکتریایی کیتوزان در نظر گرفته شده است. مورد اول به دلیل نفوذ کیتوزان به داخل سلول باکتری و مهار سنتز RNA و پروتئین است و مورد دوم به دلیل تعامل گروههای کاتیونی کیتوزان با گروههای آنیونی غشای سلولی باکتری است که افزایش تعداد بار مثبت کیتوزان به شکل NH3+ باعث میشود که آن را قویتر به دیواره سلولی باکتری متصل کرده و این واکنشها باعث تشکیل یک لایه غیرقابلنفوذ در اطراف سلول شده و از انتقال املاح حیاتی جلوگیری کند [43]. مطالعات آنتیباکتریالی بر روی چند نوع باکتری از داربست حاوی کیتوزان بر روی باکتریهای اشرشیاکلی کلبسیلا پنومونیه، باسیلوس سابتلیس و استافیلوکوکوس اورئوس با روش انتشار انجام شده است. وجود کیتوزان درون داربست بر میزان رشد تمامی این باکتریها تأثیر ضدباکتریایی داشته و رشد آنها را بهطور قابلتوجهی کم کرده است [44]. همانطور که گفته شد کیتوزان ازطریق برهمکنشهای الکتروتروستاتیک با فسفولیپیدهای دارای بار منفی، بر غشای سلولی تأثیر میگذارد و درنتیجه تغییر نفوذپذیری در غشای سلول موجب تغییر در بیان RNA و کاهش فعالیت DNA میشود [45]. بااینحال برای قارچهای مقاوم به کیتوزان، به نظر میرسد کیتوزان قادر به نفوذپذیری غشای سلولی نیست و در سطح بیرونی باقی میماند و موارد ذکرشده درمورد این نوع از میکرو ارگانیسمها صدق نمیکند [46]. به دلیل تفاوت در سیالیت غشای سلولی قارچهای مقاوم به کیتوزان، اجازه نفوذ کیتوزان به غشای سلولی را نداده و این ماده نمیتواند فعالیت این نوع قارچها را برهم زند و درنتیجه مقاومت به کیتوزان در این نوع از میکروارگانیسمها دیده میشود. مطالعه ترکیب اسیدهای چرب فسفولیپید غشای سلولی قارچهای حساس و مقاوم به کیتوزان نشان داده است افزایش فعالیت کیتوزان به اسیدهای چرب غیراشباع در غشای سلولی مرتبط است و مطالعات نشان دادهاند فعالیت ضدمیکروبی کیتوزان در برابر گونه جهشیافته N. crassa با کاهش مقدار اسیدهای چرب غیراشباع منجر به کاهش فعالیت ضدمیکروبی کیتوزان در مقایسه با نوع وحشی N. crassa میشود [45]. به این ترتیب سیالیت غشا بر فعالیت کیتوزان تأثیر میگذارد و نحوه عملکرد تا حد زیادی به نوع قارچ بستگی دارد.
ظاهراً قارچهای مقاوم به کیتوزان و حساس به کیتوزان از خانواده متفاوتی هستند [45]. طبقهبندی براساس ترکیب اسیدهای چرب ثابت کرده است که ابزاری قوی برای طبقهبندی این نوع از میکروارگانیسمها وجود دارد [47]. همچنین نشان داده شده که جذب کیتوزان توسط سلول برای قارچهای حساس به کیتوزان به ATP وابسته است. به این منظور مصرف کیتوزان در دمای 4 درجه سانتیگراد و یا در حضور آزید بررسی و ثابت شده است که در هر دو گروه، تولید ATP مهار شده و در هر دو مورد کیتوزان قادر به عبور از غشای پلاسمایی نبود و در دمای اتاق و در غیاب آزید، جذب کیتوزان در کمتر از 30 دقیقه قابلمشاهده شده است [48].
در باکتریهای گرم مثبت، کیتوزان بهصورت غیر کووالانسی با اسید تیکوئیک موجود در لایه پپتیدوگلیکان اتصال برقرار میکند [49]. اسیدهای تیکوئیک قرار گرفته در سطح غشای سلول برای تقسیم سلولی و دیگر جنبههای اساسی فیزیولوژی باکتریایی گرم مثبت مهم هستند [50]. با وجود این، در بین دانشمندان اختلاف نظراتی نیز وجود دارد و تأثیر کیتوزان بر غشای سلولی هنوز نامشخص است. برخی از گروههای تحقیقاتی معتقدند بعید است کیتوزان بر غشای سلولی تأثیر بگذارد، زیرا قطر هیدرودینامیکی کیتوزان بزرگتر از منافذ مورد انتظار در ساختار پپتیدوگلیکان است [49]. بااینحال کیتوزان با وزن مولکولی کمتر از 5 کیلو دالتون، با مسدود کردن سنتز DNA فعالیت خود رانشان میدهد [51]. باتوجهبه این موضوع وزن مولکولی عامل مهمی است که میتواند بر نحوه عملکرد کیتوزان و نفوذپذیری آن ازطریق غشای سلولی تأثیر بگذارد. تیکوئیک اسید نسبت به فعالیت کیتوزان با آزمایش گونههای جهشیافته استافیلوکوکوس اورئوس که فاقد یک یا چند ژن دخیل در بیوسنتز اسید تیکوئیک هستند، در گونههای جهشیافته استافیلوکوکوس اورئوس نسبت به نوع وحشی مقاومت بیشتری دارد که نشان میدهد تیکوئیک اسیدهای پلی آنیونی برای بهبود فعالیت ضدباکتریایی کیتوزان نسبت به باکتریهای گرم مثبت موردنیاز است [49]. درمورد باکتریهای گرم منفی 2 مکانیسم در غشای باکتری مد نظر است که اولی مرتبط با درجه شیلاته شدن کیتوزان بوده و به میزان اختلاف PH با PKa بستگی دارد [52، 53]. بنابراین، این موضوع میتواند منجر به اختلال در یکپارچگی دیواره سلولی شده و جذب مواد مغذی مهم (Ca ،Mg و غیره) را مختل کند [53، 54]. دومی به برهمکنش الکترواستاتیک کیتوزان و بخشهای آنیونی لیپوپلیساکارید در غشای خارجی مرتبط است [55، 56]. مطالعات اخیر نشان داد کیتوزان غشای داخلی را مختل میکند و منجر به نشت مواد داخل سلولی میشود و همچنین دیده شده که کیتوزان میتواند از غشای سلولی باکتریهای گرم منفی عبور کند [57]. ممکن است کیتوزان با سنتز DNA/RNA تداخل داشته باشد و باعث ایجاد پاسخهای درونسلولی در داخل سلول شود. بهطورکلی کیتوزان میتواند بهعنوان یک عامل ضدمیکروبی در برابر انواع مختلف قارچها و باکتریها استفاده شود. بااینحال، فعالیت کیتوزان تحت تأثیر عوامل بسیاری است و نحوه عملکرد آن نیز میتواند تحت تأثیر این عوامل قرار گیرد. بهطورکلی، کیتوزان بیشتر در سطح سلول فعال است. بسته به نوع میکروارگانیسم و وزن مولکولی، فعالیتهای ضدمیکروبی دیگری، مانند مهار سنتز DNA/RNA یا اختلال در سنتز پروتئین را میتواند ایجاد کند.
فعالیتهای ضدتوموری
مشتقات بهدستآمده از منابع دریایی دارای انواع فعالیتهای بیولوژیکی، ازجمله خاصیت آنتیاکسیدانی و ضدتوموری هستند [58]. بااینحال استفاده کیتوزان به دلیل حلالیت ضعیف در آب، ویسکوزیته بالا و سایر مشکلات با محدودیت مواجه شده است. برای حل این معضل، محققان به استفاده از الیگوساکاریدهای کیتوزان که ازنظر عملکردی ویژگیهای بهتری از خود نشان دادهاند، روی آوردند. الیگوساکاریدهای کیتوزان با 2 گروه فعال آمینو و هیدروکسیل میتوانند مشتقات مختلفی را تشکیل داده و در فعالیتهای ضدتوموری نقش مؤثری ایفا کنند. در حال حاضر، تحقیقات مربوط به ویژگیهای ضدتوموری الیگوساکاریدهای کیتوزان عمدتاً بر اصلاح شیمیایی الیگوساکاریدهای کیتوزان برای بهبود فعالیت ضدتوموری آنها و استفاده از مشتقاتشان بهعنوان حاملهای دارویی برای حملونقل هدفمند داروهای ضدتومور متمرکز است. فعالیت ضدتوموری الیگوساکاریدهای کیتوزان به خواص فیزیکی و شیمیایی آنها ازجمله وزن مولکولی، درجه پلیمریزاسیون، درجه استیلاسیون، توزیع بار و اصلاح شیمیایی مربوط میشود. برای بررسی فعالیت ضد توموری الیگوساکاریدهای کیتوزان، علاوه بر گروههای عاملی روی حلقه پیرانوز، ازجمله گروههای آمینو و استیل آمینو، باید تأثیر وزن مولکولی نیز در نظر گرفته شود [59]. رونگ هوا هوانگ و همکاران گزارش کردند که مشتقات الیگوساکاریدهای کیتوزان با بار بالا، بهطور قابلتوجهی توانایی بقای سلولهای تومور را کاهش میدهند و با القای نکروز در سلولهای تومور در این فرایند نقش دارند. بنابراین فعالیت ضدتوموری الیگوساکاریدی کیتوزان ارتباط نزدیکی با شدت بار مثبت دارد. هنگامی که DD از الیگوساکاریدهای کیتوزان در زنجیره قند افزایش مییابد، بار مثبت هم افزایش یافته و به دنبال آن تعامل با سلولهای توموری زیاد میشود. بهعبارتدیگر، هنگامی که چگالی بار مثبت روی حلقه پیرانوز تغییر میکند، فعالیت ضدتوموری الیگوساکاریدهای کیتوزان بهبود مییابد [60]. کربوکسی متیل الیگوساکاریدهای کیتوزان نیز فعالیت ضدتوموری را بر روی سلولهای BEL-7402 (کارسینومای کبد) در شرایط آزمایشگاهی و سلولهای H22 (سارکوما) در داخل بدن ازطریق مکانیسمهای متعدد، ازجمله مهار تکثیر، افزایش شاخص ایمنی، القای آپوپتوز و نکروز سلولی اعمال کردند، درحالیکه این ترکیبات هیچ اثر سمی بر سلولهای L-02 در کبد طبیعی و سایر اندامها نداشتند [61].
حلالیت کیتوزان محلول در آب و انواع مشتقات آن، باعث شده است این ترکیبات با خاصیت آنتیاکسیدانی بهعنوان کاندیدای بالقوهای در مطالعات ضدتوموری معرفی شوند. گونههای فعال اکسیژن میتوانند با اتمهای هیدروژن فعال موجود در هیدروکسیل یا آمینو کیتوزان واکنش دهند تا یک رادیکال ماکرومولکولی کاملاً قوی تشکیل دهند. کیتوزان با کاربرد در برنامههای غذایی هم توانسته در این صنعت موفقیتآمیز عمل کند. کیتوزان برای افزایش ماندگاری نان با استفاده از به تعویق انداختن تخریب نشاسته و یا ازطریق مهار افزایش میکروبی نقش دارد. سطح خمیر با کیتوزان 0/5، 1 و 1/5 درصد در اسید استیک 1 درصد با استفاده از قلممو آستر شد. باگت پوشش دادهشده با کیتوزان، بهویژه با 1 درصد، کاهش وزن، سختی و تخریب کمتری را نسبت به نمونه شاهد در دوره نگهداری به مدت 36 ساعت در دمای 25 درجه سانتیگراد نشان داد [62]. مشکلات متعددی در برخی از مراحل نگهداری تخممرغها رخ میدهد، ازجمله کاهش وزن، خرابی و عفونت میکروبی. کیتوزان با خاصیت تشکیل فیلم میتواند یک سد محافظ برای انتقال رطوبت و سوخت از آلبومین ازطریق پوسته تخم مرغ ایجاد کند و درنتیجه ماندگاری تخمها را افزایش میدهد [63]. تلفات اساسی میوه پس از برداشت به دلیل آلودگی قارچی، مسائل فیزیولوژیکی و حوادث فیزیکی است. یکی از تاکتیکها برای افزایش قابلیت نگهداری این مواد فاسدشدنی، استفاده از پوششهای ایمن همراه با استفاده از انبار سرد است. پوشش کیتوزان برای تنظیم محیط داخلی بدون ایجاد تنفس بیهوازی امکان پذیر است، زیرا لایههای کیتوزان بهطور انتخابی به O2 نفوذپذیرتر از CO2 هستند. بنابراین پوشش کیتوزان با توانایی خود در تغییر اکوسیستم درون بافت و متعلقات قارچی، پتانسیل افزایش عمر ذخیرهسازی و مدیریت پوسیدگی را دارد [64]. جدول شماره 1 به این ویژگیها اشاره دارد.

نانوذرات مبتنی بر کیتوزان به دلیل ساختار خاص و خصوصیات فیزیکوشیمیایی بسیار مورد توجه قرار گرفته اند. کربوکسی متیل کیتوزان همچنین میتواند در درمان بیشتر سرطانها استفاده شود. تأثیر ضد توموری نانوذرات N ـ سوکسینیل کیتوزان بر روی سلولهای K562 (لوکمی) مورد بررسی قرار گرفت. نانوذرات از تکثیر سلولهای K562 با IC50 26/ 14 میکروگرم بر میلیلیتر جلوگیری کردند. تحقیقات سیتومورفولوژی شامل میکروسکوپ الکترونی عبوری، سنجش فلورسانس و تجزیهوتحلیل قطعهقطعه شدن DNA، نشان داد کیتوزان با القای آپوپتوز و نکروز بر سلولهای مذکور اثر ضدتوموری دارد [65].
مهندسی بافت
مهندسی بافت حوزهای پیشرفته از پزشکی ترمیمی و بازساختی است که از زمینه بیومواد پدید آمده است. اساساً این تکنیک با ترکیب سلولها، مولکولهای فعال بیولوژیکی و داربستها، عملکرد بافت یا اندام آسیبدیده را بهبود میبخشد ترمیم و حفظ میکند. هدف مهندسی بافت گرد هم آوردن ساختارهای عملکردی است که حمایت بیولوژیکی از بافت / اندام آسیبدیده برای ترمیم و بازسازی مناسب آن را فراهم میکند [66، 67]. استفاده از کامپوزیتهای پلیمری در درمان آسیبهای بافتی توجه زیادی را در بالین به خود جلب کرده است که دانشمندان را وادار به بهبود روشهای طراحی پلیمرهای زیستی بهمنظور دستیابی به سیستمی کارآمد برای ترمیم کامل بافت آسیبدیده کرده است. در مهندسی بافت، بیومتریال بهعنوان یک ماتریکس خارجسلولی برای سلول عمل میکند و به اتصال، تکثیر و تمایز سلولهای زنده کشت دادهشده کمک میکند [68]. بنابراین یکی از راههای مهم انتخاب بیومواد برای مهندسی بافت نهتنها باید انتقال فعال جمعیت سلولی و عوامل درمانی باشد و بازسازی را ارتقا بخشد، بلکه باید داربستی باشد که استحکام مکانیکی کافی برای بافت هدف را فراهم کند. علاوهبراین در حالت ایدئال، ماده باید در محل پیوند با سرعت قابلقبولی در مقایسه با رشد بافت تخریب شود [69]. کیتوزان یک ماده بیولوژیکی است و دومین پلیمر فراوان پس از سلولز است. این ماده پلیمر کاتیونی است که از کیتین با فرایند استیلزدایی نسبی به دست آمده و کاندیدی مناسب برای کاربردهای مهندسی بافت براساس ویژگیهایی مانند زیستسازگاری، غیرسمی و زیستتخریبپذیری همراه با فعالیت هموستاتیک و خونسازگار است که خواص بیولوژیکی آن مانند ضدمیکروبی، آنتیاکسیدانی، ضدسرطانی و ضدالتهابی بودن ثابت شده است [70]. در مطالعات مختلف گزارش شده که کیتوزان، به دلیل گروههای عملکردی آن، میتواند بهراحتی با سایر مولکولهای زیستفعال اصلاح شود تا خواص بیشتری به ساختار بافت بدهد. علاوهبراین مولکولهای کیتوزان رشد و تکثیر سلولهای سهبعدی را تسهیل کرده و همچنین رسوب کلاژن را سازماندهی میکنند و درنتیجه بهبودی سریع را تضمین میکند [71]. تا به امروز معمولاً از غشاها / فیلم، هیدروژل، اسفنج و اشکال رشتهمانند کیتوزان برای ترمیم زخم و یا سایر کاربردهای مهندسی بافت استفاده شده است (تصویر شماره 2) [72، 73].
از کیتوزان بهصورت اسفنج نیز تا به امروز استفاده شده است. اسفنجهای کیتوزان عمدتاً بهعنوان مواد التیامدهنده زخم استفاده میشوند، زیرا میتوانند ترشحات زخم را جذب کنند و درعینحال به بازسازی بافت کمک کنند. اسفنجهای کیتوزان همچنین در مهندسی بافت استخوان نیز بهعنوان ماده پرکننده کاربرد دارند [7]. اسفنجهای کیتوزانی عمدتاً با روش خشک کردن انجمادی (لیوفیلیزاسیون) ساخته میشوند، روشی که با تصعید حلال، محلول اولیه را از بین برده و از خود اسفنج کیتوزانی متخلخلی را به جا میگذارد. همچنین در این نوع روش ساخت میتوان بهراحتی انواع کامپوزیتهای حاوی ترکیبات کلسیمی را به وجود آورد که بیشتر در ترمیم استخوان به کار گرفته شده است [26، 74]. در پانسمان زخم، الزامات خاصی باید برآورده شود تا به کارایی موردنظر بهعنوان زخمپوش رسید. پانسمان زخم باید غیرسمی و غیرحساسیتزا باشد، اجازه تبادل گاز را بدهد، محیط را مرطوب نگه دارد، زخم را در برابر میکروبها محافظت کند و ترشحات زخم را جذب کند [72]. همانطور که ذکر شد، اسفنجهای کیتوزانی بهخوبی با این نیازها جهت ترمیم زخم پوستی مطابقت دارند. با وجود این جهت ترمیم بافت پوستی، داربستهای دوبعدی بیشتر مورد استفاده قرار میگیرند و جهت تهیه فیلمهای متخلخل و سایر داربستها از کیتوزان به روش ریختهگری استفاده میشود که این نوع از مواد تهیهشده را میتوان بهراحتی به کمک مادون قرمز و یا آون خشک کرد. بهعنوان مثال، بانداژ HemCon® یک داربست مهندسیشده کیتوزان استات است که بهعنوان یک پانسمان هموستاتیک طراحی شده است و به این روش تهیه میشود [72]. برای تولید الیاف از کیتوزان در مهندسی بافت راههای مختلفی وجود دارد. تولید اولین الیاف در سال 1926 گزارش شد [75] که میتواند به روش محلول در آب یا سایر حلالها، مانند اسید استیک، لیتیوم کلراید / در متیل استامید حل و سپس از آن الیاف کیتوزانی تهیه شود [76-78]. در سالهای اخیر، الکتروریسی بهعنوان یک روش همهکاره برای تهیه الیاف پلیمری از قطر چند نانومتر تا میکرون، بسته به شرایط پردازش، معرفی و به کار گرفته شده است. در این روش از یک ولتاژ بالا برای ایجاد محلول در حال پرتاب باردار الکتریکی پلیمری استفاده میشود که میتواند منجر به تشکیل الیاف شود [79]. در مهندسی بافت کیتوزان یک پلیمر با منبع زیستی کاملاً منحصربهفرد است که توسط آمینهای اولیه موجود در ساختار آن، خواص فیزیکی و شیمیایی بسیار ارزشمندی به دست آورده و برهمکنش خاصی با پروتئینها، سلولها و موجودات زنده دارد. علاوهبراین، این پلیکاتیون (در صورت پروتونه شدن در شرایط اسیدی) حلالیت بهتری را در محیطهای آبی نشان میدهد که امکان پردازش این ماده را فراهم میکند. ژلهای نرم و لایههای نازک اسفنجها و ماتریکسهای نانوالیافی، بهراحتی عملکرد و مورفولوژی مناسبی را در دسترس قرار میدهند. بنابراین این پلیمر برای مصارف زیست پزشکی، بهویژه در مهندسی بافت بسیار جذاب است. پانل گستردهای از خواص کیتوزان و مواد فراوریشده با این پلیمر با منبع زیستی، آینده کاملاً امیدوارکنندهای را نشان میدهند. در این مطالعه سعی شد ویژگیهای بیولوژیکی کیتوزان در مهندسی بافت برجسته شود که آن را به یک بیومواد عالی برای استفاده در مهندسی بافت تبدیل کرده است. روشهای مختلف کاربردی در سنتز بیومواد کیتوزان برای مهندسی بافت بهطور گسترده در این بررسی توضیح داده شده است. سعی شد جزئیات جامع مواد زیستی مبتنی بر کیتوزان که عمدتاً در مهندسی بافت مورد استفاده قرار میگیرند ارائه شود. پیشبینی میشود این مقاله بهعنوان منبع اطلاعات پایه برای توسعه محصولات آینده مبتنی بر کیتوزان در مهندسی بافت و پزشکی بازساختی عمل کند.
بحث و نتیجهگیری
کیتین و کیتوزان کاربردهای زیادی در درمانهای جدید در حوزه پزشکی دارند. اخیراً استفاده از کیتوزان در مهندسی بافت نتایج مؤثر و چشمگیری را گزارش کرده است. کیتوزان در درمان بیماریها، ازجمله سرطان بهصورت نانوذره و همچنین در سیستم دارورسانی نقش مفیدی را ارائه میدهد. کیتوزان توانسته سیستمهای ترمیم پوست را بهشدت تحت تأثیر قرار دهد و بهعنوان داروی آنتیاکسیدانی، ضدمیکروبی و ضدباکتریایی نیز در سیستم پزشکی مورد توجه قرار گرفته است. همچنان نیز در دنیای علم مطالعات زیادی برای کاربردهای جدید این ماده در حال انجام است. همانطور که قبلاً اشاره شد، کیتین و کیتوزان بهعنوان فراوانترین آمینو پلیساکاریدها در طبیعت، دارای خصوصیات منحصربهفردی (زیستسازگاری، زیستتخریب پذیری، غیرسمی، دارای خاصیت ضدمیکروبی، ضدتوموری، آنتیاکسیدانی و هموستاتیکی) هستند [80، 81]. این ویژگیها، موجب شد تا کیتین و کیتوزان توجه زیادی را نهتنها ازنظر فراوانی در منابع طبیعی، بلکه به دلیل پتانسیل بالا، جهت تهیه مواد کاربردی، به طرف خود معطوف کنند. پیشرفتهای گستردهای در بهبود خواص آنها بهمنظور استفاده در مهندسی بافت، ترمیم زخمها و سیستمهای انتقال و رهایش دارو و همچنین درمانهای مؤثر در مطالعات سرطانی حاصل شده است. باتوجهبه مطالب مذکور میتوان گفت ویژگیهای قابلتوجه کیتوزان فرصتهای منحصربهفردی را برای توسعه کاربردهای زیست پزشکی ارائه میدهد. توضیح مکانیسم آنها منجر به درک بهتر درزمینه پزشکی و دارویی کیتوزان میشود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
باتوجهبه نوع مطالعه، ملاحظات اخلاقی وجود نداشت.
حامی مالی
این تحقیق هیچگونه کمک مالی از سازمانهای تأمین مالی در بخشهای عمومی، تجاری یا غیرانتفاعی دریافت نکرد.
مشارکت نویسندگان
مفهومسازی و طراحی مطالعه: دکتر لیلا رضاخانی، دکتر مرتضی علی زاده؛ کسب، تحلیل و تفسیر دادهها: دکتر لیلا رضاخانی، دکتر مرتضی علی زاده؛ تهیه پیشنویس دستنوشته: دکتر لیلا رضاخانی، دکتر مرتضی علی زاده؛ بازبینی نقادانه دستنوشته برای محتوای فکری مهم: دکتر لیلا رضاخانی، دکتر مرتضی علی زاده، خانم طیبه سادات طباطبایی.
تعارض منافع
بنابر اظهار نویسندگان این مقاله تعارض منافع ندارد.
بحث و نتیجهگیری
کیتین و کیتوزان کاربردهای زیادی در درمانهای جدید در حوزه پزشکی دارند. اخیراً استفاده از کیتوزان در مهندسی بافت نتایج مؤثر و چشمگیری را گزارش کرده است. کیتوزان در درمان بیماریها، ازجمله سرطان بهصورت نانوذره و همچنین در سیستم دارورسانی نقش مفیدی را ارائه میدهد. کیتوزان توانسته سیستمهای ترمیم پوست را بهشدت تحت تأثیر قرار دهد و بهعنوان داروی آنتیاکسیدانی، ضدمیکروبی و ضدباکتریایی نیز در سیستم پزشکی مورد توجه قرار گرفته است. همچنان نیز در دنیای علم مطالعات زیادی برای کاربردهای جدید این ماده در حال انجام است. همانطور که قبلاً اشاره شد، کیتین و کیتوزان بهعنوان فراوانترین آمینو پلیساکاریدها در طبیعت، دارای خصوصیات منحصربهفردی (زیستسازگاری، زیستتخریب پذیری، غیرسمی، دارای خاصیت ضدمیکروبی، ضدتوموری، آنتیاکسیدانی و هموستاتیکی) هستند [80، 81]. این ویژگیها، موجب شد تا کیتین و کیتوزان توجه زیادی را نهتنها ازنظر فراوانی در منابع طبیعی، بلکه به دلیل پتانسیل بالا، جهت تهیه مواد کاربردی، به طرف خود معطوف کنند. پیشرفتهای گستردهای در بهبود خواص آنها بهمنظور استفاده در مهندسی بافت، ترمیم زخمها و سیستمهای انتقال و رهایش دارو و همچنین درمانهای مؤثر در مطالعات سرطانی حاصل شده است. باتوجهبه مطالب مذکور میتوان گفت ویژگیهای قابلتوجه کیتوزان فرصتهای منحصربهفردی را برای توسعه کاربردهای زیست پزشکی ارائه میدهد. توضیح مکانیسم آنها منجر به درک بهتر درزمینه پزشکی و دارویی کیتوزان میشود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
باتوجهبه نوع مطالعه، ملاحظات اخلاقی وجود نداشت.
حامی مالی
این تحقیق هیچگونه کمک مالی از سازمانهای تأمین مالی در بخشهای عمومی، تجاری یا غیرانتفاعی دریافت نکرد.
مشارکت نویسندگان
مفهومسازی و طراحی مطالعه: دکتر لیلا رضاخانی، دکتر مرتضی علی زاده؛ کسب، تحلیل و تفسیر دادهها: دکتر لیلا رضاخانی، دکتر مرتضی علی زاده؛ تهیه پیشنویس دستنوشته: دکتر لیلا رضاخانی، دکتر مرتضی علی زاده؛ بازبینی نقادانه دستنوشته برای محتوای فکری مهم: دکتر لیلا رضاخانی، دکتر مرتضی علی زاده، خانم طیبه سادات طباطبایی.
تعارض منافع
بنابر اظهار نویسندگان این مقاله تعارض منافع ندارد.
References
- Satitsri S, Muanprasat C. Chitin and chitosan derivatives as biomaterial resources for biological and biomedical applications. Molecules. 2020; 25(24):5961. [DOI:10.3390/molecules25245961] [PMID]
- Dhivya S, Keshav Narayan A, Logith Kumar R, Viji Chandran S, Vairamani M, Selvamurugan N. Proliferation and differentiation of mesenchymal stem cells on scaffolds containing chitosan, calcium polyphosphate and pigeonite for bone tissue engineering. Cell Proliferation. 2018; 51(1):e12408. [DOI:10.1111/cpr.12408] [PMID]
- Saravanan S, Leena R, Selvamurugan N. Chitosan based biocomposite scaffolds for bone tissue engineering. International Journal of Biological Macromolecules. 2016; 93(Pt B):1354-65. [DOI:10.1016/j.ijbiomac.2016.01.112] [PMID]
- Bianchera A, Salomi E, Pezzanera M, Ruwet E, Bettini R, Elviri L. Chitosan hydrogels for chondroitin sulphate controlled release: an analytical characterization. Journal of Analytical Methods in Chemistry. 2014; 2014:808703. [DOI:10.1155/2014/808703] [PMID]
- He Y, Dong Y, Cui F, Chen X, Lin R. Ectopic osteogenesis and scaffold biodegradation of nano-hydroxyapatite-chitosan in a rat model. Plos One. 2015; 10(8):e0135366. [DOI:10.1371/journal.pone.0135366] [PMID]
- Rodríguez-Vázquez M, Vega-Ruiz B, Ramos-Zúñiga R, Saldaña-Koppel DA, Quiñones-Olvera LF. Chitosan and its potential use as a scaffold for tissue engineering in regenerative medicine. BioMed Research International. 2015; 2015:821279. [DOI:10.1155/2015/821279] [PMID]
- Costa-Pinto AR, Reis RL, Neves NM. Scaffolds based bone tissue engineering: The role of chitosan. Tissue Engineering Part B: Reviews. 2011; 17(5):331-47. [DOI:10.1089/ten.teb.2010.0704] [PMID]
- Furuike T, Komoto D, Hashimoto H, Tamura H. Preparation of chitosan hydrogel and its solubility in organic acids. International Journal of Biological Macromolecules. 2017; 104(Pt B):1620-5. [DOI:10.1016/j.ijbiomac.2017.02.099] [PMID]
- Aguilar A, Zein N, Harmouch E, Hafdi B, Bornert F, Offner D, et al. Application of chitosan in bone and dental engineering. Molecules. 2019; 24(16):3009. [DOI:10.3390/molecules24163009] [PMID]
- Harugade A, Sherje AP, Pethe A. Chitosan: A review on properties, biological activities and recent progress in biomedical applications. Reactive and Functional Polymers. 2023; 191:105634. [DOI:10.1016/j.reactfunctpolym.2023.105634]
- Román-Doval R, Torres-Arellanes SP, Tenorio-Barajas AY, Gómez-Sánchez A, Valencia-Lazcano AA. Chitosan: Properties and its application in agriculture in context of molecular weight. Polymers. 2023; 15(13):2867. [DOI:10.3390/polym15132867] [PMID]
- Kluczka J. Chitosan: Structural and chemical modification, properties, and application. International Journal of Molecular Sciences. 2023; 25(1):554. [DOI:10.3390/ijms25010554] [PMID]
- Che X, Zhao T, Hu J, Yang K, Ma N, Li A, et al. Application of chitosan-based hydrogel in promoting wound healing: A review. Polymers. 2024; 16(3):344. [DOI:10.3390/polym16030344] [PMID]
- Riseh RS, Vazvani MG, Kennedy JF. The application of chitosan as a carrier for fertilizer: A review. International Journal of Biological Macromolecules. 2023; 252:126483. [DOI:10.1016/j.ijbiomac.2023.126483] [PMID]
- He P, Davis SS, Illum L. In vitro evaluation of the mucoadhesive properties of chitosan microspheres. International Journal of Pharmaceutics. 1998; 166(1):75-88. [DOI:10.1016/S0378-5173(98)00027-1]
- Fila K, Podkościelna B, Szymczyk K. The application of chitosan as an eco-filler of polymeric composites. Adsorption. 2024; 30(2):157-65. [DOI:10.1007/s10450-023-00403-0]
- Park PJ, Je JY, Jung WK, Ahn CB, Kim SK. Anticoagulant activity of heterochitosans and their oligosaccharide sulfates. European Food Research and Technology. 2004; 219(5):529-33. [DOI:10.1007/s00217-004-0977-3]
- Rao SB, Sharma CP. Use of chitosan as a biomaterial: studies on its safety and hemostatic potential. Journal of Biomedical Materials Research. 1997; 34(1):21-8. [PMID]
- Klokkevold PR, Fukayama H, Sung EC, Bertolami CN. The effect of chitosan (poly-N-acetyl glucosamine) on lingual hemostasis in heparinized rabbits. Journal of Oral and Maxillofacial Surgery. 1999; 57(1):49-52. [DOI:10.1016/S0278-2391(99)90632-8] [PMID]
- Smith J, Wood E, Dornish M. Effect of chitosan on epithelial cell tight junctions. Pharmaceutical Research. 2004; 21(1):43-9. [DOI:10.1023/B:PHAM.0000012150.60180.e3] [PMID]
- Okamoto Y, Kawakami K, Miyatake K, Morimoto M, Shigemasa Y, Minami S. Analgesic effects of chitin and chitosan. Carbohydrate Polymers. 2002; 49(3):249-52. [DOI:10.1016/S0144-8617(01)00316-2]
- Dutta P, Rinki K, Dutta J. Chitosan: A promising biomaterial for tissue engineering scaffolds. In: Jayakumar R, Prabaharan M, Muzzarelli R, editors. Chitosan for Biomaterials II. Advances in Polymer Science, vol 244. Berlin: Springer; 2011.[DOI:10.1007/12_2011_112]
- Jagur-Grodzinski J. Biomedical applications of polymers 2001-2002. e-Polymers. 2003; 3(1). [DOI:10.1515/epoly.2003.3.1.141]
- Dash M, Chiellini F, Ottenbrite RM, Chiellini E. Chitosan-A versatile semi-synthetic polymer in biomedical applications. Progress in Polymer Science. 2011; 36(8):981-1014. [DOI:10.1016/j.progpolymsci.2011.02.001]
- Muzzarelli R, Muzzarelli C. Chitosan chemistry: Relevance to the biomedical sciences. Polysaccharides I. 2005; 151-209. [DOI:10.1007/b136820]
- Seol YJ, Lee JY, Park YJ, Lee YM, Young-Ku, Rhyu IC, et al. Chitosan sponges as tissue engineering scaffolds for bone formation. Biotechnology Letters. 2004; 26(13):1037-41. [DOI:10.1023/B:BILE.0000032962.79531.fd] [PMID]
- Drury JL, Mooney DJ. Hydrogels for tissue engineering: Scaffold design variables and applications. Biomaterials. 2003; 24(24):4337-51. [DOI:10.1016/S0142-9612(03)00340-5] [PMID]
- Acosta N, Sánchez E, Calderón L, Cordoba-Diaz M, Cordoba-Diaz D, Dom S, et al. Physical stability studies of semi-solid formulations from natural compounds loaded with chitosan microspheres. Marine Drugs. 2015; 13(9):5901-19. [DOI:10.3390/md13095901] [PMID]
- Jimtaisong A, Saewan N. Utilization of carboxymethyl chitosan in cosmetics. International Journal of Cosmetic Science. 2014; 36(1):12-21. [DOI:10.1111/ics.12102] [PMID]
- Casadidio C, Peregrina DV, Gigliobianco MR, Deng S, Censi R, Di Martino P. Chitin and chitosans: Characteristics, eco-friendly processes, and applications in cosmetic science. Marine Drugs. 2019; 17(6):369. [DOI:10.3390/md17060369] [PMID]
- Qin C, Du Y, Xiao L, Liu Y, Yu H. Moisture retention and antibacterial activity of modified chitosan by hydrogen peroxide. Journal of Applied Polymer Science. 2002; 86(7):1724-30. [DOI:10.1002/app.11080]
- Sionkowska A, Kaczmarek B, Michalska M, Lewandowska K, Grabska S. Preparation and characterization of collagen/chitosan/hyaluronic acid thin films for application in hair care cosmetics. Pure and Applied Chemistry. 2017; 89(12):1829-39. [DOI:10.1515/pac-2017-0314]
- Matos BN, Reis TA, Gratieri T, Gelfuso GM. Chitosan nanoparticles for targeting and sustaining minoxidil sulphate delivery to hair follicles. International Journal of Biological Macromolecules. 2015; 75:225-9. [DOI:10.1016/j.ijbiomac.2015.01.036] [PMID]
- Costa EM, Silva S, Madureira AR, Cardelle-Cobas A, Tavaria FK, Pintado MM. A comprehensive study into the impact of a chitosan mouthwash upon oral microorganism’s biofilm formation in vitro. Carbohydrate Polymers. 2014; 101:1081-6. [DOI:10.1016/j.carbpol.2013.09.041] [PMID]
- Aranaz I, Acosta N, Civera C, Elorza B, Mingo J, Castro C, et al. Cosmetics and cosmeceutical applications of chitin, chitosan and their derivatives. Polymers. 2018; 10(2):213. [DOI:10.3390/polym10020213] [PMID]
- Assunção CM, Lussi A, Rodrigues JA, Carvalho TS. Efficacy of toothpastes in the prevention of erosive tooth wear in permanent and deciduous teeth. Clinical Oral Investigations. 2019; 23(1):273-84. [DOI:10.1007/s00784-018-2434-x] [PMID]
- Beltrame APC, Suchyta D, Abd Alraheam I, Mohammed A, Schoenfisch M, Walter R, et al. Effect of phosphorylated chitosan on dentin erosion: An in vitro study. Caries Research. 2018; 52(5):378-86. [DOI:10.1159/000486521] [PMID]
- Işılay Özdoğan A, Akca G, Şenel S. Development and in vitro evaluation of chitosan based system for local delivery of atorvastatin for treatment of periodontitis. European Journal of Pharmaceutical Sciences. 2018; 124:208-16. [DOI:10.1016/j.ejps.2018.08.037] [PMID]
- Khattak S, Wahid F, Liu LP, Jia SR, Chu LQ, Xie YY, et al. Applications of cellulose and chitin/chitosan derivatives and composites as antibacterial materials: Current state and perspectives. Applied Microbiology and Biotechnology. 2019; 103(5):1989-2006. [DOI:10.1007/s00253-018-09602-0] [PMID]
- Benhabiles MS, Salah R, Lounici H, Drouiche N, Goosen MF, Mameri N. Antibacterial activity of chitin, chitosan and its oligomers prepared from shrimp shell waste. Food Hydrocolloids. 2012; 29(1):48-56. [DOI:10.1016/j.foodhyd.2012.02.013]
- Park BK, Kim MM. Applications of chitin and its derivatives in biological medicine. International Journal of Molecular Sciences. 2010; 11(12):5152-64. [DOI:10.3390/ijms11125152] [PMID]
- Bano I, Arshad M, Yasin T, Ghauri MA, Younus M. Chitosan: A potential biopolymer for wound management. International Journal of Biological Macromolecules. 2017; 102:380-3.[DOI:10.1016/j.ijbiomac.2017.04.047] [PMID]
- Sun Z, Shi C, Wang X, Fang Q, Huang J. Synthesis, characterization, and antimicrobial activities of sulfonated chitosan. Carbohydrate Polymers. 2017; 155:321-8. [DOI:10.1016/j.carbpol.2016.08.069] [PMID]
- Abdel-Mohsen A, Jancar J, Massoud D, Fohlerova Z, Elhadidy H, Spotz Z, et al. Novel chitin/chitosan-glucan wound dressing: Isolation, characterization, antibacterial activity and wound healing properties. International Journal of Pharmaceutics. 2016; 510(1):86-99. [DOI:10.1016/j.ijpharm.2016.06.003]
- Palma-Guerrero J, Lopez-Jimenez JA, Pérez-Berná AJ, Huang IC, Jansson HB, Salinas J, et al. Membrane fluidity determines sensitivity of filamentous fungi to chitosan. Molecular Microbiology. 2010; 75(4):1021-32. [DOI:10.1111/j.1365-2958.2009.07039.x] [PMID]
- Verlee A, Mincke S, Stevens CV. Recent developments in antibacterial and antifungal chitosan and its derivatives. Carbohydrate Polymers. 2017; 164:268-83. [DOI:10.1016/j.carbpol.2017.02.001] [PMID]
- Ruess L, Häggblom MM, Zapata G, Dighton J. Fatty acids of fungi and nematodes-possible biomarkers in the soil food chain? Soil Biology and Biochemistry. 2002; 34(6):745-56. [DOI:10.1016/S0038-0717(01)00231-0]
- Palma-Guerrero J, Huang IC, Jansson HB, Salinas J, Lopez-Llorca LV, Read ND. Chitosan permeabilizes the plasma membrane and kills cells of Neurospora crassa in an energy dependent manner. Fungal Genetics and Biology. 2009; 46(8):585-94. [DOI:10.1016/j.fgb.2009.02.010] [PMID]
- Raafat D, von Bargen K, Haas A, Sahl HG. Insights into the mode of action of chitosan as an antibacterial compound. Applied and Environmental Microbiology. 2008; 74(12):3764-73. [DOI:10.1128/AEM.00453-08] [PMID]
- Brown S, Santa Maria JP Jr, Walker S. Wall teichoic acids of gram-positive bacteria. Annual Review of Microbiology. 2013; 67:313-36. [DOI:10.1146/annurev-micro-092412-155620] [PMID]
- Park Y, Kim MH, Park SC, Cheong H, Jang MK, Nah JW, et al. Investigation of the antifungal activity and mechanism of action of LMWS-chitosan. Journal of Microbiology and Biotechnology. 2008; 18(10):1729-34. [PMID]
- Wang X, Du Y, Fan L, Liu H, Hu Y. Chitosan-metal complexes as antimicrobial agent: Synthesis, characterization and structure-activity study. Polymer Bulletin. 2005; 55(1):105-13. [DOI:10.1007/s00289-005-0414-1]
- Goy RC, Britto Dd, Assis OB. A review of the antimicrobial activity of chitosan. Polímeros. 2009; 19(3):241-7. [DOI:10.1590/S0104-14282009000300013]
- Kong M, Chen XG, Xing K, Park HJ. Antimicrobial properties of chitosan and mode of action: A state of the art review. International Journal of Food Microbiology. 2010; 144(1):51-63. [DOI:10.1016/j.ijfoodmicro.2010.09.012] [PMID]
- Helander IM, Nurmiaho-Lassila EL, Ahvenainen R, Rhoades J, Roller S. Chitosan disrupts the barrier properties of the outer membrane of Gram-negative bacteria. International Journal of Food Microbiology. 2001; 71(2-3):235-44. [DOI:10.1016/S0168-1605(01)00609-2] [PMID]
- Liu H, Du Y, Wang X, Sun L. Chitosan kills bacteria through cell membrane damage. International Journal of Food Microbiology. 2004; 95(2):147-55. [DOI:10.1016/j.ijfoodmicro.2004.01.022] [PMID]
- Mansilla AY, Albertengo L, Rodríguez MS, Debbaudt A, Zúñiga A, Casalongué C. Evidence on antimicrobial properties and mode of action of a chitosan obtained from crustacean exoskeletons on Pseudomonas syringae pv. tomato DC3000. Applied Microbiology and Biotechnology. 2013; 97(15):6957-66. [DOI:10.1007/s00253-013-4993-8] [PMID]
- Rezakhani L, Alizadeh M, Sharifi E, Soleimannejad M, Alizadeh A. Isolation and characterization of crab haemolymph exosomes and its effects on breast cancer cells (4T1). Cell Journal (Yakhteh). 2021; 23(6):658-64. [PMID]
- Chokradjaroen C, Theeramunkong S, Yui H, Saito N, Rujiravanit R. Cytotoxicity against cancer cells of chitosan oligosaccharides prepared from chitosan powder degraded by electrical discharge plasma. Carbohydrate Polymers. 2018; 201:20-30. [DOI:10.1016/j.carbpol.2018.08.037] [PMID]
- Huang R, Mendis E, Rajapakse N, Kim SK. Strong electronic charge as an important factor for anticancer activity of chitooligosaccharides (COS). Life Sciences. 2006; 78(20):2399-408. [DOI:10.1016/j.lfs.2005.09.039] [PMID]
- Jiang Z, Wang S, Hou J, Chi J, Wang S, Shao K, et al. Effects of carboxymethyl chitosan oligosaccharide on regulating immunologic function and inhibiting tumor growth. Carbohydrate Polymers. 2020; 250:116994. [DOI:10.1016/j.carbpol.2020.116994] [PMID]
- Nadarajah K, Prinyawiwatkul W, No HK, Sathivel S, Xu Z. Sorption behavior of crawfish chitosan films as affected by chitosan extraction processes and solvent types. Journal of Food Science. 2006; 71(2):E33-E9. [DOI:10.1111/j.1365-2621.2006.tb08894.x]
- Bhale S, No H, Prinyawiwatkul W, Farr A, Nadarajah K, Meyers S. Chitosan coating improves shelf life of eggs. Journal of Food Science. 2003; 68(7):2378-83. [DOI:10.1111/j.1365-2621.2003.tb05776.x]
- No H, Meyers SP, Prinyawiwatkul W, Xu Z. Applications of chitosan for improvement of quality and shelf life of foods: A review. Journal of Food Science. 2007; 72(5):R87-100. [DOI:10.1111/j.1750-3841.2007.00383.x]
- Tan YL, Liu CG. Self-aggregated nanoparticles from linoleic acid modified carboxymethyl chitosan: Synthesis, characterization and application in vitro. Colloids and Surfaces B: Biointerfaces. 2009; 69(2):178-82. [DOI:10.1016/j.colsurfb.2008.11.026] [PMID]
- Rahmati S, Khazaei M, Nadi A, Alizadeh M, Rezakhani L. Exosome-loaded scaffolds for regenerative medicine in hard tissues. Tissue and Cell. 2023; 82:102102. [DOI:10.1016/j.tice.2023.102102] [PMID]
- Ranjbarnejad F, Khazaei M, Shahryari A, Khazaei F, Rezakhani L. Recent advances in gene therapy for bone tissue engineering. Journal of Tissue Engineering and Regenerative Medicine. 2022; 16(12):1121-37. [DOI:10.1002/term.3363] [PMID]
- Alizadeh M, Rezakhani L, Taghdiri Nooshabadi V, Alizadeh A. The effect of Scrophularia striata on cell attachment and biocompatibility of decellularized bovine pericardia. Cell and Tissue Banking. 2022; 23(2):261-9. [DOI:10.1007/s10561-021-09939-3] [PMID]
- Khazaei M, Alizadeh M, Rezakhani L. Resveratrol-loaded decellularized ovine pericardium: ECM introduced for tissue engineering. Biotechnology and Applied Biochemistry. 2024; 71(2):387-401. [PMID]
- Naveed M, Phil L, Sohail M, Hasnat M, Baig MMFA, Ihsan AU, et al. Chitosan oligosaccharide (COS): An overview. International Journal of Biological Macromolecules. 2019; 129:827-43. [DOI:10.1016/j.ijbiomac.2019.01.192] [PMID]
- Sharma S, Batra S. Recent advances of chitosan composites in artificial skin: the next era for potential biomedical application. In: Holban AM, Grumezescu AM, editors. Materials for biomedical engineering. Amsterdam: Elsevier; 2019. [DOI:10.1016/B978-0-12-816909-4.00005-1]
- Jayakumar R, Prabaharan M, Sudheesh Kumar PT, Nair SV, Tamura H. Biomaterials based on chitin and chitosan in wound dressing applications. Biotechnology Advances. 2011; 29(3):322-37. [DOI:10.1016/j.biotechadv.2011.01.005] [PMID]
- Croisier F, Jérôme C. Chitosan-based biomaterials for tissue engineering. European Polymer Journal. 2013; 49(4):780-92. [DOI:10.1016/j.eurpolymj.2012.12.009]
- Lee YM, Park YJ, Lee SJ, Ku Y, Han SB, Klokkevold PR, et al. Tissue engineered bone formation using chitosan/tricalcium phosphate sponges. Journal of Periodontology. 2000; 71(3):410-7. [DOI:10.1902/jop.2000.71.3.410] [PMID]
- Pillai CK, Paul W, Sharma CP. Chitin and chitosan polymers: Chemistry, solubility and fiber formation. Progress in Polymer Science. 2009; 34(7):641-78. [DOI:10.1016/j.progpolymsci.2009.04.001]
- Rigby GW. Process for the preparation of films and filaments and products thereof. Washington: Google Patents; 1936. [Link]
- East GC, Qin Y. Wet spinning of chitosan and the acetylation of chitosan fibers. Journal of Applied Polymer Science. 1993; 50(10):1773-9. [DOI:10.1002/app.1993.070501013]
- Agboh OC, Qin Y. Chitin and chitosan fibers. Polymers for Advanced Technologies. 1997; 8(6):355-65. [DOI:10.1002/(SICI)1099-1581(199706)8:6<355::AID-PAT651>3.0.CO;2-T]
- Anton F. Artificial thread and method of producing same. Washington: Patent and Trademark Office; 1940. [Link]
- Vinsova J, Vavrikova E. Chitosan derivatives with antimicrobial, antitumour and antioxidant activities-a review. Current Pharmaceutical Design. 2011; 17(32):3596-607. [DOI:10.2174/138161211798194468] [PMID]
- Hu Z, Zhang DY, Lu ST, Li PW, Li SD. Chitosan-based composite materials for prospective hemostatic applications. Marine Drugs. 2018; 16(8):273. [DOI:10.3390/md16080273] [PMID]
- El-Far M, Elshal M, Refaat M, El-Sherbiny IM. Antitumor activity and antioxidant role of a novel water-soluble carboxymethyl chitosan-based copolymer. Drug Development and Industrial Pharmacy. 2011; 37(12):1481-90. [DOI:10.3109/03639045.2011.587430] [PMID]
- Wang D, Sun Y, Wu Y, Ma L, Duan J. Synthesis, characterization and anticancer activity of tanshinone I grafted low molecular chitosan. Glycoconjugate Journal. 2017; 34(1):3-12. [DOI:10.1007/s10719-016-9712-0] [PMID]
- Kim MO, Moon DO, Kang CH, Choi YH, Lee JD, Kim GY. Water-soluble chitosan sensitizes apoptosis in human leukemia cells via the downregulation of Bcl-2 and dephosphorylation of AKT. Journal of Food Biochemistry. 2013; 37(3):270-7. [DOI:10.1111/j.1745-4514.2011.00628.x]
- Zhao L, Zhang S, An F, Ma S, Cheng Y, Liu W, et al. Water soluble chitosans shows anti-cancer effect in mouse H22 liver cancer by enhancing the immune. International Journal of Clinical and Experimental Medicine. 2016; 9(1):164-71. [Link]
- Qin C, Du Y, Xiao L, Li Z, Gao X. Enzymic preparation of water-soluble chitosan and their antitumor activity. International Journal of Biological Macromolecules. 2002; 31(1-3):111-7. [DOI:10.1016/S0141-8130(02)00064-8] [PMID]
- Liu M, Min L, Zhu C, Rao Z, Liu L, Xu W, et al. Preparation, characterization and antioxidant activity of silk peptides grafted carboxymethyl chitosan. International Journal of Biological Macromolecules. 2017; 104(Pt A):732-8. [DOI:10.1016/j.ijbiomac.2017.06.071] [PMID]
- Chatterjee NS, Panda SK, Navitha M, Asha K, Anandan R, Mathew S. Vanillic acid and coumaric acid grafted chitosan derivatives: improved grafting ratio and potential application in functional food. Journal of Food Science and Technology. 2015; 52(11):7153-62. [DOI:10.1007/s13197-015-1874-4]
- Liu J, Lu JF, Kan J, Tang YQ, Jin CH. Preparation, characterization and antioxidant activity of phenolic acids grafted carboxymethyl chitosan. International Journal of Biological Macromolecules. 2013; 62:85-93. [DOI:10.1016/j.ijbiomac.2013.08.040] [PMID]
- Liu J, Wen XY, Lu JF, Kan J, Jin CH. Free radical mediated grafting of chitosan with caffeic and ferulic acids: Structures and antioxidant activity. International Journal of Biological Macromolecules. 2014; 65:97-106. [DOI:10.1016/j.ijbiomac.2014.01.021] [PMID]
- Hu Q, Wang T, Zhou M, Xue J, Luo Y. In vitro antioxidant-activity evaluation of gallic-acid-grafted chitosan conjugate synthesized by free-radical-induced grafting method. Journal of Agricultural and Food Chemistry. 2016; 64(29):5893-900. [DOI:10.1021/acs.jafc.6b02255] [PMID]
- Khan I, Ullah S, Oh DH. Chitosan grafted monomethyl fumaric acid as a potential food preservative. Carbohydrate Polymers. 2016; 152:87-96. [DOI:10.1016/j.carbpol.2016.06.073] [PMID]
- Zhu X, Zhou X, Yi J, Tong J, Wu H, Fan L. Preparation and biological activity of quaternized carboxymethyl chitosan conjugated with collagen peptide. International Journal of Biological Macromolecules. 2014; 70:300-5. [DOI:10.1016/j.ijbiomac.2014.06.045] [PMID]
- Anraku M, Hiraga A, Iohara D, Uekama K, Tomida H, Otagiri M, et al. Preparation and antioxidant activity of PEGylated chitosans with different particle sizes. International Journal of Biological Macromolecules. 2014; 70:64-9. [DOI:10.1016/j.ijbiomac.2014.06.026] [PMID]
مقاله مروری: گزارش مورد |
موضوع مقاله:
تخصصي
دریافت: 1402/10/1 | پذیرش: 1403/4/31 | انتشار: 1403/10/10
دریافت: 1402/10/1 | پذیرش: 1403/4/31 | انتشار: 1403/10/10
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |