دوره 34، شماره 1 - ( 1-1404 )
جلد 34 شماره 1 صفحات 55-42 |
برگشت به فهرست نسخه ها
Research code: 1258
Ethics code: IR.GUMS.REC.1397.508
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Zia Ziabari S M, Motamed B, Bakhshayesh Eghbali B, Noori Roodsari N, Kamiar Y, Asgari Gesht Rudkhani A et al . Insulin Therapy to Control Hyperglycemia in Diabetic Patients With Ischemic Stroke: A Comparative of Intravenous and Subcutaneous Injection. JGUMS 2025; 34 (1) :42-55
URL: http://journal.gums.ac.ir/article-1-2712-fa.html
URL: http://journal.gums.ac.ir/article-1-2712-fa.html
ضیا ضیابری سید مهدی، معتمد بهرنگ، بخشایش اقبالی بابک، نوری رودسری نازنین، کامیار یاسمن، عسگری گشت رودخان اشکان و همکاران.. انسولیندرمانی جهت کنترل هایپرگلایسمی در بیماران دیابتی مبتلا به سکته مغزی ایسکمیک: مقایسه تزریق داخلوریدی و زیر جلد. مجله علوم پزشکی گیلان. 1404; 34 (1) :42-55
سید مهدی ضیا ضیابری1 

 ، بهرنگ معتمد2
، بهرنگ معتمد2 

 ، بابک بخشایش اقبالی3
، بابک بخشایش اقبالی3 

 ، نازنین نوری رودسری*1
، نازنین نوری رودسری*1 

 ، یاسمن کامیار1
، یاسمن کامیار1 
 ، اشکان عسگری گشت رودخان3
، اشکان عسگری گشت رودخان3 

 ، محمدعلی یزدانی پور3
، محمدعلی یزدانی پور3 




 ، بهرنگ معتمد2
، بهرنگ معتمد2 

 ، بابک بخشایش اقبالی3
، بابک بخشایش اقبالی3 

 ، نازنین نوری رودسری*1
، نازنین نوری رودسری*1 

 ، یاسمن کامیار1
، یاسمن کامیار1 
 ، اشکان عسگری گشت رودخان3
، اشکان عسگری گشت رودخان3 

 ، محمدعلی یزدانی پور3
، محمدعلی یزدانی پور3 


1- گروه طب اورژانس، دانشکده پزشکی، بیمارستان پورسینا، دانشگاه علوم پزشکی گیلان، رشت، ایران.
2- گروه بیماریهای داخلی، دانشکده پزشکی، بیمارستان رازی، دانشگاه علوم پزشکی گیلان، رشت، ایران.
3- مرکز تحقیقات علوم اعصاب، پژوهشکده تروما، دانشگاه علوم پزشکی گیلان، رشت، ایران.
2- گروه بیماریهای داخلی، دانشکده پزشکی، بیمارستان رازی، دانشگاه علوم پزشکی گیلان، رشت، ایران.
3- مرکز تحقیقات علوم اعصاب، پژوهشکده تروما، دانشگاه علوم پزشکی گیلان، رشت، ایران.
متن کامل [PDF 5449 kb]
(245 دریافت)
| چکیده (HTML) (1244 مشاهده)
مقایسه هایپوکالمی و مدتزمان کنترل قند خون در 24 ساعت اول
نتایج مقایسه هایپوکالمی و مدتزمان کنترل قند خون در 24 ساعت اول بین آزمودنیهای 2 گروه در جدول شماره 3 نشان داده شده است.

تفاوت معنیداری در فراوانی هایپوکالمی بین 2 گروه مشاهده شد. فراوانی هایپوکالمی در بیماران گروه داخلوریدی بهطور معنیداری بیشتر از گروه زیرجلدی بوده است (0/007=P). همچنین میانگین مدتزمان تحت کنترل قند خون در 24 ساعت اول در بیماران زیرجلدی بهطور معنیداری کمتر از بیماران گروه داخلوریدی بود (0/001>P).
مقایسه اثر تجویز وریدی و زیرجلدی بر میزان قند خون براساس تفکیک سطح قند خون اولیه
اثر تجویز انسولین وریدی و زیرجلدی بر میزان قند خون در طول 24 ساعت اول، به تفکیک سطح قند خون اولیه در تصویر شماره 2 نشان داده شده است.
References
متن کامل: (592 مشاهده)
مقدمه
سکته مغزی دومین علت شایع مرگومیر و اولین علت ناتوانی در بزرگسالان در جهان است [1]. سکته مغزی را میتوان به حمله ایسکمیک گذرا، سکته مغزی ایسکمیک، سکته مغزی هموراژیک و خونریزی زیر عنکبوتیه تقسیم کرد. سکته مغزی ایسکمیک حاد میتواند عواقب جدی مادامالعمر داشته باشد [2]. ازآنجاییکه سکته مغزی بهعنوان یک بیماری ناشی از قرار گرفتن طولانیمدت در معرض عوامل خطر مرتبط با سبک زندگی در نظر گرفته میشود، اصلاح این عوامل خطر بهشدت بر وقوع سکته مغزی و سطح ناتوانی مرتبط با سکته تأثیر میگذارد [3]. تأیید شده است که عوامل خطر سکته مغزی ترومبوتیک ایسکمیک، شامل عوامل خطر قابلاصلاح و غیرقابلاصلاح است که جنسیت، سن، قومیت و نژاد بهعنوان عوامل غیرقابلتغییر و فشار خون بالا، دیس لیپیدمی، دیابت شیرین و سیگار بهعنوان عوامل خطر قابلاصلاح هستند [3، 4].
هیپرگلیسمی یک هدف درمانی رایج و ضروری در سکته مغزی ایسکمیک حاد با و بدون دیابت پیش از بیماری است [5, 6]. هیپرگلیسمی تقریباً در 40 درصد از بیماران سکته مغزی ایسکمیک حاد دیده میشود [7, 8]. همانند سطح گلوکز قبل از بستری، هیپرگلیسمی در این بیماران ممکن است منعکسکننده کنترل ضعیف دیابت مزمن باشد که نشاندهنده یک پاسخ فیزیولوژیک گذرا به یک بیماری متقابل (هیپرگلیسمی استرس)، یا ترکیبی از این دو است [9, 10].
انفوزیون داخلوریدی مداوم یا تزریق زیرجلدی انسولین درمان اصلی برای کنترل قند خون پس از سکته مغزی در مرحله حاد است [11, 12]. بااینحال شواهد کمی درمورد اینکه کدام روش تجویز بهتر است گزارش شده است [13]. در آزمایشی با مقایسه انسولین داخلوریدی و زیرجلدی در مدیریت هیپرگلیسمی در بیماران پس از سکته، انسولیندرمانی داخلوریدی اثر بهتری بر کاهش گلوکز خون با افزایش خطر رویدادهای کاهش قند خون قابلکنترل داشت [14]. باتوجهبه کمبود شواهد در این زمینه و باتوجهبه اهمیت مدیریت هیپرگلیسمی در بیماران سکته مغزی ایسکمیک حاد، هدف ما بررسی نوسانات قند خون با انسولین داخلوریدی و زیرجلدی در مدیریت بیماران دیابتی و سکته مغزی ایسکمیک حاد بود. علاوهبراین، تغییرات هیپوگلیسمی و هیپوکالمیک در این بیماران نیز بررسی شد.
روشها
این مطالعه تحلیلیمقطعی روی 242 بیمار دیابتی که با سکته مغزی ایسکمیک حاد به اورژانس بیمارستان مراجعه کرده بودند و با روش تصویربرداری توموگرافی کامپیوتری (CT-Scan)، تشخیص ایسکمیک بودن سکته آنها تأیید شده بود، انجام گرفت. روش نمونهگیری بهصورت تدریجی بود. معیارهای ورود شامل سن بالای 18 سال، ابتلا به دیابت نوع دوم، ابتلا به سکته مغزی ایسکمیک حاد ایسکمیک، مراجعه به بیمارستان طی 12 ساعت از شروع علائم و معیارهای عدم ورود به مطالعه وجود حوادث خونریزیدهنده مغزی همراه با سکته مغزی ایسکمیک حاد، افراد باردار، افراد بستریشده در بخش مراقبتهای ویژه اورژانس پیش از بروز سکته مغزی ایسکمیک حاد، ابتلا به کتواسیدوز دیابتی و ابتلا به هیپرگلایسمی هایپراسمولار بود. این طرح پس از کسب تأییدیه از کمیته اخلاق دانشگاه (IR.GUMS.REC.1397.508) و مطابق با استانداردهای اخلاقی مندرج در اعلامیه 1964 هلسینکی و اصلاحات بعدی آن انجام شد. باتوجهبه اینکه کنترل قند افراد دیابتی جزو درمانهای روتین آنان است مداخله بیشتری صورت نپذیرفت. در زمان بستری به بیماران اطلاع داده شد دادههای آنها میتواند برای اهداف تحقیقاتی مورد استفاده قرار گیرد.
در مرکز موردمطالعه، پس از انتقال بیمار به در ورودی بیمارستان، متخصص طب اورژانس بیمار را تریاژ کرد و تشخیص ابتدایی محتمل با اولویت بیماریهای اورژانسی، مثل سکته مغزی صورت پذیرفت. بیماران مشکوک به سکته مغزی، بلافاصله بهCT سیتیاسکن و امآرآی بخش رادیولوژی، واقع در مجاورت اورژانس بیمارستان منتقل شده و باتوجهبه نتایج تصویربرداریهای اورژانسی، تشخیص سکته مغزی و نوع آن (ایسکمیک یا هموراژیک) توسط پزشک متخصص طب اورژانس و نورولوژی رد یا تأیید شد. در صورت تأیید سکته مغزی، بیمار به بخش مراقبتهای ویژه اورژانس منتقل شده و درمان دارویی و حمایتی بیمار آغاز میشد. در این مطالعه که بر روی بیماران دیابتی که سکته مغزی ایسکمیک داشتهاند انجام شد، مصرف داروهای خوراکی کاهنده قند خون قطع شد و بیماران دیابتی، ضمن درمان مرتبط با سکته مغزی ایسکمیک حاد، تحت پروتکل انسولین رگولار تحت جلدی یا وریدی قرار گرفتند.
انتخاب روش تزریق انسولین برحسب شرایط بالینی بیماران بوده است. در هر گروه قند خون و پتاسیم بیماران طی 24 ساعت اول، هر 6 ساعت بعد از بستری و تزریق انسولین، به همراه سایر متغیرها ثبت و گزارش شد. بیماران با در نظر گرفتن قند پایه بیشتر از 180 میلیگرم در دسیلیتر تحت پروتکل انسولین رگولار تحت جلدی یا وریدی قرار گرفتند. هدف حفظ قند خون بیماران در هر دو روش (وریدی و زیرجلدی) بین 140 تا 180 میلیگرم در دسیلیتر بوده است که در قند کمتر از 140 میلیگرم در دسیلیتر تجویز انسولین قطع شده و شروع مجدد آن براساس افزایش قند خون، بیشتر از مقدار هدف بود. همچنین در افراد با قند خون کمتر از 60 میلیگرم در دسیلیتر که در معرض هایپوگلاسیمی بودند درمان انسولین قطع شد و تحت مداخله 50 میلیلیتر دکستروز 50 درصد تزریقی قرار گرفتند. با بروز هایپوگلاسیمی حداقل 4 ساعت بعد از کنترل، رژیم انسولین در صورت نیاز تکرار شد.
تجزیهوتحلیل آماری
تجزیهوتحلیلهای آماری با استفاده از نرمافزار SPSS نسخه 20 انجام شد. دادهها بهصورت انحراف معیار و میانگین برای متغیرهای کمی و تعداد (درصد) برای متغیرهای کیفی ارائه شدند. با استفاده از روشهای کمی، مانند شاخص چولگی و کشیدگی و آزمون شاپیرو ویلک به بررسی نرمالیتی متغیرهای کمی پرداخته شد. متغیرهای کمی از توزیع نرمالی برخوردار بودند. جهت مقایسه ویژگیهای جمعیتشناختی از قبیل سن، جنس، طول مدت سابقه دیابت و برخی از بیماریهای زمینهای آزمودنیهای پژوهش در 2 گروه تحت درمان با انسولین ازطریق انفوزیون داخلوریدی یا تزریق زیرجلدی، باتوجهبه ماهیت عامل، از آزمون تی مستقل و آزمونی کایدو استفاده شد. بهمنظور مقایسه میانگین قند خون در 2 گروه موردمطالعه به تفکیک زمانهای اندازهگیری، آزمون تی مستقل به کار برده شد. از آزمون آنالیز واریانس یکطرفه اندازهگیری مکرر جهت تعیین روند تغییرات قند خون در طول زمانهای اندازه به تفکیک گروههای موردمطالعه و تأثیر همزمان گروه و زمان و همچنین تعیین این روند تغییرات به تفکیک سطح قند خون اولیه استفاده شد. با استفاده از آنالیز کوورایانس، ارتباط بین فاکتورهای تأثیرگذار بر میزان قند خون در بیماران سکته مغزی ایسکمیک حاد با حذف اثر قند خون در بدو ورود بررسی شد. P<0/05 ازنظر آماری معنیدار در نظر گرفته شد.
یافتهها
درمجموع 570 بیمار مبتلا به سکته مغزی ایسکمیک حاد که ترومبولیز داخلوریدی دریافت کرده بودند غربالگری شدند و 242 مورد تحت درمان با انسولین ازطریق انفوزیون داخلوریدی یا تزریق زیرجلدی قرار گرفتند. پس از حذف بیمارانی که اطلاعات گلوکز کافی نداشتند یا به دلایل غیرپزشکی انسولیندرمانی را به حالت تعلیق درآورده بودند، 242 شرکتکننده وارد تجزیهوتحلیل نهایی شدند.
مقایسه برخی از ویژگیهای جمعیتشناختی آزمودنیهای پژوهش از قبیل سن، جنس، طول مدت سابقه دیابت و برخی از بیماریهای زمینهای 2 گروه در جدول شماره 1 گزارش شده است.
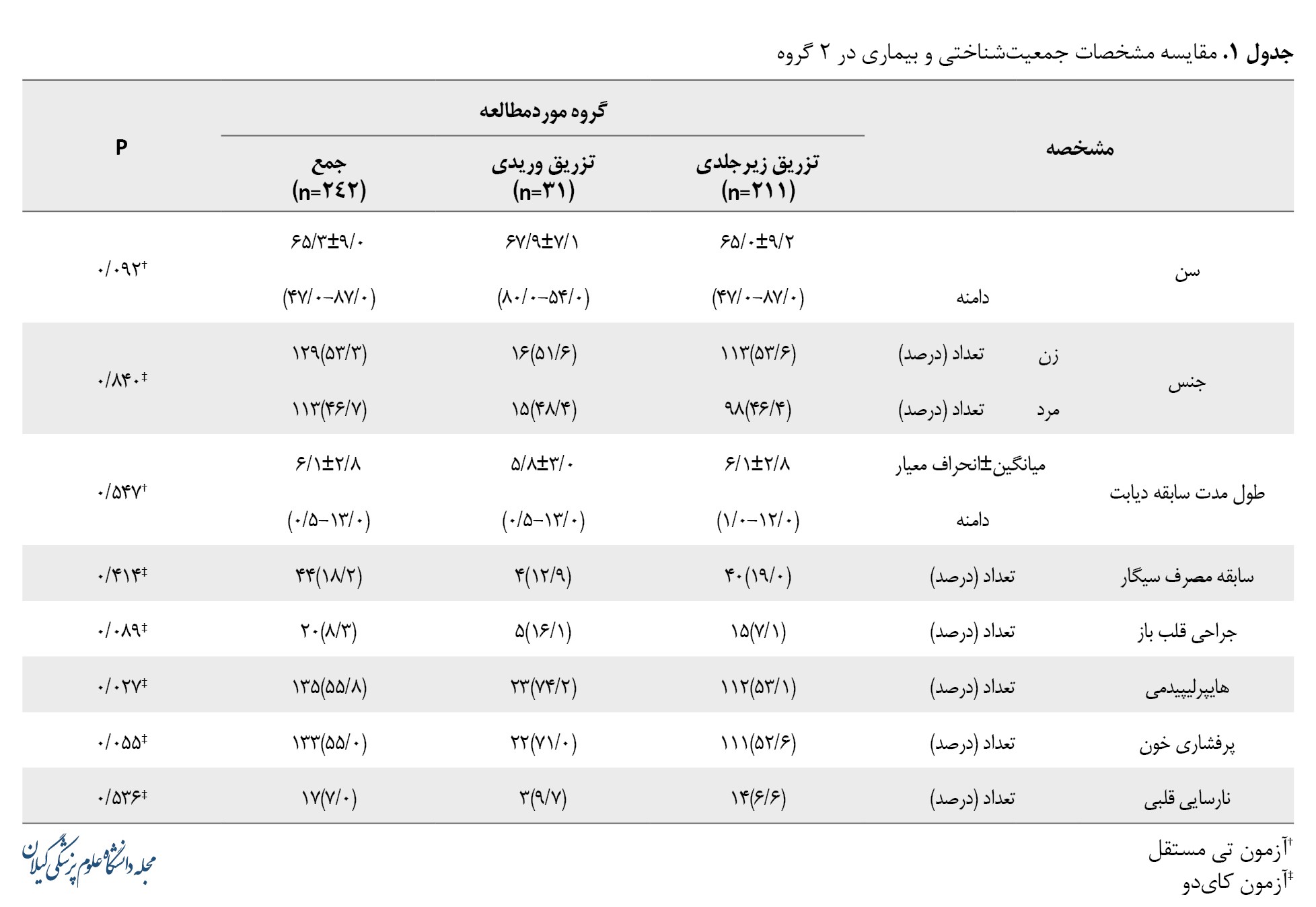
فراوانی هایپرلیپیدمی در بیماران گروه داخلوریدی بهطور معنیداری بیشتر از بیماران گروه زیرجلدی بوده است (0/027=p). همچنین فراوانی پرفشاری خون در بیماران گروه داخلوریدی بیشتر از بیماران گروه زیرجلدی بود و این تفاوت ازلحاظ آماری بهطور مرزی معنیدار بود (0/055=P).
تغییرات قند خون از بدو ورود تا 24 ساعت از پذیرش بیماران
در جدول شماره 2 به مقایسه بین و درونگروهی تغییرات قند خون از بدو ورود تا 24 ساعت پس از پذیرش بیماران پرداخته شد.
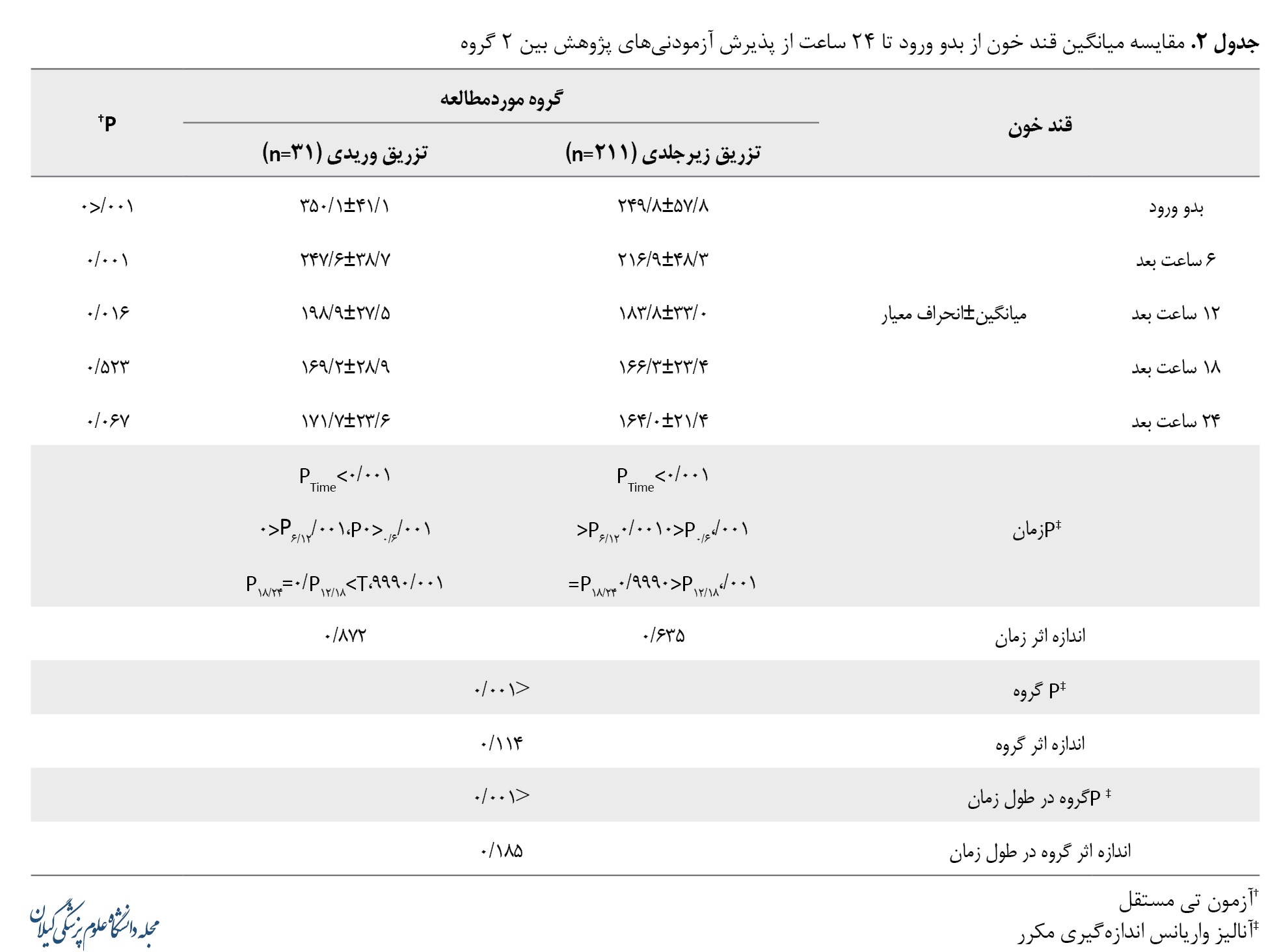
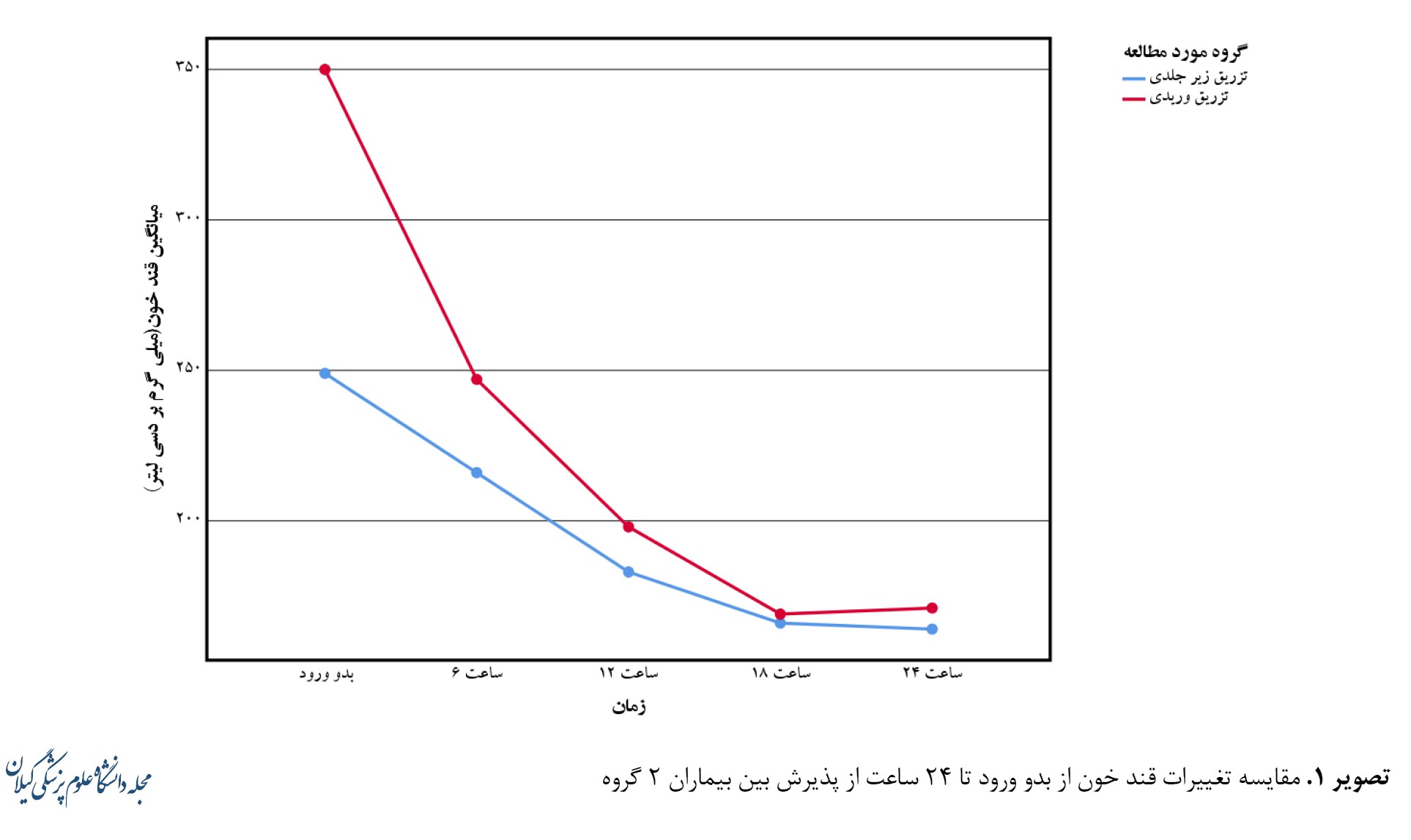
در مقایسات بینگروهی، میانگین قند خون بین 2 گروه دریافتکننده انسولین ازطریق انفوزیون داخلوریدی و تزریق زیرجلدی در زمانهای بدو ورود، 6 و 12 ساعت بعد، تفاوت آماری معنیداری داشت (001/P<0 و 0/016=P). میانگین قند خون در گروه وریدی بهطور معنیداری بیشتر از گروه زیرجلدی بود، اما تفاوت معنیداری در میانگین قند خون در 18 ساعت و 24 ساعت پس از پذیرش بین 2 گروه مشاهده نشد (05/P>0). همچنین براساس یافتههای آنالیز واریانس یکطرفه اندازهگیری مکرر، درون هر دو گروه، در طول زمان، کاهش قند خون بهطور معنیداری مشاهده شد. مقایسات زوجی نشان داد این تفاوت بین زمانهای بدو ورود تا 6 ساعت، 6 ساعت تا 12 ساعت و 12 تا 18 ساعت بهطور آماری معنیدار بود، اما بین زمان 18 تا 24 تفاوت معنیداری مشاهده نشد. باتوجهبه اندازه اثر زمان میتوان نتیجه گرفت اثر تزریق وریدی در کاهش قند خون از تزریق زیرجلدی در طول زمان بیشتر بود. این تغییرات در تصویر شماره 1 دیده میشود.
سکته مغزی دومین علت شایع مرگومیر و اولین علت ناتوانی در بزرگسالان در جهان است [1]. سکته مغزی را میتوان به حمله ایسکمیک گذرا، سکته مغزی ایسکمیک، سکته مغزی هموراژیک و خونریزی زیر عنکبوتیه تقسیم کرد. سکته مغزی ایسکمیک حاد میتواند عواقب جدی مادامالعمر داشته باشد [2]. ازآنجاییکه سکته مغزی بهعنوان یک بیماری ناشی از قرار گرفتن طولانیمدت در معرض عوامل خطر مرتبط با سبک زندگی در نظر گرفته میشود، اصلاح این عوامل خطر بهشدت بر وقوع سکته مغزی و سطح ناتوانی مرتبط با سکته تأثیر میگذارد [3]. تأیید شده است که عوامل خطر سکته مغزی ترومبوتیک ایسکمیک، شامل عوامل خطر قابلاصلاح و غیرقابلاصلاح است که جنسیت، سن، قومیت و نژاد بهعنوان عوامل غیرقابلتغییر و فشار خون بالا، دیس لیپیدمی، دیابت شیرین و سیگار بهعنوان عوامل خطر قابلاصلاح هستند [3، 4].
هیپرگلیسمی یک هدف درمانی رایج و ضروری در سکته مغزی ایسکمیک حاد با و بدون دیابت پیش از بیماری است [5, 6]. هیپرگلیسمی تقریباً در 40 درصد از بیماران سکته مغزی ایسکمیک حاد دیده میشود [7, 8]. همانند سطح گلوکز قبل از بستری، هیپرگلیسمی در این بیماران ممکن است منعکسکننده کنترل ضعیف دیابت مزمن باشد که نشاندهنده یک پاسخ فیزیولوژیک گذرا به یک بیماری متقابل (هیپرگلیسمی استرس)، یا ترکیبی از این دو است [9, 10].
انفوزیون داخلوریدی مداوم یا تزریق زیرجلدی انسولین درمان اصلی برای کنترل قند خون پس از سکته مغزی در مرحله حاد است [11, 12]. بااینحال شواهد کمی درمورد اینکه کدام روش تجویز بهتر است گزارش شده است [13]. در آزمایشی با مقایسه انسولین داخلوریدی و زیرجلدی در مدیریت هیپرگلیسمی در بیماران پس از سکته، انسولیندرمانی داخلوریدی اثر بهتری بر کاهش گلوکز خون با افزایش خطر رویدادهای کاهش قند خون قابلکنترل داشت [14]. باتوجهبه کمبود شواهد در این زمینه و باتوجهبه اهمیت مدیریت هیپرگلیسمی در بیماران سکته مغزی ایسکمیک حاد، هدف ما بررسی نوسانات قند خون با انسولین داخلوریدی و زیرجلدی در مدیریت بیماران دیابتی و سکته مغزی ایسکمیک حاد بود. علاوهبراین، تغییرات هیپوگلیسمی و هیپوکالمیک در این بیماران نیز بررسی شد.
روشها
این مطالعه تحلیلیمقطعی روی 242 بیمار دیابتی که با سکته مغزی ایسکمیک حاد به اورژانس بیمارستان مراجعه کرده بودند و با روش تصویربرداری توموگرافی کامپیوتری (CT-Scan)، تشخیص ایسکمیک بودن سکته آنها تأیید شده بود، انجام گرفت. روش نمونهگیری بهصورت تدریجی بود. معیارهای ورود شامل سن بالای 18 سال، ابتلا به دیابت نوع دوم، ابتلا به سکته مغزی ایسکمیک حاد ایسکمیک، مراجعه به بیمارستان طی 12 ساعت از شروع علائم و معیارهای عدم ورود به مطالعه وجود حوادث خونریزیدهنده مغزی همراه با سکته مغزی ایسکمیک حاد، افراد باردار، افراد بستریشده در بخش مراقبتهای ویژه اورژانس پیش از بروز سکته مغزی ایسکمیک حاد، ابتلا به کتواسیدوز دیابتی و ابتلا به هیپرگلایسمی هایپراسمولار بود. این طرح پس از کسب تأییدیه از کمیته اخلاق دانشگاه (IR.GUMS.REC.1397.508) و مطابق با استانداردهای اخلاقی مندرج در اعلامیه 1964 هلسینکی و اصلاحات بعدی آن انجام شد. باتوجهبه اینکه کنترل قند افراد دیابتی جزو درمانهای روتین آنان است مداخله بیشتری صورت نپذیرفت. در زمان بستری به بیماران اطلاع داده شد دادههای آنها میتواند برای اهداف تحقیقاتی مورد استفاده قرار گیرد.
در مرکز موردمطالعه، پس از انتقال بیمار به در ورودی بیمارستان، متخصص طب اورژانس بیمار را تریاژ کرد و تشخیص ابتدایی محتمل با اولویت بیماریهای اورژانسی، مثل سکته مغزی صورت پذیرفت. بیماران مشکوک به سکته مغزی، بلافاصله بهCT سیتیاسکن و امآرآی بخش رادیولوژی، واقع در مجاورت اورژانس بیمارستان منتقل شده و باتوجهبه نتایج تصویربرداریهای اورژانسی، تشخیص سکته مغزی و نوع آن (ایسکمیک یا هموراژیک) توسط پزشک متخصص طب اورژانس و نورولوژی رد یا تأیید شد. در صورت تأیید سکته مغزی، بیمار به بخش مراقبتهای ویژه اورژانس منتقل شده و درمان دارویی و حمایتی بیمار آغاز میشد. در این مطالعه که بر روی بیماران دیابتی که سکته مغزی ایسکمیک داشتهاند انجام شد، مصرف داروهای خوراکی کاهنده قند خون قطع شد و بیماران دیابتی، ضمن درمان مرتبط با سکته مغزی ایسکمیک حاد، تحت پروتکل انسولین رگولار تحت جلدی یا وریدی قرار گرفتند.
انتخاب روش تزریق انسولین برحسب شرایط بالینی بیماران بوده است. در هر گروه قند خون و پتاسیم بیماران طی 24 ساعت اول، هر 6 ساعت بعد از بستری و تزریق انسولین، به همراه سایر متغیرها ثبت و گزارش شد. بیماران با در نظر گرفتن قند پایه بیشتر از 180 میلیگرم در دسیلیتر تحت پروتکل انسولین رگولار تحت جلدی یا وریدی قرار گرفتند. هدف حفظ قند خون بیماران در هر دو روش (وریدی و زیرجلدی) بین 140 تا 180 میلیگرم در دسیلیتر بوده است که در قند کمتر از 140 میلیگرم در دسیلیتر تجویز انسولین قطع شده و شروع مجدد آن براساس افزایش قند خون، بیشتر از مقدار هدف بود. همچنین در افراد با قند خون کمتر از 60 میلیگرم در دسیلیتر که در معرض هایپوگلاسیمی بودند درمان انسولین قطع شد و تحت مداخله 50 میلیلیتر دکستروز 50 درصد تزریقی قرار گرفتند. با بروز هایپوگلاسیمی حداقل 4 ساعت بعد از کنترل، رژیم انسولین در صورت نیاز تکرار شد.
تجزیهوتحلیل آماری
تجزیهوتحلیلهای آماری با استفاده از نرمافزار SPSS نسخه 20 انجام شد. دادهها بهصورت انحراف معیار و میانگین برای متغیرهای کمی و تعداد (درصد) برای متغیرهای کیفی ارائه شدند. با استفاده از روشهای کمی، مانند شاخص چولگی و کشیدگی و آزمون شاپیرو ویلک به بررسی نرمالیتی متغیرهای کمی پرداخته شد. متغیرهای کمی از توزیع نرمالی برخوردار بودند. جهت مقایسه ویژگیهای جمعیتشناختی از قبیل سن، جنس، طول مدت سابقه دیابت و برخی از بیماریهای زمینهای آزمودنیهای پژوهش در 2 گروه تحت درمان با انسولین ازطریق انفوزیون داخلوریدی یا تزریق زیرجلدی، باتوجهبه ماهیت عامل، از آزمون تی مستقل و آزمونی کایدو استفاده شد. بهمنظور مقایسه میانگین قند خون در 2 گروه موردمطالعه به تفکیک زمانهای اندازهگیری، آزمون تی مستقل به کار برده شد. از آزمون آنالیز واریانس یکطرفه اندازهگیری مکرر جهت تعیین روند تغییرات قند خون در طول زمانهای اندازه به تفکیک گروههای موردمطالعه و تأثیر همزمان گروه و زمان و همچنین تعیین این روند تغییرات به تفکیک سطح قند خون اولیه استفاده شد. با استفاده از آنالیز کوورایانس، ارتباط بین فاکتورهای تأثیرگذار بر میزان قند خون در بیماران سکته مغزی ایسکمیک حاد با حذف اثر قند خون در بدو ورود بررسی شد. P<0/05 ازنظر آماری معنیدار در نظر گرفته شد.
یافتهها
درمجموع 570 بیمار مبتلا به سکته مغزی ایسکمیک حاد که ترومبولیز داخلوریدی دریافت کرده بودند غربالگری شدند و 242 مورد تحت درمان با انسولین ازطریق انفوزیون داخلوریدی یا تزریق زیرجلدی قرار گرفتند. پس از حذف بیمارانی که اطلاعات گلوکز کافی نداشتند یا به دلایل غیرپزشکی انسولیندرمانی را به حالت تعلیق درآورده بودند، 242 شرکتکننده وارد تجزیهوتحلیل نهایی شدند.
مقایسه برخی از ویژگیهای جمعیتشناختی آزمودنیهای پژوهش از قبیل سن، جنس، طول مدت سابقه دیابت و برخی از بیماریهای زمینهای 2 گروه در جدول شماره 1 گزارش شده است.

فراوانی هایپرلیپیدمی در بیماران گروه داخلوریدی بهطور معنیداری بیشتر از بیماران گروه زیرجلدی بوده است (0/027=p). همچنین فراوانی پرفشاری خون در بیماران گروه داخلوریدی بیشتر از بیماران گروه زیرجلدی بود و این تفاوت ازلحاظ آماری بهطور مرزی معنیدار بود (0/055=P).
تغییرات قند خون از بدو ورود تا 24 ساعت از پذیرش بیماران
در جدول شماره 2 به مقایسه بین و درونگروهی تغییرات قند خون از بدو ورود تا 24 ساعت پس از پذیرش بیماران پرداخته شد.

در مقایسات بینگروهی، میانگین قند خون بین 2 گروه دریافتکننده انسولین ازطریق انفوزیون داخلوریدی و تزریق زیرجلدی در زمانهای بدو ورود، 6 و 12 ساعت بعد، تفاوت آماری معنیداری داشت (001/P<0 و 0/016=P). میانگین قند خون در گروه وریدی بهطور معنیداری بیشتر از گروه زیرجلدی بود، اما تفاوت معنیداری در میانگین قند خون در 18 ساعت و 24 ساعت پس از پذیرش بین 2 گروه مشاهده نشد (05/P>0). همچنین براساس یافتههای آنالیز واریانس یکطرفه اندازهگیری مکرر، درون هر دو گروه، در طول زمان، کاهش قند خون بهطور معنیداری مشاهده شد. مقایسات زوجی نشان داد این تفاوت بین زمانهای بدو ورود تا 6 ساعت، 6 ساعت تا 12 ساعت و 12 تا 18 ساعت بهطور آماری معنیدار بود، اما بین زمان 18 تا 24 تفاوت معنیداری مشاهده نشد. باتوجهبه اندازه اثر زمان میتوان نتیجه گرفت اثر تزریق وریدی در کاهش قند خون از تزریق زیرجلدی در طول زمان بیشتر بود. این تغییرات در تصویر شماره 1 دیده میشود.
مقایسه هایپوکالمی و مدتزمان کنترل قند خون در 24 ساعت اول
نتایج مقایسه هایپوکالمی و مدتزمان کنترل قند خون در 24 ساعت اول بین آزمودنیهای 2 گروه در جدول شماره 3 نشان داده شده است.

تفاوت معنیداری در فراوانی هایپوکالمی بین 2 گروه مشاهده شد. فراوانی هایپوکالمی در بیماران گروه داخلوریدی بهطور معنیداری بیشتر از گروه زیرجلدی بوده است (0/007=P). همچنین میانگین مدتزمان تحت کنترل قند خون در 24 ساعت اول در بیماران زیرجلدی بهطور معنیداری کمتر از بیماران گروه داخلوریدی بود (0/001>P).
مقایسه اثر تجویز وریدی و زیرجلدی بر میزان قند خون براساس تفکیک سطح قند خون اولیه
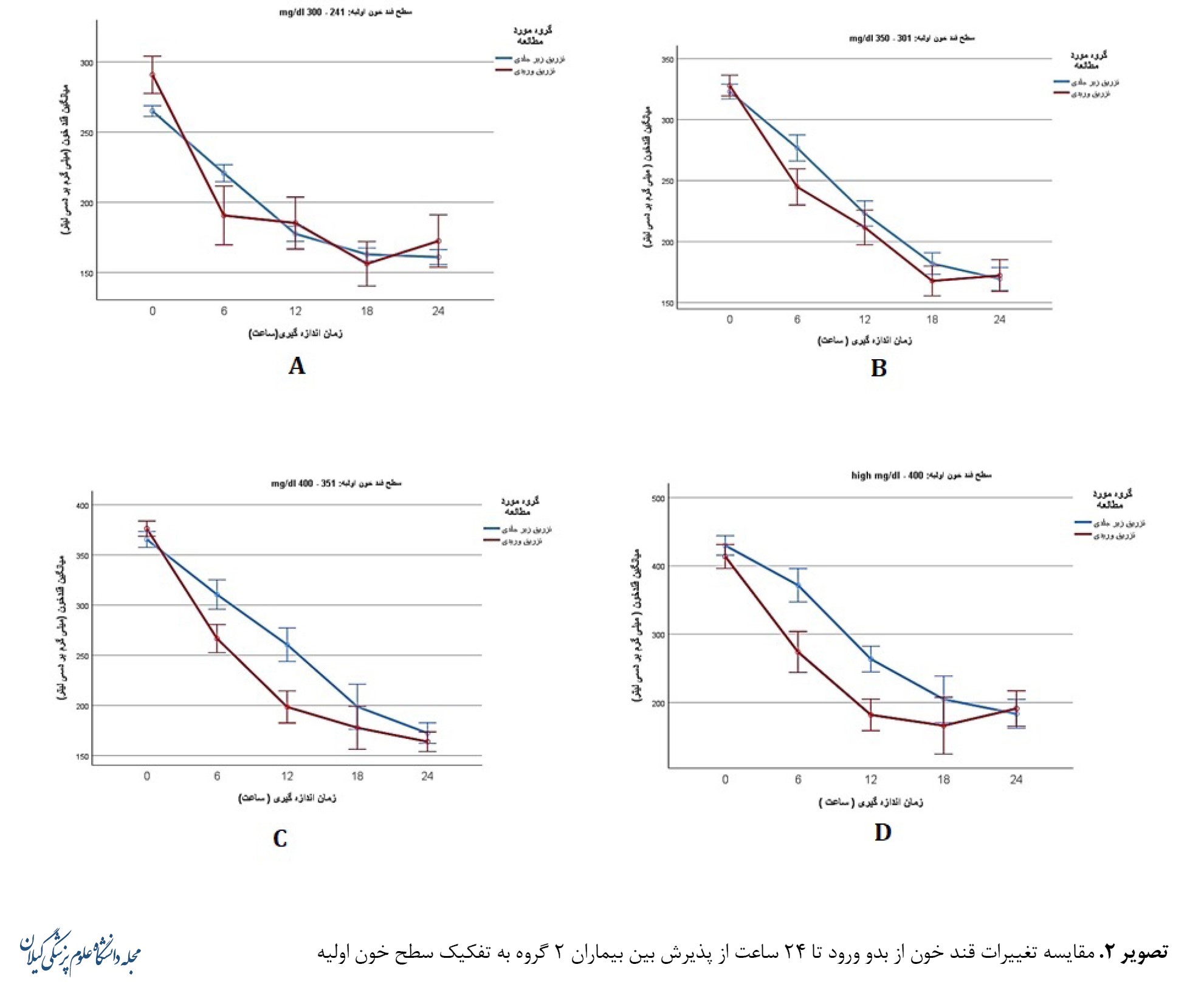
اثر تجویز انسولین وریدی و زیرجلدی بر میزان قند خون در طول 24 ساعت اول، به تفکیک سطح قند خون اولیه در تصویر شماره 2 نشان داده شده است.
تفاوت معنیداری بین اثر 2 روش تجویز زیرجلدی و داخلوریدی در کاهش قند خون در زمانیکه میانگین قند خون اولیه بین 241 تا 300 میلیگرم بوده است وجود نداشت. اما با افزایش سطح قند خون اولیه به بالاتر از محدوده 300 میلیگرم، سرعت کاهندگی قند خون توسط روش داخلوریدی بهطور معنیداری بیشتر از روش زیرجلدی بوده است. در مطالعه ما، سرعت کاهش قند خون در تجویز داخلوریدی انسولین در هر سه گروه از بیماران با قند خون اولیه بین 301 تا 350 میلی گرم (0/023=p)، 351 تا 400 میلیگرم (0/002=p) و بالاتر از 400 میلیگرم (0/001=p) در مقایسه با روش زیرجلدی بهطور معنیداری بیشتر بوده است.
زمانیکه سطح قند خون اولیه بین 241 تا 300 میلیگرم بوده است، تجویز داخلوریدی با سرعت بیشتری منجر به کاهش قند خون 6 ساعت پس از پذیرش بیمار شده بود. پس از آن تفاوت معنیداری در میانگین قند خون پس از 12، 18 و 24 ساعت بعد از پذیرش بین 2 گروه وجود نداشت (تصویر شماره 2 A). زمانیکه سطح قند خون اولیه بین 301 تا 350 میلیگرم بوده است، تجویز داخلوریدی با سرعت بیشتری منجر به کاهش قند خون 6 ساعت پس از پذیرش بیمار شده بود. پس از آن تفاوت معنیداری در میانگین قند خون پس از 12، 18 و 24 ساعت بعد از پذیرش بین 2 گروه وجود نداشت (تصویر شماره 2 B). زمانیکه سطح قند خون اولیه بین 351 تا 400 میلیگرم بوده است، تجویز داخلوریدی با سرعت بیشتری منجر به کاهش قند خون 6 ساعت و 12 ساعت پس از پذیرش بیمار شده بود. پس از آن تفاوت معنیداری در میانگین قند خون پس از 18 و 24 ساعت بعد از پذیرش بین 2 گروه وجود نداشت (تصویر شماره 2 C). زمانیکه سطح قند خون اولیه بالاتر از 400 میلیگرم بوده است، تجویز داخلوریدی با سرعت بیشتری منجر به کاهش قند خون 6 ساعت و 12 ساعت پس از پذیرش بیمار شده بود. پس از آن تفاوت معنیداری در میانگین قند خون پس از 18 و 24 ساعت بعد از پذیرش بین 2 گروه وجود نداشت (تصویر شماره 2 D).
ارتباط بین فاکتورهای تأثیرگذار بر میزان قند خون در بیماران سکته مغزی ایسکمیک حاد در 24 ساعت اول
ارتباط بین فاکتورهای تأثیرگذار بر میزان قند خون در بیماران سکته مغزی ایسکمیک حاد در 24 ساعت اول در جدول شماره 4 نشان داده شده است.
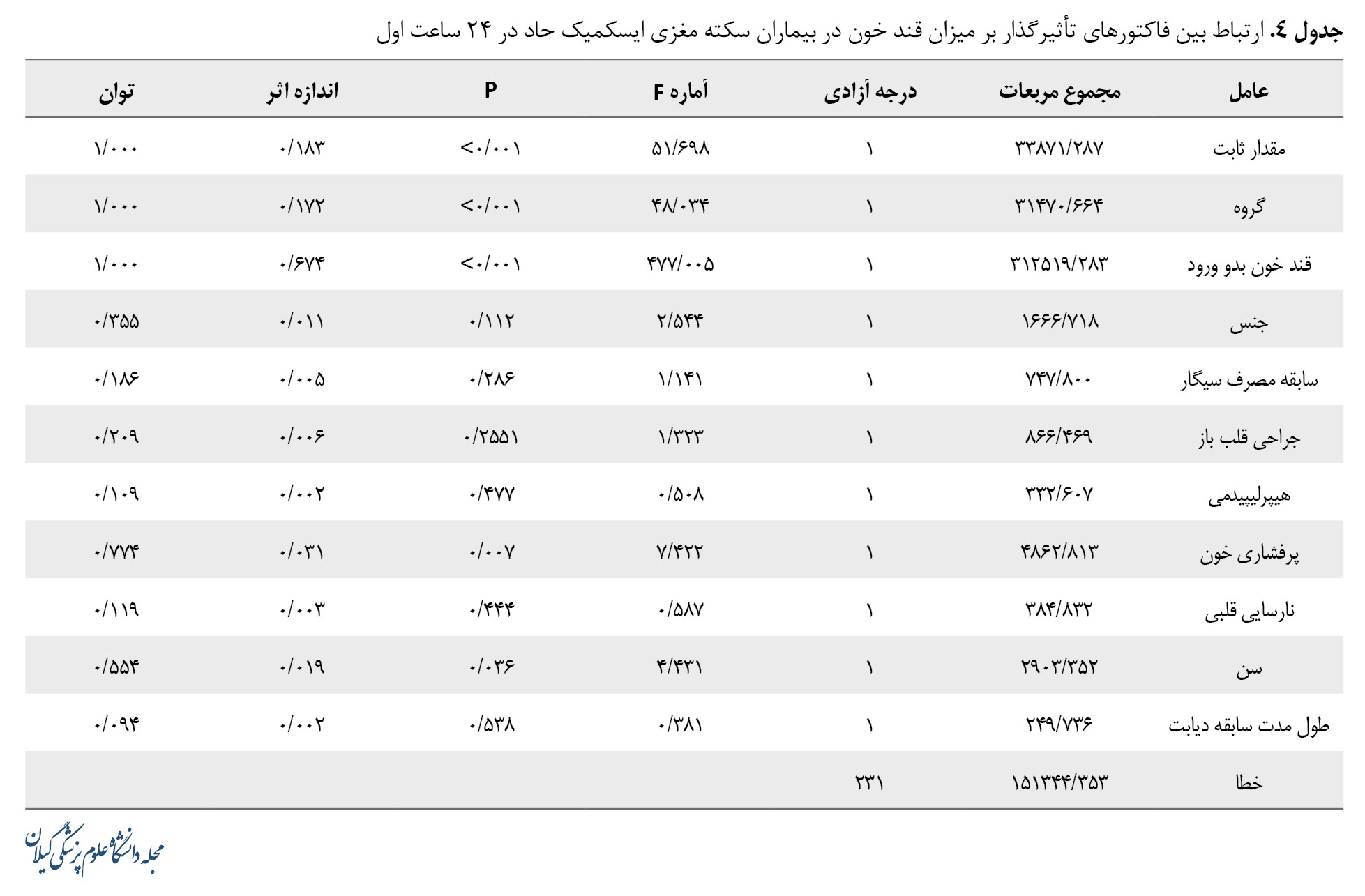
ارتباط معنیداری بین نوع تجویز انسولین بر کنترل میزان قند خون در طول 24 ساعت اول در بیماران مشاهده شد (0/001>P). علاوه بر نوع تجویز انسولین، فاکتورهایی از قبیل قند خون بدو ورود (0/001>P)، پرفشاری خون (0/007=P) و سن (0/036=P) ارتباط مثبت و معنیداری با میزان قند خون در بیماران سکته مغزی ایسکمیک حاد در 24 ساعت اول نشان دادند. بهعبارتی افزایش سن و پرفشاری خون با افزایش سطح قند خون در بیماران سکته مغزی ایسکمیک حاد در 24 ساعت اول، همراه بودند.
بحث
ازآنجاییکه استرس هایپرگلایسمی یکی از نشانههای مرگومیر در کوتاهمدت و بهبود عملکرد ضعیف در بیماران پس از سکته مغزی ایسکمیک حاد است، کنترل و مدیریت سریع آن جهت حفظ حیات بیماران بسیار ارزشمند است. به همین منظور، در این تحقیق بر آن شدیم تا کارایی 2 روش تزریق وریدی و زیرجلدی انسولین جهت کنترل هایپرگلایسمی در بیماران سکته مغزی ایسکیمیک مبتلا به دیابت نوع 2 را مورد مقایسه قرار دهیم.
در همین راستا برخی مطالعات به بررسی تجویز انسولین داخلوریدی و زیرجلدی در کنترل قند خون در بیماران دچار سکته مغزی ایسکمیک پرداختند. برای مثال، استازوسکی و همکاران (2011) به ارزیابی کنترل تهاجمی و زیرجلدی قند خون افراد غیردیابتی مبتلا به سکته مغزی ایسکمیک حاد در 2 گروه 24 نفری پرداختند. بیماران با قند خون اولیه 126 تا 180 میلیگرم وارد مطالعه شده بودند. نتایج تحقیق آنها نشان داد در گروه غیرتهاجمی و تهاجمی، میانگین قند خون طی 24 ساعت اول و نیز ساعت 24 بعد از مطالعه به ترتیب برابر 88 و 99 میلیگرم بود که از این لحاظ تفاوت معنیداری بین 2 گروه مشاهده شد. تفاوت معنیداری در سایر پارامترها ازجمله نمره مقیاس سکته مغزی مؤسسه ملی سلامت و مورتالیتی بین 2 گروه مشاهده نشد. این محققین نتیجهگیری کردند درمان وریدی انسولین در افراد دچار سکته مغزی ایسکمیک حاد ایسکیمیک و هایپرگلاسیمی متوسط، نسبتاً ایمن بوده و ممکن است پیامد بالینی این بیماران را بهبود دهد [15]. نتایج تحقیق ما تا حدود زیادی همسو با یافتههای این مطالعه است. در تحقیق ما تجویز داخلوریدی انسولین بهویژه در 6 و 12 ساعات اولیه مؤثرتر از نوع زیرجلدی بود و سریعتر منجر به کاهش قند خون شده بود. از طرفی هیچگونه اثرات جانبی جدی ناشی از آن در بیماران گزارش نشد. هرچند، فراوانی بروز هایپوکالمی در بیماران گروه انسولین وریدی بهطور معنیداری بیشتر از گروه زیرجلدی بوده است. در مطالعه دیگری روسو و همکاران [16] تأثیر انسولین زیرجلدی و وریدی را برای کنترل هایپرگلاسیمی بعد از سکته مغزی ایسکمیک حاد در بیماران مقایسه کردند. نتایج تحقیق آنها نشان داد درمان وریدی انسولین در مقایسه با روش زیرجلدی کنترل قند خون بهتری ایجاد کرد. همچنین شیوع مرگومیر در گروه وریدی کمتر بود، اما معنیدار نبود. البته در گروه تحت جلدی بروز نواحی انفارکته کمتر از گروه وریدی مشاهده شده بود. همچنین ازنظر ناتوانی جسمی عوارض جدی سکته مغزی ایسکمیک حاد، 2 گروه تفاوت معنیداری با هم نداشتند [16]. نتایج این مطالعه تا حدود زیادی همسو با یافتههای تحقیق ما بوده است. در مطالعه ما نیز تجویز وریدی انسولین بدون عارضه خاصی (بهجز هایپوکالمی) منجر به کنترل سریعتر قند خون، بهویژه در ساعات اولیه پس از پذیرش بیمار شده بود. بنابراین این نتایج دال بر این است که تجویز وریدی انسولین بدون اثر جانبی جدی در بیماران اثربخشی قویتر و سریعتری در کنترل و مدیریت قند خون دارد. در تحقیق برونو و همکاران[17] تأثیر روشهای زیرجلدی و وریدی انسولین در کنترل قند خون در بیماران مبتلا به سکته مغزی ایسکمیک بررسی شد. تمام بیماران در گروه وریدی دارای دیابت بودند و 73 درصد از بیماران در گروه جلدی دارای دیابت بودند. نتایج بررسی آنها نشان داد تجویز وریدی انسولین در مقایسه با نوع زیرجلدی بهطور مؤثرتری منجر به کاهش قند خون در طول مطالعه شده بود. بروز هایپوگلیسمی تنها در گروه وریدی و در 35 درصد از بیماران مشاهده شد که حدود 13 درصد آنها نیز علائم بسیار جزئی و تنها یک مورد علائم نورولوژیکی نشان دادند. در سایر موارد تفاوت معنیداری بین 2 گروه مشاهده نشد. بنابراین، این محققین نتیجهگیری کردند که تجویز داخلوریدی انسولین بهطور مؤثرتری هایپرگلیسمی را در این بیماران در بازه زمانی کوتاهتری برطرف کرده و گزینه بهتری در مقایسه با نوع زیرجلدی بدون ایجاد عارضه جانبی جدی است [17]. نتایج این تحقیق تا حدود زیادی همسو با یافتههای تحقیق ما بوده است. در مطالعه ما تجویز داخلوریدی انسولین، بهویژه در 6 و 12 ساعت اولیه پذیرش بیمار بهطور سریعتر و مؤثرتری منجر به کاهش سطح گلوکز خون شده بود و از طرفی عارضه جانبی خاصی نیز در بیماران مشاهده نشد. در مطالعه کارآزمایی بالینی دیگری کریسل و همکاران (2009) تأثیر روشهای زیرجلدی و وریدی انسولین را در کنترل قند خون در 40 بیمار مبتلا به سکته مغزی ایسکمیک مقایسه کردند. نتایج مطالعه آنها نشان داد میزان هایپوگلیسمی در گروه دریافتکننده انسولین وریدی بهطور معنیداری بیشتر از گروه زیرجلدی بوده است. سطح قند خون در بیماران دریافتکننده انسولین وریدی در مدتزمان کوتاهتری در مقایسه با گروه زیرجلدی کاهش یافته بود. بنابراین، این محققین نتیجهگیری کردند که در مقایسه با روش زیرجلدی، روش داخلوریدی بهطور مؤثرتری منجر به کاهش گلوکز خون در این بیماران شده است، اما ریسک هایپوگلیسمی در این گروه بیشتر است [14]. نتایج این تحقیق تا حدود زیادی همسو با یافتههای تحقیق ما است. در مطالعه ما، تنها فراوانی بروز هایپوکالمی در بیماران گروه انسولین وریدی بهطور معنیداری بیشتر از گروه زیرجلدی بوده است. در سایر موارد هیچگونه تفاوتی بین بیماران 2 گروه وجود نداشت.
بنابراین باتوجهبه نتایج حاصل از این تحقیق و مطالعات قبلی، تجویز انسولین وریدی در مقایسه با انسولین زیرجلدی بهطور مؤثرتری منجر به کاهش قند خون بهویژه در ساعات اولیه (6 و 12 ساعت اول) در بیماران مبتلا به سکته مغزی ایسکمیک میشود. یکی از پارامترهای مهم تأثیرگذار بر اثر انسولین سطح قند خون اولیه بیماران است، بهطوریکه تفاوت اثر کاهنده قند خون در گروه با تزریق وریدی نسبت به زیرجلدی در بیماران با قند خون بیش از 300 میلیگرم بر دسیلیتر معنیدار بود و این تفاوت با افزایش سطح قند خون اولیه مشهودتر شد. البته این نکته نیز حائز اهمیت است که مواردی دیگری از قبیل سن و سابقه هایپرتانسیون بیماران بهعنوان فاکتورهای تأثیرگذار بر میزان قند خون در بیماران سکته مغزی ایسکمیک حاد در 24 ساعت اول محسوب میشوند که نیازمند بررسی بیشتر هستند.
باتوجهبه اینکه روش وریدی انسولین بهطور مؤثرتری و بدون عارضه جدی منجر به کنترل یا کاهش قند خون بهخصوص در قند خون اولیه بالای 300 میلیگرم بر دسیلیتر در بیماران دیابتی مبتلا به سکته مغزی ایسکمیک در ساعات اولیه پذیرش شد، به نظر میرسد تجویز این روش در مقایسه با روش جلدی در کنترل افزایش قند خون اولیه و حفظ حیات بیماران، بهویژه بیماران با سطح قند خون اولیه بالاتر مؤثرتر باشد. هرچند قبل از اقدام تجویز، وضعیت فاکتورهای تأثیرگذاری، از قبیل سطح قند خون اولیه، سن بیماران و سابقه هایپرتانسیون در بیماران باید مورد بررسی قرار گیرد. از سویی باید بیمار ازنظر وقوع عوارضی مانند هایپوکالمی تحت نظر باشد.
مطالعه بر روی کنترل هایپرگلایسمی در بیماران دیابتی با شرایط بالینی متفاوت، بهویژه بیمارانی که با کتواسیدوز دیابتی به بیمارستانها مراجعه میکنند از اهمیت بالایی برخوردار است. امروزه مقایسه بین انسولینهای کوتاه اثر زیرجلدی و انسولین وریدی انجام میپذیرد. برخی از این مطالعات اثر مشابهی بین این دو رژیم درمانی مشاهده کردند. انتخاب نوع رژیم درمانی به سطح قند خون اولیه، شرایط بالینی بیمار و تصمیم پزشک معالج وابسته است. اکثر مطالعاتی که بر روی بیماران با شرایط بالینی وخیم و بستری در بخش مراقبتهای ویژه درزمینه کنترل دیابت انجام شده است از درمان انسولین وریدی حمایت کردهاند. در اکثر مطالعات نوسانات قند خون در ساعات اولیه، بروز هایپوگلایسمی و هایپوکالمی با تجویز انسولین وریدی بیشتر دیده شده است که این قضیه نشان میدهد بیمارانی که تحت درمان انسولین وریدی قرار میگیرند علیرغم کنترل سریعتر و دقیقتر قند خون باید تحت پایش مداوم و ترجیحاً در بخشهای مراقبت ویژه باشند [13، 18].
در بیماران سکته مغزی ایسکیمیک یکی از مواردی که شروع درمان ترومبولیز را به تعویق میاندازد سطح قند خون بالا است. ازاینرو بیمارانی که کاندیدای این درمان هستند بهتر است هرچه سریعتر سطح قند خونشان کنترل شود. ازاینرو در برخی موارد از درمان انسولین وریدی، جهت این بیماران استفاده میشود. همچنین استرس هایپرگلایسمی باعث عوارض و پیامد نهایی بدتر در بیماران سکته مغزی ایسکمیک که تحت درمان ترومبولیز قرار میگیرند میشود [19, 20].
نتیجهگیری
همانطور که در نتایج مطالعه دیده شد در گروه دریافتکننده انسولین وریدی سطح قند خون اولیه بهصورت معنیدار از گروه دریافتکننده انسولین زیرجلدی بالاتر بوده است که این یکی از مواردی است که در تصمیم درمانگر جهت انتخاب رژیم درمانی باتوجهبه شرایط بالینی بیمار جهت کاهش عوارض سکته مغزی ایسکمیک و انتخاب درمان ترومبولیز در زمان مناسب تأثیرگذار است.
از محدودیتهای اصلی این تحقیق وجود تعداد کم نمونه در گروه وریدی در مقایسه با گروه زیرجلدی بوده است. این تفاوت در تعداد نمونه احتمالاً بر روی برخی نتایج تأثیرگذار بوده و توصیه میشود مطالعهای مشابه با حجم نمونه بیشتر و همسان در 2 گروه برای تأیید نتایج کنونی انجام شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه مصوب شورای پژوهشی دانشگاه علومپزشکی گیلان با شناسه اخلاق IR.GUMS.REC.1397.508 است.
حامی مالی
این تحقیق هیچگونه کمک مالی از سازمانهای تأمین مالی در بخشهای عمومی، تجاری یا غیرانتفاعی دریافت نکرد.
مشارکت نویسندگان
مفهومسازی و اعتبارسنجی: سید مهدی ضیا ضیابری، بهرنگ معتمد، بابک بخشایش اقبالی، نازنین نوری رودسری، و یاسمن کامیار؛ روششناسی: سید مهدی ضیا ضیابری، نازنین نوری رودسری، یاسمن کامیار، محمدعلی یزدانیپور؛ تحقیق: سیدمهدی ضیا ضیابری، بهرنگ معتمد، بابک بخشایش اقبالی، نازنین نوری رودسری و یاسمن کامیار؛ نگارش پیشنویس: نازنین نوری رودسری، یاسمن کامیار، اشکان عسگری گشت رودخانی، و محمدعلی یزدانیپور؛ ویراستاری و نهاییسازی نوشته: همه نویسندگان؛ مدیریت پروژه: سید مهدی ضیا ضیابری، بهرنگ معتمد، بابک بخشایش اقبالی، نازنین نوری رودسری.
تعارض منافع
بنابر اظهار نویسندگان این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان مراتب سپاس و قدردانی خود را از دفتر توسعه آموزش علومپزشکی پورسینا و مرکز تحقیقات علوم اعصاب دانشگاه علومپزشکی گیلان اعلام میدارند.
زمانیکه سطح قند خون اولیه بین 241 تا 300 میلیگرم بوده است، تجویز داخلوریدی با سرعت بیشتری منجر به کاهش قند خون 6 ساعت پس از پذیرش بیمار شده بود. پس از آن تفاوت معنیداری در میانگین قند خون پس از 12، 18 و 24 ساعت بعد از پذیرش بین 2 گروه وجود نداشت (تصویر شماره 2 A). زمانیکه سطح قند خون اولیه بین 301 تا 350 میلیگرم بوده است، تجویز داخلوریدی با سرعت بیشتری منجر به کاهش قند خون 6 ساعت پس از پذیرش بیمار شده بود. پس از آن تفاوت معنیداری در میانگین قند خون پس از 12، 18 و 24 ساعت بعد از پذیرش بین 2 گروه وجود نداشت (تصویر شماره 2 B). زمانیکه سطح قند خون اولیه بین 351 تا 400 میلیگرم بوده است، تجویز داخلوریدی با سرعت بیشتری منجر به کاهش قند خون 6 ساعت و 12 ساعت پس از پذیرش بیمار شده بود. پس از آن تفاوت معنیداری در میانگین قند خون پس از 18 و 24 ساعت بعد از پذیرش بین 2 گروه وجود نداشت (تصویر شماره 2 C). زمانیکه سطح قند خون اولیه بالاتر از 400 میلیگرم بوده است، تجویز داخلوریدی با سرعت بیشتری منجر به کاهش قند خون 6 ساعت و 12 ساعت پس از پذیرش بیمار شده بود. پس از آن تفاوت معنیداری در میانگین قند خون پس از 18 و 24 ساعت بعد از پذیرش بین 2 گروه وجود نداشت (تصویر شماره 2 D).
ارتباط بین فاکتورهای تأثیرگذار بر میزان قند خون در بیماران سکته مغزی ایسکمیک حاد در 24 ساعت اول
ارتباط بین فاکتورهای تأثیرگذار بر میزان قند خون در بیماران سکته مغزی ایسکمیک حاد در 24 ساعت اول در جدول شماره 4 نشان داده شده است.

ارتباط معنیداری بین نوع تجویز انسولین بر کنترل میزان قند خون در طول 24 ساعت اول در بیماران مشاهده شد (0/001>P). علاوه بر نوع تجویز انسولین، فاکتورهایی از قبیل قند خون بدو ورود (0/001>P)، پرفشاری خون (0/007=P) و سن (0/036=P) ارتباط مثبت و معنیداری با میزان قند خون در بیماران سکته مغزی ایسکمیک حاد در 24 ساعت اول نشان دادند. بهعبارتی افزایش سن و پرفشاری خون با افزایش سطح قند خون در بیماران سکته مغزی ایسکمیک حاد در 24 ساعت اول، همراه بودند.
بحث
ازآنجاییکه استرس هایپرگلایسمی یکی از نشانههای مرگومیر در کوتاهمدت و بهبود عملکرد ضعیف در بیماران پس از سکته مغزی ایسکمیک حاد است، کنترل و مدیریت سریع آن جهت حفظ حیات بیماران بسیار ارزشمند است. به همین منظور، در این تحقیق بر آن شدیم تا کارایی 2 روش تزریق وریدی و زیرجلدی انسولین جهت کنترل هایپرگلایسمی در بیماران سکته مغزی ایسکیمیک مبتلا به دیابت نوع 2 را مورد مقایسه قرار دهیم.
در همین راستا برخی مطالعات به بررسی تجویز انسولین داخلوریدی و زیرجلدی در کنترل قند خون در بیماران دچار سکته مغزی ایسکمیک پرداختند. برای مثال، استازوسکی و همکاران (2011) به ارزیابی کنترل تهاجمی و زیرجلدی قند خون افراد غیردیابتی مبتلا به سکته مغزی ایسکمیک حاد در 2 گروه 24 نفری پرداختند. بیماران با قند خون اولیه 126 تا 180 میلیگرم وارد مطالعه شده بودند. نتایج تحقیق آنها نشان داد در گروه غیرتهاجمی و تهاجمی، میانگین قند خون طی 24 ساعت اول و نیز ساعت 24 بعد از مطالعه به ترتیب برابر 88 و 99 میلیگرم بود که از این لحاظ تفاوت معنیداری بین 2 گروه مشاهده شد. تفاوت معنیداری در سایر پارامترها ازجمله نمره مقیاس سکته مغزی مؤسسه ملی سلامت و مورتالیتی بین 2 گروه مشاهده نشد. این محققین نتیجهگیری کردند درمان وریدی انسولین در افراد دچار سکته مغزی ایسکمیک حاد ایسکیمیک و هایپرگلاسیمی متوسط، نسبتاً ایمن بوده و ممکن است پیامد بالینی این بیماران را بهبود دهد [15]. نتایج تحقیق ما تا حدود زیادی همسو با یافتههای این مطالعه است. در تحقیق ما تجویز داخلوریدی انسولین بهویژه در 6 و 12 ساعات اولیه مؤثرتر از نوع زیرجلدی بود و سریعتر منجر به کاهش قند خون شده بود. از طرفی هیچگونه اثرات جانبی جدی ناشی از آن در بیماران گزارش نشد. هرچند، فراوانی بروز هایپوکالمی در بیماران گروه انسولین وریدی بهطور معنیداری بیشتر از گروه زیرجلدی بوده است. در مطالعه دیگری روسو و همکاران [16] تأثیر انسولین زیرجلدی و وریدی را برای کنترل هایپرگلاسیمی بعد از سکته مغزی ایسکمیک حاد در بیماران مقایسه کردند. نتایج تحقیق آنها نشان داد درمان وریدی انسولین در مقایسه با روش زیرجلدی کنترل قند خون بهتری ایجاد کرد. همچنین شیوع مرگومیر در گروه وریدی کمتر بود، اما معنیدار نبود. البته در گروه تحت جلدی بروز نواحی انفارکته کمتر از گروه وریدی مشاهده شده بود. همچنین ازنظر ناتوانی جسمی عوارض جدی سکته مغزی ایسکمیک حاد، 2 گروه تفاوت معنیداری با هم نداشتند [16]. نتایج این مطالعه تا حدود زیادی همسو با یافتههای تحقیق ما بوده است. در مطالعه ما نیز تجویز وریدی انسولین بدون عارضه خاصی (بهجز هایپوکالمی) منجر به کنترل سریعتر قند خون، بهویژه در ساعات اولیه پس از پذیرش بیمار شده بود. بنابراین این نتایج دال بر این است که تجویز وریدی انسولین بدون اثر جانبی جدی در بیماران اثربخشی قویتر و سریعتری در کنترل و مدیریت قند خون دارد. در تحقیق برونو و همکاران[17] تأثیر روشهای زیرجلدی و وریدی انسولین در کنترل قند خون در بیماران مبتلا به سکته مغزی ایسکمیک بررسی شد. تمام بیماران در گروه وریدی دارای دیابت بودند و 73 درصد از بیماران در گروه جلدی دارای دیابت بودند. نتایج بررسی آنها نشان داد تجویز وریدی انسولین در مقایسه با نوع زیرجلدی بهطور مؤثرتری منجر به کاهش قند خون در طول مطالعه شده بود. بروز هایپوگلیسمی تنها در گروه وریدی و در 35 درصد از بیماران مشاهده شد که حدود 13 درصد آنها نیز علائم بسیار جزئی و تنها یک مورد علائم نورولوژیکی نشان دادند. در سایر موارد تفاوت معنیداری بین 2 گروه مشاهده نشد. بنابراین، این محققین نتیجهگیری کردند که تجویز داخلوریدی انسولین بهطور مؤثرتری هایپرگلیسمی را در این بیماران در بازه زمانی کوتاهتری برطرف کرده و گزینه بهتری در مقایسه با نوع زیرجلدی بدون ایجاد عارضه جانبی جدی است [17]. نتایج این تحقیق تا حدود زیادی همسو با یافتههای تحقیق ما بوده است. در مطالعه ما تجویز داخلوریدی انسولین، بهویژه در 6 و 12 ساعت اولیه پذیرش بیمار بهطور سریعتر و مؤثرتری منجر به کاهش سطح گلوکز خون شده بود و از طرفی عارضه جانبی خاصی نیز در بیماران مشاهده نشد. در مطالعه کارآزمایی بالینی دیگری کریسل و همکاران (2009) تأثیر روشهای زیرجلدی و وریدی انسولین را در کنترل قند خون در 40 بیمار مبتلا به سکته مغزی ایسکمیک مقایسه کردند. نتایج مطالعه آنها نشان داد میزان هایپوگلیسمی در گروه دریافتکننده انسولین وریدی بهطور معنیداری بیشتر از گروه زیرجلدی بوده است. سطح قند خون در بیماران دریافتکننده انسولین وریدی در مدتزمان کوتاهتری در مقایسه با گروه زیرجلدی کاهش یافته بود. بنابراین، این محققین نتیجهگیری کردند که در مقایسه با روش زیرجلدی، روش داخلوریدی بهطور مؤثرتری منجر به کاهش گلوکز خون در این بیماران شده است، اما ریسک هایپوگلیسمی در این گروه بیشتر است [14]. نتایج این تحقیق تا حدود زیادی همسو با یافتههای تحقیق ما است. در مطالعه ما، تنها فراوانی بروز هایپوکالمی در بیماران گروه انسولین وریدی بهطور معنیداری بیشتر از گروه زیرجلدی بوده است. در سایر موارد هیچگونه تفاوتی بین بیماران 2 گروه وجود نداشت.
بنابراین باتوجهبه نتایج حاصل از این تحقیق و مطالعات قبلی، تجویز انسولین وریدی در مقایسه با انسولین زیرجلدی بهطور مؤثرتری منجر به کاهش قند خون بهویژه در ساعات اولیه (6 و 12 ساعت اول) در بیماران مبتلا به سکته مغزی ایسکمیک میشود. یکی از پارامترهای مهم تأثیرگذار بر اثر انسولین سطح قند خون اولیه بیماران است، بهطوریکه تفاوت اثر کاهنده قند خون در گروه با تزریق وریدی نسبت به زیرجلدی در بیماران با قند خون بیش از 300 میلیگرم بر دسیلیتر معنیدار بود و این تفاوت با افزایش سطح قند خون اولیه مشهودتر شد. البته این نکته نیز حائز اهمیت است که مواردی دیگری از قبیل سن و سابقه هایپرتانسیون بیماران بهعنوان فاکتورهای تأثیرگذار بر میزان قند خون در بیماران سکته مغزی ایسکمیک حاد در 24 ساعت اول محسوب میشوند که نیازمند بررسی بیشتر هستند.
باتوجهبه اینکه روش وریدی انسولین بهطور مؤثرتری و بدون عارضه جدی منجر به کنترل یا کاهش قند خون بهخصوص در قند خون اولیه بالای 300 میلیگرم بر دسیلیتر در بیماران دیابتی مبتلا به سکته مغزی ایسکمیک در ساعات اولیه پذیرش شد، به نظر میرسد تجویز این روش در مقایسه با روش جلدی در کنترل افزایش قند خون اولیه و حفظ حیات بیماران، بهویژه بیماران با سطح قند خون اولیه بالاتر مؤثرتر باشد. هرچند قبل از اقدام تجویز، وضعیت فاکتورهای تأثیرگذاری، از قبیل سطح قند خون اولیه، سن بیماران و سابقه هایپرتانسیون در بیماران باید مورد بررسی قرار گیرد. از سویی باید بیمار ازنظر وقوع عوارضی مانند هایپوکالمی تحت نظر باشد.
مطالعه بر روی کنترل هایپرگلایسمی در بیماران دیابتی با شرایط بالینی متفاوت، بهویژه بیمارانی که با کتواسیدوز دیابتی به بیمارستانها مراجعه میکنند از اهمیت بالایی برخوردار است. امروزه مقایسه بین انسولینهای کوتاه اثر زیرجلدی و انسولین وریدی انجام میپذیرد. برخی از این مطالعات اثر مشابهی بین این دو رژیم درمانی مشاهده کردند. انتخاب نوع رژیم درمانی به سطح قند خون اولیه، شرایط بالینی بیمار و تصمیم پزشک معالج وابسته است. اکثر مطالعاتی که بر روی بیماران با شرایط بالینی وخیم و بستری در بخش مراقبتهای ویژه درزمینه کنترل دیابت انجام شده است از درمان انسولین وریدی حمایت کردهاند. در اکثر مطالعات نوسانات قند خون در ساعات اولیه، بروز هایپوگلایسمی و هایپوکالمی با تجویز انسولین وریدی بیشتر دیده شده است که این قضیه نشان میدهد بیمارانی که تحت درمان انسولین وریدی قرار میگیرند علیرغم کنترل سریعتر و دقیقتر قند خون باید تحت پایش مداوم و ترجیحاً در بخشهای مراقبت ویژه باشند [13، 18].
در بیماران سکته مغزی ایسکیمیک یکی از مواردی که شروع درمان ترومبولیز را به تعویق میاندازد سطح قند خون بالا است. ازاینرو بیمارانی که کاندیدای این درمان هستند بهتر است هرچه سریعتر سطح قند خونشان کنترل شود. ازاینرو در برخی موارد از درمان انسولین وریدی، جهت این بیماران استفاده میشود. همچنین استرس هایپرگلایسمی باعث عوارض و پیامد نهایی بدتر در بیماران سکته مغزی ایسکمیک که تحت درمان ترومبولیز قرار میگیرند میشود [19, 20].
نتیجهگیری
همانطور که در نتایج مطالعه دیده شد در گروه دریافتکننده انسولین وریدی سطح قند خون اولیه بهصورت معنیدار از گروه دریافتکننده انسولین زیرجلدی بالاتر بوده است که این یکی از مواردی است که در تصمیم درمانگر جهت انتخاب رژیم درمانی باتوجهبه شرایط بالینی بیمار جهت کاهش عوارض سکته مغزی ایسکمیک و انتخاب درمان ترومبولیز در زمان مناسب تأثیرگذار است.
از محدودیتهای اصلی این تحقیق وجود تعداد کم نمونه در گروه وریدی در مقایسه با گروه زیرجلدی بوده است. این تفاوت در تعداد نمونه احتمالاً بر روی برخی نتایج تأثیرگذار بوده و توصیه میشود مطالعهای مشابه با حجم نمونه بیشتر و همسان در 2 گروه برای تأیید نتایج کنونی انجام شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه مصوب شورای پژوهشی دانشگاه علومپزشکی گیلان با شناسه اخلاق IR.GUMS.REC.1397.508 است.
حامی مالی
این تحقیق هیچگونه کمک مالی از سازمانهای تأمین مالی در بخشهای عمومی، تجاری یا غیرانتفاعی دریافت نکرد.
مشارکت نویسندگان
مفهومسازی و اعتبارسنجی: سید مهدی ضیا ضیابری، بهرنگ معتمد، بابک بخشایش اقبالی، نازنین نوری رودسری، و یاسمن کامیار؛ روششناسی: سید مهدی ضیا ضیابری، نازنین نوری رودسری، یاسمن کامیار، محمدعلی یزدانیپور؛ تحقیق: سیدمهدی ضیا ضیابری، بهرنگ معتمد، بابک بخشایش اقبالی، نازنین نوری رودسری و یاسمن کامیار؛ نگارش پیشنویس: نازنین نوری رودسری، یاسمن کامیار، اشکان عسگری گشت رودخانی، و محمدعلی یزدانیپور؛ ویراستاری و نهاییسازی نوشته: همه نویسندگان؛ مدیریت پروژه: سید مهدی ضیا ضیابری، بهرنگ معتمد، بابک بخشایش اقبالی، نازنین نوری رودسری.
تعارض منافع
بنابر اظهار نویسندگان این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان مراتب سپاس و قدردانی خود را از دفتر توسعه آموزش علومپزشکی پورسینا و مرکز تحقیقات علوم اعصاب دانشگاه علومپزشکی گیلان اعلام میدارند.
References
1.Farhoudi M, Mehrvar K, Sadeghi-Bazargani H, Hashemilar M, Seyedi-Vafaee M, Sadeghi-Hokmabad E, et al. Stroke subtypes, risk factors and mortality rate in northwest of Iran. Iranian Journal of Neurology. 2017; 16(3):112-7 [PMID]
2.Waziry R, Heshmatollah A, Bos D, Chibnik LB, Ikram MA, Hofman A, et al. Time trends in survival following first hemorrhagic or ischemic stroke between 1991 and 2015 in the rotterdam study. Stroke. 2020; 51(3):STROKEAHA119027198. [DOI:10.1161/STROKEAHA.119.027198] [PMID]
3.Soliman RH, Oraby MI, Fathy M, Essam AM. Risk factors of acute ischemic stroke in patients presented to Beni-Suef University Hospital: Prevalence and relation to stroke severity at presentation. The Egyptian Journal of Neurology, Psychiatry and Neurosurgery. 2018; 54(1):8. [DOI:10.1186/s41983-018-0012-4] [PMID] [PMCID]
4.Kim SY, Guevara JP, Kim KM, Choi HK, Heitjan DF, Albert DA. Hyperuricemia and risk of stroke: A systematic review and meta-analysis. Arthritis and Rheumatism. 2009; 61(7):885-92. [DOI:10.1002/art.24612] [PMID] [PMCID]
5.Jiang Y, Liu N, Han J, Li Y, Spencer P, Vodovoz SJ, et al. Diabetes Mellitus/Poststroke Hyperglycemia: A detrimental factor for tpa thrombolytic stroke therapy. Translational Stroke Research. 2021; 12(3):416-27. [DOI:10.1007/s12975-020-00872-3] [PMID]
6.Shi Z, Guo S, Pan J, Xu C, Geng Y, Zheng S. Increased postoperative fasting glucose is associated with unfavorable outcomes in patients treated with mechanical thrombectomy treatment. Frontiers in Neurology. 2021; 12:668363. [DOI:10.3389/fneur.2021.668363] [PMID] [PMCID]
7.Gentile NT, Seftchick MW, Huynh T, Kruus LK, Gaughan J. Decreased mortality by normalizing blood glucose after acute ischemic stroke. Academic Emergency Medicine. 2006; 13(2):174-80. [DOI:10.1197/j.aem.2005.08.009] [PMID]
8.Williams LS, Rotich J, Qi R, Fineberg N, Espay A, Bruno A, et al. Effects of admission hyperglycemia on mortality and costs in acute ischemic stroke. Neurology. 2002; 59(1):67-71. [DOI:10.1212/WNL.59.1.67] [PMID]
9.Roberts GW, Quinn SJ, Valentine N, Alhawassi T, O’Dea H, Stranks SN, et al. Relative Hyperglycemia, a marker of critical illness: Introducing the stress hyperglycemia ratio. The Journal of Clinical Endocrinology and Metabolism. 2015; 100(12):4490-7. [DOI:10.1210/jc.2015-2660] [PMID]
10.Dungan KM, Braithwaite SS, Preiser JC. Stress hyperglycaemia. Lancet. 2009; 373(9677):1798-807. [DOI:10.1016/S0140-6736(09)60553-5] [PMID]
11.Tumminia A, Crimi S, Sciacca L, Buscema M, Frittitta L, Squatrito S, et al. Efficacy of real-time continuous glucose monitoring on glycaemic control and glucose variability in type 1 diabetic patients treated with either insulin pumps or multiple insulin injection therapy: A randomized controlled crossover trial. Diabetes/Metabolism Research and Reviews. 2015; 31(1):61-8. [DOI:10.1002/dmrr.2557] [PMID]
12.Cerecedo-Lopez CD, Cantu-Aldana A, Patel NJ, Aziz-Sultan MA, Frerichs KU, Du R. Insulin in the management of acute ischemic stroke: A systematic review and meta-analysis. World Neurosurgery. 2020;136:e514-34. [DOI:10.1016/j.wneu.2020.01.056] [PMID]
13.Du LZ, Liu PY, Ge CY, Li Y. Continuous Intravenous versus subcutaneous administration of insulin for glycemic variability in acute ischemic stroke. Neuropsychiatric Disease and Treatment. 2022; 18:1309-14. [DOI:10.2147/NDT.S370776] [PMID] [PMCID]
14.Kreisel SH, Berschin UM, Hammes HP, Leweling H, Bertsch T, Hennerici MG, et al. Pragmatic management of hyperglycaemia in acute ischaemic stroke: safety and feasibility of intensive intravenous insulin treatment. Cerebrovascular Diseases. 2009; 27(2):167-75. [DOI:10.1159/000185608] [PMID]
15.Staszewski J, Brodacki B, Kotowicz J, Stepien A. Intravenous insulin therapy in the maintenance of strict glycemic control in nondiabetic acute stroke patients with mild hyperglycemia. Journal of Stroke and Cerebrovascular Diseases. 2011; 20(2):150-4. [DOI:10.1016/j.jstrokecerebrovasdis.2009.11.013] [PMID]
16.Rosso C, Corvol JC, Pires C, Crozier S, Attal Y, Jacqueminet S, et al. Intensive versus subcutaneous insulin in patients with hyperacute stroke: Results from the randomized INSULINFARCT trial. Stroke. 2012; 43(9):2343-9. [DOI:10.1161/STROKEAHA.112.657122] [PMID]
17.Bruno A, Kent TA, Coull BM, Shankar RR, Saha C, Becker KJ, et al. Treatment of hyperglycemia in ischemic stroke (THIS): A randomized pilot trial. Stroke. 2008; 39(2):384-9. [DOI:10.1161/STROKEAHA.107.493544] [PMID]
18.Bruno A, Durkalski VL, Hall CE, Juneja R, Barsan WG, Janis S, et al. The Stroke Hyperglycemia Insulin Network Effort (SHINE) trial protocol: A randomized, blinded, efficacy trial of standard vs. intensive hyperglycemia management in acute stroke. International Journal of Stroke. 2014; 9(2):246-51. [DOI:10.1111/ijs.12045] [PMID] [PMCID]
19.Bruno A, Liebeskind D, Hao Q, Raychev R. Diabetes mellitus, acute hyperglycemia, and ischemic stroke. Current Treatment Options in Neurology. 2010; 12(6):492-503. [DOI:10.1007/s11940-010-0093-6] [PMID] [PMCID]
2.Waziry R, Heshmatollah A, Bos D, Chibnik LB, Ikram MA, Hofman A, et al. Time trends in survival following first hemorrhagic or ischemic stroke between 1991 and 2015 in the rotterdam study. Stroke. 2020; 51(3):STROKEAHA119027198. [DOI:10.1161/STROKEAHA.119.027198] [PMID]
3.Soliman RH, Oraby MI, Fathy M, Essam AM. Risk factors of acute ischemic stroke in patients presented to Beni-Suef University Hospital: Prevalence and relation to stroke severity at presentation. The Egyptian Journal of Neurology, Psychiatry and Neurosurgery. 2018; 54(1):8. [DOI:10.1186/s41983-018-0012-4] [PMID] [PMCID]
4.Kim SY, Guevara JP, Kim KM, Choi HK, Heitjan DF, Albert DA. Hyperuricemia and risk of stroke: A systematic review and meta-analysis. Arthritis and Rheumatism. 2009; 61(7):885-92. [DOI:10.1002/art.24612] [PMID] [PMCID]
5.Jiang Y, Liu N, Han J, Li Y, Spencer P, Vodovoz SJ, et al. Diabetes Mellitus/Poststroke Hyperglycemia: A detrimental factor for tpa thrombolytic stroke therapy. Translational Stroke Research. 2021; 12(3):416-27. [DOI:10.1007/s12975-020-00872-3] [PMID]
6.Shi Z, Guo S, Pan J, Xu C, Geng Y, Zheng S. Increased postoperative fasting glucose is associated with unfavorable outcomes in patients treated with mechanical thrombectomy treatment. Frontiers in Neurology. 2021; 12:668363. [DOI:10.3389/fneur.2021.668363] [PMID] [PMCID]
7.Gentile NT, Seftchick MW, Huynh T, Kruus LK, Gaughan J. Decreased mortality by normalizing blood glucose after acute ischemic stroke. Academic Emergency Medicine. 2006; 13(2):174-80. [DOI:10.1197/j.aem.2005.08.009] [PMID]
8.Williams LS, Rotich J, Qi R, Fineberg N, Espay A, Bruno A, et al. Effects of admission hyperglycemia on mortality and costs in acute ischemic stroke. Neurology. 2002; 59(1):67-71. [DOI:10.1212/WNL.59.1.67] [PMID]
9.Roberts GW, Quinn SJ, Valentine N, Alhawassi T, O’Dea H, Stranks SN, et al. Relative Hyperglycemia, a marker of critical illness: Introducing the stress hyperglycemia ratio. The Journal of Clinical Endocrinology and Metabolism. 2015; 100(12):4490-7. [DOI:10.1210/jc.2015-2660] [PMID]
10.Dungan KM, Braithwaite SS, Preiser JC. Stress hyperglycaemia. Lancet. 2009; 373(9677):1798-807. [DOI:10.1016/S0140-6736(09)60553-5] [PMID]
11.Tumminia A, Crimi S, Sciacca L, Buscema M, Frittitta L, Squatrito S, et al. Efficacy of real-time continuous glucose monitoring on glycaemic control and glucose variability in type 1 diabetic patients treated with either insulin pumps or multiple insulin injection therapy: A randomized controlled crossover trial. Diabetes/Metabolism Research and Reviews. 2015; 31(1):61-8. [DOI:10.1002/dmrr.2557] [PMID]
12.Cerecedo-Lopez CD, Cantu-Aldana A, Patel NJ, Aziz-Sultan MA, Frerichs KU, Du R. Insulin in the management of acute ischemic stroke: A systematic review and meta-analysis. World Neurosurgery. 2020;136:e514-34. [DOI:10.1016/j.wneu.2020.01.056] [PMID]
13.Du LZ, Liu PY, Ge CY, Li Y. Continuous Intravenous versus subcutaneous administration of insulin for glycemic variability in acute ischemic stroke. Neuropsychiatric Disease and Treatment. 2022; 18:1309-14. [DOI:10.2147/NDT.S370776] [PMID] [PMCID]
14.Kreisel SH, Berschin UM, Hammes HP, Leweling H, Bertsch T, Hennerici MG, et al. Pragmatic management of hyperglycaemia in acute ischaemic stroke: safety and feasibility of intensive intravenous insulin treatment. Cerebrovascular Diseases. 2009; 27(2):167-75. [DOI:10.1159/000185608] [PMID]
15.Staszewski J, Brodacki B, Kotowicz J, Stepien A. Intravenous insulin therapy in the maintenance of strict glycemic control in nondiabetic acute stroke patients with mild hyperglycemia. Journal of Stroke and Cerebrovascular Diseases. 2011; 20(2):150-4. [DOI:10.1016/j.jstrokecerebrovasdis.2009.11.013] [PMID]
16.Rosso C, Corvol JC, Pires C, Crozier S, Attal Y, Jacqueminet S, et al. Intensive versus subcutaneous insulin in patients with hyperacute stroke: Results from the randomized INSULINFARCT trial. Stroke. 2012; 43(9):2343-9. [DOI:10.1161/STROKEAHA.112.657122] [PMID]
17.Bruno A, Kent TA, Coull BM, Shankar RR, Saha C, Becker KJ, et al. Treatment of hyperglycemia in ischemic stroke (THIS): A randomized pilot trial. Stroke. 2008; 39(2):384-9. [DOI:10.1161/STROKEAHA.107.493544] [PMID]
18.Bruno A, Durkalski VL, Hall CE, Juneja R, Barsan WG, Janis S, et al. The Stroke Hyperglycemia Insulin Network Effort (SHINE) trial protocol: A randomized, blinded, efficacy trial of standard vs. intensive hyperglycemia management in acute stroke. International Journal of Stroke. 2014; 9(2):246-51. [DOI:10.1111/ijs.12045] [PMID] [PMCID]
19.Bruno A, Liebeskind D, Hao Q, Raychev R. Diabetes mellitus, acute hyperglycemia, and ischemic stroke. Current Treatment Options in Neurology. 2010; 12(6):492-503. [DOI:10.1007/s11940-010-0093-6] [PMID] [PMCID]
20.Merlino G, Smeralda C, Gigli GL, Lorenzut S, Pez S, Surcinelli A, et al. Stress hyperglycemia is predictive of worse outcome in patients with acute ischemic stroke undergoing intravenous thrombolysis. Journal of Thrombosis and Thrombolysis. 2021; 51(3):789-97. [DOI:10.1007/s11239-020-02252-y] [PMID]
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |