دوره 34، شماره 3 - ( 7-1404 )
جلد 34 شماره 3 صفحات 321-308 |
برگشت به فهرست نسخه ها
Research code: 179342/ 1401
Ethics code: IR.GUILAN.REC.1403.027
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Khoshkar Chalaksarei Z, Mashayekhi F. The Impact of Folic Acid Supplementation During Pregnancy on the Expression of Nav1 and Nlgn1 Genes in the Cerebral Cortex of Newborn Mice. JGUMS 2025; 34 (3) :308-321
URL: http://journal.gums.ac.ir/article-1-2740-fa.html
URL: http://journal.gums.ac.ir/article-1-2740-fa.html
خوشکار چالکسرائی زهرا، مشایخی فرهاد. تأثیر مصرف مکمل اسید فولیک در دوران بارداری بر تغییرات بیان ژنهای Nav1 وNlgn1 در قشر مغز نوزاد موش. مجله علوم پزشکی گیلان. 1404; 34 (3) :308-321
1- گروه زیست شناسی، دانشکده علوم پایه، دانشگاه گیلان، رشت، ایران.
متن کامل [PDF 6029 kb]
(183 دریافت)
| چکیده (HTML) (954 مشاهده)
متن کامل: (181 مشاهده)
مقدمه
تکوین مغز شامل مراحل مختلفی از رشد سلولهای عصبی و سازماندهی آنها است. در طی گاسترولاسیون که 3 لایه جنینی تشکیل میشود، مغز از اکتودرم منشأ میگیرد. سپس در طی نورولاسیون لوله عصبی از اکتودرم شکل میگیرد و سیستم عصبی مرکزی را میسازد [1]. تکوین مغز در موشها ازنظر مراحل کلیدی، مانند ایجاد سیناپسها و مهاجرت نورونها بسیار شبیه به انسان است، ولی تفاوتهایی در زمانبندی و برخی جزئیات وجود دارد. تشکیل نورونها از حدود E11 شروع میشود. در این مرحله، سلولهای پیشساز عصبی شروع به تولید نورونها میکنند که به نواحی مختلف قشر مغز مهاجرت میکنند. این مهاجرت به شکلگیری لایههای قشری منجر میشود [2، 3].
مواد غذایی شامل ویتامینها نقش مهمی در بیان ژنها دارند. فولات که بهعنوان ویتامین B9 نیز شناخته میشود، یک حامل کلیدی برای متیل عمل است و در واکنشهای متیلاسیون مانند واکنشهای لازم برای سنتز نوکلئوتیدها شرکت میکند. بنابراین، فولات با فعال کردن سنتز DNA در سلولهای در حال تکثیر، از رشد سریع پشتیبانی میکند [4]. بهطورکلی واژه اسید فولیک به اشکال مصنوعی ویتامین B9 و فولات به فرم طبیعی آن گفته میشود [5]. کمبود اسید فولیک در رژیم غذایی که منجر به افزایش سطح هموسیستئین خون به دلیل تبدیل ناکافی هموسیستئین به متیونین میشود، منجر به کاهش تعداد سلولهای پیشساز عصبی در حال تکثیر شده و بر ایجاد نورونها تأثیر میگذارد و باعث نقصهای لوله عصبی میشود [6]. شواهد نشان میدهد کمبود فولات با تغییر رشد عصبی زادهها، ازجمله حجم کوچکتر کل مغز، تغییر در ضخامت قشر مغز، نوروژنز تغییریافته و ایجاد سیناپس مرتبط بوده و نقش مهمی در تغییر بیان ژنهای مؤثر در تکوین مغز دارد [7].
ژنهای زیادی در تمایز، تکثیر و مهاجرت نورونها در طی تکوین مغز نقش دارند. بهعنوان نمونه برای مهاجرت نورونها، رشد و هدایت آکسونها، پروتئینهای مرتبط با اسکلت سلولی به نام ناوبرهای عصبی وجود دارند. هدایتگر عصبی1 (Nav1)بهعنوان یکی از پروتئینهای مرتبط با اسکلت سلولی، در مهاجرت عصبی و مسیرهای سیگنالدهی عصبی دخالت دارد که آکسونها را در جهت مناسب هدایت میکند. مطالعات نشان دادهاند موشهای فاقد Nav1 یا دارای جهشها در این ژن دچار نقصهایی در هدایت آکسونها و شکلگیری صحیح شبکههای عصبی میشوند. این نقصها میتوانند منجر به مشکلات عملکردی در سیستم عصبی، ازجمله اختلالات حرکتی و شناختی شوند [8]. کاهش بیان Nav1 در نورونها، شکل ظاهری مخروط رشد و نوریتوژنز یا جوانه زدن رشتههای عصبی از یک سلول، که اولین گام در توسعه شکل ظاهری یک نورون بالغ است را مختل میکند [9-11]. از ژنهایی دیگری که در ایجاد سیناپس نقش دارد، اعضای خانواده نورولیجین هستند که ممکن است تماسهای ترانس سیناپسی با نورکسینهای پیشسیناپسی ایجاد کنند. نورولیجینها ازطریق بهکارگیری پروتئینهای داربست، گیرندههای پسسیناپسی و سیگنالدهی پروتئینها برای بلوغ مناسب سیناپسها و عملکرد مغز نیاز هستند [12]. بهعلاوه نورولیجینها، بهعنوان مولکولهای چسبندگی سلولی پسسیناپسی، با اتصال به نورکسینها (که بر روی غشای پیشسیناپسی قرار دارند) عوامل مهم تنظیمکننده رشد عصبی و انتقال سیناپسی هستند [13]. ژنوم موش شامل حداقل 4 ژن نورولیجین است که شامل Nlgn1، Nlgn2، Nlgn3 و Nlgn4 است. Nlgn1 در سطوح پایین قبل از تولد بیان میشود، ولی بیان آن پس از تولد افزایش مییابد و نسبتاً بالا باقی میماند [14]. پروتئین Nlgn1 در تنظیم عملکرد سیناپسهای تحریکی دخیل بوده و تغییر در بیان آن میتواند به اختلالات رفتاری و شناختی، مشابه آنچه در برخی از اختلالات طیف اُتیسم مشاهده میشود، منجر شود [15].
بهطورکلی، فولات یک ماده مغذی ضروری است که برای تکثیر DNA و بهعنوان بستری برای طیف وسیعی از واکنشهای آنزیمی درگیر در سنتز اسید آمینه و متابولیسم ویتامین نیاز است. نیاز به فولات در دوران بارداری افزایش مییابد، زیرا برای تکثیر سلولها و رشد و تکوین جنین نیز لازم است. کمبود فولات با ناهنجاریهایی در مادران (کمخونی، نوروپاتی محیطی) و جنین (ناهنجاریهای مادرزادی) همراه است. مکملهای غذایی با اسید فولیک در چند ماه قبل از لقاح و در مراحل اولیه رشدونمو جنینی خطر نقص لوله عصبی را کاهش میدهد [16]. بنابراین باتوجهبه مطالب مذکور میزان طبیعی فولات میتواند با تغییر بیان ژنها باعث کاهش نقصهای لوله عصبی شده و به تکوین طبیعی سیستم عصبی مرکزی کمک کند. از طرف دیگر، بسیاری از ژنهای پروتئین سیناپسی با پاتوژنز اختلال طیف اُتیسم مرتبط هستند. همچنین نشان داده شده است مجموعهای از جهشها در ژنهای دخیل در تشکیل سیناپس در انسان با اختلال طیف اُتیسم مرتبط هستند [17]. به همین دلیل در این تحقیق به بررسی اثر اسید فولیک بر ژنهای دخیل در سیناپس پرداخته شده است. بهطور خلاصه، باتوجه به نقش اسید فولیک در تنظیم بیان ژن و همچنین عملکردهای ژنهای Nav1 و Nlgn1 در مهاجرت نورونها، ایجاد سیناپس و تکوین مغز، در این تحقیق به بررسی اثر دُزهای مختلف اسید فولیک (دُز 2 و 40 میلیگرم بر کیلوگرم وزن بدن) بر بیان Nav1 و Nlgn1 در قشر مغز زادههای موش پس از تولد پرداخته شد.
روشها
روش انتخاب ژنهای هدف
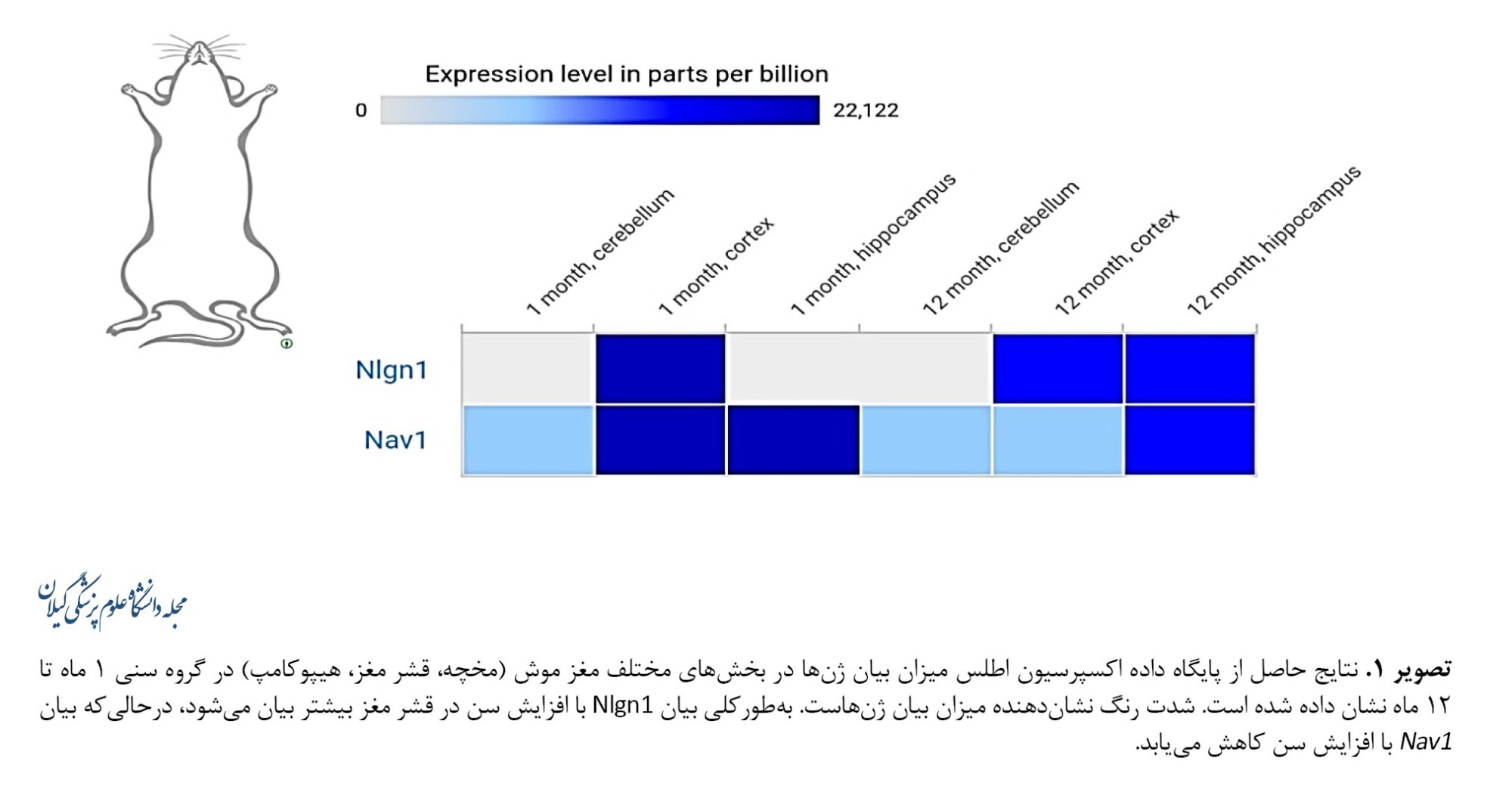
با استناد به مقالات پاوور و همکاران[10] و جانگ و همکاران [18] ژنهای موردمطالعه انتخاب و میزان بیان آنها در قشر مغز موش به کمک پایگاه داده اکسپرسیون اطلس به دست آمد (تصویر شماره 1).
نحوه انتخاب دُز اسید فولیک خوراکی
براساس استاندارد رژیم غذایی توصیهشده توسط مؤسسه تغذیه آمریکا، 2 گروه از رژیم غذایی اسید فولیک برای موشها طراحی شد: الف) رژیم غذایی متشکل از 2 میلیگرم بر کیلوگرم وزن بدن اسید فولیک که نیاز اساسی برای جوندگان ازجمله موش است. ب) رژیم غذایی متشکل از40 میلیگرم بر کیلوگرم وزن بدن اسید فولیک که بیش از نیاز اساسی است. دُز 40 میلیگرم بر کیلوگرم وزن بدن بهعنوان دُز بالای اسید فولیک انتخاب شد. دُز 2 میلیگرم بر کیلوگرم وزن بدن براساس نیاز اساسی جوندگان طبق استاندارد مؤسسه تغذیه آمریکا تعیین شد. دُز 40 میلیگرم، که بیش از نیاز طبیعی است، برای بررسی اثرات بالقوه دُزهای بالا و خطرات مرتبط با مصرف بیشازحد انتخاب شد [19-21].
محاسبه حجم نمونه
به کمک نرمافزار جیپاور (نسخه 3/1/9/4) [22]، حجم نمونه براساس تحلیل توان آماری محاسبه شد. برای این منظور حجم کل نمونه براساس آزمون آماری بهکاررفته در پژوهش، خطای نوع اول 0/05، توان آماری 0/80، و اندازه اثر 0/49 برابر با 45 رأس موش به دست آمد؛ بهطوریکه موشها به 3 گروه 15 تایی تقسیم شدند.
تهیه نمونه
موشهای سوری نژاد BALB/c از پژوهشکده شمال انستیتو پاستور ایران، واقع در شهر آمل تهیه و به اتاق حیوانات دانشکده علوم دانشگاه گیلان منتقل و نگهداری شد. در طی این دوره، چرخههای شبانهروزی بهصورت 12 ساعت روز و 12 ساعت شب تنظیم شد و غذای مخصوص موش از شرکت دام و طیور پارس واقع در تهران خریداری و در اختیار موشها قرار داده شد. برای به دست آوردن نوزادان، موشهای نر و ماده به مدت 10 ساعت در طول شب در یک قفس قرار داده شدند. صبح روز بعد، موشهای ماده ازنظر وجود یا عدم وجود درپوش واژنی مورد بررسی قرار گرفتند. وجود درپوش واژنی نشاندهنده جفتگیری است. از روز نخست بارداری بهطور روزانه، به گروه اول مقدار 2 میلیگرم بر کیلوگرم وزن بدن اسید فولیک (دُز طبیعی)، به گروه دوم 40 میلیگرم بر کیلوگرم اسید فولیک (دُز بالا) داده شد و گروه سوم بهعنوان گروه کنترل تحت هیچگونه تیماری قرار نگرفت. بهطور متوسط 67 نوزاد 1 روز پس از تولد هر گروه جمعآوری شدند. 20 نمونه بافت قشر مغز موشها استخراج شد. از واکنش ذنجیرهای پلیمراز کمی(Real Time PCR) جهت بررسی بیان Nav1 و Nlgn1 استفاده شد.
استخراج RNA از بافت مغز
5±60 میلیگرم بافت قشر مغز در یک میکروتیوب ۵/۱ میکرولیتر ریخته شد. سپس 1000 میکرولیتر ترایزول سرد به میکروتیوب افزوده شد. توسط سانتریفیوژ یخچالدار RNA از DNA و پروتئین جدا شد. میکروتیوب حاوی نمونه به مدت 15 دقیقه با دور در دقیقه 12000 در سانتریفیوژ یخچالدار قرار گرفت. سپس ایزوپروپانول بیرون ریخته شد و فقط رسوب RNA در انتهای میکروتیوب باقی ماند. 1000 میکرولیتر الکل 75 درصد سرد به میکروتیوب افزوده و به مدت 15 دقیقه در دمای 4 درجه سانتیگراد با دور در دقیقه 7500 سانتریفیوژ شد. پس از آن مایع رویی حاوی اتانول بیرون ریخته شد و فقط رسوب سفید رنگ RNA در انتهای میکروتیوب باقی ماند. در ادامه میکروتیوبهای حاوی رسوب به مدت 10 دقیقه زیر هود بهصورت وارونه قرارداده شد تا الکل باقیمانده تبخیر شود. سپس مقدار 20 تا 50 میکرولیتر آب DEPC سرد به میکروتیوب اضافه شد. درنهایت RNA استخراجشده جهت آنالیزهای بعدی به فریزر منهای70 درجه سانتیگراد منتقل شد.
بررسی کمی و کیفی RNA استخراجشده
الف) سطح کمی غلظت RNA، به کمک دستگاه نانودراپ (NanoDrop Spectrophotometer Blue-Ray EZ1000) مورد بررسی قرار گرفت. جذب نوری 280/260 نانومتر، خلوص RNA استخراجشده را نشان داد. بهترین حالت در محدوده 1/8 -2/2 نانومتر است.
ب) جهت تأیید نتایج نانودراپ، کیفیت نمونهها بر روی ژل الکتروفورز (آگارز 1/5) درصد بررسی شدند.
سنتز cDNA
سنتزcDNA مطابق با پروتکل پیشنهادی شرکت سازنده کیت سنتز cDNA انجام شد (شرکت زیست ویرایش ـ ایران). درنهایت جهت نگهداری طولانیمدت، cDNA سنتزشده به فریزر منهای 20 درجه سانتیگراد منتقل شد. جهت صحت انجام تست PCR و نیز نرمالسازی کردن بیان ژنها، از ژن کنترل داخلی GAPDH برای Nav1 و Nlgn1 استفاده شد.
رقیق سازی پرایمرها و انواع آن
بهمنظور استفاده از رسوب پرایمرهای سنتزشده، ابتدا رقیقسازی اولیه و سپس رقیقسازی ثانویه صورت گرفت (مطابق پروتکل پیشنهادی شرکت سیناکلون، ایران).
بررسی بیان ژن توسط Real Time PCR
باتوجهبه پروتکل پیشنهادشده توسط شرکت سازنده SYBR Green، میکس مرتبط با Real Time PCR ساخته شد و به استریپ اضافه شد. به جهت اطمینان از صحت نتایج، هر نمونه بهصورت 2 تکرار به درون استریپ انتقال یافت و برای هر نمونه بهعنوان کنترل منفی در نظر گرفته شد. در انتها استریپهای حاوی نمونه به دستگاه Real Time PCR انتقال داده شد. جهت تعیین دمای مناسب، شیب دمایی از دمای 53 تا 58 درجه سانتیگراد قرار داده شد تا دمای مناسب تعیین شود (شیب دمایی PCR). درنهایت باتوجهبه کیفیت باندها برای Nav1 و Nlgn1 به ترتیب دمای 57 و 54 در نطر گرفته شد. برنامه دستگاه Real Time PCR باتوجهبه پروتکل پیشنهادی SYBR Green شرکت زیست ویرایش انجام شد.
آنالیز آماری دادهها
بیان نسبی ژن Nav1 و Nlgn1 در 2 گروه تیمارشده با دُزهای 2 و 40 میلیگرم بر کیلوگرم وزن بدن اسید فولیک و گروه کنترل به روش ΔΔCt به دست آمد و مقادیر چند برابری براساس فرمول شماره 1 محاسبه شد.
1.

برای مقایسه بیان ژنها بین گروهها، از آزمون آنووای یکطرفه با سطح معنیداری P<0/05 استفاده شد. پیشفرضهای آماری مانند نرمالیتی دادهها با آزمون کولموگروف اسمیرنف بررسی شدند. مقادیر Fold Change به روش ΔΔCt محاسبه و نمودارها با نرمافزار GraphPad Prism ترسیم شدند.
آنالیز بیوانفورماتیک
ساخت شبکه تعاملی پروتئین ـ پروتئین
به کمک نرمافزار Cytoscape (نسخه 3/10/2) شبکه 100 پروتئین مرتبط با Nlgn1 و Nav1 ترسیم شد و غنیسازی کاردی برای یافتن مرتبطترین فرایندهای زیستی، کارکردیهای مولکولی، ساختارهای سلولی و مسیرهایی KEGG، انجام شد.
یافتهها
نتایج حاصل از بررسی کمی و کیفی Total RNA
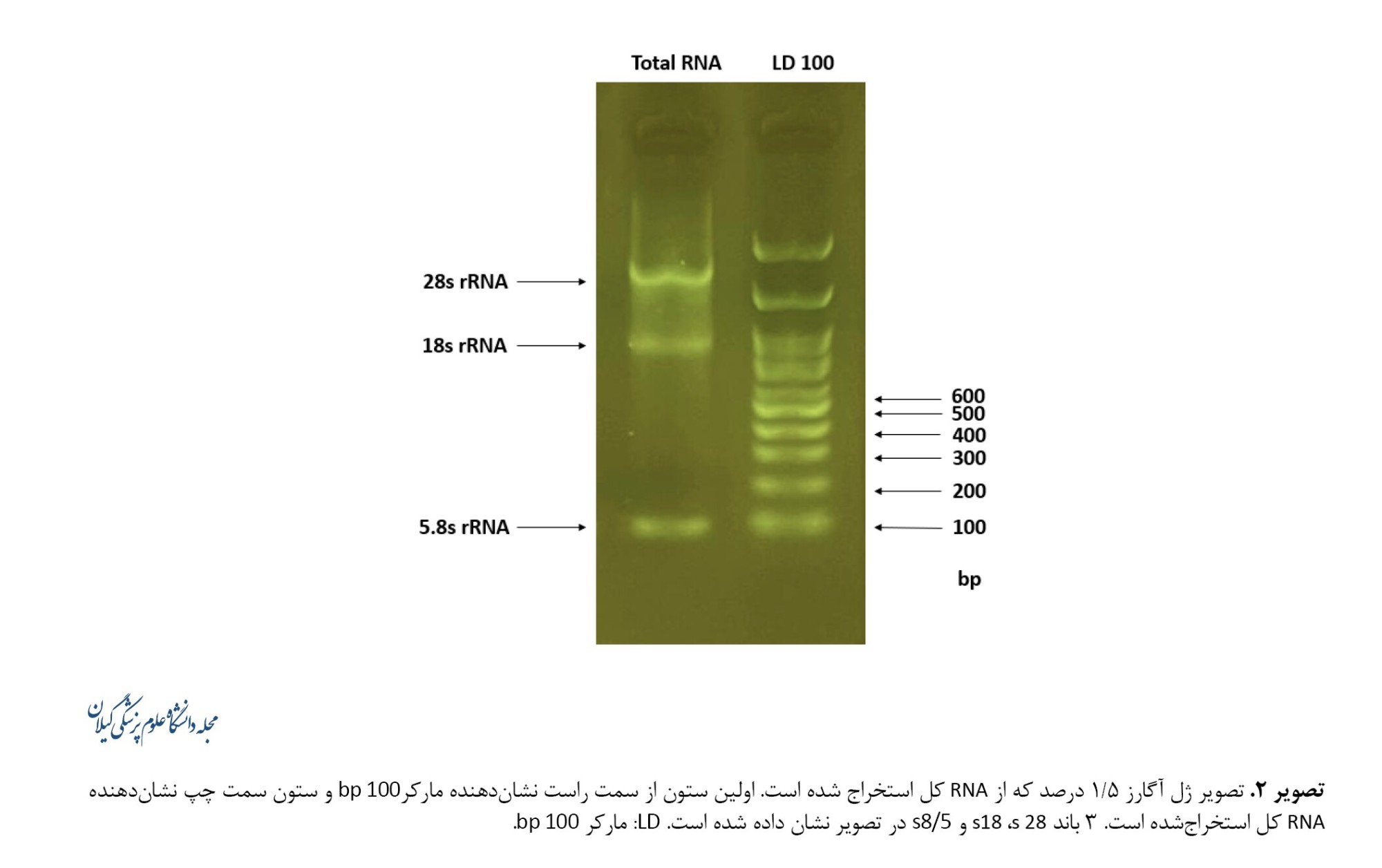
براساس نتایج دستگاه نانودراپ، غلظت اکثر نمونهها در بازه 6۰۰ تا9۰۰ نانوگرم بر میکرولیتر و جذب در طول موجهای 260/280 که شاخصی جهت بررسی خلوص، عدم آلودگی و کیفیت است، در بازه 1/8 تا 2 قرار داشت. بعد از آن بهمنظور بررسی کیفیت RNAهای استخراجی، ژل آگارز با دستگاه الکتروفورز بررسی شد و باندهای s 18،s 28 وs8/5 rRNAs مشاهده شد که نشاندهنده کیفیت خوب RNAها است (تصویر شماره 2).
نتایج بیان Nav1 در قشر مغز نوزادان تیمارشده با اسید فولیک و گروه کنترل
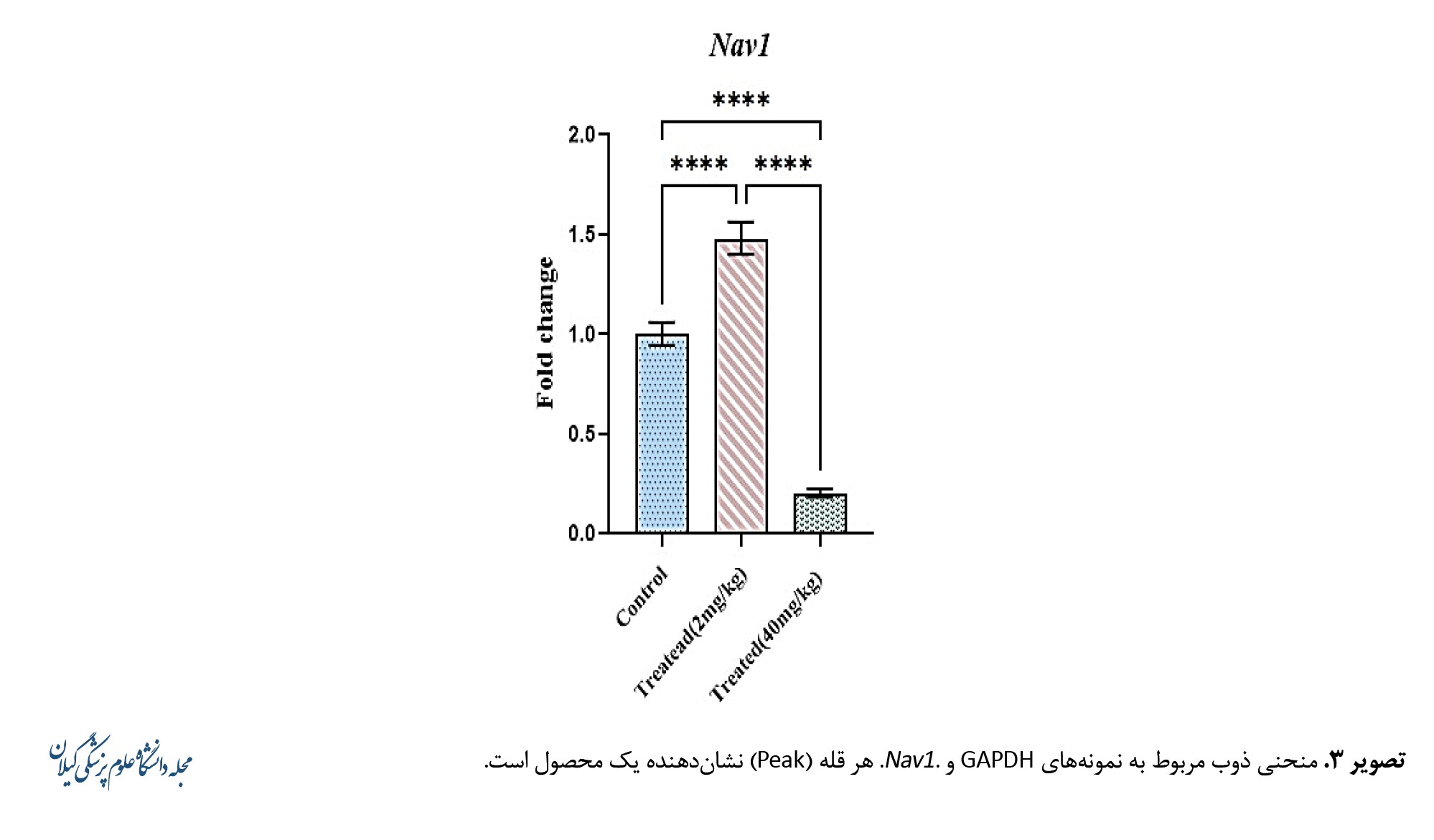
در گروه تیمار با دُز 2 میلیگرم بر کیلوگرم وزن بدن، میزان بیان ژن Nav1 بهطور معنیداری بالاتر از گروه کنترل بود (0/08±1/48 در مقابل 0/05±1/001، P<0/0001). در گروه تیمار با دُز 40 میلیگرم بر کیلوگرم، بیان این ژن کاهش معنیداری نسبت به گروه کنترل نشان داد (0/02±0/20، P<0/0001). همچنین اختلاف معنیداری بین گروه دُز طبیعی و دُز بالا مشاهده شد (P<0/0001) (تصویر شماره 4).
نتایج بیان Nlgn1 در قشر مغز نوزادان تیمارشده با اسید فولیک و گروه کنترل
نمودار ذوب برای Nlgn1 و GAPDH باتوجهبه شیب دمایی پرایمرها در دمای 54 درجه سانتیگراد رسم شد (تصویر شماره 5).
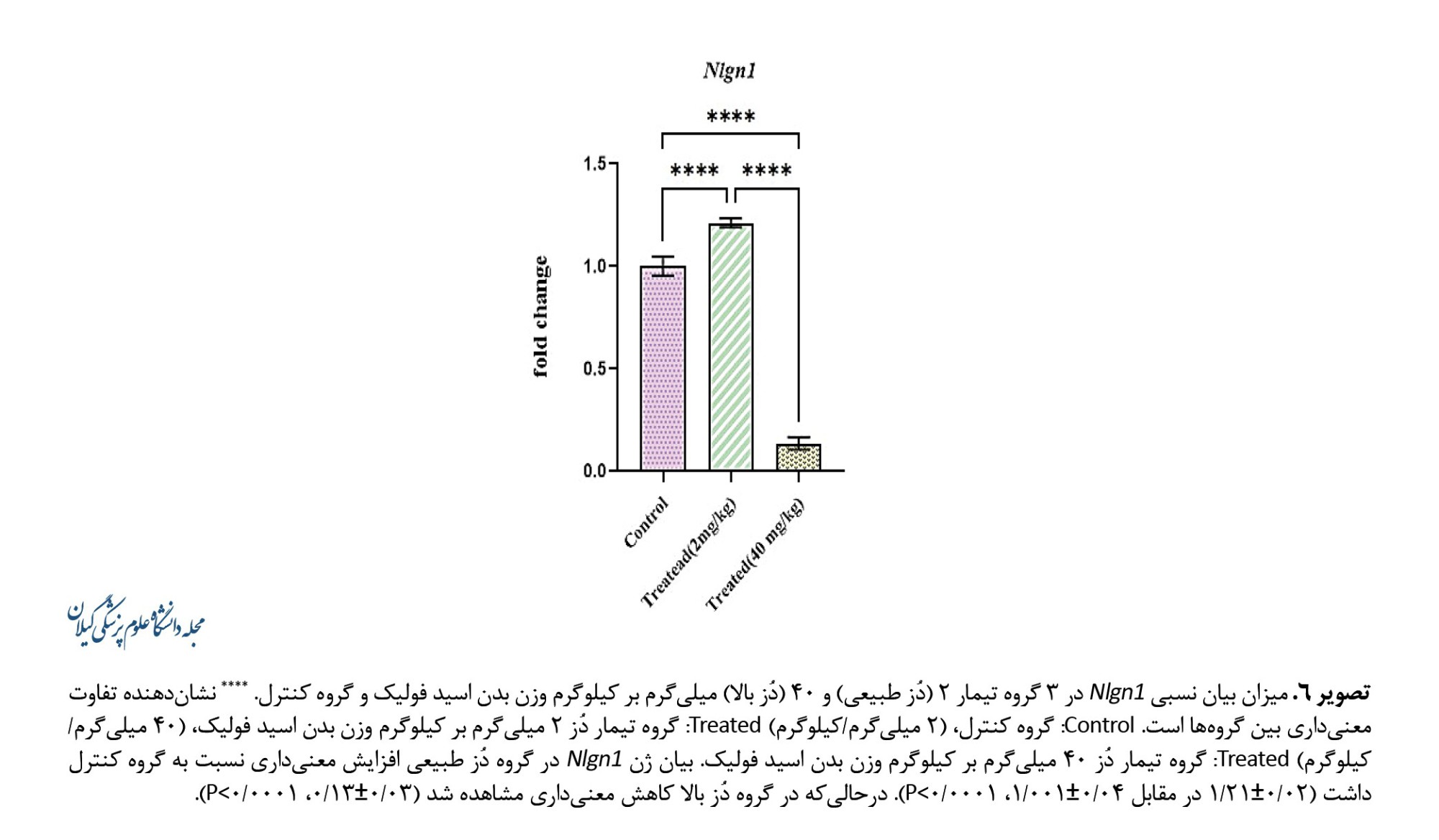
نتایج مشابهی برای بیان ژن Nlgn1 مشاهده شد. بیان این ژن در گروه دُز طبیعی افزایش معنیداری نسبت به گروه کنترل داشت (0/02±1/21 در مقابل 0/04±1/001 P<0/0001). درحالیکه در گروه دُز بالا کاهش قابلتوجهی مشاهده شد (0/03±0/13، P<0/0001، تصویر شماره 6).
نتایج حاصل از برهمکنش پروتئین ـ پروتئین
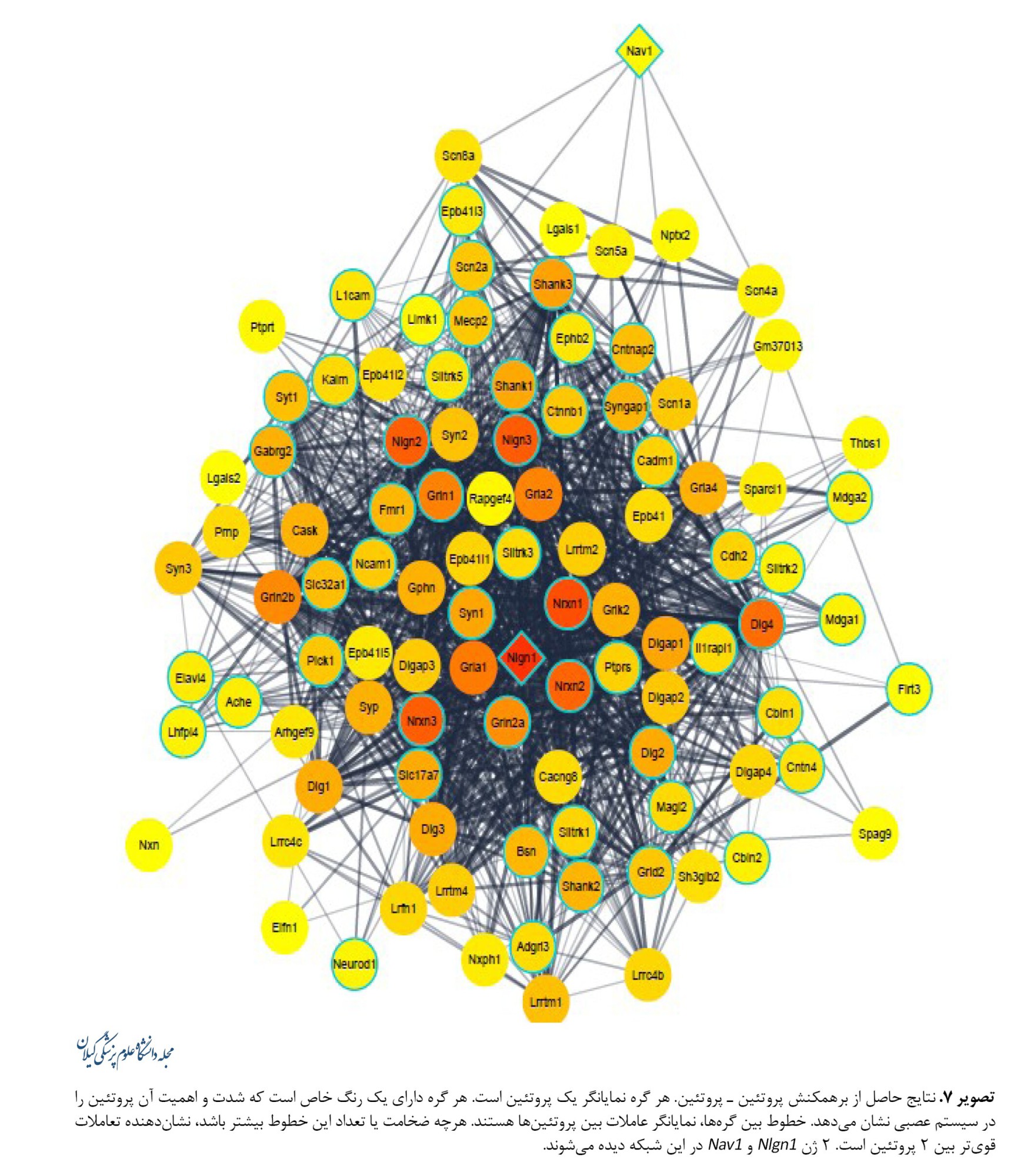
شبکه 100 پروتئین مرتبط با Nlgn1 و Nav1 ترسیم شد و غنیسازی کارکردی برای یافتن مرتبطترین فرایندهای زیستی، کارکردیهای مولکولی، ساختارهای سلولی، و مسیر هایی KEGG انجام شد. رنگ هر پروتئین نشاندهنده تعداد برهمکنشهای آن در شبکه و رنگ دور پروتئین بیانگر نقش آن در تکوین سیستم عصبی است. خطوط بین گرهها، نمایانگر تعاملات بین پروتئینها هستند. هرچه ضخامت یا تعداد این خطوط بیشتر باشد، نشاندهنده تعاملات قویتر بین دو پروتئین است. 2 ژن Nlgn1 و Nav1 ازطریق تعاملات پروتئینی یا عملکردی به یکدیگر متصلاند و ازطریق تنظیمات سیناپسی هم در ارتباط هستند. خطوط آبی دور 2 پروتئین Nlgn1 و Nav1 و بقیه نشاندهنده نقش ویژه آنها درتنظیم سیناپس است (تصویر شماره 7).
بحث
فولات یا ویتامین B9 طی چرخه متابولیسمی خود در بدن موجودات زنده با شرکت در واکنش یک کربن به یکسری از فرایندهای حیاتی، ازجمله سنتز متیونین، کاهش سطح هموسیستئین، ساخت بازهای آلی مورد استفاده در ساختار DNA و متیلاسیون DNA کمک میکند [23]. در طول تشکیل مغز در مهرهداران، یکی از مهمترین اتفاقات شکلگیری لوله عصبی است که مقدار ناکافی فولات در رژیم غذایی مادر باردار میتواند بر این فرایند تأثیر منفی بگذارد [24]. ژنهای زیادی در تکوین صحیح مغز نقش دارند و هرگونه تغییر در بیان این ژنها میتواند باعث ایجاد ناهنجاریهای سیستم عصبی شود [25]. مطالعات متعددی در خصوص اثر اسید فولیک بر بیان ژنها انجام شده است. ولی مکانیسم دقیق اثر اسید فولیک در تکوین مغز هنوز مشخص نیست.
وانگ و همکارانش در سال 2024 نشان دادند دُز بالای اسید فولیک در دوران بارداری موشها، تاًثیر منفی بر رشد فیزیولوزیکی و عصبیرفتاری فرزندان دارد [26]. در مطالعهای دیگر حیدری و همکاران در سال 2024 نشان دادند تزریق داخل جنینی اسید فولیک باعث افزایش بیان DAB1 در قشر مغز جنین جوجه میشود [27]. در سال 2023لینگ و همکاران با مطالعاتی که روی موشهای صحرایی انجام دادند و دریافتند اسید فولیک سبب کاهش مرگ سلولهای عصبی و افزایش تعداد سیناپسها و بیان پروتئینهای مرتبط با سیناپسها میشود [28]. در مطالعهای دیگر رازقی و همکاران در سال2023 نشان دادند دُز طبیعی اسید فولیک باعث افزایش بیان BDNF (فاکتور رشد نروتروفیک مغزی) در قشر مغز جنین جوجه میشود [29]. همچنین یان و همکاران در سال 2022 با بررسی اثرات اسید فولیک با غلظت 5 برابر بیشتر از سطح توصیهشده در جنینها و نوزادان موش نشان دادند افزایش دُز اسید فولیک باعث تغییرات رونویسی در قشر مغز جنینها و نوزادان موش میشود [30]. لی و همکاران درسال 2019 با مطالعاتی که بر روی موشهای صحرایی انجام دادند، دریافتند کمبود اسید فولیک مادر باعث افزایش مرگ سلولی فیزیولوژیک سلولهای عصبی در هیپوکامپ و قشر مغز در زادهها شده و کمبود اسید فولیک مادر، بیان ژن Bcl-2 را کاهش و بیان ژن Bax و microRNA-34a را افزایش داد [31]. در سال 2017، هنزل و همکارانش نشان دادند اختلال در رشد جنین، از دست دادن جنین و تأخیر در رشد جنینی موشها میتواند ناشی از مصرف دُز بالای اسید فولیک در غذای مادر در طول بارداری باشد. همچنین وضعیت فولات مادر در موشها بر متیلاسیون DNA و بیان ژن در نیمکرههای مغزی زادهها تأثیر میگذارد [32]. در سال 2016پارتریو و همکاران اسید فولیک را با دُزهای صفر، 8، 40 و 2 میلیگرم بر کیلوگرم وزن بدن در موشهای صحرایی بررسی کردند و دریافتند موشهای در حال رشدی که از رژیم غذایی غنیشده با اسید فولیک تغذیه میشوند، شامل رژیمهای غذایی دُز صفر و 8، خطر اختلال در تکوین مخچه را افزایش میدهند [33]. در مطالعهای دیگر بورا و همکاران در سال 2015 با بررسی دُزهای 2 و 20 میلیگرم بر کیلوگرم وزن بدن اسید فولیک در موش دریافتند اسید فولیک اضافی در طول بارداری میتواند متیلاسیون DNA و بیان ژنهایی مثلSlc6a4 را در مخچه زادهها تغییر داده و باعث تغییر بیان این ژنها میشود [34]. در طی مطالعاتی که بورا و همکاران در سال 2014 انجام دادند، نشان داده شد افزایش مصرف اسید فولیک در طول بارداری بیان ژنهایی را در نیمکره مغزی زادهها تغییر میدهد که در رشد مغز نقش دارند و باعث کاهش بیان ژنهای Vgll2 ،Zfp353 ،Htr4 ،Cpn2 و افزایش بیان ژنهای Slcl7a7 ،Nfix ،Leprel1 و Xist میشود. بنابراین باتوجه به اهمیت ویژه اسید فولیک در تکوین مغز، ممکن است در مقادیر بالا اثر منفی داشته باشد [35]. گیروتو و همکارن در سال 2013 نشان دادند دُز بالای اسید فولیک سبب تغییر انتقال سیناپسی و افزایش سطح تشنج در زادههای موشهای صحرایی میشود [36]. در مطالعهای دیگر لیون و همکارانش در سال 2012 نشان دادند بروز نقص لوله عصبی از زمان غنیسازی مواد غذایی با اسید فولیک بهطور قابلتوجهی کاهش یافته است. رژیم غذایی حاوی20 برابر بیشتر از میزان مصرف توصیهشده برای جوندگان، اثرات نامطلوبی بر رشد جنین موش داشت [37]. در تحقیقی دیگر نشان داده شد کاهش میزان فولات خون و بالا رفتن هموسیستئین در طی حاملگی در مادران احتمال ابتلا به نقص لوله عصبی در فرزندان را بیشتر میکند [38]. بهطورکلی نتایج تحقیقات نشان میدهد اسید فولیک میتواند با تغییر در حالت متیلاسیون DNA بر بیان ژنها اثر داشته باشد. متیلاسیون DNA یک عامل تعیینکننده اپیژنتیکی مهم در بیان ژن (رابطه معکوس)، در حفظ یکپارچگی و پایداری DNA، در تغییرات کروماتین و در ایجاد جهش است. الگوهای غیرطبیعی متیلاسیون DNA با تغییر در بیان ژن در ایجاد بیماریها و اختلالات رشدونموی مرتبط است. فولات، به شکل 5 ـ متیل تتراهیدروفولات، در متیلاسیون مجدد هموسیستئین به متیونین، که پیشساز S ـ آدنوزیل متیونین، دهنده اولیه گروه متیل برای اکثر واکنشهای متیلاسیون بیولوژیکی، ازجمله DNA است، نقش دارد. متیلاسیون DNA توسط متیل ترانسفرازهای DNA انجام میشود؛ آنزیم هایی که میتوانند با استفاده از SAM، یک گروه متیل را به پنجمین اتم کربن باقیمانده سیتوزین برای تشکیل 5 ـ متیل سیتوزین منتقل کنند [39].
نتایج این تحقیق نشان داد دُز طبیعی اسید فولیک سبب افزایش بیان Nav1 و Nlgn1 نسبت به گروه کنترل شد. اما دُز بالای اسید فولیک سبب کاهش بیان هر دو ژن مذکور نسبت به گروه کنترل شد. بنابراین یکی از علتهای کاهش بیان ژنها در دُز بالای اسید فولیک احتمالاً افزایش سطح متیلاسیون پروموتر ژن توسط دهنده متیل، یعنی اسید فولیک است. دُز بالای اسید فولیک سبب متیله شدن پروموتر ژنها میشود که یک مکانیسم سرکوب بیان ژن است. بنابراین در دُز بالا میتواند تأثیر منفی بر بیان ژنها داشته باشد. همچنین شبکه برهمکنش پروتئینها برای نمایش ارتباط میان 2 پروتئین Nav1 و Nlgn1 و نیز یافتن کارکردهای مرتبط با آنها، نشاندهنده نقش مهم این دو پروتئین در سیناپس و درنهایت تکوین مغز است.
نتیجهگیری
بهطورکلی نتیجهگیری میشود که دُز طبیعی اسید فولیک سبب افزایش بیان Nav1 و Nlgn1 نسبت به گروه کنترل میشود، اما دُز بالاتر از حد طبیعی آن سبب کاهش بیان هر دو ژن نسبت به گروه کنترل میشود. بنابراین اسید فولیک باعث تغییر بیان Nav1 و Nlgn1 شده و ممکن است از این طریق بر تکوین مغز تأثیر بگذارد. بررسیهای بیوانفورماتیک شامل برهمکنش پروتئینها نشاندهنده اهمیت این دو ژن در تشکیل سیناپس و درنتیجه تکوین مغز است.
از محدودیتهای این تحقیق میتوان به استفاده از موش بهعنوان مدل اشاره کرد که ممکن است نتوان نتایج آن را برای انسان نیز تعمیم داد. ضمن اینکه در این پژوهش فقط به بررسی بیان 2 ژن دخیل در تکوین مغز پرداخته شده است. بنابراین پیشنهاد میشود در پژوهشهای آینده به بررسی اثرات اسید فولیک بر تعداد بیشتری از ژنهای مؤثر در تکوین مغز و همچنین اثرات آن بر رفتارها و عملکرد شناختی جانور پرداخته شود. همچنین پیشنهاد میشود در تحقیقات آینده به بررسی اثر دُزهای مختلف اسید فولیک بر میزان بیان فرم متیلهشده ژنها نیز پرداخته شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه در کمیته اخلاق دانشگاه گیلان با شناسه اخلاق (IR.GUILAN.REC.1403.027) تصویب شد.
حامی مالی
مطالعه حاضر با حمایت مالی معاونت تحقیقات و فناوری دانشگاه گیلان انجام شده است.
مشارکت نویسندگان
مفهومسازی، طراحی مطالعه، بازبینی نقادانه دستنوشته برای محتوای فکری مهم، جذب منابع مالی و نظارت: فرهاد مشایخی؛ تحلیل و تفسیر دادهها و حمایت اداری، فنی یا موادی: زهرا خوشکار و فرهاد مشایخی؛ تهیه پیشنویس دستنوشته، تحلیل آمار: زهرا خوشکار.
تعارض منافع
بنابر اظهار نویسندگان این مقاله تعارض منافع ندارد.
تشکر و قدردانی
از معاونت پژوهشی دانشکده علوم پایه دانشگاه گیلان جهت تأمین منابع مالی این پژوهش تشکر و قدردانی میشود.
تکوین مغز شامل مراحل مختلفی از رشد سلولهای عصبی و سازماندهی آنها است. در طی گاسترولاسیون که 3 لایه جنینی تشکیل میشود، مغز از اکتودرم منشأ میگیرد. سپس در طی نورولاسیون لوله عصبی از اکتودرم شکل میگیرد و سیستم عصبی مرکزی را میسازد [1]. تکوین مغز در موشها ازنظر مراحل کلیدی، مانند ایجاد سیناپسها و مهاجرت نورونها بسیار شبیه به انسان است، ولی تفاوتهایی در زمانبندی و برخی جزئیات وجود دارد. تشکیل نورونها از حدود E11 شروع میشود. در این مرحله، سلولهای پیشساز عصبی شروع به تولید نورونها میکنند که به نواحی مختلف قشر مغز مهاجرت میکنند. این مهاجرت به شکلگیری لایههای قشری منجر میشود [2، 3].
مواد غذایی شامل ویتامینها نقش مهمی در بیان ژنها دارند. فولات که بهعنوان ویتامین B9 نیز شناخته میشود، یک حامل کلیدی برای متیل عمل است و در واکنشهای متیلاسیون مانند واکنشهای لازم برای سنتز نوکلئوتیدها شرکت میکند. بنابراین، فولات با فعال کردن سنتز DNA در سلولهای در حال تکثیر، از رشد سریع پشتیبانی میکند [4]. بهطورکلی واژه اسید فولیک به اشکال مصنوعی ویتامین B9 و فولات به فرم طبیعی آن گفته میشود [5]. کمبود اسید فولیک در رژیم غذایی که منجر به افزایش سطح هموسیستئین خون به دلیل تبدیل ناکافی هموسیستئین به متیونین میشود، منجر به کاهش تعداد سلولهای پیشساز عصبی در حال تکثیر شده و بر ایجاد نورونها تأثیر میگذارد و باعث نقصهای لوله عصبی میشود [6]. شواهد نشان میدهد کمبود فولات با تغییر رشد عصبی زادهها، ازجمله حجم کوچکتر کل مغز، تغییر در ضخامت قشر مغز، نوروژنز تغییریافته و ایجاد سیناپس مرتبط بوده و نقش مهمی در تغییر بیان ژنهای مؤثر در تکوین مغز دارد [7].
ژنهای زیادی در تمایز، تکثیر و مهاجرت نورونها در طی تکوین مغز نقش دارند. بهعنوان نمونه برای مهاجرت نورونها، رشد و هدایت آکسونها، پروتئینهای مرتبط با اسکلت سلولی به نام ناوبرهای عصبی وجود دارند. هدایتگر عصبی1 (Nav1)بهعنوان یکی از پروتئینهای مرتبط با اسکلت سلولی، در مهاجرت عصبی و مسیرهای سیگنالدهی عصبی دخالت دارد که آکسونها را در جهت مناسب هدایت میکند. مطالعات نشان دادهاند موشهای فاقد Nav1 یا دارای جهشها در این ژن دچار نقصهایی در هدایت آکسونها و شکلگیری صحیح شبکههای عصبی میشوند. این نقصها میتوانند منجر به مشکلات عملکردی در سیستم عصبی، ازجمله اختلالات حرکتی و شناختی شوند [8]. کاهش بیان Nav1 در نورونها، شکل ظاهری مخروط رشد و نوریتوژنز یا جوانه زدن رشتههای عصبی از یک سلول، که اولین گام در توسعه شکل ظاهری یک نورون بالغ است را مختل میکند [9-11]. از ژنهایی دیگری که در ایجاد سیناپس نقش دارد، اعضای خانواده نورولیجین هستند که ممکن است تماسهای ترانس سیناپسی با نورکسینهای پیشسیناپسی ایجاد کنند. نورولیجینها ازطریق بهکارگیری پروتئینهای داربست، گیرندههای پسسیناپسی و سیگنالدهی پروتئینها برای بلوغ مناسب سیناپسها و عملکرد مغز نیاز هستند [12]. بهعلاوه نورولیجینها، بهعنوان مولکولهای چسبندگی سلولی پسسیناپسی، با اتصال به نورکسینها (که بر روی غشای پیشسیناپسی قرار دارند) عوامل مهم تنظیمکننده رشد عصبی و انتقال سیناپسی هستند [13]. ژنوم موش شامل حداقل 4 ژن نورولیجین است که شامل Nlgn1، Nlgn2، Nlgn3 و Nlgn4 است. Nlgn1 در سطوح پایین قبل از تولد بیان میشود، ولی بیان آن پس از تولد افزایش مییابد و نسبتاً بالا باقی میماند [14]. پروتئین Nlgn1 در تنظیم عملکرد سیناپسهای تحریکی دخیل بوده و تغییر در بیان آن میتواند به اختلالات رفتاری و شناختی، مشابه آنچه در برخی از اختلالات طیف اُتیسم مشاهده میشود، منجر شود [15].
بهطورکلی، فولات یک ماده مغذی ضروری است که برای تکثیر DNA و بهعنوان بستری برای طیف وسیعی از واکنشهای آنزیمی درگیر در سنتز اسید آمینه و متابولیسم ویتامین نیاز است. نیاز به فولات در دوران بارداری افزایش مییابد، زیرا برای تکثیر سلولها و رشد و تکوین جنین نیز لازم است. کمبود فولات با ناهنجاریهایی در مادران (کمخونی، نوروپاتی محیطی) و جنین (ناهنجاریهای مادرزادی) همراه است. مکملهای غذایی با اسید فولیک در چند ماه قبل از لقاح و در مراحل اولیه رشدونمو جنینی خطر نقص لوله عصبی را کاهش میدهد [16]. بنابراین باتوجهبه مطالب مذکور میزان طبیعی فولات میتواند با تغییر بیان ژنها باعث کاهش نقصهای لوله عصبی شده و به تکوین طبیعی سیستم عصبی مرکزی کمک کند. از طرف دیگر، بسیاری از ژنهای پروتئین سیناپسی با پاتوژنز اختلال طیف اُتیسم مرتبط هستند. همچنین نشان داده شده است مجموعهای از جهشها در ژنهای دخیل در تشکیل سیناپس در انسان با اختلال طیف اُتیسم مرتبط هستند [17]. به همین دلیل در این تحقیق به بررسی اثر اسید فولیک بر ژنهای دخیل در سیناپس پرداخته شده است. بهطور خلاصه، باتوجه به نقش اسید فولیک در تنظیم بیان ژن و همچنین عملکردهای ژنهای Nav1 و Nlgn1 در مهاجرت نورونها، ایجاد سیناپس و تکوین مغز، در این تحقیق به بررسی اثر دُزهای مختلف اسید فولیک (دُز 2 و 40 میلیگرم بر کیلوگرم وزن بدن) بر بیان Nav1 و Nlgn1 در قشر مغز زادههای موش پس از تولد پرداخته شد.
روشها
روش انتخاب ژنهای هدف
با استناد به مقالات پاوور و همکاران[10] و جانگ و همکاران [18] ژنهای موردمطالعه انتخاب و میزان بیان آنها در قشر مغز موش به کمک پایگاه داده اکسپرسیون اطلس به دست آمد (تصویر شماره 1).

نحوه انتخاب دُز اسید فولیک خوراکی
براساس استاندارد رژیم غذایی توصیهشده توسط مؤسسه تغذیه آمریکا، 2 گروه از رژیم غذایی اسید فولیک برای موشها طراحی شد: الف) رژیم غذایی متشکل از 2 میلیگرم بر کیلوگرم وزن بدن اسید فولیک که نیاز اساسی برای جوندگان ازجمله موش است. ب) رژیم غذایی متشکل از40 میلیگرم بر کیلوگرم وزن بدن اسید فولیک که بیش از نیاز اساسی است. دُز 40 میلیگرم بر کیلوگرم وزن بدن بهعنوان دُز بالای اسید فولیک انتخاب شد. دُز 2 میلیگرم بر کیلوگرم وزن بدن براساس نیاز اساسی جوندگان طبق استاندارد مؤسسه تغذیه آمریکا تعیین شد. دُز 40 میلیگرم، که بیش از نیاز طبیعی است، برای بررسی اثرات بالقوه دُزهای بالا و خطرات مرتبط با مصرف بیشازحد انتخاب شد [19-21].
محاسبه حجم نمونه
به کمک نرمافزار جیپاور (نسخه 3/1/9/4) [22]، حجم نمونه براساس تحلیل توان آماری محاسبه شد. برای این منظور حجم کل نمونه براساس آزمون آماری بهکاررفته در پژوهش، خطای نوع اول 0/05، توان آماری 0/80، و اندازه اثر 0/49 برابر با 45 رأس موش به دست آمد؛ بهطوریکه موشها به 3 گروه 15 تایی تقسیم شدند.
تهیه نمونه
موشهای سوری نژاد BALB/c از پژوهشکده شمال انستیتو پاستور ایران، واقع در شهر آمل تهیه و به اتاق حیوانات دانشکده علوم دانشگاه گیلان منتقل و نگهداری شد. در طی این دوره، چرخههای شبانهروزی بهصورت 12 ساعت روز و 12 ساعت شب تنظیم شد و غذای مخصوص موش از شرکت دام و طیور پارس واقع در تهران خریداری و در اختیار موشها قرار داده شد. برای به دست آوردن نوزادان، موشهای نر و ماده به مدت 10 ساعت در طول شب در یک قفس قرار داده شدند. صبح روز بعد، موشهای ماده ازنظر وجود یا عدم وجود درپوش واژنی مورد بررسی قرار گرفتند. وجود درپوش واژنی نشاندهنده جفتگیری است. از روز نخست بارداری بهطور روزانه، به گروه اول مقدار 2 میلیگرم بر کیلوگرم وزن بدن اسید فولیک (دُز طبیعی)، به گروه دوم 40 میلیگرم بر کیلوگرم اسید فولیک (دُز بالا) داده شد و گروه سوم بهعنوان گروه کنترل تحت هیچگونه تیماری قرار نگرفت. بهطور متوسط 67 نوزاد 1 روز پس از تولد هر گروه جمعآوری شدند. 20 نمونه بافت قشر مغز موشها استخراج شد. از واکنش ذنجیرهای پلیمراز کمی(Real Time PCR) جهت بررسی بیان Nav1 و Nlgn1 استفاده شد.
استخراج RNA از بافت مغز
5±60 میلیگرم بافت قشر مغز در یک میکروتیوب ۵/۱ میکرولیتر ریخته شد. سپس 1000 میکرولیتر ترایزول سرد به میکروتیوب افزوده شد. توسط سانتریفیوژ یخچالدار RNA از DNA و پروتئین جدا شد. میکروتیوب حاوی نمونه به مدت 15 دقیقه با دور در دقیقه 12000 در سانتریفیوژ یخچالدار قرار گرفت. سپس ایزوپروپانول بیرون ریخته شد و فقط رسوب RNA در انتهای میکروتیوب باقی ماند. 1000 میکرولیتر الکل 75 درصد سرد به میکروتیوب افزوده و به مدت 15 دقیقه در دمای 4 درجه سانتیگراد با دور در دقیقه 7500 سانتریفیوژ شد. پس از آن مایع رویی حاوی اتانول بیرون ریخته شد و فقط رسوب سفید رنگ RNA در انتهای میکروتیوب باقی ماند. در ادامه میکروتیوبهای حاوی رسوب به مدت 10 دقیقه زیر هود بهصورت وارونه قرارداده شد تا الکل باقیمانده تبخیر شود. سپس مقدار 20 تا 50 میکرولیتر آب DEPC سرد به میکروتیوب اضافه شد. درنهایت RNA استخراجشده جهت آنالیزهای بعدی به فریزر منهای70 درجه سانتیگراد منتقل شد.
بررسی کمی و کیفی RNA استخراجشده
الف) سطح کمی غلظت RNA، به کمک دستگاه نانودراپ (NanoDrop Spectrophotometer Blue-Ray EZ1000) مورد بررسی قرار گرفت. جذب نوری 280/260 نانومتر، خلوص RNA استخراجشده را نشان داد. بهترین حالت در محدوده 1/8 -2/2 نانومتر است.
ب) جهت تأیید نتایج نانودراپ، کیفیت نمونهها بر روی ژل الکتروفورز (آگارز 1/5) درصد بررسی شدند.
سنتز cDNA
سنتزcDNA مطابق با پروتکل پیشنهادی شرکت سازنده کیت سنتز cDNA انجام شد (شرکت زیست ویرایش ـ ایران). درنهایت جهت نگهداری طولانیمدت، cDNA سنتزشده به فریزر منهای 20 درجه سانتیگراد منتقل شد. جهت صحت انجام تست PCR و نیز نرمالسازی کردن بیان ژنها، از ژن کنترل داخلی GAPDH برای Nav1 و Nlgn1 استفاده شد.
رقیق سازی پرایمرها و انواع آن
بهمنظور استفاده از رسوب پرایمرهای سنتزشده، ابتدا رقیقسازی اولیه و سپس رقیقسازی ثانویه صورت گرفت (مطابق پروتکل پیشنهادی شرکت سیناکلون، ایران).
بررسی بیان ژن توسط Real Time PCR
باتوجهبه پروتکل پیشنهادشده توسط شرکت سازنده SYBR Green، میکس مرتبط با Real Time PCR ساخته شد و به استریپ اضافه شد. به جهت اطمینان از صحت نتایج، هر نمونه بهصورت 2 تکرار به درون استریپ انتقال یافت و برای هر نمونه بهعنوان کنترل منفی در نظر گرفته شد. در انتها استریپهای حاوی نمونه به دستگاه Real Time PCR انتقال داده شد. جهت تعیین دمای مناسب، شیب دمایی از دمای 53 تا 58 درجه سانتیگراد قرار داده شد تا دمای مناسب تعیین شود (شیب دمایی PCR). درنهایت باتوجهبه کیفیت باندها برای Nav1 و Nlgn1 به ترتیب دمای 57 و 54 در نطر گرفته شد. برنامه دستگاه Real Time PCR باتوجهبه پروتکل پیشنهادی SYBR Green شرکت زیست ویرایش انجام شد.
آنالیز آماری دادهها
بیان نسبی ژن Nav1 و Nlgn1 در 2 گروه تیمارشده با دُزهای 2 و 40 میلیگرم بر کیلوگرم وزن بدن اسید فولیک و گروه کنترل به روش ΔΔCt به دست آمد و مقادیر چند برابری براساس فرمول شماره 1 محاسبه شد.
1.

برای مقایسه بیان ژنها بین گروهها، از آزمون آنووای یکطرفه با سطح معنیداری P<0/05 استفاده شد. پیشفرضهای آماری مانند نرمالیتی دادهها با آزمون کولموگروف اسمیرنف بررسی شدند. مقادیر Fold Change به روش ΔΔCt محاسبه و نمودارها با نرمافزار GraphPad Prism ترسیم شدند.
آنالیز بیوانفورماتیک
ساخت شبکه تعاملی پروتئین ـ پروتئین
به کمک نرمافزار Cytoscape (نسخه 3/10/2) شبکه 100 پروتئین مرتبط با Nlgn1 و Nav1 ترسیم شد و غنیسازی کاردی برای یافتن مرتبطترین فرایندهای زیستی، کارکردیهای مولکولی، ساختارهای سلولی و مسیرهایی KEGG، انجام شد.
یافتهها
نتایج حاصل از بررسی کمی و کیفی Total RNA
براساس نتایج دستگاه نانودراپ، غلظت اکثر نمونهها در بازه 6۰۰ تا9۰۰ نانوگرم بر میکرولیتر و جذب در طول موجهای 260/280 که شاخصی جهت بررسی خلوص، عدم آلودگی و کیفیت است، در بازه 1/8 تا 2 قرار داشت. بعد از آن بهمنظور بررسی کیفیت RNAهای استخراجی، ژل آگارز با دستگاه الکتروفورز بررسی شد و باندهای s 18،s 28 وs8/5 rRNAs مشاهده شد که نشاندهنده کیفیت خوب RNAها است (تصویر شماره 2).


نتایج بیان Nav1 در قشر مغز نوزادان تیمارشده با اسید فولیک و گروه کنترل
در گروه تیمار با دُز 2 میلیگرم بر کیلوگرم وزن بدن، میزان بیان ژن Nav1 بهطور معنیداری بالاتر از گروه کنترل بود (0/08±1/48 در مقابل 0/05±1/001، P<0/0001). در گروه تیمار با دُز 40 میلیگرم بر کیلوگرم، بیان این ژن کاهش معنیداری نسبت به گروه کنترل نشان داد (0/02±0/20، P<0/0001). همچنین اختلاف معنیداری بین گروه دُز طبیعی و دُز بالا مشاهده شد (P<0/0001) (تصویر شماره 4).

نتایج بیان Nlgn1 در قشر مغز نوزادان تیمارشده با اسید فولیک و گروه کنترل
نمودار ذوب برای Nlgn1 و GAPDH باتوجهبه شیب دمایی پرایمرها در دمای 54 درجه سانتیگراد رسم شد (تصویر شماره 5).

نتایج مشابهی برای بیان ژن Nlgn1 مشاهده شد. بیان این ژن در گروه دُز طبیعی افزایش معنیداری نسبت به گروه کنترل داشت (0/02±1/21 در مقابل 0/04±1/001 P<0/0001). درحالیکه در گروه دُز بالا کاهش قابلتوجهی مشاهده شد (0/03±0/13، P<0/0001، تصویر شماره 6).

نتایج حاصل از برهمکنش پروتئین ـ پروتئین
شبکه 100 پروتئین مرتبط با Nlgn1 و Nav1 ترسیم شد و غنیسازی کارکردی برای یافتن مرتبطترین فرایندهای زیستی، کارکردیهای مولکولی، ساختارهای سلولی، و مسیر هایی KEGG انجام شد. رنگ هر پروتئین نشاندهنده تعداد برهمکنشهای آن در شبکه و رنگ دور پروتئین بیانگر نقش آن در تکوین سیستم عصبی است. خطوط بین گرهها، نمایانگر تعاملات بین پروتئینها هستند. هرچه ضخامت یا تعداد این خطوط بیشتر باشد، نشاندهنده تعاملات قویتر بین دو پروتئین است. 2 ژن Nlgn1 و Nav1 ازطریق تعاملات پروتئینی یا عملکردی به یکدیگر متصلاند و ازطریق تنظیمات سیناپسی هم در ارتباط هستند. خطوط آبی دور 2 پروتئین Nlgn1 و Nav1 و بقیه نشاندهنده نقش ویژه آنها درتنظیم سیناپس است (تصویر شماره 7).

بحث
فولات یا ویتامین B9 طی چرخه متابولیسمی خود در بدن موجودات زنده با شرکت در واکنش یک کربن به یکسری از فرایندهای حیاتی، ازجمله سنتز متیونین، کاهش سطح هموسیستئین، ساخت بازهای آلی مورد استفاده در ساختار DNA و متیلاسیون DNA کمک میکند [23]. در طول تشکیل مغز در مهرهداران، یکی از مهمترین اتفاقات شکلگیری لوله عصبی است که مقدار ناکافی فولات در رژیم غذایی مادر باردار میتواند بر این فرایند تأثیر منفی بگذارد [24]. ژنهای زیادی در تکوین صحیح مغز نقش دارند و هرگونه تغییر در بیان این ژنها میتواند باعث ایجاد ناهنجاریهای سیستم عصبی شود [25]. مطالعات متعددی در خصوص اثر اسید فولیک بر بیان ژنها انجام شده است. ولی مکانیسم دقیق اثر اسید فولیک در تکوین مغز هنوز مشخص نیست.
وانگ و همکارانش در سال 2024 نشان دادند دُز بالای اسید فولیک در دوران بارداری موشها، تاًثیر منفی بر رشد فیزیولوزیکی و عصبیرفتاری فرزندان دارد [26]. در مطالعهای دیگر حیدری و همکاران در سال 2024 نشان دادند تزریق داخل جنینی اسید فولیک باعث افزایش بیان DAB1 در قشر مغز جنین جوجه میشود [27]. در سال 2023لینگ و همکاران با مطالعاتی که روی موشهای صحرایی انجام دادند و دریافتند اسید فولیک سبب کاهش مرگ سلولهای عصبی و افزایش تعداد سیناپسها و بیان پروتئینهای مرتبط با سیناپسها میشود [28]. در مطالعهای دیگر رازقی و همکاران در سال2023 نشان دادند دُز طبیعی اسید فولیک باعث افزایش بیان BDNF (فاکتور رشد نروتروفیک مغزی) در قشر مغز جنین جوجه میشود [29]. همچنین یان و همکاران در سال 2022 با بررسی اثرات اسید فولیک با غلظت 5 برابر بیشتر از سطح توصیهشده در جنینها و نوزادان موش نشان دادند افزایش دُز اسید فولیک باعث تغییرات رونویسی در قشر مغز جنینها و نوزادان موش میشود [30]. لی و همکاران درسال 2019 با مطالعاتی که بر روی موشهای صحرایی انجام دادند، دریافتند کمبود اسید فولیک مادر باعث افزایش مرگ سلولی فیزیولوژیک سلولهای عصبی در هیپوکامپ و قشر مغز در زادهها شده و کمبود اسید فولیک مادر، بیان ژن Bcl-2 را کاهش و بیان ژن Bax و microRNA-34a را افزایش داد [31]. در سال 2017، هنزل و همکارانش نشان دادند اختلال در رشد جنین، از دست دادن جنین و تأخیر در رشد جنینی موشها میتواند ناشی از مصرف دُز بالای اسید فولیک در غذای مادر در طول بارداری باشد. همچنین وضعیت فولات مادر در موشها بر متیلاسیون DNA و بیان ژن در نیمکرههای مغزی زادهها تأثیر میگذارد [32]. در سال 2016پارتریو و همکاران اسید فولیک را با دُزهای صفر، 8، 40 و 2 میلیگرم بر کیلوگرم وزن بدن در موشهای صحرایی بررسی کردند و دریافتند موشهای در حال رشدی که از رژیم غذایی غنیشده با اسید فولیک تغذیه میشوند، شامل رژیمهای غذایی دُز صفر و 8، خطر اختلال در تکوین مخچه را افزایش میدهند [33]. در مطالعهای دیگر بورا و همکاران در سال 2015 با بررسی دُزهای 2 و 20 میلیگرم بر کیلوگرم وزن بدن اسید فولیک در موش دریافتند اسید فولیک اضافی در طول بارداری میتواند متیلاسیون DNA و بیان ژنهایی مثلSlc6a4 را در مخچه زادهها تغییر داده و باعث تغییر بیان این ژنها میشود [34]. در طی مطالعاتی که بورا و همکاران در سال 2014 انجام دادند، نشان داده شد افزایش مصرف اسید فولیک در طول بارداری بیان ژنهایی را در نیمکره مغزی زادهها تغییر میدهد که در رشد مغز نقش دارند و باعث کاهش بیان ژنهای Vgll2 ،Zfp353 ،Htr4 ،Cpn2 و افزایش بیان ژنهای Slcl7a7 ،Nfix ،Leprel1 و Xist میشود. بنابراین باتوجه به اهمیت ویژه اسید فولیک در تکوین مغز، ممکن است در مقادیر بالا اثر منفی داشته باشد [35]. گیروتو و همکارن در سال 2013 نشان دادند دُز بالای اسید فولیک سبب تغییر انتقال سیناپسی و افزایش سطح تشنج در زادههای موشهای صحرایی میشود [36]. در مطالعهای دیگر لیون و همکارانش در سال 2012 نشان دادند بروز نقص لوله عصبی از زمان غنیسازی مواد غذایی با اسید فولیک بهطور قابلتوجهی کاهش یافته است. رژیم غذایی حاوی20 برابر بیشتر از میزان مصرف توصیهشده برای جوندگان، اثرات نامطلوبی بر رشد جنین موش داشت [37]. در تحقیقی دیگر نشان داده شد کاهش میزان فولات خون و بالا رفتن هموسیستئین در طی حاملگی در مادران احتمال ابتلا به نقص لوله عصبی در فرزندان را بیشتر میکند [38]. بهطورکلی نتایج تحقیقات نشان میدهد اسید فولیک میتواند با تغییر در حالت متیلاسیون DNA بر بیان ژنها اثر داشته باشد. متیلاسیون DNA یک عامل تعیینکننده اپیژنتیکی مهم در بیان ژن (رابطه معکوس)، در حفظ یکپارچگی و پایداری DNA، در تغییرات کروماتین و در ایجاد جهش است. الگوهای غیرطبیعی متیلاسیون DNA با تغییر در بیان ژن در ایجاد بیماریها و اختلالات رشدونموی مرتبط است. فولات، به شکل 5 ـ متیل تتراهیدروفولات، در متیلاسیون مجدد هموسیستئین به متیونین، که پیشساز S ـ آدنوزیل متیونین، دهنده اولیه گروه متیل برای اکثر واکنشهای متیلاسیون بیولوژیکی، ازجمله DNA است، نقش دارد. متیلاسیون DNA توسط متیل ترانسفرازهای DNA انجام میشود؛ آنزیم هایی که میتوانند با استفاده از SAM، یک گروه متیل را به پنجمین اتم کربن باقیمانده سیتوزین برای تشکیل 5 ـ متیل سیتوزین منتقل کنند [39].
نتایج این تحقیق نشان داد دُز طبیعی اسید فولیک سبب افزایش بیان Nav1 و Nlgn1 نسبت به گروه کنترل شد. اما دُز بالای اسید فولیک سبب کاهش بیان هر دو ژن مذکور نسبت به گروه کنترل شد. بنابراین یکی از علتهای کاهش بیان ژنها در دُز بالای اسید فولیک احتمالاً افزایش سطح متیلاسیون پروموتر ژن توسط دهنده متیل، یعنی اسید فولیک است. دُز بالای اسید فولیک سبب متیله شدن پروموتر ژنها میشود که یک مکانیسم سرکوب بیان ژن است. بنابراین در دُز بالا میتواند تأثیر منفی بر بیان ژنها داشته باشد. همچنین شبکه برهمکنش پروتئینها برای نمایش ارتباط میان 2 پروتئین Nav1 و Nlgn1 و نیز یافتن کارکردهای مرتبط با آنها، نشاندهنده نقش مهم این دو پروتئین در سیناپس و درنهایت تکوین مغز است.
نتیجهگیری
بهطورکلی نتیجهگیری میشود که دُز طبیعی اسید فولیک سبب افزایش بیان Nav1 و Nlgn1 نسبت به گروه کنترل میشود، اما دُز بالاتر از حد طبیعی آن سبب کاهش بیان هر دو ژن نسبت به گروه کنترل میشود. بنابراین اسید فولیک باعث تغییر بیان Nav1 و Nlgn1 شده و ممکن است از این طریق بر تکوین مغز تأثیر بگذارد. بررسیهای بیوانفورماتیک شامل برهمکنش پروتئینها نشاندهنده اهمیت این دو ژن در تشکیل سیناپس و درنتیجه تکوین مغز است.
از محدودیتهای این تحقیق میتوان به استفاده از موش بهعنوان مدل اشاره کرد که ممکن است نتوان نتایج آن را برای انسان نیز تعمیم داد. ضمن اینکه در این پژوهش فقط به بررسی بیان 2 ژن دخیل در تکوین مغز پرداخته شده است. بنابراین پیشنهاد میشود در پژوهشهای آینده به بررسی اثرات اسید فولیک بر تعداد بیشتری از ژنهای مؤثر در تکوین مغز و همچنین اثرات آن بر رفتارها و عملکرد شناختی جانور پرداخته شود. همچنین پیشنهاد میشود در تحقیقات آینده به بررسی اثر دُزهای مختلف اسید فولیک بر میزان بیان فرم متیلهشده ژنها نیز پرداخته شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه در کمیته اخلاق دانشگاه گیلان با شناسه اخلاق (IR.GUILAN.REC.1403.027) تصویب شد.
حامی مالی
مطالعه حاضر با حمایت مالی معاونت تحقیقات و فناوری دانشگاه گیلان انجام شده است.
مشارکت نویسندگان
مفهومسازی، طراحی مطالعه، بازبینی نقادانه دستنوشته برای محتوای فکری مهم، جذب منابع مالی و نظارت: فرهاد مشایخی؛ تحلیل و تفسیر دادهها و حمایت اداری، فنی یا موادی: زهرا خوشکار و فرهاد مشایخی؛ تهیه پیشنویس دستنوشته، تحلیل آمار: زهرا خوشکار.
تعارض منافع
بنابر اظهار نویسندگان این مقاله تعارض منافع ندارد.
تشکر و قدردانی
از معاونت پژوهشی دانشکده علوم پایه دانشگاه گیلان جهت تأمین منابع مالی این پژوهش تشکر و قدردانی میشود.
References
- Stiles J, Jernigan TL. The basics of brain development. Neuropsychology Review. 2010; 20(4):327-48. [DOI:10.1007/s11065-010-9148-4] [PMID] [PMCID]
- Schepanski S, Buss C, Hanganu-Opatz IL, Arck PC. Prenatal immune and endocrine modulators of offspring's brain development and cognitive functions later in life. Frontiers in Immunology. 2018; 9:2186. [DOI:10.3389/fimmu.2018.02186] [PMID] [PMCID]
- Kwan KY, Sestan N, Anton ES. Transcriptional co-regulation of neuronal migration and laminar identity in the neocortex. Development. 2012; 139(9):1535-46. [DOI:10.1242/dev.069963] [PMID] [PMCID]
- Grützner N, Opriessnig T, Lopes R, Suchodolski JS, Nathues H, Steiner JM. Assessment of folate and cobalamin concentrations in relation to their dependent intracellular metabolites in serum of pigs between 6 and 26 weeks of age. Research in Veterinary Science. 2020; 130:59-67. [DOI:10.1016/j.rvsc.2020.02.002] [PMID]
- Imbard A, Benoist JF, Blom HJ. Neural tube defects, folic acid and methylation. International Journal of Environmental Research and Public Health. 2013; 10(9):4352-89. [DOI:10.3390/ijerph10094352] [PMID] [PMCID]
- Harlan De Crescenzo A, Panoutsopoulos AA, Tat L, Schaaf Z, Racherla S, et al. Deficient or excess folic acid supply during pregnancy alter cortical neurodevelopment in mouse offspring. Cerebral Cortex. 2021; 31(1):635-49. [DOI:10.1093/cercor/bhaa248] [PMID] [PMCID]
- Virdi S, Jadavji NM. The impact of maternal folates on brain development and function after birth. Metabolites. 2022; 12(9):876. [DOI:10.3390/metabo12090876] [PMID] [PMCID]
- Sandeep P, Sharma P, Luhach K, Dhiman N, Kharkwal H, Sharma B. Neuron navigators: A novel frontier with physiological and pathological implications. Molecular and Cellular Neurosciences. 2023; 127:103905. [DOI:10.1016/j.mcn.2023.103905] [PMID]
- Powers RM, Hevner RF, Halpain S. The neuron navigators: Structure, function, and evolutionary history. Frontiers in Molecular Neuroscience. 2023; 15:1099554. [DOI:10.3389/fnmol.2022.1099554] [PMID] [PMCID]
- Powers RM, Daza R, Koehler AE, Courchet J, Calabrese B, Hevner RF, et al. Growth cone macropinocytosis of neurotrophin receptor and neuritogenesis are regulated by neuron navigator 1. Molecular Biology of the Cell. 2022; 33(7):ar64. [DOI:10.1091/mbc.E21-12-0623] [PMID] [PMCID]
- van Haren J, Boudeau J, Schmidt S, Basu S, Liu Z, Lammers D, et al. Dynamic microtubules catalyze formation of navigator-TRIO complexes to regulate neurite extension. Current Biology. 2014; 24(15):1778-85. [DOI:10.1016/j.cub.2014.06.037] [PMID]
- Wang J, Sudhof T, Wernig M. Distinct mechanisms control the specific synaptic functions of neuroligin 1 and neuroligin 2. EMBO Reports. 2025; 26(3):860-79. [DOI:10.1038/s44319-024-00286-4] [PMID] [PMCID]
- Nguyen TA, Lehr AW, Roche KW. Neuroligins and neurodevelopmental disorders: X-linked genetics. Frontiers in Synaptic Neuroscience. 2020; 12:33. [DOI:10.3389/fnsyn.2020.00033] [PMID] [PMCID]
- Lisé MF, El-Husseini A. The neuroligin and neurexin families: From structure to function at the synapse. Cellular and Molecular Life Sciences. 2006; 63(16):1833-49. [DOI:10.1007/s00018-006-6061-3] [PMID] [PMCID]
- Trobiani L, Meringolo M, Diamanti T, Bourne Y, Marchot P, Martella G, et al. The neuroligins and the synaptic pathway in Autism Spectrum Disorder. Neuroscience and Biobehavioral Reviews. 2020; 119:37-51. [DOI:10.1016/j.neubiorev.2020.09.017] [PMID]
- Greenberg JA, Bell SJ, Guan Y, Yu YH. Folic Acid supplementation and pregnancy: More than just neural tube defect prevention. Reviews in Obstetrics and Gynecology. 2011; 4(2):52-9. [DOI:10.18370/2309-4117.2017.34.57-63]
- Giovedí S, Corradi A, Fassio A, Benfenati F. Involvement of synaptic genes in the pathogenesis of autism spectrum disorders: the case of synapsins. Frontiers in Pediatrics. 2014; 2:94. [DOI:10.3389/fped.2014.00094] [PMID] [PMCID]
- Jang S, Lee H, Kim E. Synaptic adhesion molecules and excitatory synaptic transmission. Current Opinion in Neurobiology. 2017; 45:45-50. [DOI:10.1016/j.conb.2017.03.005] [PMID]
- Huang Y, He Y, Sun X, He Y, Li Y, Sun C. Maternal high folic acid supplement promotes glucose intolerance and insulin resistance in male mouse offspring fed a high-fat diet. International Journal of Molecular Sciences. 2014; 15(4):6298-313. [DOI:10.3390/ijms15046298] [PMID] [PMCID]
- Naninck EFG, Stijger PC, Brouwer-Brolsma EM. The importance of maternal folate status for brain development and function of offspring. Advances in Nutrition. 2019; 10(3):502-19. [DOI:10.1093/advances/nmy120] [PMID] [PMCID]
- Sun WX, Shu YP, Yang XY, Huang W, Chen J, Yu NN, et al. Effects of folic acid supplementation in pregnant mice on glucose metabolism disorders in male offspring induced by lipopolysaccharide exposure during pregnancy. Scientific Reports. 2023; 13(1):7984. [DOI:10.1038/s41598-023-31690-w] [PMID] [PMCID]
- Faul F, Erdfelder E, Lang AG, Buchner A. G*Power 3: A flexible statistical power analysis program for the social, behavioral, and biomedical sciences. Behavior Research Methods. 2007; 39(2):175-91. [DOI:10.3758/BF03193146] [PMID]
- van de Rest O, van Hooijdonk LW, Doets E, Schiepers OJ, Eilander A, de Groot LC. B vitamins and n-3 fatty acids for brain development and function: Review of human studies. Annals of Nutrition & Metabolism. 2012; 60(4):272-92. [DOI:10.1159/000337945] [PMID]
- Greene ND, Copp AJ. Neural tube defects. Annual Review of Neuroscience. 2014; 37:221-42. [DOI:10.1146/annurev-neuro-062012-170354] [PMID] [PMCID]
- Douet V, Chang L, Cloak C, Ernst T. Genetic influences on brain developmental trajectories on neuroimaging studies: From infancy to young adulthood. Brain Imaging and Behavior. 2014; 8(2):234-50. [DOI:10.1007/s11682-013-9260-1] [PMID] [PMCID]
- Wang D, Xu Y, Hong L, Qi B, Li X, Xie C, et al. Expose to high doses of folic acid during pregnancy causes adolescent anxiety- and depression-like behaviors in offspring mice. Journal of Affective Disorders. 2025; 368:770-8. [DOI:10.1016/j.jad.2024.09.105] [PMID]
- Heydari B, Mashayekhi F, Kashani MHG. Effect of in ovo feeding of folic acid on Disabled-1 and gga-miR-182-5p expression in the cerebral cortex of chick embryo. Journal of Animal Physiology and Animal Nutrition. 2024; 108(2):285-90. [DOI:10.1111/jpn.13889] [PMID]
- Liang X, Shi L, Wang M, Zhang L, Gong Z, Luo S, et al. Folic acid ameliorates synaptic impairment following cerebral ischemia/reperfusion injury via inhibiting excessive activation of NMDA receptors. The Journal of Nutritional Biochemistry. 2023; 112:109209. [DOI:10.1016/j.jnutbio.2022.109209] [PMID]
- Razeghi E, Mashayekhi F, Ghasemian F, Salehi Z. Effect of in ovo feeding of folic acid on brain derived neurotrophic factor (BDNF) and gga-miR-190a-3p expression in the developing cerebral cortex of chickens. Research in Veterinary Science. 2023; 154:73-77. [DOI:10.1016/j.rvsc.2022.11.010] [PMID]
- Luan Y, Cosín-Tomás M, Leclerc D, Malysheva OV, Caudill MA, Rozen R. Moderate folic acid supplementation in pregnant mice results in altered sex-specific gene expression in brain of young mice and embryos. Nutrients. 2022; 14(5):1051. [DOI:10.3390/nu14051051] [PMID] [PMCID]
- Li W, Li Z, Zhou D, Zhang X, Yan J, Huang G. Maternal folic acid deficiency stimulates neural cell apoptosis via miR-34a associated with Bcl-2 in the rat foetal brain. International Journal of Developmental Neuroscience. 2019; 72:6-12. [DOI:10.1016/j.ijdevneu.2018.11.002] [PMID]
- Henzel KS, Ryan DP, Schröder S, Weiergräber M, Ehninger D. High-dose maternal folic acid supplementation before conception impairs reversal learning in offspring mice. Scientific Reports. 2017; 7(1):3098. [DOI:10.1038/s41598-017-03158-1] [PMID] [PMCID]
- Partearroyo T, Pérez-Miguelsanz J, Peña-Melián Á, Maestro-de-Las-Casas C, Úbeda N, Varela-Moreiras G. Low and high dietary folic acid levels perturb postnatal cerebellar morphology in growing rats. The British Journal of Nutrition. 2016; 115(11):1967-77. [DOI:10.1017/S0007114516001008] [PMID]
- Barua S, Kuizon S, Chadman KK, Brown WT, Junaid MA. Microarray analysis reveals higher gestational folic Acid alters expression of genes in the cerebellum of mice offspring-a pilot study. Brain Sciences. 2015; 5(1):14-31. [DOI:10.3390/brainsci5010014] [PMID] [PMCID]
- Barua S, Chadman KK, Kuizon S, Buenaventura D, Stapley NW, Ruocco F, Begum U, et al. Increasing maternal or post-weaning folic acid alters gene expression and moderately changes behavior in the offspring. Plos One. 2014; 9(7):e101674. [DOI:10.1371/journal.pone.0101674] [PMID] [PMCID]
- Girotto F, Scott L, Avchalumov Y, Harris J, Iannattone S, Drummond-Main C, et al. High dose folic acid supplementation of rats alters synaptic transmission and seizure susceptibility in offspring. Scientific Reports. 2013; 3:1465. [DOI:10.1038/srep01465] [PMID] [PMCID]
- Mikael LG, Deng L, Paul L, Selhub J, Rozen R. Moderately high intake of folic acid has a negative impact on mouse embryonic development. Birth Defects Research. Part A, Clinical and Molecular Teratology. 2013; 97(1):47-52. [DOI:10.1002/bdra.23092] [PMID]
- Kucha W, Seifu D, Tirsit A, Yigeremu M, Abebe M, Hailu D, et al. Folate, vitamin B12, and homocysteine levels in women with neural tube defect-affected pregnancy in Addis Ababa, Ethiopia. Frontiers in Nutrition. 2022; 9:873900. [DOI:10.3389/fnut.2022.873900] [PMID] [PMCID]
- Kiselev IS, Kulakova OG, Boyko AN, Favorova OO. DNA methylation as an epigenetic mechanism in the development of multiple sclerosis. Acta Naturae. 2021; 13(2):45-57. [DOI:10.32607/actanaturae.11043] [PMID] [PMCID]
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |









