دوره 33، شماره 2 - ( 4-1403 )
جلد 33 شماره 2 صفحات 159-134 |
برگشت به فهرست نسخه ها
Research code: برگرفته از طرح نمیباشد.
Ethics code: این مقاله از نوع مروری است که هیچگونه آزمایشی بر روی ا
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Rostamani H, Fakhraei O, Toosizadeh Khorasani F, Kelidari N. A Review of 3D Bioprinting Technologies in the Reconstruction of Human Nasal Cartilaginous Tissue. JGUMS 2024; 33 (2) :134-159
URL: http://journal.gums.ac.ir/article-1-2574-fa.html
URL: http://journal.gums.ac.ir/article-1-2574-fa.html
رستمانی حسین، فخرایی امید، طوسی زاده خراسانی فاطمه، کلیدری نرگس. مروری بر فناوریهای چاپ زیستی سهبعدی در بازسازی بافت غضروفی بینی انسان. مجله علوم پزشکی گیلان. 1403; 33 (2) :134-159
1- گروه مهندسی پزشکی، دانشکده پزشکی، واحد مشهد، دانشگاه آزاد اسلامی، مشهد، ایران.
متن کامل [PDF 10714 kb]
(765 دریافت)
| چکیده (HTML) (2410 مشاهده)
روش اکستروژن
روش اکستروژن رایجترین، تطبیقپذیرترین و در دسترسترین روش چاپ زیستی است. این روش با رسوب دادن لایهبهلایه مواد زیستی رشتهای، که فیلامنت نامیده میشوند، عمل میکند. اکسترود کردن مواد معمولاً به یکی از روشهای توزیع پنوماتیکی، پیستونی یا پیچشی صورت میگیرد که توزیع پیچشی برای هیدروژلهای با ویسکوزیته بالا مطلوبتر است [27، 34].
چاپ اکستروژن پنوماتیکی با استفاده از فشردن هوا جوهرهای زیستی را اکسترود میکند، درحالیکه در روش پیستونی یا پیچشی ماده بهطور فیزیکی اکسترود میشود. در فناوری هوای فشرده ممکن است تأخیر کمی در توزیع وجود داشته باشد که بر وضوح مؤثر باشد، بااینحال کلیه این روشها با موفقیت در چاپ زیستی به کار رفتهاند. از اقسام فناوریهای مبتنی بر اکستروژن میتوان به مدلسازی رسوبشده و چاپ زیستی مبتنی بر اکستروژن اشاره کرد. نازلی که در اکستروژن استفاده میشود اغلب شبیه سرنگ بدون سوزن، یک نازل مخروطیشکل یا مشابه لوله مویرگی شیشهای است. هندسه مقطع دهانه نازل بر هندسه فیلامنت چاپشده تأثیر دارد [27].
چاپ زیستی مبتنی بر اکستروژن از فناوری مدلسازی رسوبشده سرچشمه میگیرد. این دستگاهها از سرهای چاپ سرنگیمانند برای هدایت پنوماتیک، مکانیکی یا الکترومغناطیسی جوهر زیستی (غالباً هیدروژل حاوی سلولها) و رسوب دادن آن استفاده میکنند. در این فرایند، میتوان در یک مرحله چاپ زیستی انجام داد یا آنکه بعداً سلولها را در داربست اولیه کاشت. چاپ زیستی اکستروژن با بسیاری از بیومواد که ویسکوزیتهای بیش از 6×107 مگاپاسکال در ثانیه دارند، سازگار است. در شرایطی که عموماً مواد با ویسکوزیته بالا از خواص مکانیکی بهتر بهره میبرند و مواد با ویسکوزیته پایینتر، از زندهمانی سلولی پشتیبانی میکنند. نیرویهای برشی را میتوان با کاهش فشار توزیع و طول نازل و با افزایش قطر نازل کنترل کرد. بااینحال این کار باعث از دست دادن زمان و وضوح چاپ میشود [27، 35]. در حالت ایدئال، جوهر زیستی مورداستفاده در چاپ زیستی اکستروژن برای چاپ یک ایمپلنت زیستتقلیدشده میبایست علاوهبر زیستسازگاری، زیستتخریبپذیری و الاستیسیته بودن، از نازک شدن و بازیابی برشی سریع و نیز سینتیک ژل شدن پشتیبانی کند. جوهرهای با ویسکوزیته بالا اگرچه وفاداری شکل بهتری دارند، اما ممکن است آسیب سلولی یا گرفتگی نازل را در پی داشته باشند [16، 36].
مزیت اصلی چاپ زیستی مبتنی بر اکستروژن، توانایی چشمگیر آن در استفاده از سلولهای با چگالی و گرانروی بالا و سازگاری با انواع مواد، ازجمله هیدروژلهای مملو از سلول، میکروحاملها و ماتریکس خارجی بدون سلول است. همچنین این روش قادر به چاپ ساختارهای زیستتقلیدشده در ابعاد بزرگ و در کنار آن، نسبتاً مقرونبهصرفه است. بااینحال موارد چالشبرانگیزی همچون تثبیت خواص سازه پس از چاپ را با خود همراه دارد و نقطه ضعف اصلی این روش این است که سرعت، وضوح و زندهمانی کمتری را نسبت به سایر روشها نتیجه میدهد. با تغییر پارامترهایی چون اندازه و قطر نازل، نیروی وارده بر جوهر زیستی، سرعت و دمای چاپ و میزان ترشوندگی بستر، میتوان بر وضوح تأثیر گذاشت. با کاهش فشار اکستروژن و افزایش اندازه نازل، زندهمانی سلولی در حدود 40 تا 80 درصد است و وجود نیروی برشی بر روی سلولهای موجود در جوهر زیستی نیز اثر میگذارد. چاپ با سرعت بسیار بالا به کشیده شدن خطوط و خواص مکانیکی ضعیف ختم میشود و چاپ با سرعت بسیار کند، منجر به افزایش عرض خطوط چاپی میشود [28، 37-39]. محدودیت در وضوح میتواند کاربرد این فناوری زیستی را در حد ترمیم بافتهای نرم تقلیل دهد، با آنکه همچنان برای بافتهای سخت بزرگتر از 10 میلیمتر قابلاستفاده است [40].
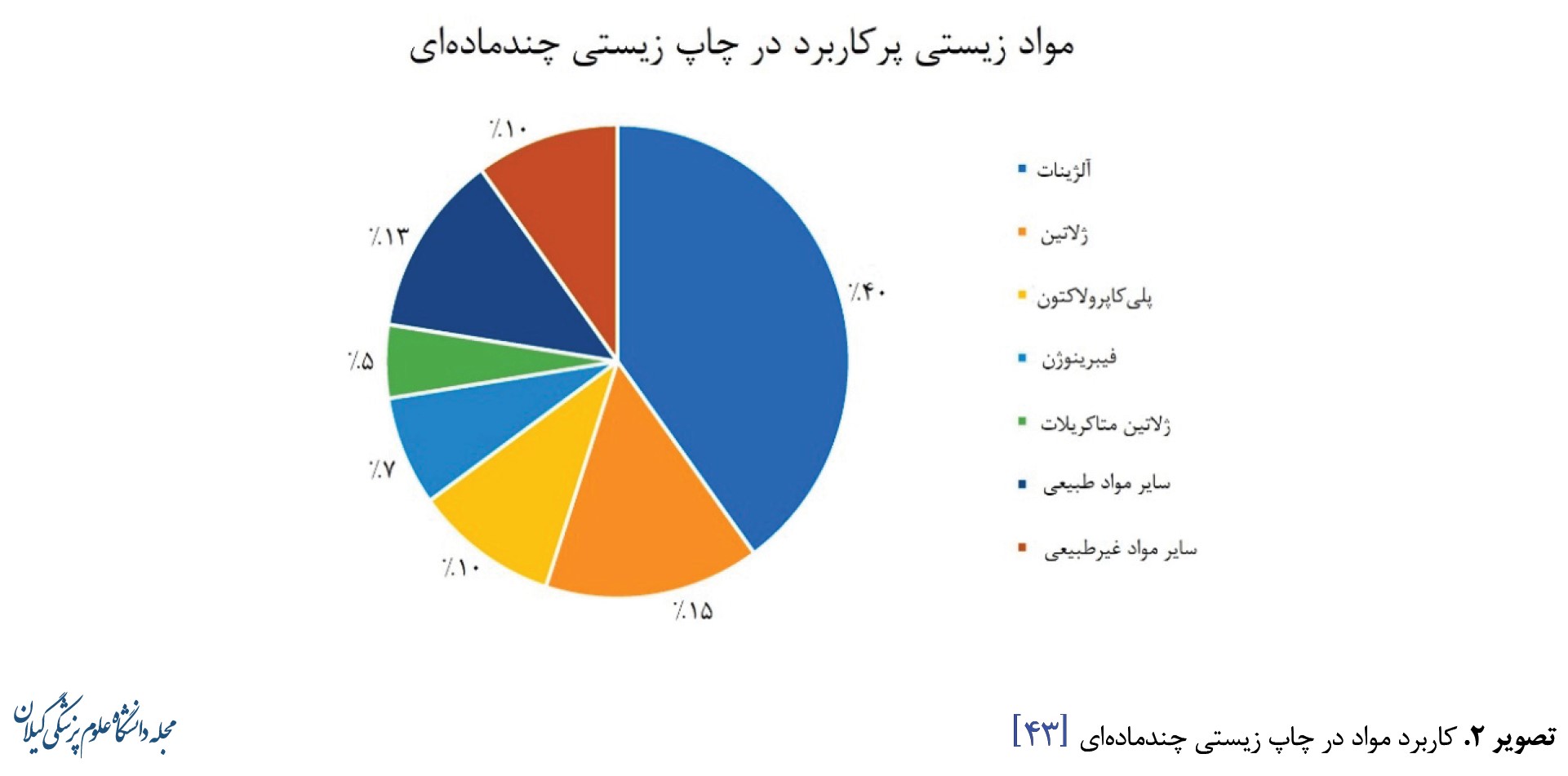
یکی از روشهای پیشرفته اکستروژن چاپ زیستی چندمادهای است که هدف آن تکرار نظم پیچیده بافت و اندامهای میزبان در سازه است. ازآنجاییکه بافتها و اندامهای بومی انسان دارای ساختارهای درونسلولی و برونسلولی ناهمگن هستند، توانایی ساخت سازههایی با چند جوهر زیستی بسیار حائز اهمیت است. چاپ یک هندسه چندمادهای اغلب شامل چاپ متوالی مواد منفرد با استفاده از نازلهای متعدد است. چاپ چندمادهای به فرد اجازه میدهد تا مواد طبیعی را با مواد مصنوعی با استحکام مکانیکی بالا ترکیب کند تا از مزایای هر دو ماده استفاده شود. بااینحال کند بودن و نیازمندی به دقت زیاد در تراز بودن نازلها از معایب آن است. آلژینات در این نوع چاپ زیستی بسیار پرکاربرد است. چاپ زیستی چندمادهای را میتوان براساس نحوه سازماندهی مواد به چند دسته تقسیم کرد. رایجترین تکنیک چندمادهای چاپ سایدبایساید است که در آن چندین ماده متناوباً در یک یا چند لایه قرار میگیرند که جهت افزایش خواص مکانیکی در تولید ساختارهای غضروفی قابلبهکارگیری است [41, 42]. در تصویر شماره 2 پرکاربردترین مواد زیستی قابلاستفاده در چاپ زیستی چندمادهای نمایش داده شده است [43].
جوهر زیستی
جوهر زیستی جزو اصلی و زنده چاپ زیستی است و معمولاً حاوی ترکیبی زیستسازگار از مواد داربست، سلولهای قابلکاشت و مواد زیستفعالی است که خواص مکانیکی و زیستشناختی بافت میزبان را تقلید میکنند [84]. زیستسازگار یعنی هیچ اثر نامطلوب موضعی یا سیستمی ایجاد نشود و از عملکرد بافت پشتیبانی شود. همچنین جوهر زیستی ایدئال میبایست با دارا بودن سینتیک ژل شدن و نازک شدن برشی، قابلیت چاپ دقیق و کنترلشده داشته باشد و دارای خواص مکانیکی مناسب باشد؛ به این معنا که در شرایط اعمال نیروی خارجی شکل اولیه خود را حفظ کند. زیستتخریبپذیری و سازگاری با حداقل 1 روش استریل شدن از دیگر ویژگیهای جوهر زیستی ایدئال است. فرایند تخریب داربست باید با تشکیل بافت همراه باشد [14، 27، 85]. جوهرهای زیستی چندجزئی به ترکیبی از چند نوع ماده زیستی، یک یا چند نوع سلول و مواد زیستفعال اطلاق میشود [86].
طی فرایند چاپ، به کمک اتصال عرضی، جوهر زیستی به ساختاری سهبعدی تبدیل میشود. اتصال عرضی میان این محلول پلیمری میتواند به روش شیمیایی (مانند استفاده از نور، حرارت، واکنشهای شیمیایی یا اتصالدهندهها)، فیزیکی (مانند فعلوانفعالات یونی)، آنزیمی یا ترکیبی از آنها رخ دهد [87، 88]. برای مثال میتوان به استفاده از نور ماورای بنفش برای اتصال عرضی هیدروژلهای ژلاتین متاکریلات (شیمیایی) یا یونهای کلسیم برای اتصال عرضی آلژینات (فیزیکی) اشاره کرد [89، 90].
مواد زیستی
بهطورکلی مواد زیستی بهکاررفته در جوهر زیستی را میتوان به 2 دسته طبیعی و غیرطبیعی تقسیم کرد. مواد زیستی طبیعی خود میتوانند از منبع حیوانی یا غیرحیوانی باشند. ازجمله مواد زیستی طبیعی ژلاتین، آلژینات، کلاژن، فیبروئین ابریشم، هیالورونیک اسید، کیتوزان و ECM بدون سلول در ساخت جوهرهای زیستی مناسب برای چاپ بافت غضروفی به کار رفتهاند. مواد زیستی غیرطبیعی خود میتوانند از منبع آلی یا معدنی باشند. ازجمله آنها میتوان به پلیکاپرولاکتون، پلیاتیلن گلیکول، پلیلاکتیک اسید و نانولولههای کربنی اشاره کرد. مواد زیستی طبیعی برخلاف انواع غیرطبیعی عموماً زیستسازگاری خوبی دارند، اما خواص مکانیکی آنان ضعیفتر است [27، 85، 91]. پلیمرهای طبیعی ازآنجاییکه تحت اثر آنزیمهایی که از سیستم بدن یا میکروارگانیسمها ترشح میشوند قرار میگیرند و تجزیه میشوند، زیستتخریبپذیر هستند. از سوی دیگر بیوپلیمرها مانند پلی کاپرولاکتون بهصورت هیدرولیتیکی در بدن تخریب میشوند [92].
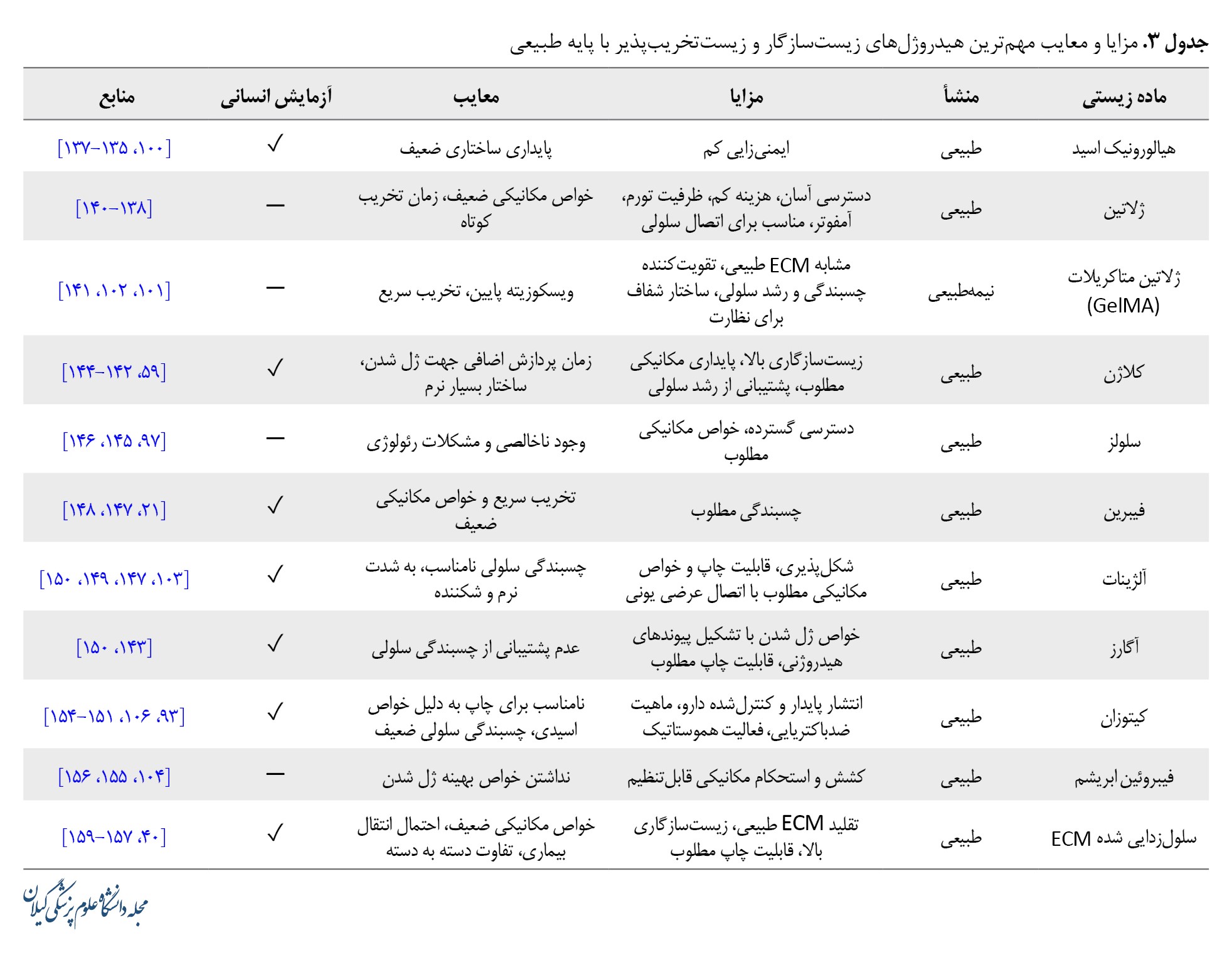
هیدروژلها زنجیرههای پلیمری بسیار آبدوست هستند که با اتصالات عرضی به یکدیگر وصل شدند تا یک شبکه سهبعدی را تشکیل دهند [93]. هیدروژلها به دلیل تخلخل و توانایی بارگذاری مواد مختلف و همچنین توانایی در جذب آب و محصور کردن سلولها به گزینهای عالی برای تقلید ریزمحیط بافت میزبان بدل شدهاند. از دیگر ویژگیهای منحصربهفرد هیدروژلها میتوان به زیستتخریبپذیری، زیستسازگاری، پشتیبانی از اتصال، رشد یا تمایز سلولی اشاره کرد. پلیمرهای طبیعی و ECM سلول زدایی شده به علت زیستسازگاری بالا و قابلیت ژل شدن، مکرراً در ساخت جوهر زیستی مناسب مهندسی بافت غضروف استفاده شدهاند [59، 94، 95]. همچنین هیدروژلها میتوانند بهعنوان حامل مواد، دارو و سلولها عمل کنند و در شرایط کشت، در تأمین مواد مغذی و ایجاد یک ریزمحیط مناسب برای سلولهای محصورشده نقش ایفا کنند و پس از قرارگیری در بدن، رهاسازی کنترلشده مواد را باعث شوند. بنابر این دلایل هیدروژلها گزینه اصلی برای مهندسی بافت غضروف با استفاده از چاپ زیستی هستند [96 ,97]. هیدروژلها میتوانند از پلیمرهای طبیعی یا غیرطبیعی یا ترکیبی از آنان تشکیل شده باشند که برای یک جوهر زیستی بهبودیافته قابلچاپ ساخته میشوند [98 ,99]. در جدول شماره 3 فهرستی از مهمترین هیدروژلهای زیستسازگار طبیعی به همراه مزایا و معایب شاخص آنها درج شده است.
کلیه این هیدروژلها آزمونهای برونتنی و درونتنی حیوانی را با موفقیت پشت سرگذاشتهاند. امروزه، بسیاری از این بیوپلیمرها بهعنوان جایگزین بافت زنده وارد فاز آزمایشهای انسانی شدهاند.
ندونچزیان و همکاران با اصلاح هیالورونیک اسید ازطریق اتصالات عرضی شیمیایی و پیوندهای غیرکووالانسی یک هیدروژل مناسب برای ترمیم غضروف ساختند [100]. لو و همکاران یک جوهر زیستی مبتنی بر ژلاتین متاکریلات مملو از سلول تولید کرد که پس از اتصال عرضی نوری، غضروفزایی منحصربهفردی از خود نشان داد. [101 ,102] مواد زیستی طبیعی غیرحیوانی که عمدتاً از خانواده پلیساکاریدها هستند، مانند آلژینات و آگارز، خواص مکانیکی و قابلیت چاپ بسیار مطلوبی دارند، اما از سویی خواص زیستی آنها برای تحقق عملکرد سلولی ایدئال نیست [84]. تلفیق دیگر پلیمرهای طبیعی همچون ژلاتین و کلاژن با آلژینات برای رسیدن به خواص زیستی مدنظر بسیار رایج است. یانگ ایکس و همکاران از غضروف مهندسیشده کلاژن ـ آلژینات استفاده کردند که قادر است فنوتیپ غضروفی را بهطور مؤثر حفظ کند و نرخ انبساط و خواص مکانیکی مطلوبی داشته باشد [103 ,104].
در تحقیقی که وایشر و همکاران انجام دادند یک جوهر زیستی سلولزداییشده مبتنی بر ECM غضروفی ضمن اتصال عرضی نوری، با ایجاد ریزمحیطی برای فعالیت و بلوغ سلولی و پایداری مکانیکی نتایج امیدوارکنندهای برای بازسازی غضروف ارائه کرد [105]. پلیاستر پلیکاپرولاکتون پلیمری زیستسازگار، با سرعت تخریب مناسب و دارای خواص مکانیکی مطلوب است که عمدتاً بهعنوان چارچوب هیدروژلها، مثلاً برای پشتیبانی مکانیکی از ساختار غضروف، استفاده میشود. باوجوداین، توانایی محصور کردن سلولها را ندارد. چراکه ذوب یا حل کردن پلیمر در حلال برای سلولها آسیبزاست [106-108]. میکروالیافهای پلیاستر پلیکاپرولاکتون به دلیل خواص مکانیکی مناسب در جوهرهای زیستی استفاده میشوند. با افزودن میکروالیاف پلیاستر پلیکاپرولاکتون به جوهر زیستی، میتوان مدول الاستیک آلژینات و ژلاتین متاکریلات را به ترتیب 544 و 45 برابر افزایش داد [109]. بااینحال سطح آبگریز پلیاستر پلیکاپرولاکتون دارای میل سلولی ضعیف است. جوهرهای زیستی هیبریدی که نانوذرات PDA و پلی (ال ـ لاکتیک اسید ـ کو ـ گلیکولید) را ازطریق چاپ سهبعدی در داربست پلیاستر پلیکاپرولاکتون وارد میکنند، میتوانند زاویه تماس آب با پلیاستر پلیکاپرولاکتون خالص را کاهش دهند و زیستسازگاری ریزمحیط را بهبود بخشند [110]. پلیاتیلن گلیکول پلیمری خطی و محلول در آب است که معمولاً به اشکال پلی (اتیلن گلیکول) دیاکریلات یا متاکریلات در چاپ زیستی کاربرد دارد [111, 112]. پلیلاکتیک اسید و پلی (ال ـ لاکتیک اسید ـ کو ـ گلیکولید) به دلیل ساختار قابلتنظیم، زیستسازگاری و زیستتخریبپذیری در جوهرهای زیستی قابلاستفاده است. بااینحال به دلیل آبگریزی، آنها چسبندگی سلولی ضعیفی دارند [113]. مطالعات ثابت کردهاند که نانولولههای کربنی تولیدشده با استفاده از فناوری چاپ زیستی میتوانند خواص فیزیکی داربستهای غضروفی را افزایش دهند [90]. برخی از هیدروژلهای مصنوعی مانند هیدروژل پلیمتاکریلهشده برای مهندسی بافت غضروف مناسب به نظر میرسند [114].
منابع سلولی
یک منبع سلولی با عملکرد بیولوژیکی و ظرفیت بازساختی، ضمن عدم ایمنیزایی از مهمترین بخشهای یک مهندسی بافت است؛ چنانکه بسیاری از غضروفهای آلوژن اغلب توسط سیستم ایمنی بدن رد میشوند. کندروسیتهای اتولوگ و سلولهای بنیادی مزانشیمی، 2 منبع اصلی برای مهندسی بافت غضروف بینی هستند [115، 116].
کندروسیتهای اولیه اتولوگ، مطلوبترین و پرمصرفترین منبع سلولی برای کاربرد در جوهرهای زیستی مناسب چاپ زیستی غضروف هستند. غضروفهای مفصلی، سپتوم، گوش و مهمتر از همه دندهای از این دست منابع سلولیاند. بااینحال به دلیل مشکلاتی همچون عوارض ناحیه اهداکننده و دسترسی، از منابع جایگزینی، مانند سلولهای بنیادی پرتوان القایی مشتق شده از انسان، سلولهای بنیادی مزانشیمی مغز استخوان، پد چربی زیر کشککی، سلولهای بنیادی جنینی و غیره استفاده میشود. این سلولهای بنیادی قدرت تکثیر بالایی دارند و بهوسیله زیستفعالها قابلتمایز به کندروسیتها هستند. افزون بر این، مطالعات جدید از کشت مشترک چند نوع سلول برای دستیابی به غضروفزایی حمایت میکنند [79، 117]. سلولهای بنیادی مزانشیمی برداشتهشده از یک بالغ، تمایل بیشتری برای تمایز به غضروف دارند [118]. کندروسیتهای بهدستآمده از تیغه بینی توانایی تکثیر نسبتاً بالاتری برای تولید بافتهای هیالین دارند [14]. منابع آلوژنیک یا اهداکننده افزون بر مشکلات منابع اتولوگ، میتوانند رد شدن توسط بافت میزبان و نیاز به سرکوب سیستم ایمنی بهصورت مادامالعمر را در پی داشته باشند [119, 120].
کندروسیتها میتوانند از منبع انسانی یا حیوانی تهیه شوند، اما باید توجه داشت فنوتیپ آنها بهسرعت در محیط آزمایشگاهی از بین میرود که این امر را میتوان با فاکتورهای رشد کنترل کرد [14, 120]. در آزمایشی که اوگنی و همکاران انجام دادند منبع سلولی از غضروف دندهای موشهای تازه متولدشده تأمین شد که محتوای سلولی بالایی را فراهم کردند [121].
زیستفعالها
عوامل زیستفعال نقش کلیدی در هدایت سلولی و بهبود خواص بیوشیمیایی و بیومکانیکی بافت دارند. فاکتورهای رشدی همچون فاکتور رشد تغییردهنده بتا، فاکتور رشد شبهانسولین و فاکتور رشد فیبروبلاست جهت تنظیم سنتز و متابولیسم ماتریکس غضروفی، تقویت تکثیر و تمایز و حفظ فنوتیپ در جوهر زیستی استفاده میشوند. برای نمونه فاکتورهای رشد تغییردهنده بتا 1 و 3 جهت تحریک تمایز سلولهای بنیادی به سلولهای غضروفی کاربرد دارد [122، 123]. در مطالعات مشخص شد فاکتورهای رشد فیبروبلاست پتانسیل غضروفی شدن در طول دوره کشت بافت چاپشده را بهطور قابلتوجهی افزایش دادهاند. همچنین داروهای مختلف، هورمونها و سیتوکینها را میتوان برای تقویت رشد سلولها در نظر گرفت [124].
ارزیابیهای برونتنی
کشت مدلهای سهبعدی به شکل وسیعی در تحقیقات زیستپزشکی مورد استفاده قرار گرفته است. همچنین چاپ بافتهای مقیاس کوچک به شکل میکروسفرهای هیدروژل نیز درزمینه مهندسی بافت و غربالگری دارو کاربرد دارد [125]. پس از چاپ زیستی بافت، بافت چاپ سهبعدیشده ممکن است در شرایط برونتنی بهوسیله بیوراکتورها کشت داده شود تا پیش از کاشت درون بدن بالغ شود [126]. بیوراکتورها با شبیهسازی محیط بافت طبیعی، مواد مغذی و محرکهای رشد را برای بافت چاپشده تأمین میکنند. برای کشت باید به الزامات ذاتی و رفتاری هر نوع سلول توجه داشت [127، 128]. آزمون کمی سمیت سلولی MTT، رنگآمیزی هماتوکسیلین ـ ائوزین، رنگآمیزی دپی، رنگ آلسیان آبی برای گلیکوزامینوگلیکانها، ارزیابیهای فلوسیتومتری و مطالعه بهوسیله میکروسکوپ الکترونی روبشی ازجمله بررسیهایی است که محققان برای ارزیابی زندهمانی، بافتشناسی و ریختشناسی بافت چاپشده انجام میدهند. همچنین سنجش کمی محتوای گلیکوزامینوگلیکانها، DNA و کلاژن نوع II در ECM، طیفسنجی تبدیل فوریه، بلورنگاری پرتوی ایکس، سنجش فعالیت میتوکندری، آزمون نسبت تورم و آزمونهای رئولوژیکی و مکانیکی نیز برای بررسیهای دقیقتر میتواند صورت بگیرد تا ویژگیها، فنوتیپ و کارایی ساختار چاپشده مشخص شود [112، 129].
براساس مطالعات، چاپ زیستی اکستروژن هیدروژلهای آلژینات و آگارز از تشکیل هیالین بیشتری نسبت به هیدروژلهای دیگر پشتیبانی میکند [109]. داربستهای پلیاستر پلیکاپرولاکتون / آلژینات چاپشده حاوی فاکتور رشد تغییردهنده بتا، منجر به تشکیل سطوح بالاتری ECM شدند [130]. باید توجه داشت که برای شناسایی سلولها در منبع جمعآوریشده از رنگآمیزی آبی آلیسان استفاده میشود. تولید گلیکوزامینوگلیکان و تجمع آنها در ECM نمایانگر وجود سلولهاست [121]. هنگامی که سلولهای بنیادی مزانشیمی در کنار فاکتور رشد تغییردهنده بتا 3 به جوهرهای زیستی اضافه شد، پشتیبانی قابلتوجهی برای ایجاد غضروف مستحکم نشان داد که این ترکیب برای استراتژی چاپ درجا مناسب تلقی شد [131].
لیم و همکاران به کمک جوهر زیستی متشکل از سلولهای بنیادی مزانشیمی، متاکریلات پلیوینیل الکل و ژلاتین متاکریلات و بکارگیری چاپگر پردازش نور دیجیتال تعدادی ساختار بیولوژیکی با دقت بالا چاپ کردند. پس از 21 روز کشت، زنده ماندن بالایی (90 درصد) را حفظ کردند [132]. یانگ و همکاران توانستند به کمک فناوری چاپ زیستی اکستروژن داربستهای سدیم آلژینات /آگارز و سدیم آلژینات / کلاژن را همراه کندروسیتها چاپ کنند. مشخص شد جوهر زیستی سدیم آلژینات / کلاژن ترکیبی بالقوه برای بازسازی غضروف است، چراکه در کشت سلولی افزایش تکثیر، بیان ژن اختصاصی غضروف و چسبندگی سلول غضروفی را نشان داد [103]. همچنین در آزمایش کوشیک کوژول و همکاران آلژینات و میکروفیبرهای پلیلاکتیک اسید را همراه با کندروسیتهای انسانی چاپ کردند که در بررسیها زندهمانی 80 درصد و خواص مکانیکی بهبودیافته را نتیجه داد [133].
ارزیابیهای درونتنی
بدیهی است زمانی که یک ایمپلنت بهعنوان یک جسم خارجی در بافت میزبان قرار میگیرد عوارض مختلفی ممکن است رخ دهد [92]. در حال حاضر اگرچه تحقیقات گستردهای درزمینه چاپ زیستی غضروف بینی صورت گرفته، اما اکثر آنها فاقد تحقیقات بالینی هستند، چراکه عمدتاً ساختارها به حدی بالغ نشدند که برای این تحقیقات تأیید شوند [5].
در مطالعهای که لان و همکاران انجام دادند، ساختارهای هیدروژل کلاژن و کندروسیت پس از آنکه در چند دوره کشت در انکوباتور خواص مکانیکی مطلوب و فنوتیپ غضروف بینی را نشان دادند، بهصورت زیرجلدی در 7 موش برهنه کاشته شدند. یک موش بهعنوان نمونه کنترل، داربست بدون سلول را دریافت کرد. هیچ عارضهای پس از جراحی مشاهده نشد و 5 هفته پس از کاشت ارزیابیهای مکانیکی، بافتشناسی و ایمنیشناسی روی ایمپلنتها انجام شد. نتایج حاکی از آن بود که چاپ زیستی غضروف بینی میتواند گزینهای قوی برای جراحی بازساختی بینی باشد [2]. در آزمایش مشابهی آپلگرن و همکاران 48 موش ماده برهنه مورد استفاده قرار دادند. در ساختارهای کاشتهشده غضروفزایی پیشرونده و یکپارچگی ساختاری مشاهده شد و پس از 2 ماه، مورفولوژی ایمپلنت مانند غضروف بومی شد [134].
نتیجهگیری
چاپ زیستی سهبعدی از فناوریهای نوظهوری است که در پزشکی بازساختی، با ترمیم و بهبود بافت غضروفی بینی توانایی بالقوهای را از خود نشان داده است. روشهای بازسازی بافت غضروفی تا چندی پیش محدود به استفاده از غضروفهای اتولوگ، آلوژنیک یا استفاده از پیوندهای آلوپلاستیک بوده که هریک معایب اجتنابناپذیری به همراه داشته است. به همین جهت، چاپ زیستی برای حل این معضلات در پزشکی بازساختی به کار گرفته میشود. باتوجهبه الزامات خاص جوهر زیستی بافت هدف، محققان از فناوریهای مختلفی برای چاپ بافت و اندام بهره بردهاند که هریک مزایا و محدودیتهای ویژهای دارند. فناوری چاپ زیستی همچنین یک بازار تجاری رو به رشد است که امروزه ارزش جهانی آن به حدود 2/6 میلیارد دلار میرسد.
براساس مطالعات درونتنی و برونتنی که تا به امروز بر روی بافت چاپشده غضروفی بینی صورت گرفته است، فناوری چاپ زیستی توانسته است بافت میزبان غضروف را تا حد بسیار قابلقبولی ازلحاظ مورفولوژیکی، بیوشیمیایی و مکانیکی تقلید کند. اگرچه استفاده از این فناوری در سطح بالینی همچنان با محدودیتهایی روبهرو است، اما چشمانداز این فناوری از آنجایی امیدوارکننده است که میتواند با هزینه پایین، دقت منحصربهفرد و شخصیسازی، معایب و نقایص بینی را برطرف کند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مقاله از نوع مروری است و هیچگونه آزمایشی بر روی انسان یا حیوان نداشته است. هیچکدام از دادهها در حمایت از نتیجه نهایی پژوهش دست کاری نشدهاند و به تمامی مطالعات در دسترس در راستای موضوع پژوهش اشاره شده است.
حامی مالی
این تحقیق هیچگونه کمک مالی از سازمانهای تأمین مالی در بخشهای عمومی، تجاری یا غیرانتفاعی دریافت نکرد.
مشارکت نویسندگان
مفهومسازی، طراحی مطالعه، کسب، تحلیل و تفسیر دادهها: فاطمه طوسیزاده خراسانی، حسین رستمانی؛ تهیه پیشنویس دستنوشته: حسین رستمانی؛ بازبینی نقادانه دستنوشته برای محتوای فکری مهم: امید فخرایی، نرگس کلیدری؛ تحلیل آماری: حسین رستمانی؛ نظارت: امید فخرایی.
تعارض منافع
نویسندگان اعلام میدارند که در این مقاله هیچگونه تعارض منافعی وجود ندارد.
تشکر و قدردانی
نویسندگان از گروه مهندسی پزشکی دانشگاه آزاد اسلامی مشهد که در این پژوهش ما را همراهی کردند، تشکر و قدردانی کنند.
متن کامل: (1614 مشاهده)
مقدمه
نقایص غضروف بینی ناشی از تروما، عدم وجود غضروف، خطای پزشکی یا انواع ناهنجاریهای مادرزادی میتواند اثرات نامطلوب جسمی و روانی بر بیمار داشته باشد. همچنین در جراحی سرطان، غیرمعمول نیست که بافت فیبروعضلانی اطراف لوبول آلار و غضروف تیغه بینی در حین برداشتن تومور برداشته شود. عیوب بینی علاوهبر نقص عملکردی بهعنوان یک نقص زیبایی نیز شناخته میشوند، چراکه شکل بینی از بارزترین ویژگیهایی است که چهره انسان را مشخص میکند [1، 6, 7]. غضروف بینی یک بافت همبند تخصصی از نوع هیالین، بدون عصب، رگ و لنف است و تعداد سلول بسیار پایینی دارد. این بافت متشکل از تقریباً 1 درصد سلولهای غضروفی (کندروسیت) و 99 درصد ماتریکس خارج سلولی است و کندروسیتهای آن از سلولهای بنیادی مزانشیمی منشأ میگیرد [1]. ماتریکس خارج سلولی غضروف عمدتاً از آب، ماکرومولکولها و پروتئوگلیکانها تشکیل شده است و محصول و درعینحال میزبان کندروسیتهاست [3]. این ویژگیها باعث ویژگیهای مکانیکی خاص و ظرفیت خودترمیمی پایین شده است. در حال حاضر، درمان رایج و استاندارد طلایی، مبتنی بر بازسازی با فلپ موضعی یا کاشت غضروف اتولوگ است [1، 4].
جراحی پیوند اتولوگ برای بازسازی عمده بینی، یک روش پیچیده، زمانبر و نیازمند مهارت است که شامل برداشت غضروف دنده، برش و بخیه زدن دستی آنها در چارچوب شکل بینی است. مدتزمان عمل میتواند بیش از 8 ساعت باشد که در این مدت بیمار تحت بیهوشی عمومی است [4]. به دلیل کمبود غضروف تیغه بینی، معمولاً غضروف دندهای اصلاحشده اتولوگ برای پیوند استفاده میشود [6, 7]. بااینحال، این فرایند ممکن است با عوارض ناحیه اهداکننده همچون عفونت همراه باشد و مقدار بافت بهدستآمده بسته به دردسترس بودن بافت اهداکننده ازنظر اندازه و شکل محدود است [1، 5]. این محدودیتها، جراحان را به تلاش برای توسعه انواع پیوندهای آلوژنیک سوق داده است که ازلحاظ نظری زیستسازگار و غیرایمونوژن هستند، بااینحال تاکنون نتوانستهاند جایگزین استاندارد طلایی فعلی شوند. مواد آلوژنیک میتوانند معایبی همچون نرخ جذب بالا، جابهجایی، عفونت یا انتقال بیماری را داشته باشند یا تحت تأثیر رد ایمنی قرار گیرند، درنتیجه با استقبال گسترده مواجه نشدهاند [1، 6, 7].
هدف از ترمیم بافت غضروف بازگرداندن خواص کلیدی غضروف هیالین بومی از منظر بافتشناسی و بیومکانیکی است. در سالهای اخیر، کاربردهای مهندسی پزشکی برای غضروف بینی بهسرعت توسعه یافته است [6, 7]. چاپ زیستی سهبعدی یا چاپ زیستی بهعنوان یک روش امیدوارکننده جایگزین برای ساخت یا ترمیم غضروف بینی بیمار در حال ظهور است بهطوری که بافتهای ساده مانند پوست و غضروف به کمک این فناوری با موفقیت ساخته و تجاریسازی شدهاند، اما ساخت بافتهای پیچیدهتر همچنان با دشواریهایی همراه است. چاپ سهبعدی یا تولید افزودنی که متفاوت با روشهای سنتی ساخت است، برای چاپ یک داربست سهبعدی بهصورت مستقیم و لایهبهلایه از روی یک مدل دیجیتالی به کار گرفته میشود. تولید افزودنی امروزه دارای طیف گستردهای از کاربردها در پزشکی است [6، 8، 9]. عمدتاً از چارلز دبیلو. هال بهعنوان مخترع اولین چاپگر سهبعدی در سال 1983 یاد میکنند [10]. روشهای سنتی ساخت به دلیل مشکلاتی همچون عدم توانایی در ترکیب سلولها، استفاده از حلال سمی و ناتوانی در کنترل دقیق معماری داربست با چاپ سهبعدی امروزی جایگزین شدند [3، 11].
چاپ زیستی یک علم میانرشتهای مابین علومپزشکی، زیستشناسی، مهندسی مکانیک و علم مواد است و همچنین بهعنوان یک رویکرد نوین در مهندسی بافت شناخته میشود [12 ,13]. بهعنوان یکی از شاخههای چاپ سهبعدی، فناوریهای چاپ زیستی براساس قرار دادن دقیق سلولهای زنده و بیوموادها، بافتهای جایگزین را براساس الزامات هندسی و عملکردی خاص هر بافت، با عملکرد و خواص مشابه میسازند. چاپ زیستی در کنار اجتناب از عوارض ناحیه اهداکننده و شخصیسازی، فرصتهای بینظیری را برای ترمیم و بازسازی غضروف ایجاد کرده است [4، 14]. این فناوری چاپ ساختارهایی با جزئیات کوچک و ظریف تا ابعاد چند صد نانومتر را امکانپذیر میکند [15].
درحالیکه دستگاههای چاپگر زیستی پس از توسعه اولیه خود بهسرعت تجاری شدند، به دلیل قیمت بالای سیستم توزیعکننده رباتیک، جذب آنها تا حد زیادی محدود به نهادهای تجاری شد [16]. عموماً فناوریهای چاپ زیستی را به 3 دسته تقسیم میکنند: مبتنی بر اکستروژن، جوهرافشان و مبتنی بر لیزر که هرکدام مزایا و محدودیتهای خاص خود را دارند. هر فناوری الزامات ویژهای برای جوهر زیستی دارد. باید توجه داشت که بر ویژگی و عملکرد سازه چاپشده عوامل مختلفی همچون خواص ماده و پارامترهای فرایند چاپ (مانند دما، سرعت و نیروی اعمال شده برای چاپ) میتوانند تأثیر داشته باشند [17-19].
جوهر زیستی بهعنوان یکی از مهمترین جنبههای چاپ زیستی باید هم سازگاری سلولی برای بازسازی بافت و هم قابلیت چاپ را برای پشتیبانی از فرایند چاپ برآورده کند. افزون بر این، ویسکوالاستیسیته بودن، قابلیت اتصال عرضی، یکپارچگی مکانیکی بالا و تجزیهپذیری مناسب از دیگر خصوصیات یک جوهر زیستی ایدئال است [2، 20]. امروزه همچنین امکان رسوب همزمان 2 یا چند جوهر زیستی و تولید ساختارهای پیچیده و شخصیسازیشده براساس تصاویر پزشکی بیمار نیز امکانپذیر شده است [21]. چاپ زیستی توانسته است بسیاری از محدودیتهای مهندسی بافت مانند توزیع دقیق سلولی و عملکرد بیولوژیکی بافت را برطرف کند، بااینحال چالشهایی در بازسازی غضروف بینی به کمک چاپ زیستی وجود دارد. ازجمله مهمترین موانع در دسترس نبودن جوهر زیستی مطلوب است [18، 22].
در این مقاله ابتدا به طرز کار و مفاهیم اصلی چاپ زیستی اشاره شده است، سپس فناوریهای این حوزه که پیشتر نام برده شد بررسی شده و روشها، فرایند کلی و مزایا و معایب هرکدام تشریح میشود. در ادامه پس از معرفی کاربرد این فناوری درزمینه غضروف بینی به فرایند آن، مانند مدلسازی، انتخاب و تهیه جوهر زیستی مطلوب پرداخته میشود و در پایان نتایج ارزیابیهای برونتنی و درونتنی بیان خواهد شد.
روشها
در این مطالعه مروری از مقالات موجود در پایگاههای اطلاعاتی ساینس دایرکت، اشپرینگر، وایلی، کمبریج، دی گرویتر و گوگلاسکالر استفاده شده است. جستوجو با استفاده از کلیدواژههای tissue engineering ،nasal cartilage ،3D bioprinting وbioink materials و با محدودیت زمانی 4 سال اخیر انجام شد که از بین 300 مقاله مروری و پژوهشی، 159 مقاله برای گردآوری دقیقتر این مقاله استفاده شدند.
یافتهها
یافتههای کلی
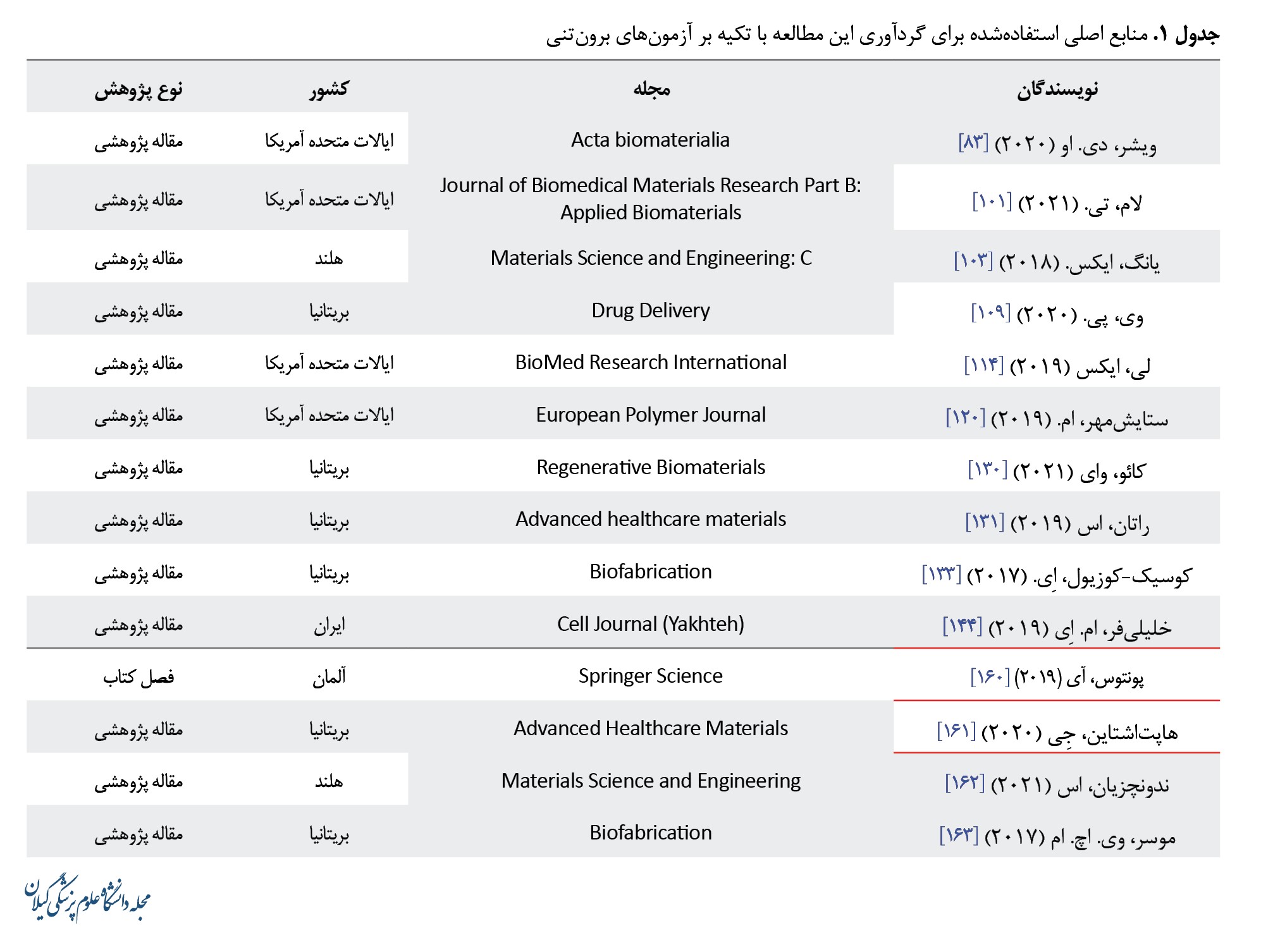
در این مقاله مروری، یک دید کلی از تحقیقات و مقالات متعدد درزمینه تلاشها برای چاپ زیستی غضروف بینی، فناوریهای مرتبط و فرایند آن ارائه شده است. مطالعه و بررسی این مقالات نشان داده است که برای کسب نتایج موردنظر در محیط برونتنی یا درونتنی، انتخاب رویکرد چاپ و جوهر زیستی مناسب در این حوزه نقش محوری دارد. مهمترین منابع دربرگیرنده آزمونهای برونتنی در این پژوهش در جدول شماره 1 نشان داده شدهاند.
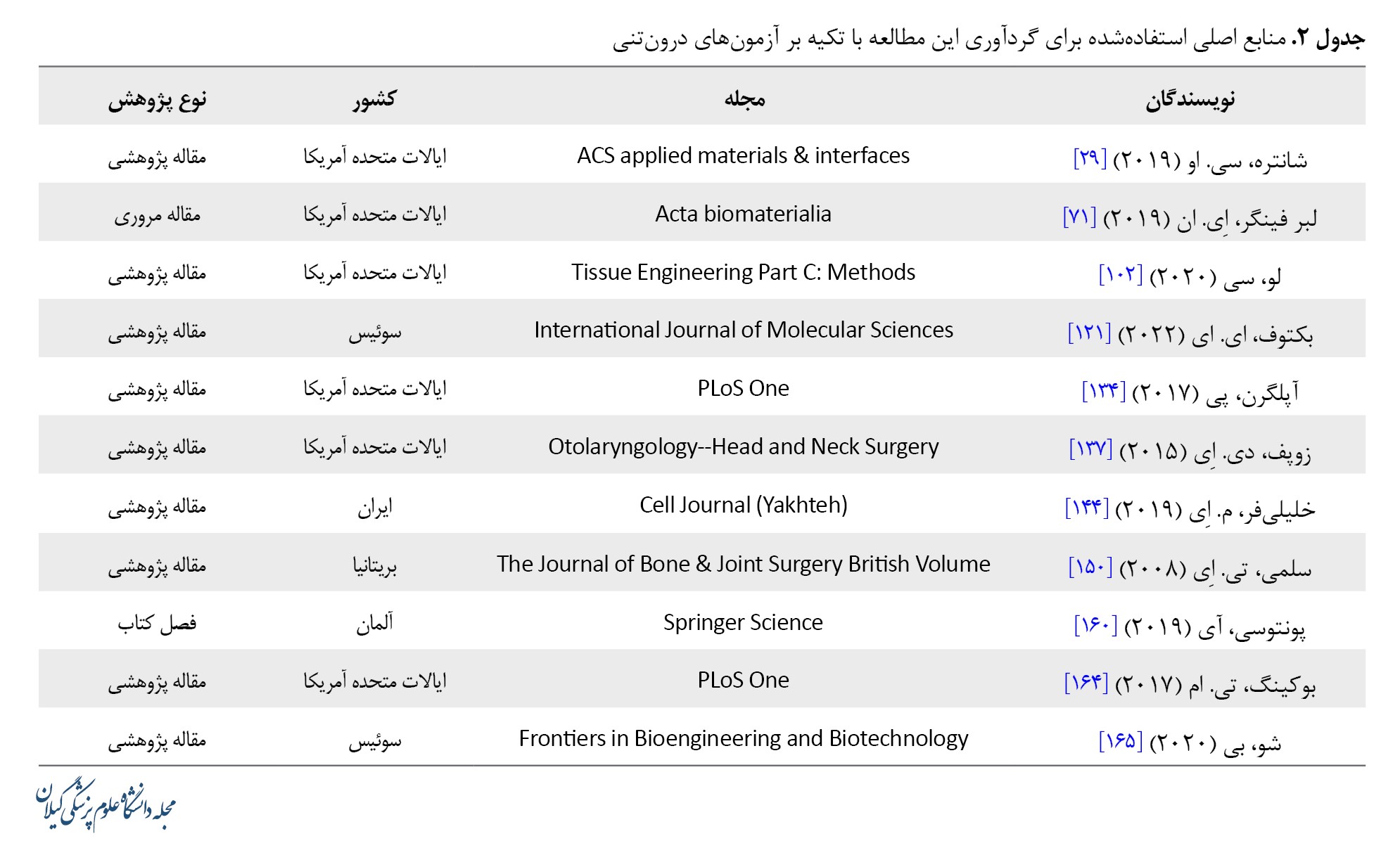
بهطور مشابه، جدول شماره 2 برای منابع درزمینه آزمونهای درونتنی ترسیم شد.
به تحلیل و بررسی دقیقتر یافتهها بهطور دستهبندیشده در ادامه مقاله پرداخته شده است.
فناوریهای چاپ زیستی سهبعدی
فرایند
برای چاپ یک سازه، اول یک مدل سهبعدی دیجیتالی از بافت معیوب با استفاده از تکنیکهای تصویربرداری، ازجمله توموگرافی کامپیوتری، تصویربرداری رزونانس مغناطیسی، سونوگرافی و تصویربرداری پزشکی هستهای، گرفته میشود. سپس از طریق طراحی به کمک کامپیوتر (CAD)، جزئیات داخلی و خارجی سازه، مانند هندسه و اندازه منافذ و تخلخل، در مدل سهبعدی بافت معیوب منعکس میشود. سپس این مدل به فایل سطح ـ مش با فرمت استاندارد STL تبدیل میشود. فرمت STL نمایش دیجیتالی سطوح یک جسم به شکل مجموعهای از مثلثهای مجزاست که حجم یک جسم را مشخص میکند، اما کاربر باید تصمیم بگیرد که از چه موادی برای چاپ آن استفاده کند. در گام بعد، درمورد رویکردهای لایهبهلایه، که اغلب روشهای چاپ زیستی را تشکیل میدهند، فایل STL باید توسط نرمافزار برش (Slicing Software) ازنظر محاسباتی به برشهایی تقسیم شود و فایل قابلپردازش توسط ماشین (معمولاً G-code) را خروجی دهد. در فایل G-code براساس ساختار هر برش، یک سری دستورات ایجاد میشود که نحوه حرکت چاپگر و رسوب مواد در طول این حرکات و اطلاعاتی همچون الزامات ساختار پشتیبان را تعیین میکند. درنهایت، بعد از انتخاب یک یا چند جوهر زیستی مطلوب، این فایل قابلپردازش در یک چاپگر زیستی وارد شده و فرایند آغاز میشود. درنهایت بافت تشکیلشده در کشت برونتنی، در داخل بدن کاشته میشود [23، 24].
پس از ایجاد ساختار بافت، ممکن است برای تثبیت ساختار چاپی یا حذف مواد پشتیبان نیاز به فرایندهای پسپردازش باشد [25]. همچنین ممکن است لازم باشد سلولها بر روی یک ساختار سلولی یا بدون سلول وارد شوند یا برای تکمیل برخی فرایندهای سلولی در مدتزمانی در رآکتور زیستی کشت داده شوند تا به بافتی با عملکرد کاربردی تبدیل شوند؛ در نظر گرفتن این موارد، محدودیتهایی را برای چاپ زیستی به همراه میآورد [26، 27].
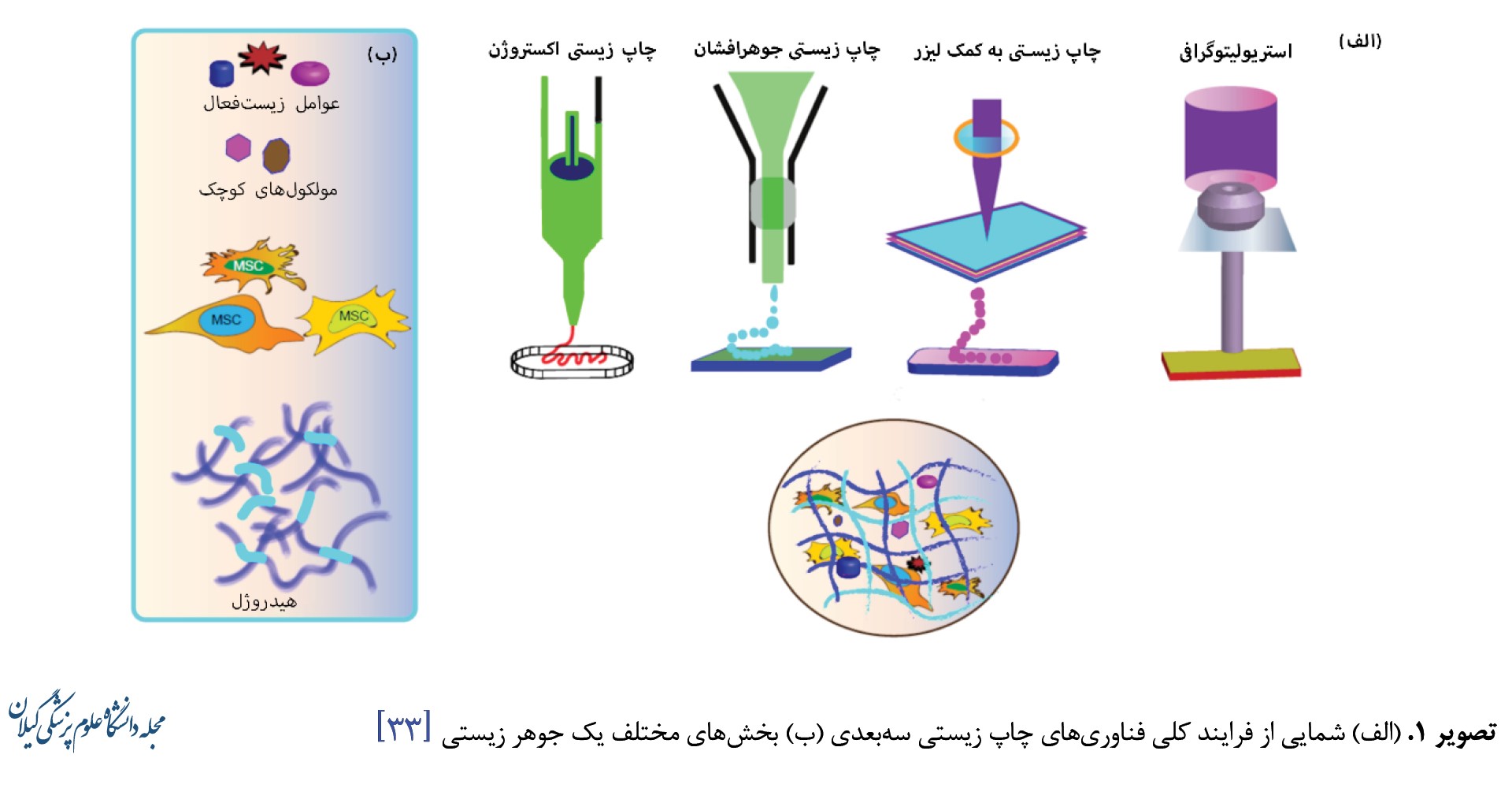
بهطورکلی رویکردهای چاپ زیستی به 3 دسته بر پایه اکستروژن، جوهرافشان و لیزری (شامل استریولیتوگرافی) تقسیم میشوند که در بخش بعدی به آنها پرداخته شده است. هرکدام از آنها دارای نقاط قوت و چالشهایی هستند، اما محبوبترین فناوری در این میان نوع اکستروژن است. تلفیق روشهای چاپ زیستی نیز فرصتهایی را برای طراحی فرایندهایی ارائه میدهد که ابزارهای متعددی را برای حل مشکلات پیچیده به همراه میآورند، جایی که ممکن است یک فناوری واحد برای همه جنبههای یک مشکل بهینه نباشد [28, 29]. چاپ زیستی مبتنی بر اکستروژن به دلیل کاربردی بودن، تنوع انتخاب بالا در جوهرهای زیستی و توانایی ایجاد ساختارها در مقیاس بزرگ، پرکاربردترین فناوری بوده است. پیشبینی میشود بازار تجاری فناوری چاپ زیستی در مقیاس جهانی تا سال 2024 به ارزش 2/6 میلیارد دلار برسد. چاپ زیستی را میتوان در مهندسی بافت و پزشکی ترمیمی، علوم پیوند بافت یا عضو، مطالعات زیستشناسی سلولی، غربالگری داروها و تحقیقات سرطان به کار برد. انتقال چاپ زیستی به عمل بالینی هنوز در انتظار توسعه بیشتر فناوری است؛ بااینحال، استفاده از آن در داروسازی بسیار رایج بوده و برای ساخت بافتهایی برای آزمایش دارو و غربالگری بازده بالا، یا تولید اشکال دارویی چندلایه، که در آن هر لایه خواص آزادسازی متفاوتی دارد، استفاده میشود. همچنین بهعنوان جایگزینی برای مدلهای حیوانی برای آزمایش داروها مشکلاتی همچون هزینه بسیار بالا، نگرانیهای اخلاقی و برگردان ضعیف به کاربردهای بالینی را دربر ندارد [16، 30]. توسعه سریع فناوریهای تولید افزودنی، تعریف دستورالعملها و استانداردهای مشخص ساخت را در این حوزه با چالشهایی همراه کرده است. چاپ زیستی چهاربعدی مفهومی نوآورانه است که به چاپ بافتهای سهبعدی با قابلیت خودبلوغی پس از فرایند چاپ اشاره دارد که در طول زمان تحت اثر محرکها قرار میگیرند. چاپ زیستی بهطور مداوم در دهه گذشته توسعه یافته و هنوز هم در حال تکامل است؛ بهطوریکه چاپ زیستی با چند جوهر زیستی غیرقابلاختلاط یک رویکرد امیدوارکننده برای آمادهسازی اندامهایی با خواص موضعی متفاوت است [31، 32]. در تصویر شماره 1 انواع مختلف فناوریهای چاپ زیستی به همراه اجزای یک جوهر زیستی نشان داده شده است [33].
نقایص غضروف بینی ناشی از تروما، عدم وجود غضروف، خطای پزشکی یا انواع ناهنجاریهای مادرزادی میتواند اثرات نامطلوب جسمی و روانی بر بیمار داشته باشد. همچنین در جراحی سرطان، غیرمعمول نیست که بافت فیبروعضلانی اطراف لوبول آلار و غضروف تیغه بینی در حین برداشتن تومور برداشته شود. عیوب بینی علاوهبر نقص عملکردی بهعنوان یک نقص زیبایی نیز شناخته میشوند، چراکه شکل بینی از بارزترین ویژگیهایی است که چهره انسان را مشخص میکند [1، 6, 7]. غضروف بینی یک بافت همبند تخصصی از نوع هیالین، بدون عصب، رگ و لنف است و تعداد سلول بسیار پایینی دارد. این بافت متشکل از تقریباً 1 درصد سلولهای غضروفی (کندروسیت) و 99 درصد ماتریکس خارج سلولی است و کندروسیتهای آن از سلولهای بنیادی مزانشیمی منشأ میگیرد [1]. ماتریکس خارج سلولی غضروف عمدتاً از آب، ماکرومولکولها و پروتئوگلیکانها تشکیل شده است و محصول و درعینحال میزبان کندروسیتهاست [3]. این ویژگیها باعث ویژگیهای مکانیکی خاص و ظرفیت خودترمیمی پایین شده است. در حال حاضر، درمان رایج و استاندارد طلایی، مبتنی بر بازسازی با فلپ موضعی یا کاشت غضروف اتولوگ است [1، 4].
جراحی پیوند اتولوگ برای بازسازی عمده بینی، یک روش پیچیده، زمانبر و نیازمند مهارت است که شامل برداشت غضروف دنده، برش و بخیه زدن دستی آنها در چارچوب شکل بینی است. مدتزمان عمل میتواند بیش از 8 ساعت باشد که در این مدت بیمار تحت بیهوشی عمومی است [4]. به دلیل کمبود غضروف تیغه بینی، معمولاً غضروف دندهای اصلاحشده اتولوگ برای پیوند استفاده میشود [6, 7]. بااینحال، این فرایند ممکن است با عوارض ناحیه اهداکننده همچون عفونت همراه باشد و مقدار بافت بهدستآمده بسته به دردسترس بودن بافت اهداکننده ازنظر اندازه و شکل محدود است [1، 5]. این محدودیتها، جراحان را به تلاش برای توسعه انواع پیوندهای آلوژنیک سوق داده است که ازلحاظ نظری زیستسازگار و غیرایمونوژن هستند، بااینحال تاکنون نتوانستهاند جایگزین استاندارد طلایی فعلی شوند. مواد آلوژنیک میتوانند معایبی همچون نرخ جذب بالا، جابهجایی، عفونت یا انتقال بیماری را داشته باشند یا تحت تأثیر رد ایمنی قرار گیرند، درنتیجه با استقبال گسترده مواجه نشدهاند [1، 6, 7].
هدف از ترمیم بافت غضروف بازگرداندن خواص کلیدی غضروف هیالین بومی از منظر بافتشناسی و بیومکانیکی است. در سالهای اخیر، کاربردهای مهندسی پزشکی برای غضروف بینی بهسرعت توسعه یافته است [6, 7]. چاپ زیستی سهبعدی یا چاپ زیستی بهعنوان یک روش امیدوارکننده جایگزین برای ساخت یا ترمیم غضروف بینی بیمار در حال ظهور است بهطوری که بافتهای ساده مانند پوست و غضروف به کمک این فناوری با موفقیت ساخته و تجاریسازی شدهاند، اما ساخت بافتهای پیچیدهتر همچنان با دشواریهایی همراه است. چاپ سهبعدی یا تولید افزودنی که متفاوت با روشهای سنتی ساخت است، برای چاپ یک داربست سهبعدی بهصورت مستقیم و لایهبهلایه از روی یک مدل دیجیتالی به کار گرفته میشود. تولید افزودنی امروزه دارای طیف گستردهای از کاربردها در پزشکی است [6، 8، 9]. عمدتاً از چارلز دبیلو. هال بهعنوان مخترع اولین چاپگر سهبعدی در سال 1983 یاد میکنند [10]. روشهای سنتی ساخت به دلیل مشکلاتی همچون عدم توانایی در ترکیب سلولها، استفاده از حلال سمی و ناتوانی در کنترل دقیق معماری داربست با چاپ سهبعدی امروزی جایگزین شدند [3، 11].
چاپ زیستی یک علم میانرشتهای مابین علومپزشکی، زیستشناسی، مهندسی مکانیک و علم مواد است و همچنین بهعنوان یک رویکرد نوین در مهندسی بافت شناخته میشود [12 ,13]. بهعنوان یکی از شاخههای چاپ سهبعدی، فناوریهای چاپ زیستی براساس قرار دادن دقیق سلولهای زنده و بیوموادها، بافتهای جایگزین را براساس الزامات هندسی و عملکردی خاص هر بافت، با عملکرد و خواص مشابه میسازند. چاپ زیستی در کنار اجتناب از عوارض ناحیه اهداکننده و شخصیسازی، فرصتهای بینظیری را برای ترمیم و بازسازی غضروف ایجاد کرده است [4، 14]. این فناوری چاپ ساختارهایی با جزئیات کوچک و ظریف تا ابعاد چند صد نانومتر را امکانپذیر میکند [15].
درحالیکه دستگاههای چاپگر زیستی پس از توسعه اولیه خود بهسرعت تجاری شدند، به دلیل قیمت بالای سیستم توزیعکننده رباتیک، جذب آنها تا حد زیادی محدود به نهادهای تجاری شد [16]. عموماً فناوریهای چاپ زیستی را به 3 دسته تقسیم میکنند: مبتنی بر اکستروژن، جوهرافشان و مبتنی بر لیزر که هرکدام مزایا و محدودیتهای خاص خود را دارند. هر فناوری الزامات ویژهای برای جوهر زیستی دارد. باید توجه داشت که بر ویژگی و عملکرد سازه چاپشده عوامل مختلفی همچون خواص ماده و پارامترهای فرایند چاپ (مانند دما، سرعت و نیروی اعمال شده برای چاپ) میتوانند تأثیر داشته باشند [17-19].
جوهر زیستی بهعنوان یکی از مهمترین جنبههای چاپ زیستی باید هم سازگاری سلولی برای بازسازی بافت و هم قابلیت چاپ را برای پشتیبانی از فرایند چاپ برآورده کند. افزون بر این، ویسکوالاستیسیته بودن، قابلیت اتصال عرضی، یکپارچگی مکانیکی بالا و تجزیهپذیری مناسب از دیگر خصوصیات یک جوهر زیستی ایدئال است [2، 20]. امروزه همچنین امکان رسوب همزمان 2 یا چند جوهر زیستی و تولید ساختارهای پیچیده و شخصیسازیشده براساس تصاویر پزشکی بیمار نیز امکانپذیر شده است [21]. چاپ زیستی توانسته است بسیاری از محدودیتهای مهندسی بافت مانند توزیع دقیق سلولی و عملکرد بیولوژیکی بافت را برطرف کند، بااینحال چالشهایی در بازسازی غضروف بینی به کمک چاپ زیستی وجود دارد. ازجمله مهمترین موانع در دسترس نبودن جوهر زیستی مطلوب است [18، 22].
در این مقاله ابتدا به طرز کار و مفاهیم اصلی چاپ زیستی اشاره شده است، سپس فناوریهای این حوزه که پیشتر نام برده شد بررسی شده و روشها، فرایند کلی و مزایا و معایب هرکدام تشریح میشود. در ادامه پس از معرفی کاربرد این فناوری درزمینه غضروف بینی به فرایند آن، مانند مدلسازی، انتخاب و تهیه جوهر زیستی مطلوب پرداخته میشود و در پایان نتایج ارزیابیهای برونتنی و درونتنی بیان خواهد شد.
روشها
در این مطالعه مروری از مقالات موجود در پایگاههای اطلاعاتی ساینس دایرکت، اشپرینگر، وایلی، کمبریج، دی گرویتر و گوگلاسکالر استفاده شده است. جستوجو با استفاده از کلیدواژههای tissue engineering ،nasal cartilage ،3D bioprinting وbioink materials و با محدودیت زمانی 4 سال اخیر انجام شد که از بین 300 مقاله مروری و پژوهشی، 159 مقاله برای گردآوری دقیقتر این مقاله استفاده شدند.
یافتهها
یافتههای کلی
در این مقاله مروری، یک دید کلی از تحقیقات و مقالات متعدد درزمینه تلاشها برای چاپ زیستی غضروف بینی، فناوریهای مرتبط و فرایند آن ارائه شده است. مطالعه و بررسی این مقالات نشان داده است که برای کسب نتایج موردنظر در محیط برونتنی یا درونتنی، انتخاب رویکرد چاپ و جوهر زیستی مناسب در این حوزه نقش محوری دارد. مهمترین منابع دربرگیرنده آزمونهای برونتنی در این پژوهش در جدول شماره 1 نشان داده شدهاند.

بهطور مشابه، جدول شماره 2 برای منابع درزمینه آزمونهای درونتنی ترسیم شد.

به تحلیل و بررسی دقیقتر یافتهها بهطور دستهبندیشده در ادامه مقاله پرداخته شده است.
فناوریهای چاپ زیستی سهبعدی
فرایند
برای چاپ یک سازه، اول یک مدل سهبعدی دیجیتالی از بافت معیوب با استفاده از تکنیکهای تصویربرداری، ازجمله توموگرافی کامپیوتری، تصویربرداری رزونانس مغناطیسی، سونوگرافی و تصویربرداری پزشکی هستهای، گرفته میشود. سپس از طریق طراحی به کمک کامپیوتر (CAD)، جزئیات داخلی و خارجی سازه، مانند هندسه و اندازه منافذ و تخلخل، در مدل سهبعدی بافت معیوب منعکس میشود. سپس این مدل به فایل سطح ـ مش با فرمت استاندارد STL تبدیل میشود. فرمت STL نمایش دیجیتالی سطوح یک جسم به شکل مجموعهای از مثلثهای مجزاست که حجم یک جسم را مشخص میکند، اما کاربر باید تصمیم بگیرد که از چه موادی برای چاپ آن استفاده کند. در گام بعد، درمورد رویکردهای لایهبهلایه، که اغلب روشهای چاپ زیستی را تشکیل میدهند، فایل STL باید توسط نرمافزار برش (Slicing Software) ازنظر محاسباتی به برشهایی تقسیم شود و فایل قابلپردازش توسط ماشین (معمولاً G-code) را خروجی دهد. در فایل G-code براساس ساختار هر برش، یک سری دستورات ایجاد میشود که نحوه حرکت چاپگر و رسوب مواد در طول این حرکات و اطلاعاتی همچون الزامات ساختار پشتیبان را تعیین میکند. درنهایت، بعد از انتخاب یک یا چند جوهر زیستی مطلوب، این فایل قابلپردازش در یک چاپگر زیستی وارد شده و فرایند آغاز میشود. درنهایت بافت تشکیلشده در کشت برونتنی، در داخل بدن کاشته میشود [23، 24].
پس از ایجاد ساختار بافت، ممکن است برای تثبیت ساختار چاپی یا حذف مواد پشتیبان نیاز به فرایندهای پسپردازش باشد [25]. همچنین ممکن است لازم باشد سلولها بر روی یک ساختار سلولی یا بدون سلول وارد شوند یا برای تکمیل برخی فرایندهای سلولی در مدتزمانی در رآکتور زیستی کشت داده شوند تا به بافتی با عملکرد کاربردی تبدیل شوند؛ در نظر گرفتن این موارد، محدودیتهایی را برای چاپ زیستی به همراه میآورد [26، 27].
بهطورکلی رویکردهای چاپ زیستی به 3 دسته بر پایه اکستروژن، جوهرافشان و لیزری (شامل استریولیتوگرافی) تقسیم میشوند که در بخش بعدی به آنها پرداخته شده است. هرکدام از آنها دارای نقاط قوت و چالشهایی هستند، اما محبوبترین فناوری در این میان نوع اکستروژن است. تلفیق روشهای چاپ زیستی نیز فرصتهایی را برای طراحی فرایندهایی ارائه میدهد که ابزارهای متعددی را برای حل مشکلات پیچیده به همراه میآورند، جایی که ممکن است یک فناوری واحد برای همه جنبههای یک مشکل بهینه نباشد [28, 29]. چاپ زیستی مبتنی بر اکستروژن به دلیل کاربردی بودن، تنوع انتخاب بالا در جوهرهای زیستی و توانایی ایجاد ساختارها در مقیاس بزرگ، پرکاربردترین فناوری بوده است. پیشبینی میشود بازار تجاری فناوری چاپ زیستی در مقیاس جهانی تا سال 2024 به ارزش 2/6 میلیارد دلار برسد. چاپ زیستی را میتوان در مهندسی بافت و پزشکی ترمیمی، علوم پیوند بافت یا عضو، مطالعات زیستشناسی سلولی، غربالگری داروها و تحقیقات سرطان به کار برد. انتقال چاپ زیستی به عمل بالینی هنوز در انتظار توسعه بیشتر فناوری است؛ بااینحال، استفاده از آن در داروسازی بسیار رایج بوده و برای ساخت بافتهایی برای آزمایش دارو و غربالگری بازده بالا، یا تولید اشکال دارویی چندلایه، که در آن هر لایه خواص آزادسازی متفاوتی دارد، استفاده میشود. همچنین بهعنوان جایگزینی برای مدلهای حیوانی برای آزمایش داروها مشکلاتی همچون هزینه بسیار بالا، نگرانیهای اخلاقی و برگردان ضعیف به کاربردهای بالینی را دربر ندارد [16، 30]. توسعه سریع فناوریهای تولید افزودنی، تعریف دستورالعملها و استانداردهای مشخص ساخت را در این حوزه با چالشهایی همراه کرده است. چاپ زیستی چهاربعدی مفهومی نوآورانه است که به چاپ بافتهای سهبعدی با قابلیت خودبلوغی پس از فرایند چاپ اشاره دارد که در طول زمان تحت اثر محرکها قرار میگیرند. چاپ زیستی بهطور مداوم در دهه گذشته توسعه یافته و هنوز هم در حال تکامل است؛ بهطوریکه چاپ زیستی با چند جوهر زیستی غیرقابلاختلاط یک رویکرد امیدوارکننده برای آمادهسازی اندامهایی با خواص موضعی متفاوت است [31، 32]. در تصویر شماره 1 انواع مختلف فناوریهای چاپ زیستی به همراه اجزای یک جوهر زیستی نشان داده شده است [33].
روش اکستروژن
روش اکستروژن رایجترین، تطبیقپذیرترین و در دسترسترین روش چاپ زیستی است. این روش با رسوب دادن لایهبهلایه مواد زیستی رشتهای، که فیلامنت نامیده میشوند، عمل میکند. اکسترود کردن مواد معمولاً به یکی از روشهای توزیع پنوماتیکی، پیستونی یا پیچشی صورت میگیرد که توزیع پیچشی برای هیدروژلهای با ویسکوزیته بالا مطلوبتر است [27، 34].
چاپ اکستروژن پنوماتیکی با استفاده از فشردن هوا جوهرهای زیستی را اکسترود میکند، درحالیکه در روش پیستونی یا پیچشی ماده بهطور فیزیکی اکسترود میشود. در فناوری هوای فشرده ممکن است تأخیر کمی در توزیع وجود داشته باشد که بر وضوح مؤثر باشد، بااینحال کلیه این روشها با موفقیت در چاپ زیستی به کار رفتهاند. از اقسام فناوریهای مبتنی بر اکستروژن میتوان به مدلسازی رسوبشده و چاپ زیستی مبتنی بر اکستروژن اشاره کرد. نازلی که در اکستروژن استفاده میشود اغلب شبیه سرنگ بدون سوزن، یک نازل مخروطیشکل یا مشابه لوله مویرگی شیشهای است. هندسه مقطع دهانه نازل بر هندسه فیلامنت چاپشده تأثیر دارد [27].
چاپ زیستی مبتنی بر اکستروژن از فناوری مدلسازی رسوبشده سرچشمه میگیرد. این دستگاهها از سرهای چاپ سرنگیمانند برای هدایت پنوماتیک، مکانیکی یا الکترومغناطیسی جوهر زیستی (غالباً هیدروژل حاوی سلولها) و رسوب دادن آن استفاده میکنند. در این فرایند، میتوان در یک مرحله چاپ زیستی انجام داد یا آنکه بعداً سلولها را در داربست اولیه کاشت. چاپ زیستی اکستروژن با بسیاری از بیومواد که ویسکوزیتهای بیش از 6×107 مگاپاسکال در ثانیه دارند، سازگار است. در شرایطی که عموماً مواد با ویسکوزیته بالا از خواص مکانیکی بهتر بهره میبرند و مواد با ویسکوزیته پایینتر، از زندهمانی سلولی پشتیبانی میکنند. نیرویهای برشی را میتوان با کاهش فشار توزیع و طول نازل و با افزایش قطر نازل کنترل کرد. بااینحال این کار باعث از دست دادن زمان و وضوح چاپ میشود [27، 35]. در حالت ایدئال، جوهر زیستی مورداستفاده در چاپ زیستی اکستروژن برای چاپ یک ایمپلنت زیستتقلیدشده میبایست علاوهبر زیستسازگاری، زیستتخریبپذیری و الاستیسیته بودن، از نازک شدن و بازیابی برشی سریع و نیز سینتیک ژل شدن پشتیبانی کند. جوهرهای با ویسکوزیته بالا اگرچه وفاداری شکل بهتری دارند، اما ممکن است آسیب سلولی یا گرفتگی نازل را در پی داشته باشند [16، 36].
مزیت اصلی چاپ زیستی مبتنی بر اکستروژن، توانایی چشمگیر آن در استفاده از سلولهای با چگالی و گرانروی بالا و سازگاری با انواع مواد، ازجمله هیدروژلهای مملو از سلول، میکروحاملها و ماتریکس خارجی بدون سلول است. همچنین این روش قادر به چاپ ساختارهای زیستتقلیدشده در ابعاد بزرگ و در کنار آن، نسبتاً مقرونبهصرفه است. بااینحال موارد چالشبرانگیزی همچون تثبیت خواص سازه پس از چاپ را با خود همراه دارد و نقطه ضعف اصلی این روش این است که سرعت، وضوح و زندهمانی کمتری را نسبت به سایر روشها نتیجه میدهد. با تغییر پارامترهایی چون اندازه و قطر نازل، نیروی وارده بر جوهر زیستی، سرعت و دمای چاپ و میزان ترشوندگی بستر، میتوان بر وضوح تأثیر گذاشت. با کاهش فشار اکستروژن و افزایش اندازه نازل، زندهمانی سلولی در حدود 40 تا 80 درصد است و وجود نیروی برشی بر روی سلولهای موجود در جوهر زیستی نیز اثر میگذارد. چاپ با سرعت بسیار بالا به کشیده شدن خطوط و خواص مکانیکی ضعیف ختم میشود و چاپ با سرعت بسیار کند، منجر به افزایش عرض خطوط چاپی میشود [28، 37-39]. محدودیت در وضوح میتواند کاربرد این فناوری زیستی را در حد ترمیم بافتهای نرم تقلیل دهد، با آنکه همچنان برای بافتهای سخت بزرگتر از 10 میلیمتر قابلاستفاده است [40].
یکی از روشهای پیشرفته اکستروژن چاپ زیستی چندمادهای است که هدف آن تکرار نظم پیچیده بافت و اندامهای میزبان در سازه است. ازآنجاییکه بافتها و اندامهای بومی انسان دارای ساختارهای درونسلولی و برونسلولی ناهمگن هستند، توانایی ساخت سازههایی با چند جوهر زیستی بسیار حائز اهمیت است. چاپ یک هندسه چندمادهای اغلب شامل چاپ متوالی مواد منفرد با استفاده از نازلهای متعدد است. چاپ چندمادهای به فرد اجازه میدهد تا مواد طبیعی را با مواد مصنوعی با استحکام مکانیکی بالا ترکیب کند تا از مزایای هر دو ماده استفاده شود. بااینحال کند بودن و نیازمندی به دقت زیاد در تراز بودن نازلها از معایب آن است. آلژینات در این نوع چاپ زیستی بسیار پرکاربرد است. چاپ زیستی چندمادهای را میتوان براساس نحوه سازماندهی مواد به چند دسته تقسیم کرد. رایجترین تکنیک چندمادهای چاپ سایدبایساید است که در آن چندین ماده متناوباً در یک یا چند لایه قرار میگیرند که جهت افزایش خواص مکانیکی در تولید ساختارهای غضروفی قابلبهکارگیری است [41, 42]. در تصویر شماره 2 پرکاربردترین مواد زیستی قابلاستفاده در چاپ زیستی چندمادهای نمایش داده شده است [43].
امروزه چاپگرهای زیستی تجاری اکستروژن را میتوان برای کاربردهای خاص سفارشیسازی کرد، چنانکه امکان پخت UV در میانه چاپ یا پس از چاپ، اکستروژن ترکیبی، الکتروریسی و تلفیق با سایر فناوریهای نوظهور مهندسی بافت را داشته باشند [44]. باید توجه داشت روش اتصال عرضی جوهر زیستی ـ اتصال عرضی حرارتی، یونی، نوری، آنزیمی و غیره ـ بر انتخاب استراتژی چاپ و فرایندهای حین و پس از چاپ تأثیر میگذارد [45].
روش جوهرافشان
چاپ سهبعدی جوهرافشان روشی بدون تماس است که با پاشش متوالی قطرات گسسته جوهر زیستی از نازلها بر روی یک بستر به ساخت لایهبهلایه سازه میانجامد. این فناوری مشابه سیستم جوهرافشان دوبعدی است. کیفیت و وضوح چاپ به اندازه و گرانروی قطرات بستگی دارد. ازآنجاییکه قطرات میتوانند در حجم پیکولیتر باشند، چاپ زیستی جوهرافشان وضوح چاپ بالا تا 50 میکرون را در قرار دادن دقیق سلولها ارائه میدهد. جوهر زیستی با ویسکوزیته پایین میتواند تشکیل قطرات را افزایش دهد، از انسداد نازل پاشش خودداری کند و نیروی برشی را کاهش دهد، هرچند به خواص مکانیکی پایینتر منجر میشود و ممکن است برای تثبیت ساختار چاپشده نیاز به اتصال عرضی اضافی داشته باشد. در نقطه مقابل ویسکوزیته بالا اغلب باعث گرفتگی مکرر نازل میشود. پس از پاشش قطرات در مکانهای مشخص، قطرات باید بهراحتی تثبیت شوند که این امر معمولاً بهوسیله برخورد قطره با یک عامل اتصال عرضی در بستر رخ میدهد [27، 46]. چاپ زیستی جوهرافشان با وجود برتری در وضوح نسبتاً بالاتر در سطح میکرون، تا حد زیادی به چاپ بافت در مقیاس کوچک محدود میشود. از سوی دیگر معمولاً برای چاپ ساختارهای ضخیم مناسب نیست و نسبت به روش اکستروژن آنچنان در چاپ چندمادهای استفاده نمیشود [47, 48]. قطر نازل میتواند تا حدود 18 میکرومتر باشد، نازکی نازل باعث کشش سطحی میشود که از نشت جوهر جلوگیری میکند. از مزایای روش جوهرافشان میتوان به قابلیت رسوب مستقیم سلولها جهت چاپ سلولی بدون داربست اشاره کرد. همچنین این فناوری قادر است با تغییر تراکم یا اندازه قطرات، امکان چاپ مواد یا سلولها را با گرادیان غلظت در سراسر ساختار فراهم کند [49]. عموماً روشهای جوهرافشان نسبت به روشهای اکستروژن در سرعت و زندهمانی برتری دارند، اما نسبت به روشهای لیزری در این موارد نتایج ضعیفتری میدهند [3، 50، 51].
بایندر جت و متریال جت 2 نوع فناوری جوهرافشان ازنظر ماهیت ماده رسوبکننده هستند. هر دوی این فناوریها برای رسوب دادن قطرات مایع یک ماده استفاده میشوند. در بایندر جت قطرات چسب پیونددهنده روی یک بستر پودری پاشیده میشوند، بهطوریکه ذرات پودر مجاور و همچنین لایه فعلی را با لایه قبلی به هم میچسباند. هنگامی که لایه تکمیل شد، سکو پایین میآید و یک لایه جدید پودر بهطور یکنواخت روی لایه قبلی ازطریق یک سیستم تغذیه پودر گذاشته میشود. در متریال جت حجمی بسیار کوچکی از ماده موردنظر (از پیکولیتر تا نانولیتر) را روی بستر هدف رسوب میدهند. متریال جت به دلیل کمهزینه بودن، زندهمانی مطلوب، وضوح بالا و امکان رسوب مستقیم سلولها، بهطور گسترده در مهندسی بافت به کار گرفته شده است. بااینحال، این تکنیک با محدودیتهای متعددی ازجمله در انتخاب مواد، به دلیل محدودیتهای ویسکوزیته و کشش سطحی، مواجه است [3].
براساس مکانیسم تشکیل قطرات، چاپ زیستی جوهرافشان بهطورکلی به 2 دسته حرارتی و پیزوالکتریک تقسیم میشود. عموماً دستگاههای دارای سر چاپ حرارتی دارای واحد گرمایش الکتریکی در مجاورت نازل هستند که با تبخیر مواد همبند جوهر زیستی و تشکیل حباب بخار عمل میکنند. این حباب بخار در اثر فشار منبسط میشود و بهصورت قطرهای از سر چاپ خارج میشود [35، 52]. زمان گرمایش آنقدر کوتاه است که فقط 4 تا 10 درجه سانتیگراد دمای جوهر زیستی زیاد میشود که تأثیری بر زندهمانی ندارد [53]. در مقابل دستگاههای پیزوالکتریک توسط پالسهای فشاری قطرات جوهر زیستی را به روی بستر چاپ میکنند. با این پالسها دیواره محفظه توسط سرامیک پیزوالکتریک تغییر شکل داده و در اثر این تغییر حجم، جوهر بهصورت قطرهای از نازل خارج میشود باتوجهبه عدم استفاده از حرارت، آسیب سلولی بر اثر دما وجود نخواهد داشت [54].
روش لیزری
چاپ سهبعدی مبتنی بر لیزر ویژگیهای سودمند مختلفی همچون فرکانس بالای چاپ، وضوح بالا، نرخ بقای سلولی بالا (بیش از 95 درصد) و توانایی چاپ همهجهته ساختارهای پیچیده را نشان میدهد [55]. عموماً روشهای مبتنی بر لیزر سرعت و نرخ زندهمانی متوسط بیشتری را نسبت به سایر روشها (اکستروژن و جوهرافشان) ارائه میدهند [49-51].
فناوری چاپ زیستی به کمک لیزر که با نام انتقال توسط لیزر نیز شناخته میشود، بهطورکلی از اجزای زیر تشکیل شده است:
1. منبع لیزر پالسی؛
2. لایه جاذب انرژی (مانند طلا یا تیتانیوم)؛
3. لایه اهداکننده، معمولاً به شکل یک اسلاید یا نوار شیشهای؛
4. لایه جوهر زیستی؛
5. بستر مواد.
این چاپگرها فاقد نازل هستند، بنابراین از چالشهایی همچون گرفتگی نازل جلوگیری میشود. درعینحال این روش از جوهرهای با گرانروی بالا (1 تا 300 میلیپاسکال بر ثانیه) نیز پشتیبانی میکند [56, 57]. لایه جاذب سرعت لیزر را بهبود میبخشد و جوهر زیستی را از تماس مستقیم با پرتو لیزر بازمیدارد. با تابیدن لیزر، در ناحیه مشخصی از نوار اهداکننده یا قربانی، یک حباب با فشار بالا ایجاد میشود، فشار حباب باعث چکیدن قطرات لایه جوهر زیستی در مکانهای تعیینشده روی بستر میشود. بستر هیچ پرتوی را جذب نمیکند. این فرایند تا زمانی که ساختار سهبعدی به وجود آید تکرار میشود. همچون چاپ زیستی اکستروژن، این روش نیز تراکم سلولی بالایی را نتیجه میدهد. قابلیت استفاده از جوهر زیستی با ویسکوزینههای مختلف، وضوح بالا، عدم وجود مشکلات نازل و خطر پایین آلودگی از مزیتهای این روش است. بااینحال این روش علاوه بر ضعف در مقیاسپذیری، پرهزینه بوده و انرژی بالای پرتو لیزر، با آسیب سلولی در ارتباط است که با افزایش ویسکوزیته جوهر و ضخامت بستر میتوان به حفاظت بیشتر از سلولها کمک کرد. میزان بقای سلولی اغلب حدود 85 درصد گزارش شده است [18، 58، 59]. ازآنجاییکه چاپ زیستی به کمک لیزر مانند روش جوهرافشان یک روش غیرتماسی است، میتواند انواع مواد زیستی و سلولها را در محیطهای کشت مختلف چاپ کند تا از آلودگی و آسیب سلولی جلوگیری کند [57].
در روش تفجوشی لیزری انتخابی یک پرتو لیزر که به بستری از پودر ساطع میشود، پودر را در یک الگوی برنامهریزیشده ذوب میکند. پس از ایجاد یک لایه، بستر پودری عقب رفته و لایه بعدی روی آن غلت میخورد و این فرایند تا زمانی که داربست کامل شود، تکرار میشود و در پایان پودر اضافی حذف میشود. در جایی که سازه چاپشده دارای منافذ در ابعاد میکرون باشد، این فرایند حذف پودر اضافی میتواند بسیار دشوار باشد. از زمان ابداع فناوری تفجوشی لیزری انتخابی، این روش بهطور گسترده برای بازسازی بافتهای آناتومیک پیچیده، مانند غضروف استفاده شده است [60].
دیگر فناوری پراستفاده مبتنی بر لیزر، پلیمریزاسیون در ظرف است که استریولیتوگرافی از انواع آن است. استریولیتوگرافی معمولاً از لیزر ماورای بنفش (UV) برای فتوپلیمریزاسیون سطح حمامی از پلیمرهای حساس به نور استفاده میکند. استریولیتوگرافی عموماً متشکل از یک مخزن پرشده با محلول یا رزین پلیمری شامل آغازگرهای نوری، لیزر با محور x-y قابلکنترل و یک پایه ساخت با کنترل محور z است. طی فرایند با پایین آمدن تدریجی پایه، لایههای بیومواد توسط اتصالات عرضی روی هم پلیمریزه میشوند و درنتیجه سازههای سهبعدی با وضوح بالا، بین 5 تا 300 میکرون، به روش از پایین به بالا تشکیل میشوند. نواحی اسکننشده در فاز مایع باقی میمانند [61, 62]. آغازگرهای نوری موادی حساس به دامنههای مختلف طول موج هستند که وقتی در معرض انرژی نور قرار میگیرند، طی یک مکانیسم شیمیایی با مونومرهای یک ماده واکنش داده و تشکیل زنجیره پلیمری میدهند. اشعه ماورای بنفش میتواند برای DNA سلولها مضر باشد؛ اگرچه توسعه استریولیتوگرافی مبتنی بر نور مرئی امکان گنجاندن سلولها را در فرایند چاپ فراهم کرده است، بااینحال محدودیت قابلتوجه این فناوری این است که امکان چاپ فقط به مواد حساس به نور، مانند ژلاتین متاکریلات و پلیاتیلن گلیکول دیاکریلات، محدود است. افزون بر این، عدم محدودیت در ویسکوزیته جوهر زیستی، سرعت بالا و نبود تنش برشی از مزایای استریولیتوگرافی است [63, 64]. سیستمهای استریولیتوگرافی ازنظر منبع روشنایی به 2 دسته روشهای تکفوتون (ماورای بنفش و نور مرئی) و چندفوتون (مادون قرمز) تقسیم میشوند. اخیراً با استفاده از دستگاههای آینه دیجیتال با استریولیتوگرافی پروجکشن نوری پویا برای افزایش سرعت چاپ ساختارهای بزرگ استفاده میکنند [65، 66].
در روش پردازش نور دیجیتال، طرح سهبعدی با مقیاسپذیری منحصربهفرد و همچنین با سرعت و وضوح قابلتوجه چاپ میشود. این روش ازنظر مکانیسم کار بسیار به استریولیتوگرافی مشابه است، اگرچه عموماً از نور مرئی و پروژکتور دیجیتال برای فتوپلیمریزاسیون استفاده میکند تا یک طرح واحد از کل لایه را به یکباره در کل رزین فلاش کند [67، 68]. روش پردازش نور دیجیتال از حرکت مکانیکی در صفحه x-y بینیاز است و صرفاً با تشکیل هر لایه، در جهت z حرکت میکند. این فناوری ارزش زیادی در ساخت سریع محصولات شخصیسازیشده دارد [69، 70]. این فناوری همچون استریولیتوگرافی میتواند بافتهای با تراکم بالای سلولی چاپ کند [58، 71]. روشهای مبتنی بر لیزر چندمادهای عموماً براساس سیستمی کار میکنند که بهطور خودکار مخزن رزین را تغییر میدهد یا آنکه اقدام به تزریق متوالی جوهرهای مختلف میکند. با وجود این، فوتوپلیمریزاسیون چندمادهای باتوجهبه چالشهای مختلف همچنان محدود است [72, 73].
کاربرد درزمینه غضروف بینی
ویژگیهای غضروف بینی
بافت غضروف شامل سلولهای تخصصی کندروسیتها و کندروبلاستهاست که در ECM غضروفی قرار گرفتهاند. ECM غضروف مملو از الیاف کلاژن، فیبرهای الاستین و آب است. همچنین این فضا شامل پروتئوگلیکانها و گلیکوپروتئینها بوده که با ایجاد تعامل بین سلولها و الیاف کلاژنی باعث اتصال آنها میشود که مقاومت بافت غضروفی در برابر نیروهای فشاری را در پی دارد [74، 75]. بافت غضروفی دارای ساختاری هیدراته، ناهمگن، با اصطکاک سطح کم و مقاومت در برابر سایش است. علاوهبرآن بافتی بدون عروق، بدون لنف و بدون عصب است و با تعداد کم سلولهای غضروفی شناخته میشود. به همین جهت، در صورت هرگونه آسیب توانایی ترمیم بسیار پایینی دارد. بااینحال سادگی نسبی ساختار غضروف ساخت آن را تسهیل و به هدفی ایدئال برای چاپ زیستی تبدیل کرده است. 3 دسته کلی غضروف در بدن وجود دارد که عبارتاند از: غضروف هیالین، غضروف الاستیک و غضروف فیبرو. غضروف بینی از نوع هیالین است [76, 77].
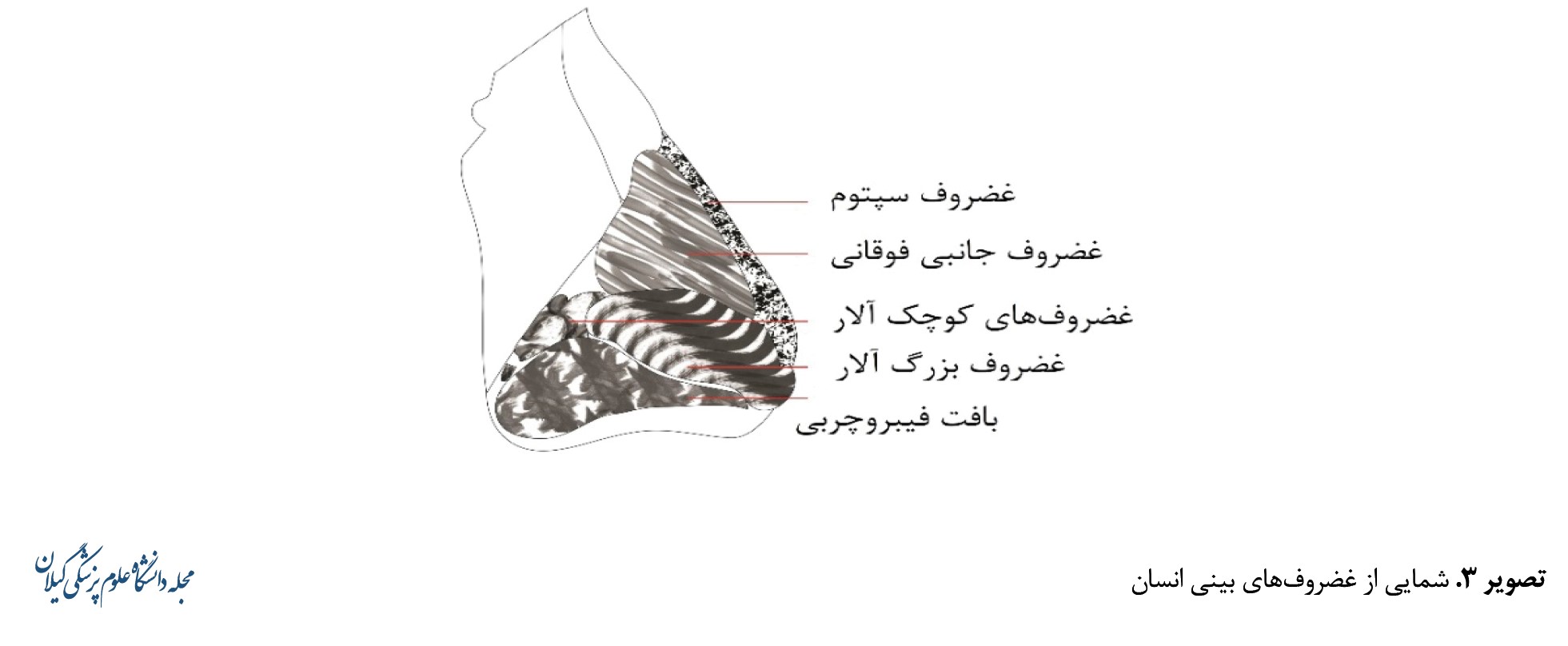
غضروف هیالین بینی از 3 بخش اصلی سپتوم یا تیغه بینی، غضروفهای جانبی فوقانی و غضروفهای جانبی تحتانی معروف به آلار تشکیل شده است (تصویر شماره 3).
روش جوهرافشان
چاپ سهبعدی جوهرافشان روشی بدون تماس است که با پاشش متوالی قطرات گسسته جوهر زیستی از نازلها بر روی یک بستر به ساخت لایهبهلایه سازه میانجامد. این فناوری مشابه سیستم جوهرافشان دوبعدی است. کیفیت و وضوح چاپ به اندازه و گرانروی قطرات بستگی دارد. ازآنجاییکه قطرات میتوانند در حجم پیکولیتر باشند، چاپ زیستی جوهرافشان وضوح چاپ بالا تا 50 میکرون را در قرار دادن دقیق سلولها ارائه میدهد. جوهر زیستی با ویسکوزیته پایین میتواند تشکیل قطرات را افزایش دهد، از انسداد نازل پاشش خودداری کند و نیروی برشی را کاهش دهد، هرچند به خواص مکانیکی پایینتر منجر میشود و ممکن است برای تثبیت ساختار چاپشده نیاز به اتصال عرضی اضافی داشته باشد. در نقطه مقابل ویسکوزیته بالا اغلب باعث گرفتگی مکرر نازل میشود. پس از پاشش قطرات در مکانهای مشخص، قطرات باید بهراحتی تثبیت شوند که این امر معمولاً بهوسیله برخورد قطره با یک عامل اتصال عرضی در بستر رخ میدهد [27، 46]. چاپ زیستی جوهرافشان با وجود برتری در وضوح نسبتاً بالاتر در سطح میکرون، تا حد زیادی به چاپ بافت در مقیاس کوچک محدود میشود. از سوی دیگر معمولاً برای چاپ ساختارهای ضخیم مناسب نیست و نسبت به روش اکستروژن آنچنان در چاپ چندمادهای استفاده نمیشود [47, 48]. قطر نازل میتواند تا حدود 18 میکرومتر باشد، نازکی نازل باعث کشش سطحی میشود که از نشت جوهر جلوگیری میکند. از مزایای روش جوهرافشان میتوان به قابلیت رسوب مستقیم سلولها جهت چاپ سلولی بدون داربست اشاره کرد. همچنین این فناوری قادر است با تغییر تراکم یا اندازه قطرات، امکان چاپ مواد یا سلولها را با گرادیان غلظت در سراسر ساختار فراهم کند [49]. عموماً روشهای جوهرافشان نسبت به روشهای اکستروژن در سرعت و زندهمانی برتری دارند، اما نسبت به روشهای لیزری در این موارد نتایج ضعیفتری میدهند [3، 50، 51].
بایندر جت و متریال جت 2 نوع فناوری جوهرافشان ازنظر ماهیت ماده رسوبکننده هستند. هر دوی این فناوریها برای رسوب دادن قطرات مایع یک ماده استفاده میشوند. در بایندر جت قطرات چسب پیونددهنده روی یک بستر پودری پاشیده میشوند، بهطوریکه ذرات پودر مجاور و همچنین لایه فعلی را با لایه قبلی به هم میچسباند. هنگامی که لایه تکمیل شد، سکو پایین میآید و یک لایه جدید پودر بهطور یکنواخت روی لایه قبلی ازطریق یک سیستم تغذیه پودر گذاشته میشود. در متریال جت حجمی بسیار کوچکی از ماده موردنظر (از پیکولیتر تا نانولیتر) را روی بستر هدف رسوب میدهند. متریال جت به دلیل کمهزینه بودن، زندهمانی مطلوب، وضوح بالا و امکان رسوب مستقیم سلولها، بهطور گسترده در مهندسی بافت به کار گرفته شده است. بااینحال، این تکنیک با محدودیتهای متعددی ازجمله در انتخاب مواد، به دلیل محدودیتهای ویسکوزیته و کشش سطحی، مواجه است [3].
براساس مکانیسم تشکیل قطرات، چاپ زیستی جوهرافشان بهطورکلی به 2 دسته حرارتی و پیزوالکتریک تقسیم میشود. عموماً دستگاههای دارای سر چاپ حرارتی دارای واحد گرمایش الکتریکی در مجاورت نازل هستند که با تبخیر مواد همبند جوهر زیستی و تشکیل حباب بخار عمل میکنند. این حباب بخار در اثر فشار منبسط میشود و بهصورت قطرهای از سر چاپ خارج میشود [35، 52]. زمان گرمایش آنقدر کوتاه است که فقط 4 تا 10 درجه سانتیگراد دمای جوهر زیستی زیاد میشود که تأثیری بر زندهمانی ندارد [53]. در مقابل دستگاههای پیزوالکتریک توسط پالسهای فشاری قطرات جوهر زیستی را به روی بستر چاپ میکنند. با این پالسها دیواره محفظه توسط سرامیک پیزوالکتریک تغییر شکل داده و در اثر این تغییر حجم، جوهر بهصورت قطرهای از نازل خارج میشود باتوجهبه عدم استفاده از حرارت، آسیب سلولی بر اثر دما وجود نخواهد داشت [54].
روش لیزری
چاپ سهبعدی مبتنی بر لیزر ویژگیهای سودمند مختلفی همچون فرکانس بالای چاپ، وضوح بالا، نرخ بقای سلولی بالا (بیش از 95 درصد) و توانایی چاپ همهجهته ساختارهای پیچیده را نشان میدهد [55]. عموماً روشهای مبتنی بر لیزر سرعت و نرخ زندهمانی متوسط بیشتری را نسبت به سایر روشها (اکستروژن و جوهرافشان) ارائه میدهند [49-51].
فناوری چاپ زیستی به کمک لیزر که با نام انتقال توسط لیزر نیز شناخته میشود، بهطورکلی از اجزای زیر تشکیل شده است:
1. منبع لیزر پالسی؛
2. لایه جاذب انرژی (مانند طلا یا تیتانیوم)؛
3. لایه اهداکننده، معمولاً به شکل یک اسلاید یا نوار شیشهای؛
4. لایه جوهر زیستی؛
5. بستر مواد.
این چاپگرها فاقد نازل هستند، بنابراین از چالشهایی همچون گرفتگی نازل جلوگیری میشود. درعینحال این روش از جوهرهای با گرانروی بالا (1 تا 300 میلیپاسکال بر ثانیه) نیز پشتیبانی میکند [56, 57]. لایه جاذب سرعت لیزر را بهبود میبخشد و جوهر زیستی را از تماس مستقیم با پرتو لیزر بازمیدارد. با تابیدن لیزر، در ناحیه مشخصی از نوار اهداکننده یا قربانی، یک حباب با فشار بالا ایجاد میشود، فشار حباب باعث چکیدن قطرات لایه جوهر زیستی در مکانهای تعیینشده روی بستر میشود. بستر هیچ پرتوی را جذب نمیکند. این فرایند تا زمانی که ساختار سهبعدی به وجود آید تکرار میشود. همچون چاپ زیستی اکستروژن، این روش نیز تراکم سلولی بالایی را نتیجه میدهد. قابلیت استفاده از جوهر زیستی با ویسکوزینههای مختلف، وضوح بالا، عدم وجود مشکلات نازل و خطر پایین آلودگی از مزیتهای این روش است. بااینحال این روش علاوه بر ضعف در مقیاسپذیری، پرهزینه بوده و انرژی بالای پرتو لیزر، با آسیب سلولی در ارتباط است که با افزایش ویسکوزیته جوهر و ضخامت بستر میتوان به حفاظت بیشتر از سلولها کمک کرد. میزان بقای سلولی اغلب حدود 85 درصد گزارش شده است [18، 58، 59]. ازآنجاییکه چاپ زیستی به کمک لیزر مانند روش جوهرافشان یک روش غیرتماسی است، میتواند انواع مواد زیستی و سلولها را در محیطهای کشت مختلف چاپ کند تا از آلودگی و آسیب سلولی جلوگیری کند [57].
در روش تفجوشی لیزری انتخابی یک پرتو لیزر که به بستری از پودر ساطع میشود، پودر را در یک الگوی برنامهریزیشده ذوب میکند. پس از ایجاد یک لایه، بستر پودری عقب رفته و لایه بعدی روی آن غلت میخورد و این فرایند تا زمانی که داربست کامل شود، تکرار میشود و در پایان پودر اضافی حذف میشود. در جایی که سازه چاپشده دارای منافذ در ابعاد میکرون باشد، این فرایند حذف پودر اضافی میتواند بسیار دشوار باشد. از زمان ابداع فناوری تفجوشی لیزری انتخابی، این روش بهطور گسترده برای بازسازی بافتهای آناتومیک پیچیده، مانند غضروف استفاده شده است [60].
دیگر فناوری پراستفاده مبتنی بر لیزر، پلیمریزاسیون در ظرف است که استریولیتوگرافی از انواع آن است. استریولیتوگرافی معمولاً از لیزر ماورای بنفش (UV) برای فتوپلیمریزاسیون سطح حمامی از پلیمرهای حساس به نور استفاده میکند. استریولیتوگرافی عموماً متشکل از یک مخزن پرشده با محلول یا رزین پلیمری شامل آغازگرهای نوری، لیزر با محور x-y قابلکنترل و یک پایه ساخت با کنترل محور z است. طی فرایند با پایین آمدن تدریجی پایه، لایههای بیومواد توسط اتصالات عرضی روی هم پلیمریزه میشوند و درنتیجه سازههای سهبعدی با وضوح بالا، بین 5 تا 300 میکرون، به روش از پایین به بالا تشکیل میشوند. نواحی اسکننشده در فاز مایع باقی میمانند [61, 62]. آغازگرهای نوری موادی حساس به دامنههای مختلف طول موج هستند که وقتی در معرض انرژی نور قرار میگیرند، طی یک مکانیسم شیمیایی با مونومرهای یک ماده واکنش داده و تشکیل زنجیره پلیمری میدهند. اشعه ماورای بنفش میتواند برای DNA سلولها مضر باشد؛ اگرچه توسعه استریولیتوگرافی مبتنی بر نور مرئی امکان گنجاندن سلولها را در فرایند چاپ فراهم کرده است، بااینحال محدودیت قابلتوجه این فناوری این است که امکان چاپ فقط به مواد حساس به نور، مانند ژلاتین متاکریلات و پلیاتیلن گلیکول دیاکریلات، محدود است. افزون بر این، عدم محدودیت در ویسکوزیته جوهر زیستی، سرعت بالا و نبود تنش برشی از مزایای استریولیتوگرافی است [63, 64]. سیستمهای استریولیتوگرافی ازنظر منبع روشنایی به 2 دسته روشهای تکفوتون (ماورای بنفش و نور مرئی) و چندفوتون (مادون قرمز) تقسیم میشوند. اخیراً با استفاده از دستگاههای آینه دیجیتال با استریولیتوگرافی پروجکشن نوری پویا برای افزایش سرعت چاپ ساختارهای بزرگ استفاده میکنند [65، 66].
در روش پردازش نور دیجیتال، طرح سهبعدی با مقیاسپذیری منحصربهفرد و همچنین با سرعت و وضوح قابلتوجه چاپ میشود. این روش ازنظر مکانیسم کار بسیار به استریولیتوگرافی مشابه است، اگرچه عموماً از نور مرئی و پروژکتور دیجیتال برای فتوپلیمریزاسیون استفاده میکند تا یک طرح واحد از کل لایه را به یکباره در کل رزین فلاش کند [67، 68]. روش پردازش نور دیجیتال از حرکت مکانیکی در صفحه x-y بینیاز است و صرفاً با تشکیل هر لایه، در جهت z حرکت میکند. این فناوری ارزش زیادی در ساخت سریع محصولات شخصیسازیشده دارد [69، 70]. این فناوری همچون استریولیتوگرافی میتواند بافتهای با تراکم بالای سلولی چاپ کند [58، 71]. روشهای مبتنی بر لیزر چندمادهای عموماً براساس سیستمی کار میکنند که بهطور خودکار مخزن رزین را تغییر میدهد یا آنکه اقدام به تزریق متوالی جوهرهای مختلف میکند. با وجود این، فوتوپلیمریزاسیون چندمادهای باتوجهبه چالشهای مختلف همچنان محدود است [72, 73].
کاربرد درزمینه غضروف بینی
ویژگیهای غضروف بینی
بافت غضروف شامل سلولهای تخصصی کندروسیتها و کندروبلاستهاست که در ECM غضروفی قرار گرفتهاند. ECM غضروف مملو از الیاف کلاژن، فیبرهای الاستین و آب است. همچنین این فضا شامل پروتئوگلیکانها و گلیکوپروتئینها بوده که با ایجاد تعامل بین سلولها و الیاف کلاژنی باعث اتصال آنها میشود که مقاومت بافت غضروفی در برابر نیروهای فشاری را در پی دارد [74، 75]. بافت غضروفی دارای ساختاری هیدراته، ناهمگن، با اصطکاک سطح کم و مقاومت در برابر سایش است. علاوهبرآن بافتی بدون عروق، بدون لنف و بدون عصب است و با تعداد کم سلولهای غضروفی شناخته میشود. به همین جهت، در صورت هرگونه آسیب توانایی ترمیم بسیار پایینی دارد. بااینحال سادگی نسبی ساختار غضروف ساخت آن را تسهیل و به هدفی ایدئال برای چاپ زیستی تبدیل کرده است. 3 دسته کلی غضروف در بدن وجود دارد که عبارتاند از: غضروف هیالین، غضروف الاستیک و غضروف فیبرو. غضروف بینی از نوع هیالین است [76, 77].
غضروف هیالین بینی از 3 بخش اصلی سپتوم یا تیغه بینی، غضروفهای جانبی فوقانی و غضروفهای جانبی تحتانی معروف به آلار تشکیل شده است (تصویر شماره 3).
یکپارچگی ساختاری غضروف بینی برای عملکرد آن، که عبارت است از بویایی و گرم، مرطوب و تهویه کردن هوای استنشاقی قبل از ورود به ریه، از اهمیت حیاتی برخوردار است. سپتوم بینی را به دو حفره تقسیم میکند و غضروفهای جانبی فوقانی از سپتوم امتداد یافته و به استخوانهای فوقانی و فک میرسند [3، 6، 78].
درونکاشت غضروف بینی
درزمینه بافت غضروفی بینی، چاپ زیستی در مواردی همچون شبیهسازی قبل از عمل، گرافتهای شخصی، تولید بستری برای دارورسانی هدفمند جهت ترمیم غضروف و طراحی ساخت مستقیم پروتزهای بینی نقش دارد. همچنین چاپ زیستی میتواند نقایص کوچک بینی را ترمیم کند [79، 80].
در پیشروی علم پزشکی، چاپ زیستی نقش دارد که هدف آن چاپ بافتها و اندامها، باتوجهبه جنبههای کاربردی و زیباییشناختی است. بافت غضروف ازجمله بافتهایی است که تاکنون به کمک این فناوری چاپ شده و از این فناوری برای تولید ایمپلنتهای بینی با شکل و اندازه دقیق و قابلقبول استفاده شده است تا با جراحی کاشته شود [6، 81]. علاوهبراین ایمپلنتهای بینی ممکن است در عملهای رینوپلاستی استفاده شوند [3]. امروزه دستگاههای بیونیک بینی با قابلیت تشخیص بو معرفی شدند که دارای یک سیستم حسگر زیستی الکتروشیمیایی یکپارچه است که میتوان آن را برای انواع بوها، ساختارهای شیمیایی و نشانگرهای زیستی تنظیم کرد. این دستگاهها قابلیت یکپارچهسازی با ایمپلنت زیستچاپشده غضروف بینی را دارند [21].
مدلسازی سهبعدی
قبل از فرایند چاپ، تصویربرداری از توموگرافی بافت موردنظر معمولاً با استفاده از روشهای مرسوم مانند MRI ،CT یا اولتراسوند انجام میشود، چراکه تصویربرداری اساس بازسازی مدلهای پزشکی است. در حال حاضر روش اصلی برای به دست آوردن تصاویر سهبعدی سیتیاسکن است. ازآنجاییکه غضروف بینی توسط بافت نرم احاطه شده و کوچک و پیچیده است، تعیین ویژگیهای دقیق مورفولوژیکی غضروف بینی دشوار است [6، 27، 79]. پس از فرایند بخشبندی تصویر دیجیتال، مرحله بعدی، طراحی و شبیهسازی CAD مدل سهبعدی براساس تصاویر بافت موردنظر است که توسط نرمافزارهای مدلسازی نظیر SolidWorks ،Autodesk Fusion 360 و3D Slicer قابلانجام است. با استفاده از این نرمافزارهای CAD به تصویر اندازه و حجم مشخص داده میشود و اصلاح عیوب هندسی مدل قابلانجام است. همچنین این مرحله میتواند با کمک آسیبشناسی دیجیتالی صورت گیرد. باید توجه داشت بروز اشکالات در طراحی CAD میتواند بر یکپارچگی ایمپلنت چاپشده تأثیر بگذارد که نتایج نامطلوب در آزمونهای بیومکانیکی برونتنی را به همراه دارد. علاوهبراین یک طراحی ضعیف میتواند منجر به عدم پایداری طولانیمدت ساختار در آزمایشهای درونتنی شود. پردازش مدل سهبعدی بهوسیله نرمافزار برش و تقسیم به لایههای دوبعدی، گام بعدی در این مرحله است. درنهایت فایل برششده به یک فرمت قابلتفسیر توسط ماشین، معمولاً G-code تبدیل میشود تا در زمان چاپ وارد چاپگر زیستی شود [81، 82]. در تصویر شماره 4 تصاویر پزشکی گرفتهشده از غضروف آلار بینی از 3 نمای مختلف نشان داده شده است [83].
درونکاشت غضروف بینی
درزمینه بافت غضروفی بینی، چاپ زیستی در مواردی همچون شبیهسازی قبل از عمل، گرافتهای شخصی، تولید بستری برای دارورسانی هدفمند جهت ترمیم غضروف و طراحی ساخت مستقیم پروتزهای بینی نقش دارد. همچنین چاپ زیستی میتواند نقایص کوچک بینی را ترمیم کند [79، 80].
در پیشروی علم پزشکی، چاپ زیستی نقش دارد که هدف آن چاپ بافتها و اندامها، باتوجهبه جنبههای کاربردی و زیباییشناختی است. بافت غضروف ازجمله بافتهایی است که تاکنون به کمک این فناوری چاپ شده و از این فناوری برای تولید ایمپلنتهای بینی با شکل و اندازه دقیق و قابلقبول استفاده شده است تا با جراحی کاشته شود [6، 81]. علاوهبراین ایمپلنتهای بینی ممکن است در عملهای رینوپلاستی استفاده شوند [3]. امروزه دستگاههای بیونیک بینی با قابلیت تشخیص بو معرفی شدند که دارای یک سیستم حسگر زیستی الکتروشیمیایی یکپارچه است که میتوان آن را برای انواع بوها، ساختارهای شیمیایی و نشانگرهای زیستی تنظیم کرد. این دستگاهها قابلیت یکپارچهسازی با ایمپلنت زیستچاپشده غضروف بینی را دارند [21].
مدلسازی سهبعدی
قبل از فرایند چاپ، تصویربرداری از توموگرافی بافت موردنظر معمولاً با استفاده از روشهای مرسوم مانند MRI ،CT یا اولتراسوند انجام میشود، چراکه تصویربرداری اساس بازسازی مدلهای پزشکی است. در حال حاضر روش اصلی برای به دست آوردن تصاویر سهبعدی سیتیاسکن است. ازآنجاییکه غضروف بینی توسط بافت نرم احاطه شده و کوچک و پیچیده است، تعیین ویژگیهای دقیق مورفولوژیکی غضروف بینی دشوار است [6، 27، 79]. پس از فرایند بخشبندی تصویر دیجیتال، مرحله بعدی، طراحی و شبیهسازی CAD مدل سهبعدی براساس تصاویر بافت موردنظر است که توسط نرمافزارهای مدلسازی نظیر SolidWorks ،Autodesk Fusion 360 و3D Slicer قابلانجام است. با استفاده از این نرمافزارهای CAD به تصویر اندازه و حجم مشخص داده میشود و اصلاح عیوب هندسی مدل قابلانجام است. همچنین این مرحله میتواند با کمک آسیبشناسی دیجیتالی صورت گیرد. باید توجه داشت بروز اشکالات در طراحی CAD میتواند بر یکپارچگی ایمپلنت چاپشده تأثیر بگذارد که نتایج نامطلوب در آزمونهای بیومکانیکی برونتنی را به همراه دارد. علاوهبراین یک طراحی ضعیف میتواند منجر به عدم پایداری طولانیمدت ساختار در آزمایشهای درونتنی شود. پردازش مدل سهبعدی بهوسیله نرمافزار برش و تقسیم به لایههای دوبعدی، گام بعدی در این مرحله است. درنهایت فایل برششده به یک فرمت قابلتفسیر توسط ماشین، معمولاً G-code تبدیل میشود تا در زمان چاپ وارد چاپگر زیستی شود [81، 82]. در تصویر شماره 4 تصاویر پزشکی گرفتهشده از غضروف آلار بینی از 3 نمای مختلف نشان داده شده است [83].
جوهر زیستی
جوهر زیستی جزو اصلی و زنده چاپ زیستی است و معمولاً حاوی ترکیبی زیستسازگار از مواد داربست، سلولهای قابلکاشت و مواد زیستفعالی است که خواص مکانیکی و زیستشناختی بافت میزبان را تقلید میکنند [84]. زیستسازگار یعنی هیچ اثر نامطلوب موضعی یا سیستمی ایجاد نشود و از عملکرد بافت پشتیبانی شود. همچنین جوهر زیستی ایدئال میبایست با دارا بودن سینتیک ژل شدن و نازک شدن برشی، قابلیت چاپ دقیق و کنترلشده داشته باشد و دارای خواص مکانیکی مناسب باشد؛ به این معنا که در شرایط اعمال نیروی خارجی شکل اولیه خود را حفظ کند. زیستتخریبپذیری و سازگاری با حداقل 1 روش استریل شدن از دیگر ویژگیهای جوهر زیستی ایدئال است. فرایند تخریب داربست باید با تشکیل بافت همراه باشد [14، 27، 85]. جوهرهای زیستی چندجزئی به ترکیبی از چند نوع ماده زیستی، یک یا چند نوع سلول و مواد زیستفعال اطلاق میشود [86].
طی فرایند چاپ، به کمک اتصال عرضی، جوهر زیستی به ساختاری سهبعدی تبدیل میشود. اتصال عرضی میان این محلول پلیمری میتواند به روش شیمیایی (مانند استفاده از نور، حرارت، واکنشهای شیمیایی یا اتصالدهندهها)، فیزیکی (مانند فعلوانفعالات یونی)، آنزیمی یا ترکیبی از آنها رخ دهد [87، 88]. برای مثال میتوان به استفاده از نور ماورای بنفش برای اتصال عرضی هیدروژلهای ژلاتین متاکریلات (شیمیایی) یا یونهای کلسیم برای اتصال عرضی آلژینات (فیزیکی) اشاره کرد [89، 90].
مواد زیستی
بهطورکلی مواد زیستی بهکاررفته در جوهر زیستی را میتوان به 2 دسته طبیعی و غیرطبیعی تقسیم کرد. مواد زیستی طبیعی خود میتوانند از منبع حیوانی یا غیرحیوانی باشند. ازجمله مواد زیستی طبیعی ژلاتین، آلژینات، کلاژن، فیبروئین ابریشم، هیالورونیک اسید، کیتوزان و ECM بدون سلول در ساخت جوهرهای زیستی مناسب برای چاپ بافت غضروفی به کار رفتهاند. مواد زیستی غیرطبیعی خود میتوانند از منبع آلی یا معدنی باشند. ازجمله آنها میتوان به پلیکاپرولاکتون، پلیاتیلن گلیکول، پلیلاکتیک اسید و نانولولههای کربنی اشاره کرد. مواد زیستی طبیعی برخلاف انواع غیرطبیعی عموماً زیستسازگاری خوبی دارند، اما خواص مکانیکی آنان ضعیفتر است [27، 85، 91]. پلیمرهای طبیعی ازآنجاییکه تحت اثر آنزیمهایی که از سیستم بدن یا میکروارگانیسمها ترشح میشوند قرار میگیرند و تجزیه میشوند، زیستتخریبپذیر هستند. از سوی دیگر بیوپلیمرها مانند پلی کاپرولاکتون بهصورت هیدرولیتیکی در بدن تخریب میشوند [92].
هیدروژلها زنجیرههای پلیمری بسیار آبدوست هستند که با اتصالات عرضی به یکدیگر وصل شدند تا یک شبکه سهبعدی را تشکیل دهند [93]. هیدروژلها به دلیل تخلخل و توانایی بارگذاری مواد مختلف و همچنین توانایی در جذب آب و محصور کردن سلولها به گزینهای عالی برای تقلید ریزمحیط بافت میزبان بدل شدهاند. از دیگر ویژگیهای منحصربهفرد هیدروژلها میتوان به زیستتخریبپذیری، زیستسازگاری، پشتیبانی از اتصال، رشد یا تمایز سلولی اشاره کرد. پلیمرهای طبیعی و ECM سلول زدایی شده به علت زیستسازگاری بالا و قابلیت ژل شدن، مکرراً در ساخت جوهر زیستی مناسب مهندسی بافت غضروف استفاده شدهاند [59، 94، 95]. همچنین هیدروژلها میتوانند بهعنوان حامل مواد، دارو و سلولها عمل کنند و در شرایط کشت، در تأمین مواد مغذی و ایجاد یک ریزمحیط مناسب برای سلولهای محصورشده نقش ایفا کنند و پس از قرارگیری در بدن، رهاسازی کنترلشده مواد را باعث شوند. بنابر این دلایل هیدروژلها گزینه اصلی برای مهندسی بافت غضروف با استفاده از چاپ زیستی هستند [96 ,97]. هیدروژلها میتوانند از پلیمرهای طبیعی یا غیرطبیعی یا ترکیبی از آنان تشکیل شده باشند که برای یک جوهر زیستی بهبودیافته قابلچاپ ساخته میشوند [98 ,99]. در جدول شماره 3 فهرستی از مهمترین هیدروژلهای زیستسازگار طبیعی به همراه مزایا و معایب شاخص آنها درج شده است.

کلیه این هیدروژلها آزمونهای برونتنی و درونتنی حیوانی را با موفقیت پشت سرگذاشتهاند. امروزه، بسیاری از این بیوپلیمرها بهعنوان جایگزین بافت زنده وارد فاز آزمایشهای انسانی شدهاند.
ندونچزیان و همکاران با اصلاح هیالورونیک اسید ازطریق اتصالات عرضی شیمیایی و پیوندهای غیرکووالانسی یک هیدروژل مناسب برای ترمیم غضروف ساختند [100]. لو و همکاران یک جوهر زیستی مبتنی بر ژلاتین متاکریلات مملو از سلول تولید کرد که پس از اتصال عرضی نوری، غضروفزایی منحصربهفردی از خود نشان داد. [101 ,102] مواد زیستی طبیعی غیرحیوانی که عمدتاً از خانواده پلیساکاریدها هستند، مانند آلژینات و آگارز، خواص مکانیکی و قابلیت چاپ بسیار مطلوبی دارند، اما از سویی خواص زیستی آنها برای تحقق عملکرد سلولی ایدئال نیست [84]. تلفیق دیگر پلیمرهای طبیعی همچون ژلاتین و کلاژن با آلژینات برای رسیدن به خواص زیستی مدنظر بسیار رایج است. یانگ ایکس و همکاران از غضروف مهندسیشده کلاژن ـ آلژینات استفاده کردند که قادر است فنوتیپ غضروفی را بهطور مؤثر حفظ کند و نرخ انبساط و خواص مکانیکی مطلوبی داشته باشد [103 ,104].
در تحقیقی که وایشر و همکاران انجام دادند یک جوهر زیستی سلولزداییشده مبتنی بر ECM غضروفی ضمن اتصال عرضی نوری، با ایجاد ریزمحیطی برای فعالیت و بلوغ سلولی و پایداری مکانیکی نتایج امیدوارکنندهای برای بازسازی غضروف ارائه کرد [105]. پلیاستر پلیکاپرولاکتون پلیمری زیستسازگار، با سرعت تخریب مناسب و دارای خواص مکانیکی مطلوب است که عمدتاً بهعنوان چارچوب هیدروژلها، مثلاً برای پشتیبانی مکانیکی از ساختار غضروف، استفاده میشود. باوجوداین، توانایی محصور کردن سلولها را ندارد. چراکه ذوب یا حل کردن پلیمر در حلال برای سلولها آسیبزاست [106-108]. میکروالیافهای پلیاستر پلیکاپرولاکتون به دلیل خواص مکانیکی مناسب در جوهرهای زیستی استفاده میشوند. با افزودن میکروالیاف پلیاستر پلیکاپرولاکتون به جوهر زیستی، میتوان مدول الاستیک آلژینات و ژلاتین متاکریلات را به ترتیب 544 و 45 برابر افزایش داد [109]. بااینحال سطح آبگریز پلیاستر پلیکاپرولاکتون دارای میل سلولی ضعیف است. جوهرهای زیستی هیبریدی که نانوذرات PDA و پلی (ال ـ لاکتیک اسید ـ کو ـ گلیکولید) را ازطریق چاپ سهبعدی در داربست پلیاستر پلیکاپرولاکتون وارد میکنند، میتوانند زاویه تماس آب با پلیاستر پلیکاپرولاکتون خالص را کاهش دهند و زیستسازگاری ریزمحیط را بهبود بخشند [110]. پلیاتیلن گلیکول پلیمری خطی و محلول در آب است که معمولاً به اشکال پلی (اتیلن گلیکول) دیاکریلات یا متاکریلات در چاپ زیستی کاربرد دارد [111, 112]. پلیلاکتیک اسید و پلی (ال ـ لاکتیک اسید ـ کو ـ گلیکولید) به دلیل ساختار قابلتنظیم، زیستسازگاری و زیستتخریبپذیری در جوهرهای زیستی قابلاستفاده است. بااینحال به دلیل آبگریزی، آنها چسبندگی سلولی ضعیفی دارند [113]. مطالعات ثابت کردهاند که نانولولههای کربنی تولیدشده با استفاده از فناوری چاپ زیستی میتوانند خواص فیزیکی داربستهای غضروفی را افزایش دهند [90]. برخی از هیدروژلهای مصنوعی مانند هیدروژل پلیمتاکریلهشده برای مهندسی بافت غضروف مناسب به نظر میرسند [114].
منابع سلولی
یک منبع سلولی با عملکرد بیولوژیکی و ظرفیت بازساختی، ضمن عدم ایمنیزایی از مهمترین بخشهای یک مهندسی بافت است؛ چنانکه بسیاری از غضروفهای آلوژن اغلب توسط سیستم ایمنی بدن رد میشوند. کندروسیتهای اتولوگ و سلولهای بنیادی مزانشیمی، 2 منبع اصلی برای مهندسی بافت غضروف بینی هستند [115، 116].
کندروسیتهای اولیه اتولوگ، مطلوبترین و پرمصرفترین منبع سلولی برای کاربرد در جوهرهای زیستی مناسب چاپ زیستی غضروف هستند. غضروفهای مفصلی، سپتوم، گوش و مهمتر از همه دندهای از این دست منابع سلولیاند. بااینحال به دلیل مشکلاتی همچون عوارض ناحیه اهداکننده و دسترسی، از منابع جایگزینی، مانند سلولهای بنیادی پرتوان القایی مشتق شده از انسان، سلولهای بنیادی مزانشیمی مغز استخوان، پد چربی زیر کشککی، سلولهای بنیادی جنینی و غیره استفاده میشود. این سلولهای بنیادی قدرت تکثیر بالایی دارند و بهوسیله زیستفعالها قابلتمایز به کندروسیتها هستند. افزون بر این، مطالعات جدید از کشت مشترک چند نوع سلول برای دستیابی به غضروفزایی حمایت میکنند [79، 117]. سلولهای بنیادی مزانشیمی برداشتهشده از یک بالغ، تمایل بیشتری برای تمایز به غضروف دارند [118]. کندروسیتهای بهدستآمده از تیغه بینی توانایی تکثیر نسبتاً بالاتری برای تولید بافتهای هیالین دارند [14]. منابع آلوژنیک یا اهداکننده افزون بر مشکلات منابع اتولوگ، میتوانند رد شدن توسط بافت میزبان و نیاز به سرکوب سیستم ایمنی بهصورت مادامالعمر را در پی داشته باشند [119, 120].
کندروسیتها میتوانند از منبع انسانی یا حیوانی تهیه شوند، اما باید توجه داشت فنوتیپ آنها بهسرعت در محیط آزمایشگاهی از بین میرود که این امر را میتوان با فاکتورهای رشد کنترل کرد [14, 120]. در آزمایشی که اوگنی و همکاران انجام دادند منبع سلولی از غضروف دندهای موشهای تازه متولدشده تأمین شد که محتوای سلولی بالایی را فراهم کردند [121].
زیستفعالها
عوامل زیستفعال نقش کلیدی در هدایت سلولی و بهبود خواص بیوشیمیایی و بیومکانیکی بافت دارند. فاکتورهای رشدی همچون فاکتور رشد تغییردهنده بتا، فاکتور رشد شبهانسولین و فاکتور رشد فیبروبلاست جهت تنظیم سنتز و متابولیسم ماتریکس غضروفی، تقویت تکثیر و تمایز و حفظ فنوتیپ در جوهر زیستی استفاده میشوند. برای نمونه فاکتورهای رشد تغییردهنده بتا 1 و 3 جهت تحریک تمایز سلولهای بنیادی به سلولهای غضروفی کاربرد دارد [122، 123]. در مطالعات مشخص شد فاکتورهای رشد فیبروبلاست پتانسیل غضروفی شدن در طول دوره کشت بافت چاپشده را بهطور قابلتوجهی افزایش دادهاند. همچنین داروهای مختلف، هورمونها و سیتوکینها را میتوان برای تقویت رشد سلولها در نظر گرفت [124].
ارزیابیهای برونتنی
کشت مدلهای سهبعدی به شکل وسیعی در تحقیقات زیستپزشکی مورد استفاده قرار گرفته است. همچنین چاپ بافتهای مقیاس کوچک به شکل میکروسفرهای هیدروژل نیز درزمینه مهندسی بافت و غربالگری دارو کاربرد دارد [125]. پس از چاپ زیستی بافت، بافت چاپ سهبعدیشده ممکن است در شرایط برونتنی بهوسیله بیوراکتورها کشت داده شود تا پیش از کاشت درون بدن بالغ شود [126]. بیوراکتورها با شبیهسازی محیط بافت طبیعی، مواد مغذی و محرکهای رشد را برای بافت چاپشده تأمین میکنند. برای کشت باید به الزامات ذاتی و رفتاری هر نوع سلول توجه داشت [127، 128]. آزمون کمی سمیت سلولی MTT، رنگآمیزی هماتوکسیلین ـ ائوزین، رنگآمیزی دپی، رنگ آلسیان آبی برای گلیکوزامینوگلیکانها، ارزیابیهای فلوسیتومتری و مطالعه بهوسیله میکروسکوپ الکترونی روبشی ازجمله بررسیهایی است که محققان برای ارزیابی زندهمانی، بافتشناسی و ریختشناسی بافت چاپشده انجام میدهند. همچنین سنجش کمی محتوای گلیکوزامینوگلیکانها، DNA و کلاژن نوع II در ECM، طیفسنجی تبدیل فوریه، بلورنگاری پرتوی ایکس، سنجش فعالیت میتوکندری، آزمون نسبت تورم و آزمونهای رئولوژیکی و مکانیکی نیز برای بررسیهای دقیقتر میتواند صورت بگیرد تا ویژگیها، فنوتیپ و کارایی ساختار چاپشده مشخص شود [112، 129].
براساس مطالعات، چاپ زیستی اکستروژن هیدروژلهای آلژینات و آگارز از تشکیل هیالین بیشتری نسبت به هیدروژلهای دیگر پشتیبانی میکند [109]. داربستهای پلیاستر پلیکاپرولاکتون / آلژینات چاپشده حاوی فاکتور رشد تغییردهنده بتا، منجر به تشکیل سطوح بالاتری ECM شدند [130]. باید توجه داشت که برای شناسایی سلولها در منبع جمعآوریشده از رنگآمیزی آبی آلیسان استفاده میشود. تولید گلیکوزامینوگلیکان و تجمع آنها در ECM نمایانگر وجود سلولهاست [121]. هنگامی که سلولهای بنیادی مزانشیمی در کنار فاکتور رشد تغییردهنده بتا 3 به جوهرهای زیستی اضافه شد، پشتیبانی قابلتوجهی برای ایجاد غضروف مستحکم نشان داد که این ترکیب برای استراتژی چاپ درجا مناسب تلقی شد [131].
لیم و همکاران به کمک جوهر زیستی متشکل از سلولهای بنیادی مزانشیمی، متاکریلات پلیوینیل الکل و ژلاتین متاکریلات و بکارگیری چاپگر پردازش نور دیجیتال تعدادی ساختار بیولوژیکی با دقت بالا چاپ کردند. پس از 21 روز کشت، زنده ماندن بالایی (90 درصد) را حفظ کردند [132]. یانگ و همکاران توانستند به کمک فناوری چاپ زیستی اکستروژن داربستهای سدیم آلژینات /آگارز و سدیم آلژینات / کلاژن را همراه کندروسیتها چاپ کنند. مشخص شد جوهر زیستی سدیم آلژینات / کلاژن ترکیبی بالقوه برای بازسازی غضروف است، چراکه در کشت سلولی افزایش تکثیر، بیان ژن اختصاصی غضروف و چسبندگی سلول غضروفی را نشان داد [103]. همچنین در آزمایش کوشیک کوژول و همکاران آلژینات و میکروفیبرهای پلیلاکتیک اسید را همراه با کندروسیتهای انسانی چاپ کردند که در بررسیها زندهمانی 80 درصد و خواص مکانیکی بهبودیافته را نتیجه داد [133].
ارزیابیهای درونتنی
بدیهی است زمانی که یک ایمپلنت بهعنوان یک جسم خارجی در بافت میزبان قرار میگیرد عوارض مختلفی ممکن است رخ دهد [92]. در حال حاضر اگرچه تحقیقات گستردهای درزمینه چاپ زیستی غضروف بینی صورت گرفته، اما اکثر آنها فاقد تحقیقات بالینی هستند، چراکه عمدتاً ساختارها به حدی بالغ نشدند که برای این تحقیقات تأیید شوند [5].
در مطالعهای که لان و همکاران انجام دادند، ساختارهای هیدروژل کلاژن و کندروسیت پس از آنکه در چند دوره کشت در انکوباتور خواص مکانیکی مطلوب و فنوتیپ غضروف بینی را نشان دادند، بهصورت زیرجلدی در 7 موش برهنه کاشته شدند. یک موش بهعنوان نمونه کنترل، داربست بدون سلول را دریافت کرد. هیچ عارضهای پس از جراحی مشاهده نشد و 5 هفته پس از کاشت ارزیابیهای مکانیکی، بافتشناسی و ایمنیشناسی روی ایمپلنتها انجام شد. نتایج حاکی از آن بود که چاپ زیستی غضروف بینی میتواند گزینهای قوی برای جراحی بازساختی بینی باشد [2]. در آزمایش مشابهی آپلگرن و همکاران 48 موش ماده برهنه مورد استفاده قرار دادند. در ساختارهای کاشتهشده غضروفزایی پیشرونده و یکپارچگی ساختاری مشاهده شد و پس از 2 ماه، مورفولوژی ایمپلنت مانند غضروف بومی شد [134].
نتیجهگیری
چاپ زیستی سهبعدی از فناوریهای نوظهوری است که در پزشکی بازساختی، با ترمیم و بهبود بافت غضروفی بینی توانایی بالقوهای را از خود نشان داده است. روشهای بازسازی بافت غضروفی تا چندی پیش محدود به استفاده از غضروفهای اتولوگ، آلوژنیک یا استفاده از پیوندهای آلوپلاستیک بوده که هریک معایب اجتنابناپذیری به همراه داشته است. به همین جهت، چاپ زیستی برای حل این معضلات در پزشکی بازساختی به کار گرفته میشود. باتوجهبه الزامات خاص جوهر زیستی بافت هدف، محققان از فناوریهای مختلفی برای چاپ بافت و اندام بهره بردهاند که هریک مزایا و محدودیتهای ویژهای دارند. فناوری چاپ زیستی همچنین یک بازار تجاری رو به رشد است که امروزه ارزش جهانی آن به حدود 2/6 میلیارد دلار میرسد.
براساس مطالعات درونتنی و برونتنی که تا به امروز بر روی بافت چاپشده غضروفی بینی صورت گرفته است، فناوری چاپ زیستی توانسته است بافت میزبان غضروف را تا حد بسیار قابلقبولی ازلحاظ مورفولوژیکی، بیوشیمیایی و مکانیکی تقلید کند. اگرچه استفاده از این فناوری در سطح بالینی همچنان با محدودیتهایی روبهرو است، اما چشمانداز این فناوری از آنجایی امیدوارکننده است که میتواند با هزینه پایین، دقت منحصربهفرد و شخصیسازی، معایب و نقایص بینی را برطرف کند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مقاله از نوع مروری است و هیچگونه آزمایشی بر روی انسان یا حیوان نداشته است. هیچکدام از دادهها در حمایت از نتیجه نهایی پژوهش دست کاری نشدهاند و به تمامی مطالعات در دسترس در راستای موضوع پژوهش اشاره شده است.
حامی مالی
این تحقیق هیچگونه کمک مالی از سازمانهای تأمین مالی در بخشهای عمومی، تجاری یا غیرانتفاعی دریافت نکرد.
مشارکت نویسندگان
مفهومسازی، طراحی مطالعه، کسب، تحلیل و تفسیر دادهها: فاطمه طوسیزاده خراسانی، حسین رستمانی؛ تهیه پیشنویس دستنوشته: حسین رستمانی؛ بازبینی نقادانه دستنوشته برای محتوای فکری مهم: امید فخرایی، نرگس کلیدری؛ تحلیل آماری: حسین رستمانی؛ نظارت: امید فخرایی.
تعارض منافع
نویسندگان اعلام میدارند که در این مقاله هیچگونه تعارض منافعی وجود ندارد.
تشکر و قدردانی
نویسندگان از گروه مهندسی پزشکی دانشگاه آزاد اسلامی مشهد که در این پژوهش ما را همراهی کردند، تشکر و قدردانی کنند.
References
1.Chiesa-Estomba CM, Aiastui A, González-Fernández I, Hernáez-Moya R, Rodiño C, Delgado A, et al. Three-dimensional bioprinting scaffolding for nasal cartilage defects: A systematic review. Tissue Engineering and Regenerative Medicine. 2021; 18(3):343-53. [DOI:10.1007/s13770-021-00331-6] [PMID]
2.Lan X, Liang Y, Vyhlidal M, Erkut EJ, Kunze M, Mulet-Sierra A, et al. In vitro maturation and in vivo stability of bioprinted human nasal cartilage. Journal of Tissue Engineering. 2022; 13:20417314221086368. [DOI:10.1177/20417314221086368] [PMID]
3.Agarwal T, Chiesa I, Presutti D, Irawan V, Vajanthri KY, Costantini M, et al. Recent advances in bioprinting technologies for engineering different cartilage-based tissues. Materials Science and Engineering: C. 2021; 123:112005. [DOI:10.1016/j.msec.2021.112005] [PMID]
4.Ruiz-Cantu L, Gleadall A, Faris C, Segal J, Shakesheff K, Yang J. Multi-material 3D bioprinting of porous constructs for cartilage regeneration. Materials Science & Engineering. C, Materials for Biological Applications. 2020; 109:110578. [DOI:10.1016/j.msec.2019.110578] [PMID]
5.Wang H, Wang Z, Liu H, Liu J, Li R, Zhu X, et al. Three-dimensional printing strategies for irregularly shaped cartilage tissue engineering: Current state and challenges. Frontiers in Bioengineering and Biotechnology. 2022; 9:777039. [DOI:10.3389/fbioe.2021.777039] [PMID]
6.Shi B, Huang H. Computational technology for nasal cartilage-related clinical research and application. International Journal of Oral Science. 2020; 12(1):21. [DOI:10.1038/s41368-020-00089-y] [PMID]
7.Alkaya D, Gurcan C, Kilic P, Yilmazer A, Gurman G. Where is human-based cellular pharmaceutical R&D taking us in cartilage regeneration? 3 Biotech. 2020; 10(4):161. [DOI:10.1007/s13205-020-2134-5] [PMID]
8.Eshkalak SK, Ghomi ER, Dai Y, Choudhury D, Ramakrishna S. The role of three-dimensional printing in healthcare and medicine. Materials & Design. 2020; 194:108940. [DOI:10.1016/j.matdes.2020.108940]
9.Bigham A, Foroughi F, Rezvani Ghomi E, Rafienia M, Neisiany RE, Ramakrishna S. The journey of multifunctional bone scaffolds fabricated from traditional toward modern techniques. Bio-Design and Manufacturing. 2020; 3:281-306. [DOI:10.1007/s42242-020-00094-4]
10.Osborn LS. 3D printing and intellectual property. Cambridge: Cambridge University Press; 2019. [DOI:10.1017/9781316584507]
11.Jian H, Wang M, Wang S, Wang A, Bai S. 3D bioprinting for cell culture and tissue fabrication. Bio-Design and Manufacturing. 2018; 1:45-61.[DOI:10.1007/s42242-018-0006-1]
12.Xie Z, Gao M, Lobo AO, Webster TJ. 3D bioprinting in tissue engineering for medical applications: The classic and the hybrid. Polymers. 2020; 12(8):1717. [DOI:10.3390/polym12081717]
13.Ghasemian Fard M, Sharifianjazi F, Kazemi SS, Rostamani H, Bathaei MS. Laser-based additive manufacturing of magnesium alloys for bone tissue engineering applications: From chemistry to clinic. Journal of Manufacturing and Materials Processing. 2022; 6(6):158. [DOI:10.3390/jmmp6060158]
14.Stampoultzis T, Karami P, Pioletti DP. Thoughts on cartilage tissue engineering: A 21st century perspective. Current Research in Translational Medicine. 2021; 69(3):103299. [DOI:10.1016/j.retram.2021.103299] [PMID]
15.You S, Li J, Zhu W, Yu C, Mei D, Chen S. Nanoscale 3D printing of hydrogels for cellular tissue engineering. Journal of Materials Chemistry B. 2018; 6(15):2187-97. [DOI:10.1039/C8TB00301G] [PMID]
16.Thayer P, Martinez H, Gatenholm E. History and Trends of 3D Bioprinting. Methods in Molecular Biology. 2020; 2140:3-18.[DOI:10.1007/978-1-0716-0520-2_1] [PMID]
17.Ning L, Yang B, Mohabatpour F, Betancourt N, Sarker MD, Papagerakis P, et al. Process-induced cell damage: Pneumatic versus screw-driven bioprinting. Biofabrication. 2020; 12(2):025011. [DOI:10.1088/1758-5090/ab5f53] [PMID]
18.Fu Z, Naghieh S, Xu C, Wang C, Sun W, Chen X. Printability in extrusion bioprinting. Biofabrication. 2021; 13(3):033001. [DOI:10.1088/1758-5090/abe7ab] [PMID]
19.Schwab A, Levato R, D'Este M, Piluso S, Eglin D, Malda J. Printability and shape fidelity of bioinks in 3D bioprinting. Chemical Reviews. 2020; 120(19):11028-55. [DOI:10.1021/acs.chemrev.0c00084] [PMID]
20.Miri AK, Nieto D, Iglesias L, Goodarzi Hosseinabadi H, Maharjan S, Ruiz-Esparza GU, et al. Microfluidics-enabled multimaterial maskless stereolithographic bioprinting. Advanced Materials. 2018; 30(27):1800242. [DOI:10.1002/adma.201800242]
21.Gupta N, Cruz MA, Nasser P, Rosenberg JD, Iatridis JC. Fibrin-genipin hydrogel for cartilage tissue engineering in nasal reconstruction. Annals of Otology, Rhinology & Laryngology. 2019; 128(7):640-6. [DOI:10.1177/0003489419836667] [PMID]
22.Zhang S, Wang H. Current progress in 3D bioprinting of tissue analogs. SLAS Technology. 2019; 24(1):70-8. [DOI:10.1177/2472630318799971] [PMID]
23.Kasper C, Egger D, Lavrentieva A. Basic concepts on 3d cell culture. Berlin: Springer; 2021. [DOI:10.1007/978-3-030-66749-8]
24.Singh M, Jonnalagadda S. Advances in bioprinting using additive manufacturing. European Journal of Pharmaceutical Sciences. 2020; 143:105167. [DOI:10.1016/j.ejps.2019.105167] [PMID]
25.Highley CB, Song KH, Daly AC, Burdick JA. Jammed microgel inks for 3D printing applications. Advanced Science. 2018; 6(1):1801076. [DOI:10.1002/advs.201801076] [PMID]
26.Highley CB. 3D bioprinting technologies. In: Guvendiren M. 3D bioprinting in medicine: Technologies, bioinks, and applications. Berlin: Springer; 2019. [DOI:10.1007/978-3-030-23906-0_1]
27.Xing F, Xiang Z, Rommens PM, Ritz U. 3D bioprinting for vascularized tissue-engineered bone fabrication. Materials. 2020; 13(10):2278. [DOI:10.3390/ma13102278] [PMID]
28.Ramesh S, Harrysson OL, Rao PK, Tamayol A, Cormier DR, Zhang Y, et al. Extrusion bioprinting: Recent progress, challenges, and future opportunities. Bioprinting. 2021; 21:e00116. [DOI:10.1016/j.bprint.2020.e00116]
29.Chantre CO, Gonzalez GM, Ahn S, Cera L, Campbell PH, Hoerstrup SP, et al. Porous biomimetic hyaluronic acid and extracellular matrix protein nanofiber scaffolds for accelerated cutaneous tissue repair. ACS Applied Materials & Interfaces. 2019; 11(49):45498-510. [DOI:10.1021/acsami.9b17322] [PMID]
30.Choudhury D, Anand S, Naing MW. The arrival of commercial bioprinters - Towards 3D bioprinting revolution! International Journal of Bioprinting. 2018; 4(2):139. [DOI:10.18063/ijb.v4i2.139] [PMID]
31.Maniruzzaman M. 3D and 4D printing in biomedical applications: Process engineering and additive manufacturing. New Jersey: John Wiley & Sons; 2019. [DOI:10.1002/9783527813704]
32.Ravanbakhsh H, Bao G, Luo Z, Mongeau LG, Zhang YS. Composite inks for extrusion printing of biological and biomedical constructs. ACS Biomaterials Science & Engineering. 2021; 7(9):4009-26. [DOI:10.1021/acsbiomaterials.0c01158] [PMID]
33.Huang J, Xiong J, Wang D, Zhang J, Yang L, Sun S, et al. 3D bioprinting of hydrogels for cartilage tissue engineering. Gels. 2021; 7(3):144. [DOI:10.3390/gels7030144] [PMID]
34.Pedroza-González SC, Rodriguez-Salvador M, Pérez-Benítez BE, Alvarez MM, Santiago GT. Bioinks for 3D bioprinting: A scientometric analysis of two decades of progress. International Journal of Bioprinting. 2021; 7(2):333. [DOI:10.18063/ijb.v7i2.337] [PMID]
35.Cui H, Nowicki M, Fisher JP, Zhang LG. 3D bioprinting for organ regeneration. Advanced Healthcare Materials. 2017; 6(1):1601118. [DOI:10.1002/adhm.201601118] [PMID]
36.Liu W, Zhong Z, Hu N, Zhou Y, Maggio L, Miri AK, et al. Coaxial extrusion bioprinting of 3D microfibrous constructs with cell-favorable gelatin methacryloyl microenvironments. Biofabrication. 2018; 10(2):024102. [DOI:10.1088/1758-5090/aa9d44] [PMID]
37.Unagolla JM, Jayasuriya AC. Hydrogel-based 3D bioprinting: A comprehensive review on cell-laden hydrogels, bioink formulations, and future perspectives. Applied Materials Today. 2020; 18:100479. [DOI:10.1016/j.apmt.2019.100479] [PMID]
38.Lee JM, Sing SL, Zhou M, Yeong WY. 3D bioprinting processes: A perspective on classification and terminology. International Journal of Bioprinting. 2018; 4(2):151. [DOI:10.18063/ijb.v4i2.151] [PMID]
39.Jacob GT, Passamai VE, Katz S, Castro GR, Alvarez V. Hydrogels for extrusion-based bioprinting: General considerations. Bioprinting. 2022; 27:e00212. [DOI:10.1016/j.bprint.2022.e00212]
40.Mao H, Yang L, Zhu H, Wu L, Ji P, Yang J, et al. Recent advances and challenges in materials for 3D bioprinting. Progress in Natural Science: Materials International. 2020; 30(5):618-34. [DOI:10.1016/j.pnsc.2020.09.015]
41.Tetsuka H, Shin SR. Materials and technical innovations in 3D printing in biomedical applications. Journal of Materials Chemistry B. 2020; 8(15):2930-50. [DOI:10.1039/D0TB00034E] [PMID]
42.Kang D, Hong G, An S, Jang I, Yun WS, Shim JH, et al. Bioprinting of multiscaled hepatic lobules within a highly vascularized construct. Small. 2020; 16(13):1905505. [DOI:10.1002/smll.201905505]
43.Betancourt N, Chen X. Review of extrusion-based multi-material bioprinting processes. Bioprinting. 2022; 25:e00189.[DOI:10.1016/j.bprint.2021.e00189]
44.Jiang T, Munguia-Lopez JG, Flores-Torres S, Grant J, Vijayakumar S, Leon-Rodriguez AD, et al. Directing the self-assembly of tumour spheroids by bioprinting cellular heterogeneous models within alginate/gelatin hydrogels. Scientific Reports. 2017; 7(1):4575. [DOI:10.1038/s41598-017-04691-9] [PMID]
45.Zhou LY, Gao Q, Fu JZ, Chen QY, Zhu JP, Sun Y, et al. Multimaterial 3D printing of highly stretchable silicone elastomers. ACS Applied Materials & Interfaces. 2019; 11(26):23573-83. [DOI:10.1021/acsami.9b04873] [PMID]
46.Tan B, Gan S, Wang X, Liu W, Li X. Applications of 3D bioprinting in tissue engineering: Advantages, deficiencies, improvements, and future perspectives. Journal of Materials Chemistry B. 2021; 9(27):5385-413. [DOI:10.1039/D1TB00172H] [PMID]
47.Gao G, Yonezawa T, Hubbell K, Dai G, Cui X. Inkjet-bioprinted acrylated peptides and PEG hydrogel with human mesenchymal stem cells promote robust bone and cartilage formation with minimal printhead clogging. Biotechnology Journal. 2015; 10(10):1568-77. [DOI:10.1002/biot.201400635] [PMID]
48.Zhang Z, Jin Y, Yin J, Xu C, Xiong R, Christensen K, et al. Evaluation of bioink printability for bioprinting applications. Applied Physics Reviews. 2018; 5(4):041304. [DOI:10.1063/1.5053979]
49.Miri AK, Mirzaee I, Hassan S, Mesbah Oskui S, Nieto D, Khademhosseini A, et al. Effective bioprinting resolution in tissue model fabrication. Lab On A Chip. 2019; 19(11):2019-37. [DOI:10.1039/C8LC01037D] [PMID]
50.Shen Y, Tang H, Huang X, Hang R, Zhang X, Wang Y, et al. DLP printing photocurable chitosan to build bio-constructs for tissue engineering. Carbohydrate Polymers. 2020; 235:115970. [DOI:10.1016/j.carbpol.2020.115970] [PMID]
51.Lee JM, Ng WL, Yeong WY. Resolution and shape in bioprinting: Strategizing towards complex tissue and organ printing. Applied Physics Reviews. 2019; 6(1):011307. [DOI:10.1063/1.5053909]
52.Du X. 3D bio-printing review. Paper presented at: IOP Conference Series: Materials Science and Engineering. 15–17 December 2017, Xiamen, China. [Link]
53.Zhang B, Gao L, Ma L, Luo Y, Yang H, Cui Z. 3D bioprinting: A novel avenue for manufacturing tissues and organs. Engineering. 2019; 5(4):777-94. [DOI:10.1016/j.eng.2019.03.009]
54.Zhou D, Chen J, Liu B, Zhang X, Li X, Xu T. Bioinks for jet-based bioprinting. Bioprinting. 2019; 16:e00060. [DOI:10.1016/j.bprint.2019.e00060]
55.Kumar K, Zindani D, Davim JP. Rapid prototyping, rapid tooling and reverse engineering: From biological models to 3d bioprinters: Walter de Gruyter GmbH & Co KG; 2020. [DOI:10.1515/9783110664904]
56.Derakhshanfar S, Mbeleck R, Xu K, Zhang X, Zhong W, Xing M. 3D bioprinting for biomedical devices and tissue engineering: A review of recent trends and advances. Bioactive Materials. 2018; 3(2):144-56. [DOI:10.1016/j.bioactmat.2017.11.008] [PMID]
57.Zhang B, Luo Y, Ma L, Gao L, Li Y, Xue Q, et al. 3D bioprinting: An emerging technology full of opportunities and challenges. Bio-Design and Manufacturing. 2018; 1:2-13. [DOI:10.1007/s42242-018-0004-3]
58.Li H, Tan C, Li L. Review of 3D printable hydrogels and constructs. Materials & Design. 2018; 159:20-38. [DOI:10.1016/j.matdes.2018.08.023]
59.Khoeini R, Nosrati H, Akbarzadeh A, Eftekhari A, Kavetskyy T, Khalilov R, et al. Natural and synthetic bioinks for 3D bioprinting. Advanced NanoBiomed Research. 2021; 1(8):2000097. [DOI:10.1002/anbr.202000097]
60.Mondschein RJ, Kanitkar A, Williams CB, Verbridge SS, Long TE. Polymer structure-property requirements for stereolithographic 3D printing of soft tissue engineering scaffolds. Biomaterials. 2017; 140:170-88. [DOI:10.1016/j.biomaterials.2017.06.005] [PMID]
61.Ong LJY, Islam A, DasGupta R, Iyer NG, Leo HL, Toh YC. A 3D printed microfluidic perfusion device for multicellular spheroid cultures. Biofabrication. 2017; 9(4):045005. [DOI:10.1088/1758-5090/aa8858] [PMID]
62.Raman R, Bhaduri B, Mir M, Shkumatov A, Lee MK, Popescu G, et al. High-resolution projection microstereolithography for patterning of neovasculature. Advanced Healthcare Materials. 2016; 5(5):610-9. [DOI:10.1002/adhm.201500721] [PMID]
63.Magalhães LSSM, Santos FEP, Elias CMV, Afewerki S, Sousa GF, Furtado ASA, et al. Printing 3D hydrogel structures employing low-cost stereolithography technology. Journal of Functional Biomaterials. 2020; 11(1):12. [DOI:10.3390/jfb11010012] [PMID]
64.De S, Jose J, Pal A, Roy Choudhury S, Roy S. Exposure to low UV-B dose induces DNA double-strand breaks mediated onset of endoreduplication in Vigna radiata (L.) R. Wilczek seedlings. Plant and Cell Physiology. 2022; 63(4):463-83. [DOI:10.1093/pcp/pcac012] [PMID]
65.Kumar H, Kim K. Stereolithography 3D Bioprinting. Methods in molecular biology (Clifton, N.J.). 2020; 2140:93-108.[DOI:10.1007/978-1-0716-0520-2_6] [PMID]
66.Moura D, Pereira RF, Goncalves IC. Recent advances on bioprinting of hydrogels containing carbon materials. Materials Today Chemistry. 2022; 23:100617. [DOI:10.1016/j.mtchem.2021.100617]
67.Xiang Y, Miller K, Guan J, Kiratitanaporn W, Tang M, Chen S. 3D bioprinting of complex tissues in vitro: State-of-the-art and future perspectives. Archives of Toxicology. 2022; 96(3):691-710. [DOI:10.1007/s00204-021-03212-y] [PMID]
68.Zhu W, Qu X, Zhu J, Ma X, Patel S, Liu J, et al. Direct 3D bioprinting of prevascularized tissue constructs with complex microarchitecture. Biomaterials. 2017; 124:106-15. [DOI:10.1016/j.biomaterials.2017.01.042] [PMID]
69.Xia N, Jin D, Iacovacci V, Zhang L. 3D printing of functional polymers for miniature machines. Multifunctional Materials. 2022; 5(1):012001. [DOI:10.1088/2399-7532/ac4836]
70.Debnath SK, Debnath M, Srivastava R, Omri A. Intervention of 3D printing in health care: Transformation for sustainable development. Expert Opinion on Drug Delivery. 2021; 18(11):1659-72. [DOI:10.1080/17425247.2021.1981287] [PMID]
71.Leberfinger AN, Dinda S, Wu Y, Koduru SV, Ozbolat V, Ravnic DJ, et al. Bioprinting functional tissues. Acta Biomaterialia. 2019; 95:32-49. [DOI:10.1016/j.actbio.2019.01.009] [PMID]
72.Han D, Yang C, Fang NX, Lee H. Rapid multi-material 3D printing with projection micro-stereolithography using dynamic fluidic control. Additive Manufacturing. 2019; 27:606-15. [DOI:10.1016/j.addma.2019.03.031]
73.Kim YT, Castro K, Bhattacharjee N, Folch A. Digital manufacturing of selective porous barriers in microchannels using multi-material stereolithography. Micromachines. 2018; 9(3):125. [DOI:10.3390/mi9030125] [PMID]
74.McGivern S, Boutouil H, Al-Kharusi G, Little S, Dunne NJ, Levingstone TJ. Translational application of 3D bioprinting for cartilage tissue engineering. Bioengineering. 2021; 8(10):144. [DOI:10.3390/bioengineering8100144] [PMID]
75.Baddam P, Bayona-Rodriguez F, Campbell SM, El-Hakim H, Graf D. Properties of the nasal cartilage, from development to adulthood: A scoping review. Cartilage. 2022; 13(1):19476035221087696.[DOI:10.1177/19476035221087696] [PMID]
76.Murphy SV, De Coppi P, Atala A. Opportunities and challenges of translational 3D bioprinting. Nature Biomedical Engineering. 2020; 4(4):370-80. [DOI:10.1038/s41551-019-0471-7] [PMID]
77.Agarwal S, Saha S, Balla VK, Pal A, Barui A, Bodhak S. Current developments in 3D bioprinting for tissue and organ regeneration-A review. Frontiers in Mechanical Engineering. 2020; 6:589171. [DOI:10.3389/fmech.2020.589171]
78.Lavernia L, Brown WE, Wong BJ, Hu JC, Athanasiou KA. Toward tissue-engineering of nasal cartilages. Acta Biomaterialia. 2019; 88:42-56. [DOI:10.1016/j.actbio.2019.02.025] [PMID]
79.Sun Y, Zhao Z, An Y. Application of digital technology in nasal reconstruction. Chinese Journal of Plastic and Reconstructive Surgery. 2021; 3(4):204-8. [DOI:10.1016/j.cjprs.2021.12.001]
80.Wade DE. 3D Printing, Valuation, and Service Inputs: Looking to the future rather than the past to design rules of origin for advanced manufactured products. Brexit Institute Working Paper Series. 2024; No 02/2024. [Link]
81.Wang X, Zhao L, Fuh JYH, Lee HP. Effect of porosity on mechanical properties of 3D printed polymers: Experiments and micromechanical modeling based on X-ray computed tomography analysis. Polymers. 2019; 11(7):1154. [DOI:10.3390/polym11071154] [PMID]
82.Fay CD. Computer-Aided Design and Manufacturing (CAD/CAM) for Bioprinting. Methods in Molecular Biology. 2020; 2140:27-41. [DOI:10.1007/978-1-0716-0520-2_3] [PMID]
83.Visscher DO, Lee H, van Zuijlen PPM, Helder MN, Atala A, Yoo JJ, et al. A photo-crosslinkable cartilage-derived extracellular matrix bioink for auricular cartilage tissue engineering. Acta Biomaterialia. 2021; 121:193-203. [DOI:10.1016/j.actbio.2020.11.029] [PMID]
84.Chimene D, Lennox KK, Kaunas RR, Gaharwar AK. Advanced bioinks for 3D printing: A materials science perspective. Annals of Biomedical Engineering. 2016; 44(6):2090-102. [DOI:10.1007/s10439-016-1638-y] [PMID]
85.Bian L. Functional hydrogel bioink, a key challenge of 3D cellular bioprinting. APL Bioengineering. 2020; 4(3):030401.[DOI:10.1063/5.0018548] [PMID]
86.Sodupe-Ortega E, Sanz-Garcia A, Pernia-Espinoza A, Escobedo-Lucea C. Accurate calibration in multi-material 3D bioprinting for tissue engineering. Materials. 2018; 11(8):1402. [DOI:10.3390/ma11081402] [PMID]
87.GhavamiNejad A, Ashammakhi N, Wu XY, Khademhosseini A. Crosslinking strategies for 3D bioprinting of polymeric hydrogels. Small. 2020; 16(35):2002931. [DOI:10.1002/smll.202002931]
88.Ashammakhi N, Kaarela O. Three-dimensional bioprinting can help bone. Journal of Craniofacial Surgery. 2018; 29(1):9-11. [DOI:10.1097/SCS.0000000000004143] [PMID]
89.Li Y, Liu Y, Jiang C, Li S, Liang G, Hu Q. A reactor-like spinneret used in 3D printing alginate hollow fiber: a numerical study of morphological evolution. Soft Matter. 2016; 12(8):2392-9. [DOI:10.1039/C5SM02733K] [PMID]
90.Klotz BJ, Gawlitta D, Rosenberg AJWP, Malda J, Melchels FPW. Gelatin-methacryloyl hydrogels: Towards biofabrication-based tissue repair. Trends in Biotechnology. 2016; 34(5):394-407. [DOI:10.1016/j.tibtech.2016.01.002] [PMID]
91.Wang Z, Yang Y, Gao Y, Xu Z, Yang S, Jin M. Establishing a novel 3D printing bioinks system with recombinant human collagen. International Journal of Biological Macromolecules. 2022; 211:400-9. [DOI:10.1016/j.ijbiomac.2022.05.088] [PMID]
92.Oshida Y, Miyazaki T. Biomaterials and engineering for implantology: In Medicine and Dentistry. Walter de Gruyter GmbH & Co KG; 2022. [DOI:10.1515/9783110740134]
93.Persaud A, Maus A, Strait L, Zhu D. 3D bioprinting with live cells. Engineered Regeneration. 2022; 3(3):292-309. [DOI:10.1016/j.engreg.2022.07.002]
94.Hauptstein J, Böck T, Bartolf-Kopp M, Forster L, Stahlhut P, Nadernezhad A, et al. Hyaluronic acid-based bioink composition enabling 3D bioprinting and improving quality of deposited cartilaginous extracellular matrix. Advanced Healthcare Materials. 2020; 9(15):2000737. [DOI:10.1002/adhm.202000737] [PMID]
95.Abdollahiyan P, Oroojalian F, Mokhtarzadeh A, de la Guardia M. Hydrogel-based 3D bioprinting for bone and cartilage tissue engineering. Biotechnology Journal. 2020; 15(12):e2000095.[DOI:10.1002/biot.202000095] [PMID]
96.Wang K, Wang Z, Hu H, Gao C. Supramolecular microgels/microgel scaffolds for tissue repair and regeneration. Supramolecular Materials. 2022; 1:100006. [DOI:10.1016/j.supmat.2021.100006]
97.Piras CC, Fernández-Prieto S, De Borggraeve WM. Nanocellulosic materials as bioinks for 3D bioprinting. Biomaterials Science. 2017; 5(10):1988-92. [DOI:10.1039/C7BM00510E] [PMID]
98.Li D, Zhou J, Zhang M, Ma Y, Yang Y, Han X, et al. Long-term delivery of alendronate through an injectable tetra-PEG hydrogel to promote osteoporosis therapy. Biomaterials Science. 2020; 8(11):3138-46. [DOI:10.1039/D0BM00376J] [PMID]
99.Yu T, Wang H, Zhang Y, Wang X, Han B. The delivery of RNA-interference therapies based on engineered hydrogels for bone tissue regeneration. Frontiers in Bioengineering and Biotechnology. 2020; 8:445. [DOI:10.3389/fbioe.2020.00445] [PMID]
100.Nedunchezian S, Banerjee P, Lee CY, Lee SS, Lin CW, Wu CW, et al. Generating adipose stem cell-laden hyaluronic acid-based scaffolds using 3D bioprinting via the double crosslinked strategy for chondrogenesis. Materials Science and Engineering: C. 2021; 124:112072. [DOI:10.1016/j.msec.2021.112072] [PMID]
101.Lam T, Dehne T, Krüger JP, Hondke S, Endres M, Thomas A, et al. Photopolymerizable gelatin and hyaluronic acid for stereolithographic 3D bioprinting of tissue-engineered cartilage. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 2019; 107(8):2649-57. [DOI:10.1002/jbm.b.34354] [PMID]
102.Luo C, Xie R, Zhang J, Liu Y, Li Z, Zhang Y, et al. Low-temperature three-dimensional printing of tissue cartilage engineered with gelatin methacrylamide. Tissue Engineering Part C: Methods. 2020; 26(6):306-16. [DOI:10.1089/ten.tec.2020.0053] [PMID]
103.Yang X, Lu Z, Wu H, Li W, Zheng L, Zhao J. Collagen-alginate as bioink for three-dimensional (3D) cell printing based cartilage tissue engineering. Materials Science & Engineering. C, Materials for Biological Applications. 2018; 83:195-201. [DOI:10.1016/j.msec.2017.09.002] [PMID]
104.Jammalamadaka U, Tappa K. Recent advances in biomaterials for 3D printing and tissue engineering. Journal of Functional Biomaterials. 2018; 9(1):22. [DOI:10.3390/jfb9010022] [PMID]
105.Murphy C, Kolan K, Li W, Semon J, Day D, Leu M. 3D bioprinting of stem cells and polymer/bioactive glass composite scaffolds for bone tissue engineering. International Journal of Bioprinting. 2017; 3(1):005. [DOI:10.18063/IJB.2017.01.005] [PMID]
106.Fakhraei O, Alimohammadi M, Moradi A, Akbarinezhad Nogh A, Soudmand Salarabadi S, Ghasabzadeh MS, et al. Nanofibrous polycaprolactone/chitosan membranes for preventing postsurgical tendon adhesion. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 2022; 110(6):1279-91. [DOI:10.1002/jbm.b.34999] [PMID]
107.Alimohammadi M, Fakhraei O, Moradi A, Kabiri M, Passandideh-Fard M, Tamayol A, et al. Controlled release of azithromycin from polycaprolactone/chitosan nanofibrous membranes. Journal of Drug Delivery Science and Technology. 2022; 71:103246. [DOI:10.1016/j.jddst.2022.103246]
108.Mohan T, Maver T, Štiglic AD, Stana-Kleinschek K, Kargl R. 3D bioprinting of polysaccharides and their derivatives: From characterization to application. In: Thomas S, Balakrishnan P, Sreekala MS, editors. Fundamental biomaterials: polymers. A volume in Woodhead Publishing Series in Biomaterials. London: WP; 2018. [DOI:10.1016/B978-0-08-102194-1.00006-2]
109.Wei P, Xu Y, Gu Y, Yao Q, Li J, Wang L. IGF-1-releasing PLGA nanoparticles modified 3D printed PCL scaffolds for cartilage tissue engineering. Drug Delivery. 2020; 27(1):1106-14. [DOI:10.1080/10717544.2020.1797239] [PMID]
110.Morris VB, Nimbalkar S, Younesi M, McClellan P, Akkus O. Mechanical properties, cytocompatibility and manufacturability of chitosan: PEGDA hybrid-gel scaffolds by stereolithography. Annals of Biomedical Engineering. 2017; 45(1):286-96.[DOI:10.1007/s10439-016-1643-1] [PMID]
111.Kim JS, Hong S, Hwang C. Bio-ink materials for 3D bio-printing. Journal of International Society for Simulation Surgery. 2016; 3(2):49-59. [DOI:10.18204/JISSiS.2016.3.2.049]
112.Wang H, Xu S, Fan D, Geng X, Zhi G, Wu D, et al. Multifunctional microcapsules: A theranostic agent for US/MR/PAT multi-modality imaging and synergistic chemo-photothermal osteosarcoma therapy. Bioactive Materials. 2022; 7:453-65. [DOI:10.1016/j.bioactmat.2021.05.004] [PMID]
113.Bee SL, Hamid ZA, Mariatti M, Yahaya B, Lim K, Bee ST, et al. Approaches to improve therapeutic efficacy of biodegradable PLA/PLGA microspheres: A review. Polymer Reviews. 2018; 58(3):495-536. [DOI:10.1080/15583724.2018.1437547]
114.Li X, Liang Y, Xu X, Xiong J, Ouyang K, Duan L, et al. Cell-to-cell culture inhibits dedifferentiation of chondrocytes and induces differentiation of human umbilical cord-derived mesenchymal stem cells. BioMed Research International. 2019; 2019:5871698. [DOI:10.1155/2019/5871698] [PMID]
115.Colle J, Blondeel P, De Bruyne A, Bochar S, Tytgat L, Vercruysse C, et al. Bioprinting predifferentiated adipose-derived mesenchymal stem cell spheroids with methacrylated gelatin ink for adipose tissue engineering. Journal of Materials Science: Materials in Medicine. 2020; 31(4):36. [DOI:10.1007/s10856-020-06374-w] [PMID]
116.Ong CS, Yesantharao P, Huang CY, Mattson G, Boktor J, Fukunishi T, et al. 3D bioprinting using stem cells. Pediatric Research. 2018; 83(1-2):223-31. [DOI:10.1038/pr.2017.252] [PMID]
117.Ude CC, Miskon A, Idrus RBH, Abu Bakar MB. Application of stem cells in tissue engineering for defense medicine. Military Medical Research. 2018; 5(1):7. [DOI:10.1186/s40779-018-0154-9] [PMID]
118.Grounds MD. Obstacles and challenges for tissue engineering and regenerative medicine: Australian nuances. Clinical and Experimental Pharmacology and Physiology. 2018; 45(4):390-400. [DOI:10.1111/1440-1681.12899] [PMID]
119.Wragg NM, Burke L, Wilson SL. A critical review of current progress in 3D kidney biomanufacturing: Advances, challenges, and recommendations. Renal Replacement Therapy. 2019; 5:18. [DOI:10.1186/s41100-019-0218-7]
120.Setayeshmehr M, Esfandiari E, Hashemibeni B, Tavakoli AH, Rafienia M, Samadikuchaksaraei A, et al. Chondrogenesis of human adipose-derived mesenchymal stromal cells on the [devitalized costal cartilage matrix/poly (vinyl alcohol)/fibrin] hybrid scaffolds. European Polymer Journal. 2019; 118:528-41. [DOI:10.1016/j.eurpolymj.2019.04.044]
121.Beketov EE, Isaeva EV, Yakovleva ND, Demyashkin GA, Arguchinskaya NV, Kisel AA, et al. Bioprinting of cartilage with bioink based on high-concentration collagen and chondrocytes. International Journal of Molecular Sciences. 2021; 22(21):11351. [DOI:10.3390/ijms222111351] [PMID]
122.Caddeo S, Boffito M, Sartori S. Tissue engineering approaches in the design of healthy and pathological in vitro tissue models. Frontiers in Bioengineering and Biotechnology. 2017; 5:40. [DOI:10.3389/fbioe.2017.00040] [PMID]
123.Qu M, Jiang X, Zhou X, Wang C, Wu Q, Ren L, et al. Stimuli-responsive delivery of growth factors for tissue engineering. Advanced Healthcare Materials. 2020; 9(7):e1901714. [DOI:10.1002/adhm.201901714] [PMID]
124.Mei Q, Rao J, Bei HP, Liu Y, Zhao X. 3D bioprinting photo-crosslinkable hydrogels for bone and cartilage repair. International Journal of Bioprinting. 2021; 7(3):367. [DOI:10.18063/ijb.v7i3.367] [PMID]
125.Jain P, Kathuria H, Dubey N. Advances in 3D bioprinting of tissues/organs for regenerative medicine and in-vitro models. Biomaterials. 2022; 287:121639. [DOI:10.1016/j.biomaterials.2022.121639] [PMID]
126.Augustine R. Skin bioprinting: A novel approach for creating artificial skin from synthetic and natural building blocks. Progress in Biomaterials. 2018; 7(2):77-92. [DOI:10.1007/s40204-018-0087-0] [PMID]
127.Rosser J, Thomas DJ. Bioreactor processes for maturation of 3D bioprinted tissue. In: Thomas DJ, Jessop ZM, Whitaker IS, editors. 3D Bioprinting for reconstructive surgery: Techniques and applications. London: WP; 2018. [DOI:10.1016/B978-0-08-101103-4.00010-7]
128.König I, Soranno A, Nettels D, Schuler B. Impact of in-cell and in-vitro crowding on the conformations and dynamics of an intrinsically disordered protein. Angewandte Chemie. 2021; 133(19):10819-24. [DOI:10.1002/ange.202016804]
129.Mousavi Nejad Z, Torabinejad B, Davachi SM, Zamanian A, Saeedi Garakani S, Najafi F, et al. Synthesis, physicochemical, rheological and in-vitro characterization of double-crosslinked hyaluronic acid hydrogels containing dexamethasone and PLGA/dexamethasone nanoparticles as hybrid systems for specific medical applications. International Journal of Biological Macromolecules. 2019; 126:193-208. [DOI:10.1016/j.ijbiomac.2018.12.181] [PMID]
130.Cao Y, Cheng P, Sang S, Xiang C, An Y, Wei X, et al. Mesenchymal stem cells loaded on 3D-printed gradient poly (ε-caprolactone)/methacrylated alginate composite scaffolds for cartilage tissue engineering. Regenerative Biomaterials. 2021; 8(3):rbab019. [DOI:10.1093/rb/rbab019] [PMID]
131.Rathan S, Dejob L, Schipani R, Haffner B, Möbius ME, Kelly DJ. Fiber reinforced cartilage ECM functionalized bioinks for functional cartilage tissue engineering. Advanced Healthcare Materials. 2019; 8(7):1801501. [DOI:10.1002/adhm.201801501] [PMID]
132.Zhang J, Hu Q, Wang S, Tao J, Gou M. Digital light processing based three-dimensional printing for medical applications. International Journal of Bioprinting. 2019; 6(1):242. [DOI:10.18063/ijb.v6i1.242] [PMID]
133.Kosik-Kozioł A, Costantini M, Bolek T, Szöke K, Barbetta A, Brinchmann J, et al. PLA short sub-micron fiber reinforcement of 3D bioprinted alginate constructs for cartilage regeneration. Biofabrication. 2017; 9(4):044105. [DOI:10.1088/1758-5090/aa90d7] [PMID]
134.Apelgren P, Amoroso M, Lindahl A, Brantsing C, Rotter N, Gatenholm P, et al. Chondrocytes and stem cells in 3D-bioprinted structures create human cartilage in vivo. PLoS One. 2017; 12(12):e0189428. [DOI:10.1371/journal.pone.0189428] [PMID]
135.An S, Choi S, Min S, Cho SW. Hyaluronic acid-based biomimetic hydrogels for tissue engineering and medical applications. Biotechnology and Bioprocess Engineering. 2021; 26(4):503-16. [DOI:10.1007/s12257-020-0343-8]
136.McMillan A, McMillan N, Gupta N, Kanotra SP, Salem AK. 3D bioprinting in otolaryngology: A review. Advanced Healthcare Materials. 2023; 12(19):e2203268. [DOI:10.1002/adhm.202203268] [PMID]
137.Zopf DA, Mitsak AG, Flanagan CL, Wheeler M, Green GE, Hollister SJ. Computer aided-designed, 3-dimensionally printed porous tissue bioscaffolds for craniofacial soft tissue reconstruction. Otolaryngology--Head and Neck Surgery. 2015; 152(1):57-62. [DOI:10.1177/0194599814552065] [PMID]
138.Skopinska-Wisniewska J, Tuszynska M, Olewnik-Kruszkowska E. Comparative study of gelatin hydrogels modified by various cross-linking agents. Materials. 2021; 14(2):396. [DOI:10.3390/ma14020396] [PMID]
139.Huang J, Huang Z, Liang Y, Yuan W, Bian L, Duan L, et al. 3D printed gelatin/hydroxyapatite scaffolds for stem cell chondrogenic differentiation and articular cartilage repair. Biomaterials Science. 2021; 9(7):2620-30. [DOI:10.1039/D0BM02103B] [PMID]
140.Mushtaq F, Raza ZA, Batool SR, Zahid M, Onder OC, Rafique A, et al. Preparation, properties, and applications of gelatin-based hydrogels (GHs) in the environmental, technological, and biomedical sectors. International Journal of Biological Macromolecules. 2022; 218:601-33. [DOI:10.1016/j.ijbiomac.2022.07.168][PMID]
141.Rajabi N, Rezaei A, Kharaziha M, Bakhsheshi-Rad HR, Luo H, RamaKrishna S, et al. Recent advances on bioprinted gelatin methacrylate-based hydrogels for tissue repair. Tissue Engineering Part A. 2021; 27(11-12):679-702. [DOI:10.1089/ten.tea.2020.0350] [PMID]
142.Gao Q, He Y, Fu JZ, Liu A, Ma L. Coaxial nozzle-assisted 3D bioprinting with built-in microchannels for nutrients delivery. Biomaterials. 2015; 61:203-15. [DOI:10.1016/j.biomaterials.2015.05.031] [PMID]
143.Camacho P, Busari H, Seims KB, Tolbert JW, Chow LW. Materials as bioinks and bioink design. In: Guvendiren M, editor. 3D bioprinting in medicine. Cham: Springer; 2019. [DOI:10.1007/978-3-030-23906-0_2]
144.Khalilifar MA, Eslaminejad MB, Ghasemzadeh M, Hosseini S, Baharvand H. In vitro and in vivo comparison of different types of rabbit mesenchymal stem cells for cartilage repair. Cell Journal. 2019; 21(2):150-60. [PMID]
145.Zainal S, Mohd NH, Suhaili N, Anuar FH, Lazim AM, Othaman R. Preparation of cellulose-based hydrogel: A review. Journal of Materials Research and Technology. 2021; 10:935-52. [DOI:10.1016/j.jmrt.2020.12.012]
146.Yin N, Chen SY, Cao YM, Wang HP, Wu QK. Improvement in mechanical properties and biocompatibility of biosynthetic bacterial cellulose/lotus root starch composites. Chinese Journal of Polymer Science. 2017; 35(3):354-64. [DOI:10.1007/s10118-017-1903-z]
147.Pan T, Song W, Cao X, Wang Y. 3D bioplotting of gelatin/alginate scaffolds for tissue engineering: Influence of crosslinking degree and pore architecture on physicochemical properties. Journal of Materials Science & Technology. 2016; 32(9):889-900. [DOI:10.1016/j.jmst.2016.01.007]
148.Spiller KL, Maher SA, Lowman AM. Hydrogels for the repair of articular cartilage defects. Tissue Engineering Part B: Reviews. 2011; 17(4):281-99. [DOI:10.1089/ten.teb.2011.0077] [PMID]
149.Shariatinia Z, Jalali AM. Chitosan-based hydrogels: Preparation, properties and applications. International Journal of Biological Macromolecules. 2018; 115:194-220. [DOI:10.1016/j.ijbiomac.2018.04.034] [PMID]
150.Selmi TA, Verdonk P, Chambat P, Dubrana F, Potel JF, Barnouin L, et al. Autologous chondrocyte implantation in a novel alginate-agarose hydrogel: outcome at two years. The Journal of Bone & Joint Surgery British Volume. 2008; 90(5):597-604. [DOI:10.1302/0301-620X.90B5.20360] [PMID]
151.Do NH, Truong QT, Le PK, Ha AC. Recent developments in chitosan hydrogels carrying natural bioactive compounds. Carbohydrate Polymers. 2022; 294:119726. [DOI:10.1016/j.carbpol.2022.119726] [PMID]
152.Alimohammadi M, Aghli Y, Fakhraei O, Moradi A, Passandideh-Fard M, Ebrahimzadeh MH, et al. Electrospun nanofibrous membranes for preventing tendon adhesion. ACS Biomaterials Science & Engineering. 2020; 6(8):4356-76. [DOI:10.1021/acsbiomaterials.0c00201] [PMID]
153.Chakraborty J, Mu X, Pramanick A, Kaplan DL, Ghosh S. Recent advances in bioprinting using silk protein-based bioinks. Biomaterials. 2022; 287:121672. [DOI:10.1016/j.biomaterials.2022.121672] [PMID]
154.Taghizadeh M, Taghizadeh A, Yazdi M, Zarrintaj P, Stadler FJ, Ramsey JD, et al. Chitosan-based inks for 3D printing and bioprinting. Green Chemistry. 2022; 24(1):62-101. [DOI:10.1039/D1GC01799C]
155.Tan XH, Liu L, Mitryashkin A, Wang Y, Goh JCH. Silk Fibroin as a Bioink-A thematic review of functionalization strategies for bioprinting applications. ACS Biomaterials Science & Engineering. 2022; 8(8):3242-70. [DOI:10.1021/acsbiomaterials.2c00313] [PMID]
156.Gupta S, Alrabaiah H, Christophe M, Rahimi-Gorji M, Nadeem S, Bit A. Evaluation of silk-based bioink during pre and post 3D bioprinting: a review. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 2021; 109(2):279-93. [DOI:10.1002/jbm.b.34699] [PMID]
157.Ravanbakhsh H, Karamzadeh V, Bao G, Mongeau L, Juncker D, Zhang YS. Emerging technologies in multi-material bioprinting. Advanced Materials. 2021; 33(49):e2104730.[DOI:10.1002/adma.202104730] [PMID]
158.Gopinathan J, Noh I. Recent trends in bioinks for 3D printing. Biomaterials Research. 2018; 22:11. [DOI:10.1186/s40824-018-0122-1] [PMID]
159.Benders KE, Van Weeren PR, Badylak SF, Saris DB, Dhert WJ, Malda J. Extracellular matrix scaffolds for cartilage and bone regeneration. Trends in Biotechnology. 2013; 31(3):169-76. [DOI:10.1016/j.tibtech.2012.12.004] [PMID]
160.Pountos I, Tellisi N, Ashammakhi N. Potential clinical applications of three-dimensional bioprinting. In: Guvendiren M, editor. 3D Bioprinting in Medicine: Technologies, Bioinks, and Applications. Berlin: Springer; 2019. [Link]
161.Hauptstein J, Böck T, Bartolf-Kopp M, Forster L, Stahlhut P, Nadernezhad A, et al. Hyaluronic acid-based bioink composition enabling 3D bioprinting and improving quality of deposited cartilaginous extracellular matrix. Advanced Healthcare Materials. 2020; 9(15):2000737. [PMID]
162.Nedunchezian S, Banerjee P, Lee CY, Lee SS, Lin CW, Wu CW, et al. Generating adipose stem cell-laden hyaluronic acid-based scaffolds using 3D bioprinting via the double crosslinked strategy for chondrogenesis. Materials Science & Engineering. C, Materials for Biological Applications. 2021; 124:112072. [PMID] [DOI:10.1016/j.msec.2021.112072]
163.Mouser VH, Abbadessa A, Levato R, Hennink WE, Vermonden T, Gawlitta D, et al. Development of a thermosensitive HAMA-containing bio-ink for the fabrication of composite cartilage repair constructs. Biofabrication. 2017; 9(1):015026. [DOI:10.1088/1758-5090/aa6265] [PMID]
164.Bücking TM, Hill ER, Robertson JL, Maneas E, Plumb AA, Nikitichev DI. From medical imaging data to 3D printed anatomical models. Plos One. 2017; 12(5):e0178540. [DOI:10.1371/journal.pone.0178540] [PMID]
165.Xu B, Yuan FZ, Lin L, Ye J, Fan BS, Zhang JY, et al. The higher inherent therapeutic potential of biomaterial-based hDPSCs and hEnSCs for pancreas diseases. Frontiers in Bioengineering and Biotechnology. 2020; 8:636. [PMID]
1.Chiesa-Estomba CM, Aiastui A, González-Fernández I, Hernáez-Moya R, Rodiño C, Delgado A, et al. Three-dimensional bioprinting scaffolding for nasal cartilage defects: A systematic review. Tissue Engineering and Regenerative Medicine. 2021; 18(3):343-53. [DOI:10.1007/s13770-021-00331-6] [PMID]
2.Lan X, Liang Y, Vyhlidal M, Erkut EJ, Kunze M, Mulet-Sierra A, et al. In vitro maturation and in vivo stability of bioprinted human nasal cartilage. Journal of Tissue Engineering. 2022; 13:20417314221086368. [DOI:10.1177/20417314221086368] [PMID]
3.Agarwal T, Chiesa I, Presutti D, Irawan V, Vajanthri KY, Costantini M, et al. Recent advances in bioprinting technologies for engineering different cartilage-based tissues. Materials Science and Engineering: C. 2021; 123:112005. [DOI:10.1016/j.msec.2021.112005] [PMID]
4.Ruiz-Cantu L, Gleadall A, Faris C, Segal J, Shakesheff K, Yang J. Multi-material 3D bioprinting of porous constructs for cartilage regeneration. Materials Science & Engineering. C, Materials for Biological Applications. 2020; 109:110578. [DOI:10.1016/j.msec.2019.110578] [PMID]
5.Wang H, Wang Z, Liu H, Liu J, Li R, Zhu X, et al. Three-dimensional printing strategies for irregularly shaped cartilage tissue engineering: Current state and challenges. Frontiers in Bioengineering and Biotechnology. 2022; 9:777039. [DOI:10.3389/fbioe.2021.777039] [PMID]
6.Shi B, Huang H. Computational technology for nasal cartilage-related clinical research and application. International Journal of Oral Science. 2020; 12(1):21. [DOI:10.1038/s41368-020-00089-y] [PMID]
7.Alkaya D, Gurcan C, Kilic P, Yilmazer A, Gurman G. Where is human-based cellular pharmaceutical R&D taking us in cartilage regeneration? 3 Biotech. 2020; 10(4):161. [DOI:10.1007/s13205-020-2134-5] [PMID]
8.Eshkalak SK, Ghomi ER, Dai Y, Choudhury D, Ramakrishna S. The role of three-dimensional printing in healthcare and medicine. Materials & Design. 2020; 194:108940. [DOI:10.1016/j.matdes.2020.108940]
9.Bigham A, Foroughi F, Rezvani Ghomi E, Rafienia M, Neisiany RE, Ramakrishna S. The journey of multifunctional bone scaffolds fabricated from traditional toward modern techniques. Bio-Design and Manufacturing. 2020; 3:281-306. [DOI:10.1007/s42242-020-00094-4]
10.Osborn LS. 3D printing and intellectual property. Cambridge: Cambridge University Press; 2019. [DOI:10.1017/9781316584507]
11.Jian H, Wang M, Wang S, Wang A, Bai S. 3D bioprinting for cell culture and tissue fabrication. Bio-Design and Manufacturing. 2018; 1:45-61.[DOI:10.1007/s42242-018-0006-1]
12.Xie Z, Gao M, Lobo AO, Webster TJ. 3D bioprinting in tissue engineering for medical applications: The classic and the hybrid. Polymers. 2020; 12(8):1717. [DOI:10.3390/polym12081717]
13.Ghasemian Fard M, Sharifianjazi F, Kazemi SS, Rostamani H, Bathaei MS. Laser-based additive manufacturing of magnesium alloys for bone tissue engineering applications: From chemistry to clinic. Journal of Manufacturing and Materials Processing. 2022; 6(6):158. [DOI:10.3390/jmmp6060158]
14.Stampoultzis T, Karami P, Pioletti DP. Thoughts on cartilage tissue engineering: A 21st century perspective. Current Research in Translational Medicine. 2021; 69(3):103299. [DOI:10.1016/j.retram.2021.103299] [PMID]
15.You S, Li J, Zhu W, Yu C, Mei D, Chen S. Nanoscale 3D printing of hydrogels for cellular tissue engineering. Journal of Materials Chemistry B. 2018; 6(15):2187-97. [DOI:10.1039/C8TB00301G] [PMID]
16.Thayer P, Martinez H, Gatenholm E. History and Trends of 3D Bioprinting. Methods in Molecular Biology. 2020; 2140:3-18.[DOI:10.1007/978-1-0716-0520-2_1] [PMID]
17.Ning L, Yang B, Mohabatpour F, Betancourt N, Sarker MD, Papagerakis P, et al. Process-induced cell damage: Pneumatic versus screw-driven bioprinting. Biofabrication. 2020; 12(2):025011. [DOI:10.1088/1758-5090/ab5f53] [PMID]
18.Fu Z, Naghieh S, Xu C, Wang C, Sun W, Chen X. Printability in extrusion bioprinting. Biofabrication. 2021; 13(3):033001. [DOI:10.1088/1758-5090/abe7ab] [PMID]
19.Schwab A, Levato R, D'Este M, Piluso S, Eglin D, Malda J. Printability and shape fidelity of bioinks in 3D bioprinting. Chemical Reviews. 2020; 120(19):11028-55. [DOI:10.1021/acs.chemrev.0c00084] [PMID]
20.Miri AK, Nieto D, Iglesias L, Goodarzi Hosseinabadi H, Maharjan S, Ruiz-Esparza GU, et al. Microfluidics-enabled multimaterial maskless stereolithographic bioprinting. Advanced Materials. 2018; 30(27):1800242. [DOI:10.1002/adma.201800242]
21.Gupta N, Cruz MA, Nasser P, Rosenberg JD, Iatridis JC. Fibrin-genipin hydrogel for cartilage tissue engineering in nasal reconstruction. Annals of Otology, Rhinology & Laryngology. 2019; 128(7):640-6. [DOI:10.1177/0003489419836667] [PMID]
22.Zhang S, Wang H. Current progress in 3D bioprinting of tissue analogs. SLAS Technology. 2019; 24(1):70-8. [DOI:10.1177/2472630318799971] [PMID]
23.Kasper C, Egger D, Lavrentieva A. Basic concepts on 3d cell culture. Berlin: Springer; 2021. [DOI:10.1007/978-3-030-66749-8]
24.Singh M, Jonnalagadda S. Advances in bioprinting using additive manufacturing. European Journal of Pharmaceutical Sciences. 2020; 143:105167. [DOI:10.1016/j.ejps.2019.105167] [PMID]
25.Highley CB, Song KH, Daly AC, Burdick JA. Jammed microgel inks for 3D printing applications. Advanced Science. 2018; 6(1):1801076. [DOI:10.1002/advs.201801076] [PMID]
26.Highley CB. 3D bioprinting technologies. In: Guvendiren M. 3D bioprinting in medicine: Technologies, bioinks, and applications. Berlin: Springer; 2019. [DOI:10.1007/978-3-030-23906-0_1]
27.Xing F, Xiang Z, Rommens PM, Ritz U. 3D bioprinting for vascularized tissue-engineered bone fabrication. Materials. 2020; 13(10):2278. [DOI:10.3390/ma13102278] [PMID]
28.Ramesh S, Harrysson OL, Rao PK, Tamayol A, Cormier DR, Zhang Y, et al. Extrusion bioprinting: Recent progress, challenges, and future opportunities. Bioprinting. 2021; 21:e00116. [DOI:10.1016/j.bprint.2020.e00116]
29.Chantre CO, Gonzalez GM, Ahn S, Cera L, Campbell PH, Hoerstrup SP, et al. Porous biomimetic hyaluronic acid and extracellular matrix protein nanofiber scaffolds for accelerated cutaneous tissue repair. ACS Applied Materials & Interfaces. 2019; 11(49):45498-510. [DOI:10.1021/acsami.9b17322] [PMID]
30.Choudhury D, Anand S, Naing MW. The arrival of commercial bioprinters - Towards 3D bioprinting revolution! International Journal of Bioprinting. 2018; 4(2):139. [DOI:10.18063/ijb.v4i2.139] [PMID]
31.Maniruzzaman M. 3D and 4D printing in biomedical applications: Process engineering and additive manufacturing. New Jersey: John Wiley & Sons; 2019. [DOI:10.1002/9783527813704]
32.Ravanbakhsh H, Bao G, Luo Z, Mongeau LG, Zhang YS. Composite inks for extrusion printing of biological and biomedical constructs. ACS Biomaterials Science & Engineering. 2021; 7(9):4009-26. [DOI:10.1021/acsbiomaterials.0c01158] [PMID]
33.Huang J, Xiong J, Wang D, Zhang J, Yang L, Sun S, et al. 3D bioprinting of hydrogels for cartilage tissue engineering. Gels. 2021; 7(3):144. [DOI:10.3390/gels7030144] [PMID]
34.Pedroza-González SC, Rodriguez-Salvador M, Pérez-Benítez BE, Alvarez MM, Santiago GT. Bioinks for 3D bioprinting: A scientometric analysis of two decades of progress. International Journal of Bioprinting. 2021; 7(2):333. [DOI:10.18063/ijb.v7i2.337] [PMID]
35.Cui H, Nowicki M, Fisher JP, Zhang LG. 3D bioprinting for organ regeneration. Advanced Healthcare Materials. 2017; 6(1):1601118. [DOI:10.1002/adhm.201601118] [PMID]
36.Liu W, Zhong Z, Hu N, Zhou Y, Maggio L, Miri AK, et al. Coaxial extrusion bioprinting of 3D microfibrous constructs with cell-favorable gelatin methacryloyl microenvironments. Biofabrication. 2018; 10(2):024102. [DOI:10.1088/1758-5090/aa9d44] [PMID]
37.Unagolla JM, Jayasuriya AC. Hydrogel-based 3D bioprinting: A comprehensive review on cell-laden hydrogels, bioink formulations, and future perspectives. Applied Materials Today. 2020; 18:100479. [DOI:10.1016/j.apmt.2019.100479] [PMID]
38.Lee JM, Sing SL, Zhou M, Yeong WY. 3D bioprinting processes: A perspective on classification and terminology. International Journal of Bioprinting. 2018; 4(2):151. [DOI:10.18063/ijb.v4i2.151] [PMID]
39.Jacob GT, Passamai VE, Katz S, Castro GR, Alvarez V. Hydrogels for extrusion-based bioprinting: General considerations. Bioprinting. 2022; 27:e00212. [DOI:10.1016/j.bprint.2022.e00212]
40.Mao H, Yang L, Zhu H, Wu L, Ji P, Yang J, et al. Recent advances and challenges in materials for 3D bioprinting. Progress in Natural Science: Materials International. 2020; 30(5):618-34. [DOI:10.1016/j.pnsc.2020.09.015]
41.Tetsuka H, Shin SR. Materials and technical innovations in 3D printing in biomedical applications. Journal of Materials Chemistry B. 2020; 8(15):2930-50. [DOI:10.1039/D0TB00034E] [PMID]
42.Kang D, Hong G, An S, Jang I, Yun WS, Shim JH, et al. Bioprinting of multiscaled hepatic lobules within a highly vascularized construct. Small. 2020; 16(13):1905505. [DOI:10.1002/smll.201905505]
43.Betancourt N, Chen X. Review of extrusion-based multi-material bioprinting processes. Bioprinting. 2022; 25:e00189.[DOI:10.1016/j.bprint.2021.e00189]
44.Jiang T, Munguia-Lopez JG, Flores-Torres S, Grant J, Vijayakumar S, Leon-Rodriguez AD, et al. Directing the self-assembly of tumour spheroids by bioprinting cellular heterogeneous models within alginate/gelatin hydrogels. Scientific Reports. 2017; 7(1):4575. [DOI:10.1038/s41598-017-04691-9] [PMID]
45.Zhou LY, Gao Q, Fu JZ, Chen QY, Zhu JP, Sun Y, et al. Multimaterial 3D printing of highly stretchable silicone elastomers. ACS Applied Materials & Interfaces. 2019; 11(26):23573-83. [DOI:10.1021/acsami.9b04873] [PMID]
46.Tan B, Gan S, Wang X, Liu W, Li X. Applications of 3D bioprinting in tissue engineering: Advantages, deficiencies, improvements, and future perspectives. Journal of Materials Chemistry B. 2021; 9(27):5385-413. [DOI:10.1039/D1TB00172H] [PMID]
47.Gao G, Yonezawa T, Hubbell K, Dai G, Cui X. Inkjet-bioprinted acrylated peptides and PEG hydrogel with human mesenchymal stem cells promote robust bone and cartilage formation with minimal printhead clogging. Biotechnology Journal. 2015; 10(10):1568-77. [DOI:10.1002/biot.201400635] [PMID]
48.Zhang Z, Jin Y, Yin J, Xu C, Xiong R, Christensen K, et al. Evaluation of bioink printability for bioprinting applications. Applied Physics Reviews. 2018; 5(4):041304. [DOI:10.1063/1.5053979]
49.Miri AK, Mirzaee I, Hassan S, Mesbah Oskui S, Nieto D, Khademhosseini A, et al. Effective bioprinting resolution in tissue model fabrication. Lab On A Chip. 2019; 19(11):2019-37. [DOI:10.1039/C8LC01037D] [PMID]
50.Shen Y, Tang H, Huang X, Hang R, Zhang X, Wang Y, et al. DLP printing photocurable chitosan to build bio-constructs for tissue engineering. Carbohydrate Polymers. 2020; 235:115970. [DOI:10.1016/j.carbpol.2020.115970] [PMID]
51.Lee JM, Ng WL, Yeong WY. Resolution and shape in bioprinting: Strategizing towards complex tissue and organ printing. Applied Physics Reviews. 2019; 6(1):011307. [DOI:10.1063/1.5053909]
52.Du X. 3D bio-printing review. Paper presented at: IOP Conference Series: Materials Science and Engineering. 15–17 December 2017, Xiamen, China. [Link]
53.Zhang B, Gao L, Ma L, Luo Y, Yang H, Cui Z. 3D bioprinting: A novel avenue for manufacturing tissues and organs. Engineering. 2019; 5(4):777-94. [DOI:10.1016/j.eng.2019.03.009]
54.Zhou D, Chen J, Liu B, Zhang X, Li X, Xu T. Bioinks for jet-based bioprinting. Bioprinting. 2019; 16:e00060. [DOI:10.1016/j.bprint.2019.e00060]
55.Kumar K, Zindani D, Davim JP. Rapid prototyping, rapid tooling and reverse engineering: From biological models to 3d bioprinters: Walter de Gruyter GmbH & Co KG; 2020. [DOI:10.1515/9783110664904]
56.Derakhshanfar S, Mbeleck R, Xu K, Zhang X, Zhong W, Xing M. 3D bioprinting for biomedical devices and tissue engineering: A review of recent trends and advances. Bioactive Materials. 2018; 3(2):144-56. [DOI:10.1016/j.bioactmat.2017.11.008] [PMID]
57.Zhang B, Luo Y, Ma L, Gao L, Li Y, Xue Q, et al. 3D bioprinting: An emerging technology full of opportunities and challenges. Bio-Design and Manufacturing. 2018; 1:2-13. [DOI:10.1007/s42242-018-0004-3]
58.Li H, Tan C, Li L. Review of 3D printable hydrogels and constructs. Materials & Design. 2018; 159:20-38. [DOI:10.1016/j.matdes.2018.08.023]
59.Khoeini R, Nosrati H, Akbarzadeh A, Eftekhari A, Kavetskyy T, Khalilov R, et al. Natural and synthetic bioinks for 3D bioprinting. Advanced NanoBiomed Research. 2021; 1(8):2000097. [DOI:10.1002/anbr.202000097]
60.Mondschein RJ, Kanitkar A, Williams CB, Verbridge SS, Long TE. Polymer structure-property requirements for stereolithographic 3D printing of soft tissue engineering scaffolds. Biomaterials. 2017; 140:170-88. [DOI:10.1016/j.biomaterials.2017.06.005] [PMID]
61.Ong LJY, Islam A, DasGupta R, Iyer NG, Leo HL, Toh YC. A 3D printed microfluidic perfusion device for multicellular spheroid cultures. Biofabrication. 2017; 9(4):045005. [DOI:10.1088/1758-5090/aa8858] [PMID]
62.Raman R, Bhaduri B, Mir M, Shkumatov A, Lee MK, Popescu G, et al. High-resolution projection microstereolithography for patterning of neovasculature. Advanced Healthcare Materials. 2016; 5(5):610-9. [DOI:10.1002/adhm.201500721] [PMID]
63.Magalhães LSSM, Santos FEP, Elias CMV, Afewerki S, Sousa GF, Furtado ASA, et al. Printing 3D hydrogel structures employing low-cost stereolithography technology. Journal of Functional Biomaterials. 2020; 11(1):12. [DOI:10.3390/jfb11010012] [PMID]
64.De S, Jose J, Pal A, Roy Choudhury S, Roy S. Exposure to low UV-B dose induces DNA double-strand breaks mediated onset of endoreduplication in Vigna radiata (L.) R. Wilczek seedlings. Plant and Cell Physiology. 2022; 63(4):463-83. [DOI:10.1093/pcp/pcac012] [PMID]
65.Kumar H, Kim K. Stereolithography 3D Bioprinting. Methods in molecular biology (Clifton, N.J.). 2020; 2140:93-108.[DOI:10.1007/978-1-0716-0520-2_6] [PMID]
66.Moura D, Pereira RF, Goncalves IC. Recent advances on bioprinting of hydrogels containing carbon materials. Materials Today Chemistry. 2022; 23:100617. [DOI:10.1016/j.mtchem.2021.100617]
67.Xiang Y, Miller K, Guan J, Kiratitanaporn W, Tang M, Chen S. 3D bioprinting of complex tissues in vitro: State-of-the-art and future perspectives. Archives of Toxicology. 2022; 96(3):691-710. [DOI:10.1007/s00204-021-03212-y] [PMID]
68.Zhu W, Qu X, Zhu J, Ma X, Patel S, Liu J, et al. Direct 3D bioprinting of prevascularized tissue constructs with complex microarchitecture. Biomaterials. 2017; 124:106-15. [DOI:10.1016/j.biomaterials.2017.01.042] [PMID]
69.Xia N, Jin D, Iacovacci V, Zhang L. 3D printing of functional polymers for miniature machines. Multifunctional Materials. 2022; 5(1):012001. [DOI:10.1088/2399-7532/ac4836]
70.Debnath SK, Debnath M, Srivastava R, Omri A. Intervention of 3D printing in health care: Transformation for sustainable development. Expert Opinion on Drug Delivery. 2021; 18(11):1659-72. [DOI:10.1080/17425247.2021.1981287] [PMID]
71.Leberfinger AN, Dinda S, Wu Y, Koduru SV, Ozbolat V, Ravnic DJ, et al. Bioprinting functional tissues. Acta Biomaterialia. 2019; 95:32-49. [DOI:10.1016/j.actbio.2019.01.009] [PMID]
72.Han D, Yang C, Fang NX, Lee H. Rapid multi-material 3D printing with projection micro-stereolithography using dynamic fluidic control. Additive Manufacturing. 2019; 27:606-15. [DOI:10.1016/j.addma.2019.03.031]
73.Kim YT, Castro K, Bhattacharjee N, Folch A. Digital manufacturing of selective porous barriers in microchannels using multi-material stereolithography. Micromachines. 2018; 9(3):125. [DOI:10.3390/mi9030125] [PMID]
74.McGivern S, Boutouil H, Al-Kharusi G, Little S, Dunne NJ, Levingstone TJ. Translational application of 3D bioprinting for cartilage tissue engineering. Bioengineering. 2021; 8(10):144. [DOI:10.3390/bioengineering8100144] [PMID]
75.Baddam P, Bayona-Rodriguez F, Campbell SM, El-Hakim H, Graf D. Properties of the nasal cartilage, from development to adulthood: A scoping review. Cartilage. 2022; 13(1):19476035221087696.[DOI:10.1177/19476035221087696] [PMID]
76.Murphy SV, De Coppi P, Atala A. Opportunities and challenges of translational 3D bioprinting. Nature Biomedical Engineering. 2020; 4(4):370-80. [DOI:10.1038/s41551-019-0471-7] [PMID]
77.Agarwal S, Saha S, Balla VK, Pal A, Barui A, Bodhak S. Current developments in 3D bioprinting for tissue and organ regeneration-A review. Frontiers in Mechanical Engineering. 2020; 6:589171. [DOI:10.3389/fmech.2020.589171]
78.Lavernia L, Brown WE, Wong BJ, Hu JC, Athanasiou KA. Toward tissue-engineering of nasal cartilages. Acta Biomaterialia. 2019; 88:42-56. [DOI:10.1016/j.actbio.2019.02.025] [PMID]
79.Sun Y, Zhao Z, An Y. Application of digital technology in nasal reconstruction. Chinese Journal of Plastic and Reconstructive Surgery. 2021; 3(4):204-8. [DOI:10.1016/j.cjprs.2021.12.001]
80.Wade DE. 3D Printing, Valuation, and Service Inputs: Looking to the future rather than the past to design rules of origin for advanced manufactured products. Brexit Institute Working Paper Series. 2024; No 02/2024. [Link]
81.Wang X, Zhao L, Fuh JYH, Lee HP. Effect of porosity on mechanical properties of 3D printed polymers: Experiments and micromechanical modeling based on X-ray computed tomography analysis. Polymers. 2019; 11(7):1154. [DOI:10.3390/polym11071154] [PMID]
82.Fay CD. Computer-Aided Design and Manufacturing (CAD/CAM) for Bioprinting. Methods in Molecular Biology. 2020; 2140:27-41. [DOI:10.1007/978-1-0716-0520-2_3] [PMID]
83.Visscher DO, Lee H, van Zuijlen PPM, Helder MN, Atala A, Yoo JJ, et al. A photo-crosslinkable cartilage-derived extracellular matrix bioink for auricular cartilage tissue engineering. Acta Biomaterialia. 2021; 121:193-203. [DOI:10.1016/j.actbio.2020.11.029] [PMID]
84.Chimene D, Lennox KK, Kaunas RR, Gaharwar AK. Advanced bioinks for 3D printing: A materials science perspective. Annals of Biomedical Engineering. 2016; 44(6):2090-102. [DOI:10.1007/s10439-016-1638-y] [PMID]
85.Bian L. Functional hydrogel bioink, a key challenge of 3D cellular bioprinting. APL Bioengineering. 2020; 4(3):030401.[DOI:10.1063/5.0018548] [PMID]
86.Sodupe-Ortega E, Sanz-Garcia A, Pernia-Espinoza A, Escobedo-Lucea C. Accurate calibration in multi-material 3D bioprinting for tissue engineering. Materials. 2018; 11(8):1402. [DOI:10.3390/ma11081402] [PMID]
87.GhavamiNejad A, Ashammakhi N, Wu XY, Khademhosseini A. Crosslinking strategies for 3D bioprinting of polymeric hydrogels. Small. 2020; 16(35):2002931. [DOI:10.1002/smll.202002931]
88.Ashammakhi N, Kaarela O. Three-dimensional bioprinting can help bone. Journal of Craniofacial Surgery. 2018; 29(1):9-11. [DOI:10.1097/SCS.0000000000004143] [PMID]
89.Li Y, Liu Y, Jiang C, Li S, Liang G, Hu Q. A reactor-like spinneret used in 3D printing alginate hollow fiber: a numerical study of morphological evolution. Soft Matter. 2016; 12(8):2392-9. [DOI:10.1039/C5SM02733K] [PMID]
90.Klotz BJ, Gawlitta D, Rosenberg AJWP, Malda J, Melchels FPW. Gelatin-methacryloyl hydrogels: Towards biofabrication-based tissue repair. Trends in Biotechnology. 2016; 34(5):394-407. [DOI:10.1016/j.tibtech.2016.01.002] [PMID]
91.Wang Z, Yang Y, Gao Y, Xu Z, Yang S, Jin M. Establishing a novel 3D printing bioinks system with recombinant human collagen. International Journal of Biological Macromolecules. 2022; 211:400-9. [DOI:10.1016/j.ijbiomac.2022.05.088] [PMID]
92.Oshida Y, Miyazaki T. Biomaterials and engineering for implantology: In Medicine and Dentistry. Walter de Gruyter GmbH & Co KG; 2022. [DOI:10.1515/9783110740134]
93.Persaud A, Maus A, Strait L, Zhu D. 3D bioprinting with live cells. Engineered Regeneration. 2022; 3(3):292-309. [DOI:10.1016/j.engreg.2022.07.002]
94.Hauptstein J, Böck T, Bartolf-Kopp M, Forster L, Stahlhut P, Nadernezhad A, et al. Hyaluronic acid-based bioink composition enabling 3D bioprinting and improving quality of deposited cartilaginous extracellular matrix. Advanced Healthcare Materials. 2020; 9(15):2000737. [DOI:10.1002/adhm.202000737] [PMID]
95.Abdollahiyan P, Oroojalian F, Mokhtarzadeh A, de la Guardia M. Hydrogel-based 3D bioprinting for bone and cartilage tissue engineering. Biotechnology Journal. 2020; 15(12):e2000095.[DOI:10.1002/biot.202000095] [PMID]
96.Wang K, Wang Z, Hu H, Gao C. Supramolecular microgels/microgel scaffolds for tissue repair and regeneration. Supramolecular Materials. 2022; 1:100006. [DOI:10.1016/j.supmat.2021.100006]
97.Piras CC, Fernández-Prieto S, De Borggraeve WM. Nanocellulosic materials as bioinks for 3D bioprinting. Biomaterials Science. 2017; 5(10):1988-92. [DOI:10.1039/C7BM00510E] [PMID]
98.Li D, Zhou J, Zhang M, Ma Y, Yang Y, Han X, et al. Long-term delivery of alendronate through an injectable tetra-PEG hydrogel to promote osteoporosis therapy. Biomaterials Science. 2020; 8(11):3138-46. [DOI:10.1039/D0BM00376J] [PMID]
99.Yu T, Wang H, Zhang Y, Wang X, Han B. The delivery of RNA-interference therapies based on engineered hydrogels for bone tissue regeneration. Frontiers in Bioengineering and Biotechnology. 2020; 8:445. [DOI:10.3389/fbioe.2020.00445] [PMID]
100.Nedunchezian S, Banerjee P, Lee CY, Lee SS, Lin CW, Wu CW, et al. Generating adipose stem cell-laden hyaluronic acid-based scaffolds using 3D bioprinting via the double crosslinked strategy for chondrogenesis. Materials Science and Engineering: C. 2021; 124:112072. [DOI:10.1016/j.msec.2021.112072] [PMID]
101.Lam T, Dehne T, Krüger JP, Hondke S, Endres M, Thomas A, et al. Photopolymerizable gelatin and hyaluronic acid for stereolithographic 3D bioprinting of tissue-engineered cartilage. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 2019; 107(8):2649-57. [DOI:10.1002/jbm.b.34354] [PMID]
102.Luo C, Xie R, Zhang J, Liu Y, Li Z, Zhang Y, et al. Low-temperature three-dimensional printing of tissue cartilage engineered with gelatin methacrylamide. Tissue Engineering Part C: Methods. 2020; 26(6):306-16. [DOI:10.1089/ten.tec.2020.0053] [PMID]
103.Yang X, Lu Z, Wu H, Li W, Zheng L, Zhao J. Collagen-alginate as bioink for three-dimensional (3D) cell printing based cartilage tissue engineering. Materials Science & Engineering. C, Materials for Biological Applications. 2018; 83:195-201. [DOI:10.1016/j.msec.2017.09.002] [PMID]
104.Jammalamadaka U, Tappa K. Recent advances in biomaterials for 3D printing and tissue engineering. Journal of Functional Biomaterials. 2018; 9(1):22. [DOI:10.3390/jfb9010022] [PMID]
105.Murphy C, Kolan K, Li W, Semon J, Day D, Leu M. 3D bioprinting of stem cells and polymer/bioactive glass composite scaffolds for bone tissue engineering. International Journal of Bioprinting. 2017; 3(1):005. [DOI:10.18063/IJB.2017.01.005] [PMID]
106.Fakhraei O, Alimohammadi M, Moradi A, Akbarinezhad Nogh A, Soudmand Salarabadi S, Ghasabzadeh MS, et al. Nanofibrous polycaprolactone/chitosan membranes for preventing postsurgical tendon adhesion. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 2022; 110(6):1279-91. [DOI:10.1002/jbm.b.34999] [PMID]
107.Alimohammadi M, Fakhraei O, Moradi A, Kabiri M, Passandideh-Fard M, Tamayol A, et al. Controlled release of azithromycin from polycaprolactone/chitosan nanofibrous membranes. Journal of Drug Delivery Science and Technology. 2022; 71:103246. [DOI:10.1016/j.jddst.2022.103246]
108.Mohan T, Maver T, Štiglic AD, Stana-Kleinschek K, Kargl R. 3D bioprinting of polysaccharides and their derivatives: From characterization to application. In: Thomas S, Balakrishnan P, Sreekala MS, editors. Fundamental biomaterials: polymers. A volume in Woodhead Publishing Series in Biomaterials. London: WP; 2018. [DOI:10.1016/B978-0-08-102194-1.00006-2]
109.Wei P, Xu Y, Gu Y, Yao Q, Li J, Wang L. IGF-1-releasing PLGA nanoparticles modified 3D printed PCL scaffolds for cartilage tissue engineering. Drug Delivery. 2020; 27(1):1106-14. [DOI:10.1080/10717544.2020.1797239] [PMID]
110.Morris VB, Nimbalkar S, Younesi M, McClellan P, Akkus O. Mechanical properties, cytocompatibility and manufacturability of chitosan: PEGDA hybrid-gel scaffolds by stereolithography. Annals of Biomedical Engineering. 2017; 45(1):286-96.[DOI:10.1007/s10439-016-1643-1] [PMID]
111.Kim JS, Hong S, Hwang C. Bio-ink materials for 3D bio-printing. Journal of International Society for Simulation Surgery. 2016; 3(2):49-59. [DOI:10.18204/JISSiS.2016.3.2.049]
112.Wang H, Xu S, Fan D, Geng X, Zhi G, Wu D, et al. Multifunctional microcapsules: A theranostic agent for US/MR/PAT multi-modality imaging and synergistic chemo-photothermal osteosarcoma therapy. Bioactive Materials. 2022; 7:453-65. [DOI:10.1016/j.bioactmat.2021.05.004] [PMID]
113.Bee SL, Hamid ZA, Mariatti M, Yahaya B, Lim K, Bee ST, et al. Approaches to improve therapeutic efficacy of biodegradable PLA/PLGA microspheres: A review. Polymer Reviews. 2018; 58(3):495-536. [DOI:10.1080/15583724.2018.1437547]
114.Li X, Liang Y, Xu X, Xiong J, Ouyang K, Duan L, et al. Cell-to-cell culture inhibits dedifferentiation of chondrocytes and induces differentiation of human umbilical cord-derived mesenchymal stem cells. BioMed Research International. 2019; 2019:5871698. [DOI:10.1155/2019/5871698] [PMID]
115.Colle J, Blondeel P, De Bruyne A, Bochar S, Tytgat L, Vercruysse C, et al. Bioprinting predifferentiated adipose-derived mesenchymal stem cell spheroids with methacrylated gelatin ink for adipose tissue engineering. Journal of Materials Science: Materials in Medicine. 2020; 31(4):36. [DOI:10.1007/s10856-020-06374-w] [PMID]
116.Ong CS, Yesantharao P, Huang CY, Mattson G, Boktor J, Fukunishi T, et al. 3D bioprinting using stem cells. Pediatric Research. 2018; 83(1-2):223-31. [DOI:10.1038/pr.2017.252] [PMID]
117.Ude CC, Miskon A, Idrus RBH, Abu Bakar MB. Application of stem cells in tissue engineering for defense medicine. Military Medical Research. 2018; 5(1):7. [DOI:10.1186/s40779-018-0154-9] [PMID]
118.Grounds MD. Obstacles and challenges for tissue engineering and regenerative medicine: Australian nuances. Clinical and Experimental Pharmacology and Physiology. 2018; 45(4):390-400. [DOI:10.1111/1440-1681.12899] [PMID]
119.Wragg NM, Burke L, Wilson SL. A critical review of current progress in 3D kidney biomanufacturing: Advances, challenges, and recommendations. Renal Replacement Therapy. 2019; 5:18. [DOI:10.1186/s41100-019-0218-7]
120.Setayeshmehr M, Esfandiari E, Hashemibeni B, Tavakoli AH, Rafienia M, Samadikuchaksaraei A, et al. Chondrogenesis of human adipose-derived mesenchymal stromal cells on the [devitalized costal cartilage matrix/poly (vinyl alcohol)/fibrin] hybrid scaffolds. European Polymer Journal. 2019; 118:528-41. [DOI:10.1016/j.eurpolymj.2019.04.044]
121.Beketov EE, Isaeva EV, Yakovleva ND, Demyashkin GA, Arguchinskaya NV, Kisel AA, et al. Bioprinting of cartilage with bioink based on high-concentration collagen and chondrocytes. International Journal of Molecular Sciences. 2021; 22(21):11351. [DOI:10.3390/ijms222111351] [PMID]
122.Caddeo S, Boffito M, Sartori S. Tissue engineering approaches in the design of healthy and pathological in vitro tissue models. Frontiers in Bioengineering and Biotechnology. 2017; 5:40. [DOI:10.3389/fbioe.2017.00040] [PMID]
123.Qu M, Jiang X, Zhou X, Wang C, Wu Q, Ren L, et al. Stimuli-responsive delivery of growth factors for tissue engineering. Advanced Healthcare Materials. 2020; 9(7):e1901714. [DOI:10.1002/adhm.201901714] [PMID]
124.Mei Q, Rao J, Bei HP, Liu Y, Zhao X. 3D bioprinting photo-crosslinkable hydrogels for bone and cartilage repair. International Journal of Bioprinting. 2021; 7(3):367. [DOI:10.18063/ijb.v7i3.367] [PMID]
125.Jain P, Kathuria H, Dubey N. Advances in 3D bioprinting of tissues/organs for regenerative medicine and in-vitro models. Biomaterials. 2022; 287:121639. [DOI:10.1016/j.biomaterials.2022.121639] [PMID]
126.Augustine R. Skin bioprinting: A novel approach for creating artificial skin from synthetic and natural building blocks. Progress in Biomaterials. 2018; 7(2):77-92. [DOI:10.1007/s40204-018-0087-0] [PMID]
127.Rosser J, Thomas DJ. Bioreactor processes for maturation of 3D bioprinted tissue. In: Thomas DJ, Jessop ZM, Whitaker IS, editors. 3D Bioprinting for reconstructive surgery: Techniques and applications. London: WP; 2018. [DOI:10.1016/B978-0-08-101103-4.00010-7]
128.König I, Soranno A, Nettels D, Schuler B. Impact of in-cell and in-vitro crowding on the conformations and dynamics of an intrinsically disordered protein. Angewandte Chemie. 2021; 133(19):10819-24. [DOI:10.1002/ange.202016804]
129.Mousavi Nejad Z, Torabinejad B, Davachi SM, Zamanian A, Saeedi Garakani S, Najafi F, et al. Synthesis, physicochemical, rheological and in-vitro characterization of double-crosslinked hyaluronic acid hydrogels containing dexamethasone and PLGA/dexamethasone nanoparticles as hybrid systems for specific medical applications. International Journal of Biological Macromolecules. 2019; 126:193-208. [DOI:10.1016/j.ijbiomac.2018.12.181] [PMID]
130.Cao Y, Cheng P, Sang S, Xiang C, An Y, Wei X, et al. Mesenchymal stem cells loaded on 3D-printed gradient poly (ε-caprolactone)/methacrylated alginate composite scaffolds for cartilage tissue engineering. Regenerative Biomaterials. 2021; 8(3):rbab019. [DOI:10.1093/rb/rbab019] [PMID]
131.Rathan S, Dejob L, Schipani R, Haffner B, Möbius ME, Kelly DJ. Fiber reinforced cartilage ECM functionalized bioinks for functional cartilage tissue engineering. Advanced Healthcare Materials. 2019; 8(7):1801501. [DOI:10.1002/adhm.201801501] [PMID]
132.Zhang J, Hu Q, Wang S, Tao J, Gou M. Digital light processing based three-dimensional printing for medical applications. International Journal of Bioprinting. 2019; 6(1):242. [DOI:10.18063/ijb.v6i1.242] [PMID]
133.Kosik-Kozioł A, Costantini M, Bolek T, Szöke K, Barbetta A, Brinchmann J, et al. PLA short sub-micron fiber reinforcement of 3D bioprinted alginate constructs for cartilage regeneration. Biofabrication. 2017; 9(4):044105. [DOI:10.1088/1758-5090/aa90d7] [PMID]
134.Apelgren P, Amoroso M, Lindahl A, Brantsing C, Rotter N, Gatenholm P, et al. Chondrocytes and stem cells in 3D-bioprinted structures create human cartilage in vivo. PLoS One. 2017; 12(12):e0189428. [DOI:10.1371/journal.pone.0189428] [PMID]
135.An S, Choi S, Min S, Cho SW. Hyaluronic acid-based biomimetic hydrogels for tissue engineering and medical applications. Biotechnology and Bioprocess Engineering. 2021; 26(4):503-16. [DOI:10.1007/s12257-020-0343-8]
136.McMillan A, McMillan N, Gupta N, Kanotra SP, Salem AK. 3D bioprinting in otolaryngology: A review. Advanced Healthcare Materials. 2023; 12(19):e2203268. [DOI:10.1002/adhm.202203268] [PMID]
137.Zopf DA, Mitsak AG, Flanagan CL, Wheeler M, Green GE, Hollister SJ. Computer aided-designed, 3-dimensionally printed porous tissue bioscaffolds for craniofacial soft tissue reconstruction. Otolaryngology--Head and Neck Surgery. 2015; 152(1):57-62. [DOI:10.1177/0194599814552065] [PMID]
138.Skopinska-Wisniewska J, Tuszynska M, Olewnik-Kruszkowska E. Comparative study of gelatin hydrogels modified by various cross-linking agents. Materials. 2021; 14(2):396. [DOI:10.3390/ma14020396] [PMID]
139.Huang J, Huang Z, Liang Y, Yuan W, Bian L, Duan L, et al. 3D printed gelatin/hydroxyapatite scaffolds for stem cell chondrogenic differentiation and articular cartilage repair. Biomaterials Science. 2021; 9(7):2620-30. [DOI:10.1039/D0BM02103B] [PMID]
140.Mushtaq F, Raza ZA, Batool SR, Zahid M, Onder OC, Rafique A, et al. Preparation, properties, and applications of gelatin-based hydrogels (GHs) in the environmental, technological, and biomedical sectors. International Journal of Biological Macromolecules. 2022; 218:601-33. [DOI:10.1016/j.ijbiomac.2022.07.168][PMID]
141.Rajabi N, Rezaei A, Kharaziha M, Bakhsheshi-Rad HR, Luo H, RamaKrishna S, et al. Recent advances on bioprinted gelatin methacrylate-based hydrogels for tissue repair. Tissue Engineering Part A. 2021; 27(11-12):679-702. [DOI:10.1089/ten.tea.2020.0350] [PMID]
142.Gao Q, He Y, Fu JZ, Liu A, Ma L. Coaxial nozzle-assisted 3D bioprinting with built-in microchannels for nutrients delivery. Biomaterials. 2015; 61:203-15. [DOI:10.1016/j.biomaterials.2015.05.031] [PMID]
143.Camacho P, Busari H, Seims KB, Tolbert JW, Chow LW. Materials as bioinks and bioink design. In: Guvendiren M, editor. 3D bioprinting in medicine. Cham: Springer; 2019. [DOI:10.1007/978-3-030-23906-0_2]
144.Khalilifar MA, Eslaminejad MB, Ghasemzadeh M, Hosseini S, Baharvand H. In vitro and in vivo comparison of different types of rabbit mesenchymal stem cells for cartilage repair. Cell Journal. 2019; 21(2):150-60. [PMID]
145.Zainal S, Mohd NH, Suhaili N, Anuar FH, Lazim AM, Othaman R. Preparation of cellulose-based hydrogel: A review. Journal of Materials Research and Technology. 2021; 10:935-52. [DOI:10.1016/j.jmrt.2020.12.012]
146.Yin N, Chen SY, Cao YM, Wang HP, Wu QK. Improvement in mechanical properties and biocompatibility of biosynthetic bacterial cellulose/lotus root starch composites. Chinese Journal of Polymer Science. 2017; 35(3):354-64. [DOI:10.1007/s10118-017-1903-z]
147.Pan T, Song W, Cao X, Wang Y. 3D bioplotting of gelatin/alginate scaffolds for tissue engineering: Influence of crosslinking degree and pore architecture on physicochemical properties. Journal of Materials Science & Technology. 2016; 32(9):889-900. [DOI:10.1016/j.jmst.2016.01.007]
148.Spiller KL, Maher SA, Lowman AM. Hydrogels for the repair of articular cartilage defects. Tissue Engineering Part B: Reviews. 2011; 17(4):281-99. [DOI:10.1089/ten.teb.2011.0077] [PMID]
149.Shariatinia Z, Jalali AM. Chitosan-based hydrogels: Preparation, properties and applications. International Journal of Biological Macromolecules. 2018; 115:194-220. [DOI:10.1016/j.ijbiomac.2018.04.034] [PMID]
150.Selmi TA, Verdonk P, Chambat P, Dubrana F, Potel JF, Barnouin L, et al. Autologous chondrocyte implantation in a novel alginate-agarose hydrogel: outcome at two years. The Journal of Bone & Joint Surgery British Volume. 2008; 90(5):597-604. [DOI:10.1302/0301-620X.90B5.20360] [PMID]
151.Do NH, Truong QT, Le PK, Ha AC. Recent developments in chitosan hydrogels carrying natural bioactive compounds. Carbohydrate Polymers. 2022; 294:119726. [DOI:10.1016/j.carbpol.2022.119726] [PMID]
152.Alimohammadi M, Aghli Y, Fakhraei O, Moradi A, Passandideh-Fard M, Ebrahimzadeh MH, et al. Electrospun nanofibrous membranes for preventing tendon adhesion. ACS Biomaterials Science & Engineering. 2020; 6(8):4356-76. [DOI:10.1021/acsbiomaterials.0c00201] [PMID]
153.Chakraborty J, Mu X, Pramanick A, Kaplan DL, Ghosh S. Recent advances in bioprinting using silk protein-based bioinks. Biomaterials. 2022; 287:121672. [DOI:10.1016/j.biomaterials.2022.121672] [PMID]
154.Taghizadeh M, Taghizadeh A, Yazdi M, Zarrintaj P, Stadler FJ, Ramsey JD, et al. Chitosan-based inks for 3D printing and bioprinting. Green Chemistry. 2022; 24(1):62-101. [DOI:10.1039/D1GC01799C]
155.Tan XH, Liu L, Mitryashkin A, Wang Y, Goh JCH. Silk Fibroin as a Bioink-A thematic review of functionalization strategies for bioprinting applications. ACS Biomaterials Science & Engineering. 2022; 8(8):3242-70. [DOI:10.1021/acsbiomaterials.2c00313] [PMID]
156.Gupta S, Alrabaiah H, Christophe M, Rahimi-Gorji M, Nadeem S, Bit A. Evaluation of silk-based bioink during pre and post 3D bioprinting: a review. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 2021; 109(2):279-93. [DOI:10.1002/jbm.b.34699] [PMID]
157.Ravanbakhsh H, Karamzadeh V, Bao G, Mongeau L, Juncker D, Zhang YS. Emerging technologies in multi-material bioprinting. Advanced Materials. 2021; 33(49):e2104730.[DOI:10.1002/adma.202104730] [PMID]
158.Gopinathan J, Noh I. Recent trends in bioinks for 3D printing. Biomaterials Research. 2018; 22:11. [DOI:10.1186/s40824-018-0122-1] [PMID]
159.Benders KE, Van Weeren PR, Badylak SF, Saris DB, Dhert WJ, Malda J. Extracellular matrix scaffolds for cartilage and bone regeneration. Trends in Biotechnology. 2013; 31(3):169-76. [DOI:10.1016/j.tibtech.2012.12.004] [PMID]
160.Pountos I, Tellisi N, Ashammakhi N. Potential clinical applications of three-dimensional bioprinting. In: Guvendiren M, editor. 3D Bioprinting in Medicine: Technologies, Bioinks, and Applications. Berlin: Springer; 2019. [Link]
161.Hauptstein J, Böck T, Bartolf-Kopp M, Forster L, Stahlhut P, Nadernezhad A, et al. Hyaluronic acid-based bioink composition enabling 3D bioprinting and improving quality of deposited cartilaginous extracellular matrix. Advanced Healthcare Materials. 2020; 9(15):2000737. [PMID]
162.Nedunchezian S, Banerjee P, Lee CY, Lee SS, Lin CW, Wu CW, et al. Generating adipose stem cell-laden hyaluronic acid-based scaffolds using 3D bioprinting via the double crosslinked strategy for chondrogenesis. Materials Science & Engineering. C, Materials for Biological Applications. 2021; 124:112072. [PMID] [DOI:10.1016/j.msec.2021.112072]
163.Mouser VH, Abbadessa A, Levato R, Hennink WE, Vermonden T, Gawlitta D, et al. Development of a thermosensitive HAMA-containing bio-ink for the fabrication of composite cartilage repair constructs. Biofabrication. 2017; 9(1):015026. [DOI:10.1088/1758-5090/aa6265] [PMID]
164.Bücking TM, Hill ER, Robertson JL, Maneas E, Plumb AA, Nikitichev DI. From medical imaging data to 3D printed anatomical models. Plos One. 2017; 12(5):e0178540. [DOI:10.1371/journal.pone.0178540] [PMID]
165.Xu B, Yuan FZ, Lin L, Ye J, Fan BS, Zhang JY, et al. The higher inherent therapeutic potential of biomaterial-based hDPSCs and hEnSCs for pancreas diseases. Frontiers in Bioengineering and Biotechnology. 2020; 8:636. [PMID]
مقاله مروری: مقاله مروری |
موضوع مقاله:
عمومى
دریافت: 1401/10/1 | پذیرش: 1402/8/8 | انتشار: 1403/4/11
دریافت: 1401/10/1 | پذیرش: 1402/8/8 | انتشار: 1403/4/11
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |