دوره 33، شماره 3 - ( 7-1403 )
جلد 33 شماره 3 صفحات 325-310 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Aghagolzadeh M, Moazedi A, Najafzadehvarzi H, Parsian H. Effects of Rotenone and Resveratrol on Apoptosis and Oxidative Stress in Ovariectomized Rats. JGUMS 2024; 33 (3) :310-325
URL: http://journal.gums.ac.ir/article-1-2614-fa.html
URL: http://journal.gums.ac.ir/article-1-2614-fa.html
آقاگل زاده محبوبه، معاضدی احمد علی، نجف زاده ورزی حسین، پارسیان هادی. اثر روتنون و رسوراترول بر آپوپتوز و استرس اکسیداتیو در رتهای اوارکتومیشده. مجله علوم پزشکی گیلان. 1403; 33 (3) :310-325
1- گروه زیستشناسی، دانشکده علوم، دانشگاه شهید چمران اهواز، اهواز، ایران.
2- گروه فارماکولوژی پزشکی، دانشکده پزشکی، دانشگاه علوم پزشکی بابل، بابل، ایران.
3- گروه بیوشیمی بالینی، دانشکده پزشکی، دانشگاه علوم پزشکی بابل، بابل، ایران.
2- گروه فارماکولوژی پزشکی، دانشکده پزشکی، دانشگاه علوم پزشکی بابل، بابل، ایران.
3- گروه بیوشیمی بالینی، دانشکده پزشکی، دانشگاه علوم پزشکی بابل، بابل، ایران.
متن کامل [PDF 6243 kb]
(416 دریافت)
| چکیده (HTML) (1609 مشاهده)
متن کامل: (564 مشاهده)
مقدمه
بیماریهای تحلیلبرنده عصبی نمایانگر مجموعهای از اختلالات ناهمگن است که میلیونها نفر را در سراسر جهان تحت تأثیر قرار میدهد. این بیماریها با از دست دادن پیشرونده و برگشتناپذیر عملکرد و یا مرگ نورونها در مناطق خاص مغز مشخص میشوند که به افت شدید شناختی و عملکردی منجر میشوند. شناختهشدهترین بیماریهای تخریبکننده عصبی عبارتاند از بیماریهای آلزایمر، پارکینسون، هانتینگتون و اسکلروز جانبی آمیوتروفیک که استرس اکسیداتیو و آپوپتوز از اصلیترین مکانیسمهای سلولی و مولکولی مشترک دخیل در این اختلالات عصبی میباشند [1-3]. علت دقیق شیوع و سیر افزایشی بیماریها بهطور واضح مشخص نیست، اما شواهد نشان دادند که یکی از دلایل تشدید و افزایش احتمال ابتلا به بیماریهای عصبی نوروتوکسینهای محیطی میباشند که در جوامع امروزی بهصورت کنترل نشده و بیرویه سلامت موجودات زنده را بهصورت مستقیم و یا غیرمستقیم تهدید میکنند و ریسک ابتلا به بیماریها را افزایش میدهند [4].
آفتکشها، نوروتوکسینهای محیطی هستند که قرار گرفتن در معرض آنها به افزایش خطر ابتلا به بیماریهای تحلیلبرنده عصبی منجر میشود [5، 6]. نوروتوکسین محیطی روتنون، حشرهکش و آفتکش طبیعی است که از گیاهان تیره لگومینوز استخراج میشود، بهعلت ویژگی لیپوفیلیک بالا بهراحتی و بدون نیاز به حاملها از تمام غشاهای بیولوژیک، ازجمله میتوکندری و سد خونی-مغزی عبور میکند [7-9]. مکانیسم اصلی سمیت عصبی القاشده توسط روتنون، مهار کمپلکسI زنجیره انتقال الکترون میتوکندری است. استرس اکسیداتیو، آپوپتوز و مهار اتوفاژی از نتایج کلیدی مهار کمپلکسI زنجیره انتقال الکترون میباشند. روتنون با مهار انتقال الکترونها از مراکز آهن ـ گوگرد در کمپلکسI به یوبیکوئینون در زنجیره انتقال الکترون به مهار فسفوریلاسیون اکسیداتیو و کاهش سطح آدنوزینتری فسفات (ATP) و بهطور همزمان افزایش تولید گونههای اکسیژن واکنشپذیر و درنتیجه استرس اکسیداتیو منجر میشود. افزایش گونههای اکسیژن واکنشپذیر و آسیب اکسیداتیو DNA ، لیپیدها و پروتئینها در تخریب سلولهای عصبی نقش دارند [10].
یارمحمدی و همکاران نشان دادند روتنون بهواسطه القای مسیر سیگنالینگJNK ،p38 MAPK و درنتیجه افزایش پروتئینهای پروآپوپتوز BAX و BAD به رهایی سیتوکروم C و فعالسازی کاسپازهای آغازگر و افکتور و نهایتاً القای آپوپتوز منجر میشود. ازطرفی روتنون بهواسطه سرکوب مسیر سیگنالینگ Akt/PI3K به تشدید آپوپتوز منجر میشود [11]. کاووری و همکاران نشان دادند تزریق درون صفاقی روتنون به تغییرات پارامترهای آنتی اکسیدانی و اکسیداتیو منجر شده است [12]. بنابراین بهخوبی مشخص شده است که رادیکالهای آزاد با تحریک استرس اکسیداتیو، آسیبهای عصبی را تشدید میکنند؛ ازاینرو نقش عمدهای در بیماریهای تحلیلبرنده عصبی ایفا میکنند. بنابراین میتوان تنظیم و تعدیل رادیکالهای آزاد بهواسطه تقویت آنتیاکسیدانهای درونزا و همچنین تنظیم بیان پروتئینهای آپوپتوزی را بهعنوان اهداف بالقوه عمل دارویی در مدیریت بیماریهای تحلیلبرنده عصبی به کار گرفت. سوپراکسید دیسموتاز آنزیمی است که نقش مهمی در محافظت از سلولها در برابر استرس اکسیداتیو ایفا میکند. در مغز سوپراکسید دیسموتاز، بهدلیل فعالیت متابولیک بالا و مصرف اکسیژن بالای نورونها که آنها را در برابر آسیب اکسیداتیو آسیبپذیرتر میکند، اهمیت ویژهای دارد. این آنزیم آنتیاکسیدانی با تبدیل رادیکالهای سوپراکسید به پراکسید هیدروژن و اکسیژن در محافظت از سلولها در برابر استرس اکسیداتیو نقش دارد [13].
مطالعات نشان دادهاند کاهش سطح یا فعالیت سوپراکسید دیسموتاز در مغز با افزایش استرس اکسیداتیو و تخریب عصبی مرتبط است. همانطور که در بیماری آلزایمر مشاهده شد، سطح این آنزیم در مناطق آسیبدیده مغز کاهش یافته است [14]. بهطور مشابه یان و همکاران در مطالعه مروری خود نقش سوپراکسید دیسموتاز را در شرایط مختلف پاتولوژیک در مطالعات انسانی و حیوانی متعددی بررسی کردهاند و اثرات مضر کاهش سطح و فعالیت سوپراکسید دیسموتاز در تشدید آسیبهای اکسیداتیو تحت شرایط بیماریهای مختلف را نشان دادند [15].
17بتا-استرادیول (E2، استروژن) هورمون استروئیدی است که بهعنوان محافظتکننده عصبی در برابر انواع بیماریهای تحلیلبرنده عصبی، ازجمله پارکینسون و آلزایمر نقش دارد [16-19]. استروژن بهدلیل وزن مولکولی پایین و خاصیت لیپوفیلی از سد خونی-مغزی عبور میکند و بهراحتی خود را به بافت عصبی میرساند [20]. وون و همکاران نشان دادند استروژن بیان پروتئینهای ضدآپوپتوز مانند Bcl-xL و Bcl2 را برای جلوگیری از تشکیل منافذ نفوذپذیر افزایش میدهد و با جلوگیری از انتقال پروتئینهای پروآپوپتوز مانند Bcl-xL و Bcl-2از سیتوزول به غشای میتوکندری مانع از رهایی سیتوکروم C القاشده توسط اختلالات عصبی میشود [21]. همچنین در مطالعه دیگر نشان دادند که استروژن از طریق فعالسازی مسیر Nrf2-ARE آنتیاکسیدانهای درونزا را تنظیم میکند [22]. شواهد نشان میدهد درمان طولانیمدت با استروژن در بسیاری از بیماریهای تحلیلبرنده عصبی، علاوهبر فواید خود با عوارض جانبی همراه است [23، 24].
مطالعات نشان دادهاند رژیم غذایی حاوی آنتیاکسیدان طبیعی بهدلیل خواص مهار رادیکال آزاد یا اکسیژن فعال بهطور بالقوه از آسیب اکسیداتیو و زوال شناختی جلوگیری میکند [25-28]. رسوراترول (3، 4، 5 تریهیدروکسی- ترانس استیل بن، استیل بنوئید) ترکیب پلیفنولی متعلق به گروه فیتوالکسین به نام استیلین است. رسوراترول در بسیاری از گونههای گیاهی شامل توت، زغال اخته، تمشک، بادام زمینی و بهخصوص پوست و هسته انگور قرمز وجود دارد [29-32]. رسوراترول دارای اثرات بیولوژیک متعدد است و در مدلهای آزمایشگاهی بیماری صرع، آلزایمر، پارکینسون و اسکلروز جانبی آمیوتروفیک اثرات مفیدی نشان داد [33-38]. رسوراترول در از بین بردن انواع اکسیدانها مانند آنیون سوپراکسید، پراکسید هیدروژن، رادیکال هیدروکسیل، اکسید نیتروژن و پراکسینیتریت بسیار مؤثر است. خواص آنتیاکسیدانی رسوراترول به وجود حلقههای فنلی با سه گروه هیدروکسیل در موقعیتهای3، 4 و 5 و پیوند دوگانه کونژوگه و همچنین پتانسیل جداسازی الکترون در ساختار مولکول مرتبط است. درواقع رسوراترول با تعدیل بیان SIRT1 و درنتیجه پروتئینهای غیرهیستونی مانند p53 ،NF-kB و PGC-1α نقش قابلتوجهی در دفاع آنتیاکسیدانی، ضدالتهابی و ضدآپوپتوتیک در برابر استرس اکسیداتیو ایفا میکند.
تروونگ و همکاران نشان دادند رسوراترول از طریق سرکوب فعالسازی IKKa و فسفوریلاسیون، تخریب IkBa و همچنین از طریق مهار فعالیتهای COX-2 و دکربوکسیلاز اورنیتین به مهار استرس اکسیداتیو و آپوپتوز منجر شده و درنتیجه از سلولها و بافتها محافظت میکند [39]. همچنین وانگ و همکاران نشان دادند رسوراترول از طریق فعالسازی مسیر سیگنالینگ SIRT1/Akt باعث سرکوب سمیت عصبی القاشده توسط روتنون شد [40].
بنابراین باتوجهبه افزایش فزاینده بیماریهای تحلیلبرنده عصبی و اختلالات تخریبکننده عصبی مرتبط با بسیاری از نوروتوکسینهای محیطی همانند روتنون و درک مسیرهای مختلف التهابی، آپوپتوزی و استرس اکسیداتیو در عملکرد روتنون و ازطرفی تعامل مسیرهای محافظتی ازجمله نقش محافظتی استروژن در این مسیرها و نقش تعدیلکننده رسوراترول بهعنوان پلیفنول شناختهشده با خواص ضدآپوپتوزی، ضدالتهابی و آنتیاکسیدانی در مطالعه حاضر، این فرایند با بهکارگیری حذف استروژن (برداشت تخمدان موشهای صحرایی) و تجویز روتنون بهعنوان سم کشاورزی در معرض مصرفکنندگان مواد غذایی و کشاورزان ارزیابی شد. ازنظر مولکولی بررسی تغییر بیان ژنهای Bcl2، Bax و فاکتور آنتیاکسیدانی سوپر اکسید دیسموتاز در هیپوکامپ موشها از اهداف مطالعه حاضر بود.
روشها
حیوانات
در این تحقیق از 30 سر موش صحرایی ماده نژاد ویستار از مرکز آزمایشگاهی حیوانات دانشگاه علوم پزشکی بابل به وزن تقریبی 20±170 گرم استفاده شد. حیوانات در شرایط استاندارد (12ساعت روشنایی و 12ساعت تاریکی، دسترسی آسان به آب و غذا و دمای اتاق 20-25 درجه سانتیگراد) نگهداری شدند. کلیه مراحل مطابق با دستور کمیته اخلاقی آزمایشهای حیوانی دانشگاه شهید چمران اهواز انجام شد.
گروهبندی
موشها بهطور تصادفی به 5 گروه و هر گروه شامل6 سر موش تقسیم شدند: گروه روتنون تزریق داخل صفاقی 5 میلیگرم بر کیلوگرم روتنون (سیگما آلدریچ)، گروه اوارکتومی (دوطرفه)،گروه اوارکتومی+رسوراترول، گروه اوارکتومی+روتنون، گروه اوارکتومی+ روتنون+رسوراترول، داروها روزانه بهمدت 3 هفته تجویز شدند. رسوراترول به مقدار 40 میلیگرم بر کیلوگرم گاواژ شد. در پایان موشها با تزریق داخل صفاقی کتامین80 میلیگرم بر کیلوگرم و زایلازین 5 میلیگرم بر کیلوگرم (آلفاسان هلند) بیهوش شدند. نمونههای بافت هیپوکامپ جدا شدند (تصویر شماره 1).

جراحی اوارکتومی
موشها با استفاده از تزریق داخل صفاقی مخلوط کتامین80 میلیگرم بر کیلوگرم و زایلازین 5 میلیگرم بر کیوگرم بیهوش شدند و توسط برش کوچکی در ناحیه میانی تحتانی شکم، تخمدانها خارج و انتهای لولههای فالوپ با استفاده از نخ بخیه بهطور کامل بسته شد. پس از بخیه فاشیا، عضلات و پوست، دوره ریکاوری بهمدت 10 روز سپری شد [41].
تزریق دارو
تزریق داروها 10 روز (دوره ریکاوری) بعد از انجام اوارکتومی انجام شد. روتنون با مقدار 5 میلیگرم بر کیلوگرم [42، 43] روزانه و بهمدت 21 روز بهصورت درون صفاقی تزریق شدند. رسوراترول بهصورت خوراکی بهمدت 21 روز، ساعت 8 تا 10 صبح با مقدار 40 میلیگرم بر کیلوگرم گاواژ شد [44].
جداسازی بافت هیپوکامپ
بهمنظور سنجش شاخصهای استرس اکسیداتیو و آپوپتوزی در بافت هیپوکامپ، موشها سربریده شدند و ناحیه هیپوکامپ مغز در دمای 80- درجه سانتیگراد تا زمان آزمایش نگهداری شد. به منظور سنجش شاخصهای آپوپتوزی به میکروتیوپ حاوی هیپوکامپ به میزان 200 میکرولیتر محلول RNAlater اضافه شد و بهمدت 48 ساعت در یخچال معمولی نگهداری شد. سپس با کمک سانتریفیوژ با دور 3500 بهمدت 10 دقیقه RNAlater از بافت هیپوکامپ جدا شد.
هموژن هیپوکامپ
جهت هموژن کردن بافت مغز با استفاده از ترازو بافت هیپوکامپ وزن شد و به میزان 3 برابر وزن نمونه به آن بافرفسفات سالین اضافه شد. سپس با استفاده از دستگاه هموژنایزر با دور 120 بهمدت 20 ثانیه بافتها هموژن شدند و با استفاده از دستگاه سانترفیوژ یخچالدار بهمدت 15 دقیقه در دمای 4 درجه سانتیگراد با دور 13000 مایع رویی جدا شد و تا زمان انجام آزمایش در یخچال 80- درجه سانتیگراد نگهداری شد.
اندازهگیری مقدار مالوندیآلدهید
جهت اندازهگیری مقدار مالوندیآلدهید در بافت هیپوکامپ از کیت سنجش مالوندیآلدهید شرکت طب پژوهان رازی استفاده شد. بهطور خلاصه در این روش مالوندیآلدهید موجود در نمونهها با اسید تیوباربیتوریک واکنش داده و به تولید ترکیب مالون دی آلدئید-تیوباربیتوریک اسید منجر میشود که به سادگی با روش رنگسنجی (530-540 نانومتر) اندازهگیری شد.
فعالیت آنزیم سوپراکسید دیسموتاز
سنجش میزان فعالیت آنزیم سوپراکسید دیسموتاز در بافت هیپوکمپ براساس درصد بازدارندگی این آنزیم در برابر اتواکسیداسیون پیروگالول برای هر نمونهها در مقایسه با نمونه بلانک محاسبه شد. تغییرات جذب در طول موج 40 نانومتر طی 3 دقیقه ثبت شد. بهطور خلاصه در این روش میزان بازدارندگی با اضافه کردن بافرسنجش به 760 میکرولیتر از سوپرناتانت بافت هیپوکامپ انجام شد.
روش تهیه بافرسنجش
به 50 سیسی از بافر سدیم فسفات (۵۰ میلیمولار) تهیه شده، 0/0018 گرم اتیلن دیآمین تترا استیک اسید (0/1 میلیمولار )و 0/003 گرم پیروگالول (0/48 میلیمولار) اضافه شد [45].
سنجش غلظت پروتئین
سنجش پروتئین در بافت هیپوکمپ براساس دستورالعمل یادشده در کیت سنجش پروتئین به روش برادفورد که از شرکت طب پژوهان رازی خریداری شده بود انجام شد. در این روش از تغییر رنگ کوماسی هنگام اتصال به پروتئین در محیط اسیدی استفاده میشود. بهطور خلاصه اندازهگیری پروتئین بدین روش انجام شد: ابتدا 10 میکرولیتر نمونه/استاندارد آلبومین سرم گاوی (بوین سرم آلبومین) به چاهک اضافه شد. سپس 190 میکرولیتر معرف تترا برومو فنول آبی به همه چاهکها اضافه شد و بهمدت 5 دقیقه در دمای اتاق انکوبه شود. درنهایت، بلافاصله جذب در طول موج 595 نانومتر خوانده شد.
اندازهگیری شاخصهای آپوپتوز
طراحی پرایمر
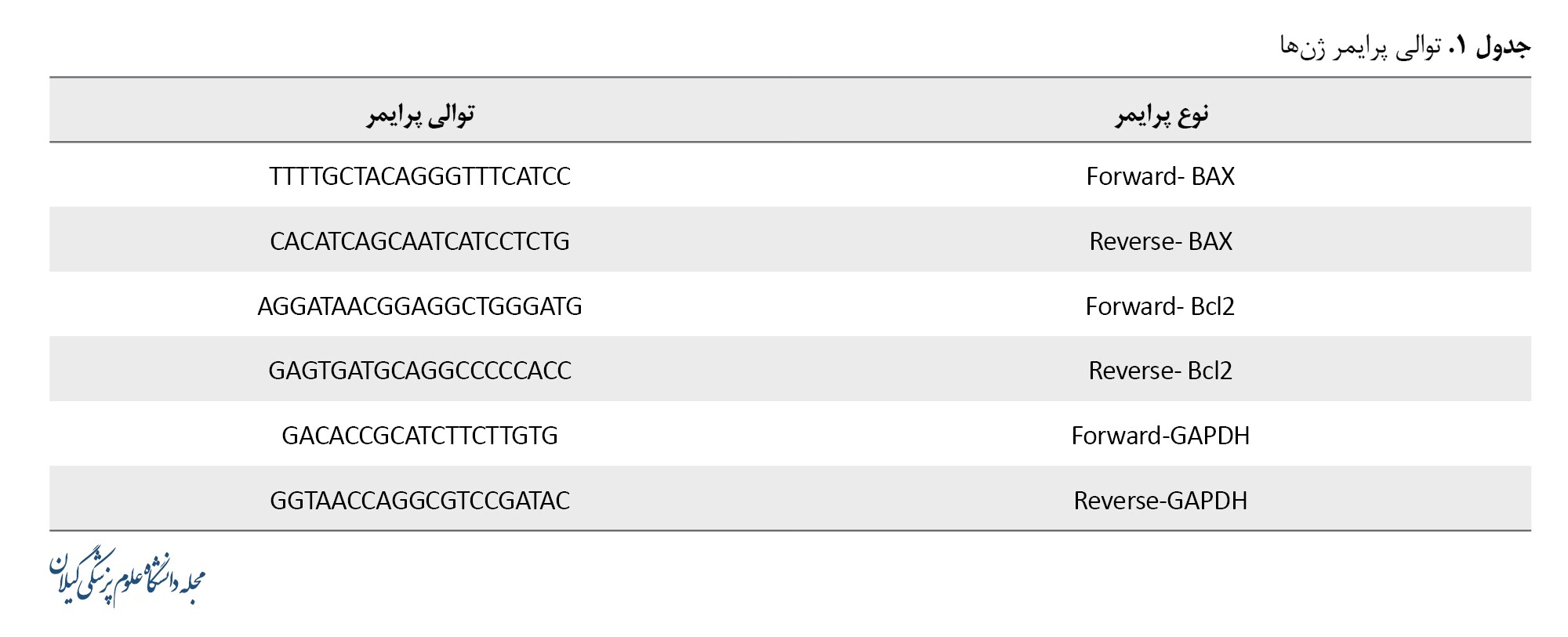
پس از دانلود فرمت FASTA توالی mRNA ژن BAX ،BCL2 و GAPDH موش صحرایی از پایگاه داده مرکز ملی اطلاعات بیوتکنولوژی، از نرمافزار الیگو برای طراحی پرایمر Forward و Reverse هریک از ژنها استفاده شد (جدول شماره 1). شرکت سیناژن سنتز پرایمرها را انجام شد. پرایمرهای لیوفیلیزه تهیهشده از شرکت سیناژن طبق دستورالعمل این شرکت با حجم مشخصی از آب دپس رقیق شد. پرایمر استوک اصلی با غلظت 100 پیکومول حاصل شد.
استخراج RNA
استخراج RNA از بافت هیپوکامپ براساس دستورالعمل یادشده در کیت استخراج RNA شرکت پارس توس انجام شد. بهطور خلاصه بدین روش انجام شد: ابتدا بافت هیپوکامپ با کمک اسکالپل به قطعات کوچک برش داده شد و20 میلیگرم از بافت به میکروتیوپ 1/5 میلیلیتری منتقل شد و 750 میکرولیتر محلول لیزکننده به آن اضافه شد. سپس بافت بهخوبی پیپتاژ شد و بعد 5 دقیقه انکوبه در دمای اتاق، 150 میکرولیتر کلروفرم به مخلوط اضافه شد و بهمدت 3 دقیقه در دمای اتاق انکوبه شد. سپس بهمدت 12 دقیقه در 13000 دور در دقیقه در دمای 4 درجه سانتیگراد سانتریفیوژ شد و فاز رویی به میکروتیوپ 1/5 میلیلیتری جدید منتقل شد و به میزان برابر اتانول70 درصد به آن اضافه شد. مخلوط به ستون چرخشی منتقل شد و بهمدت 1 دقیقه در 13000 دور در دقیقه در دمای 4 درجه سانتیگراد سانتریفیوژ شد. سپس محتویات کالکشن تیوپ تخلیه شد. در مرحله بعد 700 میکرولیتر محلول مراحل شستوشو اضافه و بهمدت 1 دقیقه در 13000 دور در دقیقه در دمای 4 درجه سانتیگراد سانتریفیوژ شد. محتویات کالکشن تیوپ تخلیه شد (مرحله 7 تکرار شد). بهمدت 2 دقیقه در 13000 دور در دقیقه در دمای 4 درجه سانتیگراد سانتریفیوژ شد و سپس Spin Column به میکروتیوپ 1/5 میلیلیتری جدید منتقل شد. در نهایت50 میکرولیتر آب دپس اضافه شد و 3 دقیقه در دمای اتاق انکوبه شد. بهمدت 1 دقیقه در 13000 دور در دقیقه در دمای 4 درجه سانتیگراد سانتریفیوژ شد و RNA استخراجشده در دمای 80- ذخیره شد.
سنجش کیفیت و کمیت استخراج RNA
به منظور بررسی کیفیت RNA استخراجشده و عدم آلودگی به پروتئین و DNA از دستگاه نانودراپ استفاده شد. در این روش 2 میکرولیتر از هر نمونه در مقابل بلانک خوانده شد. غلظت RNA برحسب نانوگرم، نسبت جذب 260/280 نانومتر (اگر اعداد حاصل از آن در حدود 0/15±2 باشد نشاندهنده خلوص بالای RNA میباشد)، نسبت جذب 260/230 نانومتر (اگر اعداد حاصل از آن در حدود 1/8تا 2/2 باشد درصد خلوص مناسب است) برای هر نمونه به دست آمد.
سنتز cDNA
به منظور سنتز cDNA از کیت استخراج RNA شرکت پارس توس مشهد استفاده شد. در این روش به کمک آنزیم ترانسکریپتاز معکوس از RNAهای استخراجشده در مراحل قبلی، مولکول DNA مکمل یا همان (Complementary DNA) که موسوم به cDNA است، ساخته شد. بهطور خلاصه ابتدا، نمونههای RNA استخراجشده اسپین شدند و به هر نمونه، مقدار مناسب مسترمیکس طبق دستورالعمل کیت اضافه شد و دوباره چرخانده شدند. در نهایت نمونهها به دستگاه ترموسایکلر منتقل شدند و به ترتیب در3 دمای مختلف قرار گرفتند. دمای 25 درجه سانتیگراد، جهت اتصال پرایمر، سپس اتصال آنزیم و سنتز cDNA است. دمای 85 درجه سانتیگراد، جهت غیرفعال کردن آنزیم است و دمای سوم جهت خنک کردن نمونه. پس از اتمام واکنش، نمونهها به فریز منفی 20 درجه سانتیگراد منتقل و در آنجا نگهداری شدند.
بررسی کارایی پرایمرها
جهت بررسی کارایی پرایمرها، رقت سریالی از cDNA نمونه با غلظت مشخص تهیه شد و Real-Time PCR این رقتها طبق پروتکل بیانشده در بخش Real-Time PCR انجام شد. با تنظیم دستگاه، نمودار استاندارد رسم شد. باتوجهبه شیب خط که دستگاه نشان داد و فرمول مربوط به کارایی، کارایی پرایمر محاسبه شد.
Real-Time PCR
بعد از سنتز cDNA از RNA استخراجشده به روشی که در سطور قبل بیان شد. به منظور تعیین میزان بیان ژنهای موردنظر از کیت سایبرگرین ریل تایم PCR شرکت SimBio استفاده شد. مواد موردنیاز برای هر نمونه طبق دستورالعمل کیت محاسبه شد. واکنشهای PCR با انکوباسیون 10 دقیقهای در دمای 95 درجه سانتیگراد آغاز شد و سپس 40 سیکل 95 درجه سانتیگراد بهمدت 15 ثانیه، 62 درجه سانتیگراد (برای Bcl-2) و 55 درجه سانتیگراد (برای Bax) برای 30 ثانیه و 72 درجه سانتیگراد بهمدت 30 ثانیه آغاز شد. جهت نرمال کردن دادهها از ژن کنترل داخلی گلیسرآلدئید3 فسفات دهیدروژناز (GAPDH) استفاده شد. روش پافل برای تجزیهوتحلیل دادههای واکنش زنجیرهای پلیمراز در استفاده شده است. وجود قله منفرد در منحنی ذوب هریک از نمونهها مؤید تکثیر اختصاصی محصول Real-Time PCR بود.
اندازهگیری میزان بیان ژن
بعد از انجام Real-Time PCR مقادیر CT بهدستآمده برای هریک از نمونهها و برای هریک از ژنهای BAX و Bcl2 و ژن کنترل داخلی (GAPDH) از دستگاه استخراج شد. جهت بررسی میزان بیان هریک از ژنها از فرمول پافل استفاده شد.
تحلیل آماری
دادههای حاصل از سنجشهای بیوشیمیایی در نرمافزار SPSS نسخه 20با آنالیز آزمون آنووا (آزمون توکی) بررسی شدند و سطح معنیدار آزمونها P کمتر از 0/05 درنظر گرفته شد.
یافتهها
مقدار مالوندیآلدهید
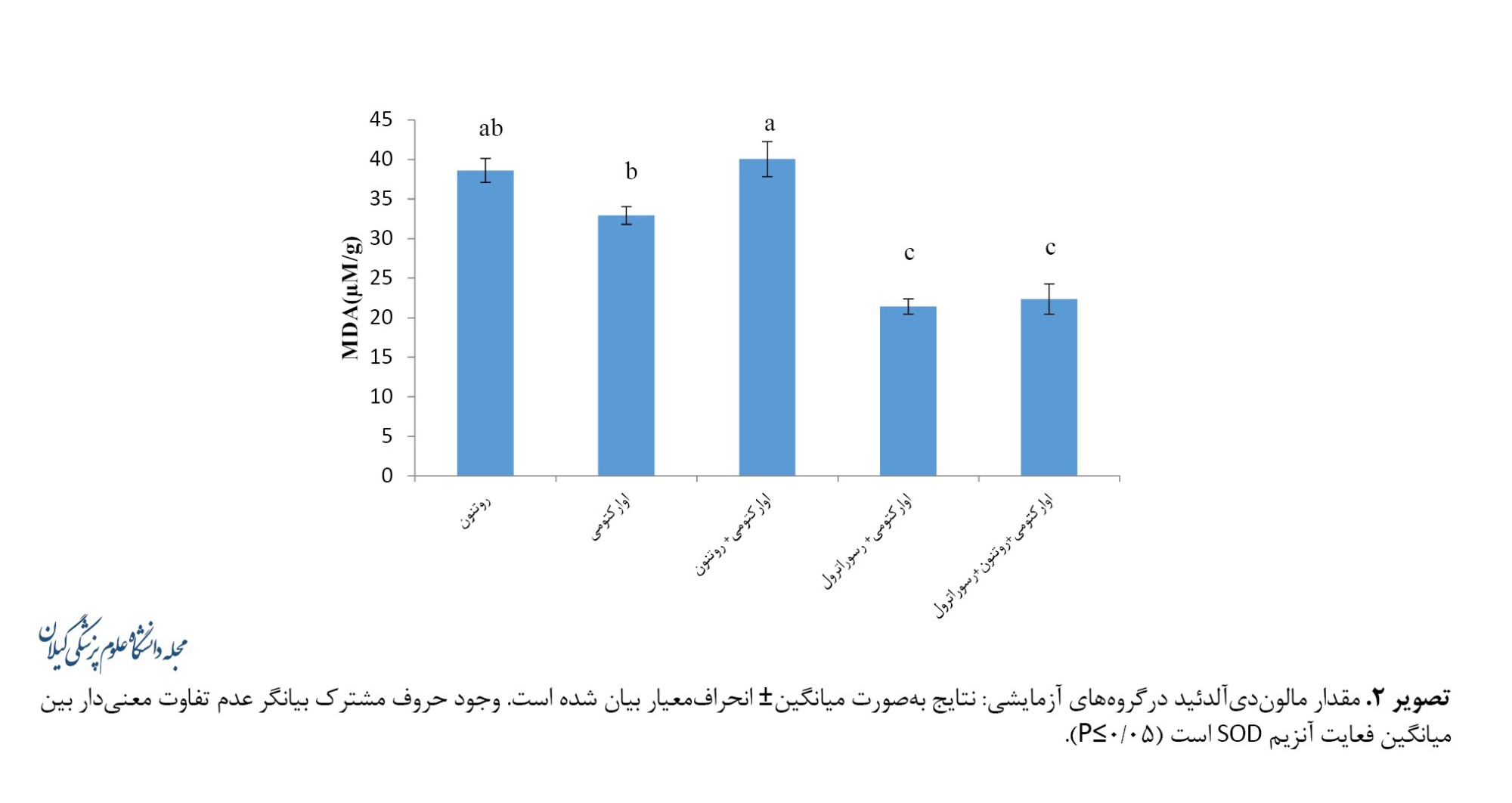
با حذف تخمدانها بیشترین مقدار مالوندیآلدهید در گروه اوارکتومی+روتنون (40/06±2/22 میکرومول بر گرم) ثبت شد که افزایش معنیداری را نسبت به گروه اوارکتومی (32/92±1/12 میکرومول بر گرم) نشان داد (0/001>P). مقدار مالوندیآلدهید در گروه اوارکتومی+رسوراترول (21/42±0/97 میکرومول بر گرم) نسبت به گروه اوارکتومی کاهش معنیداری نشان داد (0/001>P). رسوراترول به کاهش معنیدار مالوندیآلدهید در گروه اوارکتومی+روتنون+رسوراترول(22/35±1/91 میکرومول بر گرم) نسبت به گروه اوارکتومی+روتنون منجر شد (0/001>P) (تصویر شماره 2).
فعالیت آنزیم سوپراکسیددیسموتاز (SOD)
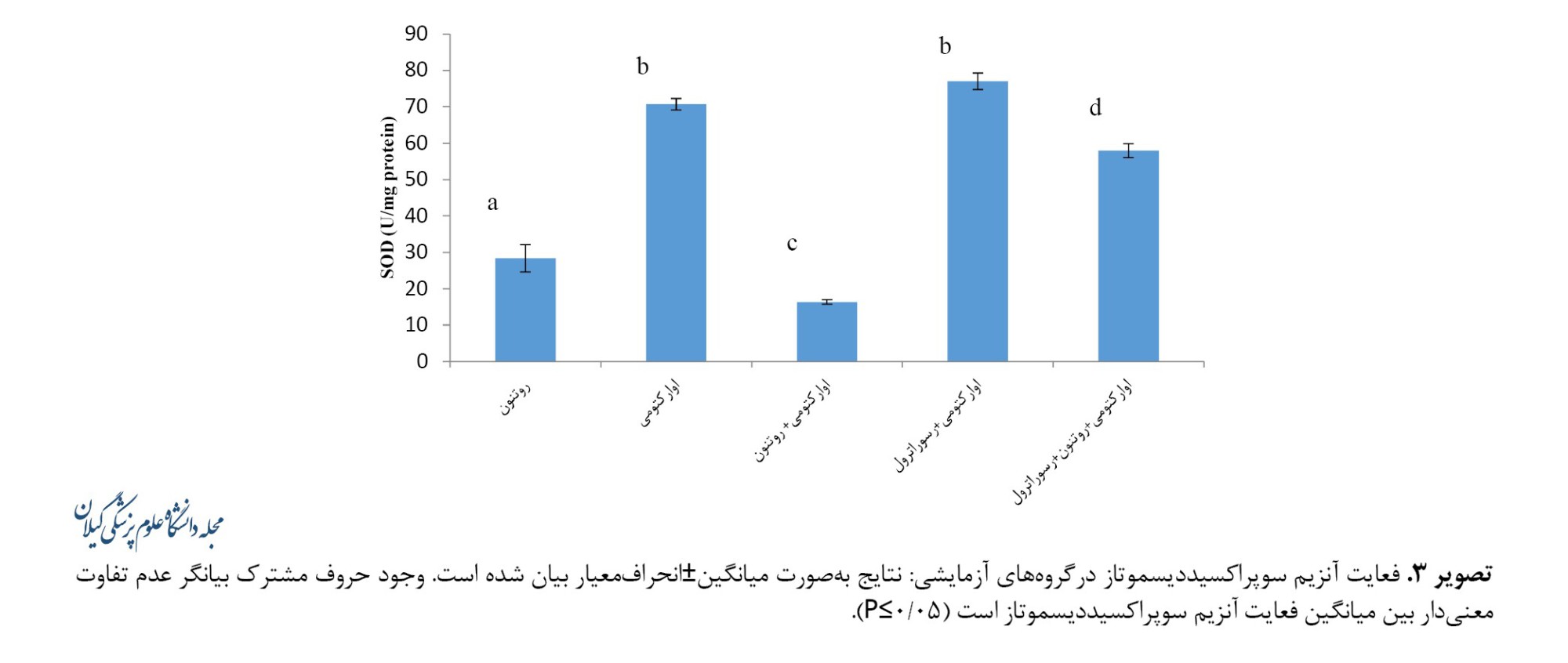
فعالیت آنزیم سوپراکسیددیسموتاز (16/36±0/61 واحد در میلیگرم) در گروه اوارکتومی+ روتنون کاهش معنیداری را نسبت به گروه اوارکتومی (70/69±1/58 واحد در میلیگرم) نشان داد (0/001≥P). دریافت رسوراترل در گروه اوارکتومی+رسوراترول به افزایش معنیدار فعالیت این آنزیم (77/02±2/2 واحد در میلیگرم) نسبت به گروه اوارکتومی منجر نشد. رسوراترول در گروه اوارکتومی+روتنون+رسوراترول نیز به افزایش معنیدار فعالیت آنزیم سوپراکسیددیسموتاز (57/9±1/94 واحد در میلیگرم) نسبت به گروه اوارکتومی+روتنون منجر شد (0/001>P) (تصویر شماره 3).
میزان بیان ژن BAX
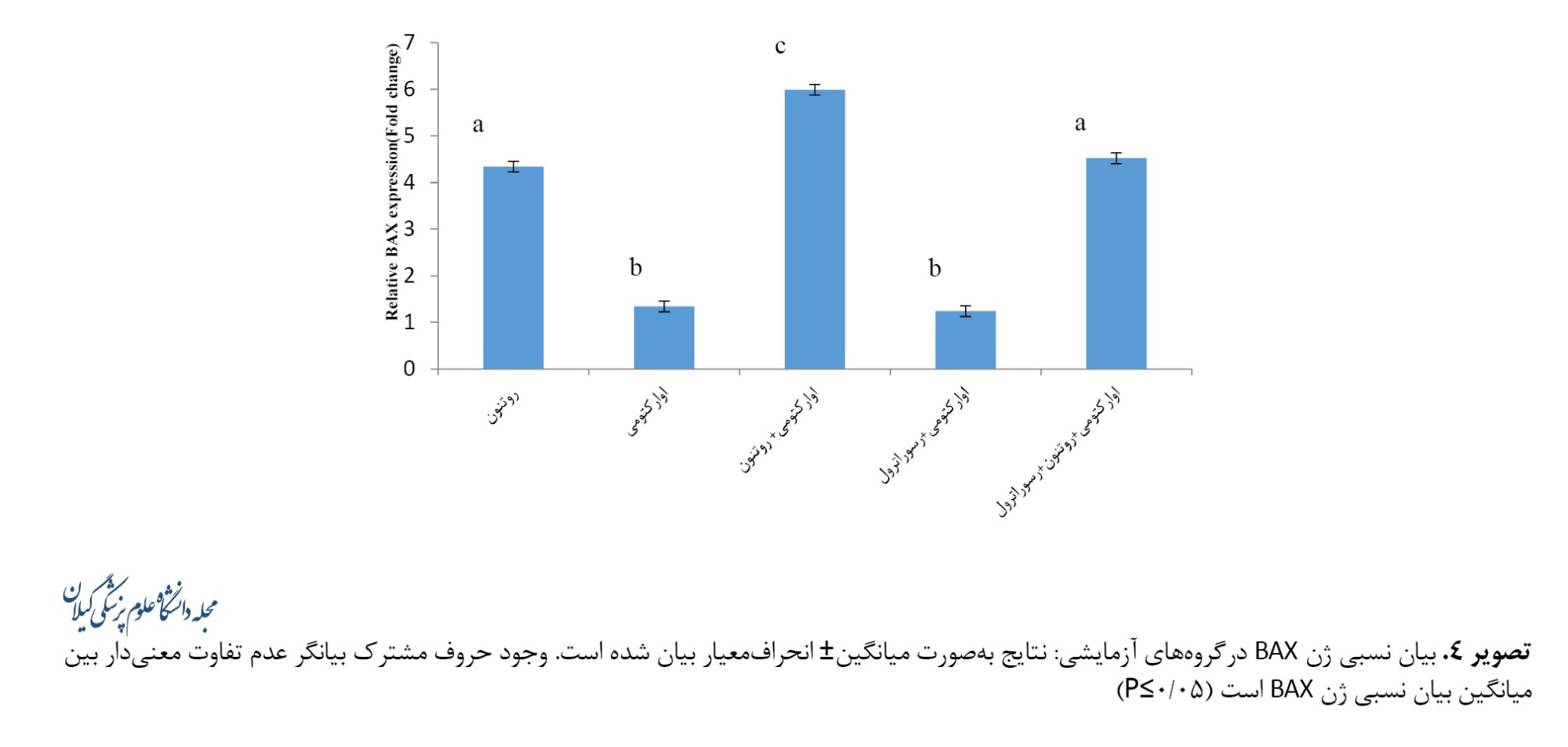
باتوجهبه نتایج مندرج در تصویر شماره 4 بیشترین میزان بیان ژن BAX در گروه اوارکتومی+روتنون (5/9±0/05) ثبت شد که افزایش معنیداری را نسبت به گروه اوارکتومی (1/3±0/11)نشان داد (0/001>P). کاهش میزان بیان ژن BAX در گروه اوارکتومی+رسوراترول (1/2±0/11) نسبت به گروه اوارکتومی معنیدار نبود. رسوراترول به کاهش معنیدار میزان بیان ژن BAX در گروه اوارکتومی+ روتنون+رسوراترول (4/5±0/11) نسبت به گروه اوارکتومی+روتنون منجر شد (0/001>P).
میزان بیان ژن Bcl2
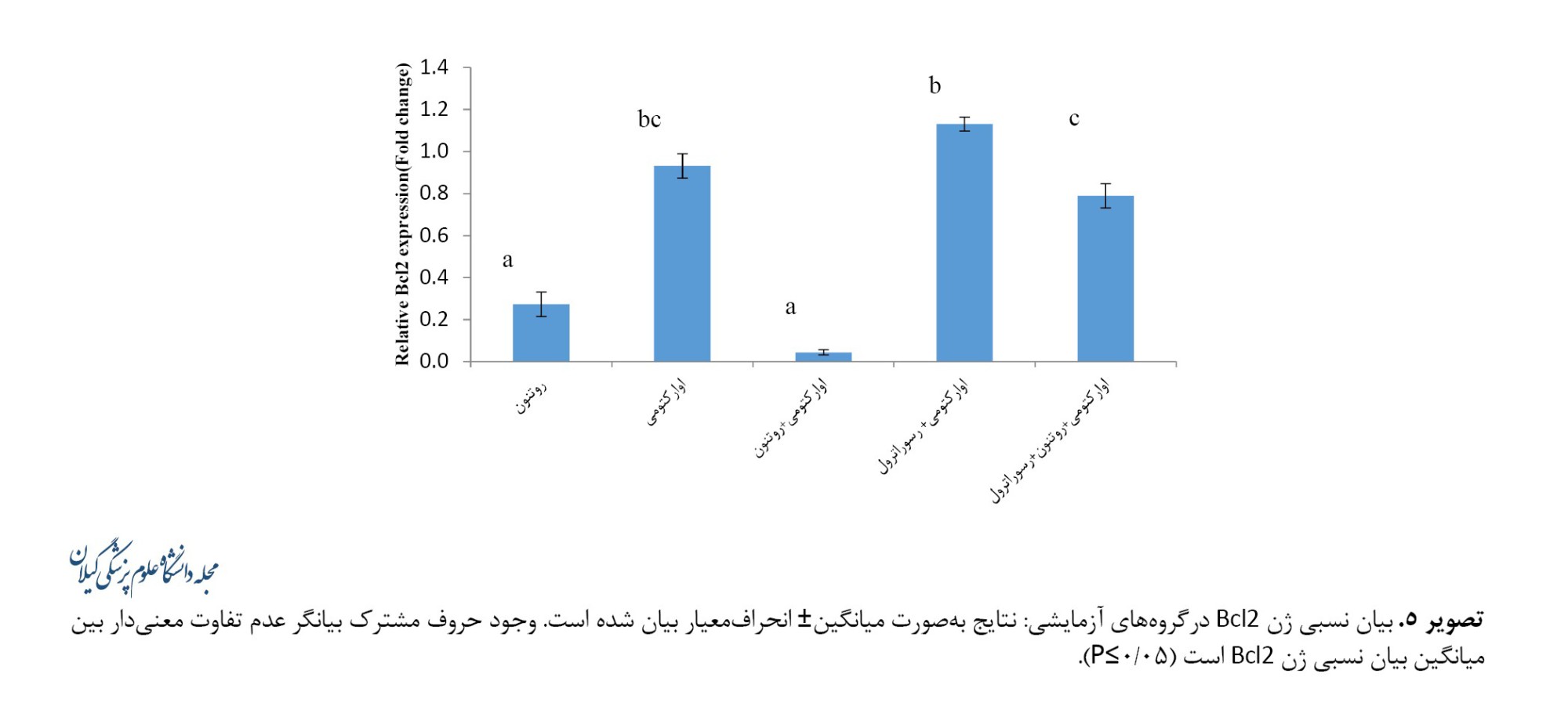
کمترین میزان بیان ژن Bcl2 در گروه اوارکتومی+روتنون (5/9±0/05) ثبت شد که کاهش معنیداری را نسبت به گروه اوارکتومی (0/93±0/05) نشان داد (0/001>P). میزان بیان ژن Bcl2 در گروه اوارکتومی+رسوراترول (1/13±0/03) به افزایش معنیدار این شاخص نسبت به گروه اوارکتومی منجر نشد. رسوراترول به افزایش معنیدار میزان بیان ژن Bcl2 در گروه اوارکتومی+روتنون+رسوراترول (0/78±0/05) نسبت به گروه اوارکتومی+روتنون منجر شد (0/001>P) (تصویر شماره 5).
بحث
در مطالعه حاضر از روتنون بهعنوان سم کشاورزی ایجادکننده اختلالات عصبی و از برداشتن تخمدان موشهای صحرایی(حذف استروژن) جهت ایجاد مدل تجربی منوپوز استفاده شد و اثر حمایتی رسوراترول در برابر این آسیب در هیپوکامپ ارزیابی شد. بررسی بیان ژنهای Bcl2 و Bax، فعالیت آنزیم سوپراکسید دیسموتازو مقدار مالوندیآلدئید در هیپوکامپ موشها از اهداف این مطالعه بود.
نتایج نشان داد روتنون در حضور استروژن بهطور قابلتوجهی به کاهش فعالیت سوپر اکسید دیسموتاز و همچنین بیان ژن Bcl2 و افزایش معنیدار مقدار مالوندیآلدهید و میزان بیان ژن BAX در هیپوکامپ منجر شد.
در همین راستا مطالعات یارمحمدی، پامیز و شیخپور نشان دادند روتنون باافزایش سطح بیومارکرهای استرس اکسیداتیو و کاهش پارامترهای آنتیاکسیدانی به ایجاد بیماری تحلیلبرنده عصبی پارکینسون در مدل حیوانی منجر شد. مواجهه با روتنون، مسیر پیامرسانی Keap1-Nrf2-ARE، عمدهترین مکانیسم دفاعی در برابر استرس اکسیداتیو را تحت تأثیر قرار میدهد [9-11].
بنابراین شاخصهای استرس اکسیداتیو و آپوپتوز یادشده در سطور قبل، برخی از نشانگرهای پاتولوژیک مواجهه با نوروتوکسین و در نتیجه ابتلای به بیماریهای تحلیلبرنده عصبی بود و تنظیم و بهبود این نشانگرها، اثرات سودمند و مفیدی در برابر تخریب عصبی ناشی از آسیب مغزی نشان داده است. باتوجهبه عدم منع مصرف روتنون و در معرض قرار گرفتن افراد بهطور غیرمستقیم و مستقیم بهویژه کشاورزان، به تقویت و استفاده از عوامل محافظتی در برابر این نوروتوکسین نیاز است. بنابراین، تصور میشود فعالسازی سیگنالینگ Nrf2 بهعنوان تنظیمکننده اصلی بسیاری از ژنهای دخیل در استرس آنتیاکسیدانی و درنهایت افزایش فعالیت آنتیاکسیدانهای درونزاد و همچنین تنظیم بیان ژنهای دخیل در مکانیسم آپوپتوز، استراتژی امیدوارکننده برای پیشگیری، درمان و یا جلوگیری از پیشرفت آسیب باشد. اثرات یائسگی بر تشدید بیماریهای تخریبکننده عصبی، بهخوبی در مدلهای سلولی، حیوانی و مطالعات بالینی نشان داده شده است [46].
براساس نتایج حاصل از مطالعه حاضر، حذف تخمدان در موشهای صحرایی بهطور قابلتوجهی به کاهش فعالیت آنزیم سوپراکسیددیسموتاز، بیان ژن Bcl2، افزایش معنیدار بیان ژن BAX و مقدار مالوندیآلدهید در هیپوکامپ منجر شد. از طرفی کاهش شاخص آنتیاکسیدانی و آنتیآپوپتوزی و افزایش شاخص پروآپوپتوزی یادشده در پژوهش حاضر گروههایی که تزریق روتنون همراه با حذف تخمدان بود، تغییرات بیشتری نسبت به گروههایی که در حضور تخمدان یا بهعبارتی در حضور استروژن در معرض روتنون قرار گرفتند داشتند و مؤید این مطلب است که حذف تخمدان بهواسطه کاهش استروژن به تشدید فاکتورهای استرس اکسیداتیو و آپوپتوز ناشی از آسیب در بافت هیپوکامپ مغز منجر میشود.
استروژن میتواند با بهبود فعالیت آنتیاکسیدانی درونزا و تنظیم بیان پروتئینهای دخیل در مرگ برنامهریزیشده سلول، استرس اکسیداتیو و آپوپتوز و درنتیجه تخریب عصبی را در مدل حیوانی SWI و مدل سمیت عصبی ناشی از روتنون و 6-هیدروکسی دوپامین را کاهش دهد [47-49].
باتوجهبه عملکرد شناختی و نقش محافظت عصبی استروژن حاصل از تخمدانها در دستگاه عصبی و نقش محافظتی آن در بیماریهای تحلیلبرنده عصبی ازجمله آلزایمر و پارکینسون، در چند دهه گذشته در استروژن درمانی استفاده میشود، اما عوارض جانبی ناشی از استفاده طولانیمدت آن که خطر ابتلا به برخی بیماریها را افزایش میدهد، بسیار نگرانکننده است [24]. باتوجهبه نقش محوری استرس اکسیداتیو در شروع و پیشرفت بیماریهای تحلیلبرنده عصبی و تشدید استرس اکسیداتیو در افراد منوپوز در معرض آفتکش روتنون، جستوجو برای ترکیبات با خواص آنتیاکسیدانی توجه بسیاری را به خود جلب میکند.
ترکیبهای طبیعی با افزایش فعالیت آنتیاکسیدانی و یا با جلوگیری از اثرات مضر ROS، استرساکسیداتیو ناشی از روتنون را کاهش میدهند. بنابراین آنتیاکسیدانهای طبیعی مانند رسوراترول میتواند در این شرایط مفید باشند. از اثرات بیولوژی رسوراترول شامل خواص آنتیاکسیدانی، ضدالتهابی، ضدآپوپتوزی و خواص اتوفاژیک و همچنین بهبود جریانخون مغزی و افزایش انعطافپذیری سیناپسی است [33]. درمجموع به واسطه خاصیت عبور از سد خونی-مغزی [50] و نقش تنظیمی رسوراترول در چندین مسیر سیگنالینگ عصبی، به انتخاب این آنتیاکسیدان بهعنوان کاندیدای اثر محافظت نورونی منجر شد.
در مطالعه حاضر رسوراترول فعالیت SOD و بیان ژن Bcl2 را در هیپوکامپ گروه اوارکتومی+روتنون+رسوراترول بهصورت معنیداری افزایش داد. علاوهبراین رسوراترول بیان ژن BAX و مقدار MDA را بهصورت معنیداری کاهش داد.
در راستای نقش محافظت نورونی رسوراترول، مطالعه کومار و همکاران در سال 2011 نشان داد تجویز رسوراترول با مهار ROS در مخچه و القای انتقال Nrf2 از سیتوپلاسم به هسته و تنظیم بیان و فعالیت ژنهای هدف پاییندست آن مانند سوپراکسیددیسموتاز، NADPH کوئینون اکسید و ردوکتاز 1 از آپوپتوز ناشی از اتانول جلوگیری میکند [51]، مسیر پیامرسانی Nrf2/ARE که از مسیرهای سرکوبشونده توسط نوروتوکسین روتنون بود و مکانیسم محافظتی استروژن میباشد و باتوجهبه آنچه در مطالب یادشده، رسوراترول نیز با تنظیم افزایشی این مسیر و افزایش آنزیمهای آنتیاکسیدانی نقش محافظت عصبی خود را ایفا میکند. بنابراین در پژوهش حاضر مسیر پیامرسانی Nrf2/ARE و بهویژه تنظیم بیان پروتئین Nrf2 میتواند مکانیسم احتمالی مشترکی باشد که بهواسطه آن رسوراترول و استروژن اثر خود را در گروههایی که در حضور استروژن و رسوراترول، تحت تأثیر روتنون قرار گرفتند اعمال کردند.
علاوهبراین سانگ و همکاران در سال2020 نشان دادند رسوراترول بهواسطه تنظیم افزایشی نسبت Bcl-2/Baxو تنظیم کاهشی بیان پروتئین Bax و سیتوکروم C باعث کاهش آپوپتوز ناشی از استرس اکسیداتیو در هیپوکامپ مدل پیری موش صحرایی میشود، همچنین رسوراترول به تنظیم سطوح SOD ،CAT و GSHو سطح MDA در هیپوکامپ منجر شد [18] که با تأثیر رسوراترول بر شاخص اکسیداتیوی و آپوپتوزی پژوهش حاضر مطابقت داشت. همچنین اوتی و همکاران در سال2022 نشان دادند رسوراترول با کاهش کاسپاز 3 و 9 و نسبت Bax/Bcl-2 میتواند بهعنوان آنتیاکسیدان و عامل درمانی در برابر استرس اکسیداتیو عصبی ناشی از هیپوکسی و بیماریهای تحلیلبرنده عصبی عمل کند [52] که تمام این مطالعات مشابه با نتایج پژوهش حاضر درمورد نقش محافظت نورونی رسوراترول بهواسطه تنظیم افزایشی شاخصهای آنتیاکسیدانی و آنتیآپوپتوزی و تنظیم کاهشی شاخص آپوپتوزی BAX بودند.
نتیجهگیری
بهطور خلاصه، اوارکتومی به کاهش فعالیت آنزیم سوپراکسیددیسموتاز، افزایش مقدار مالوندیآلدهید و بیان ژن Bax منجر شد اما تأثیری بر بیان ژن Bcl2 نداشت. روتنون همراه با اوارکتومی کاهش قابلتوجهی بر فعالیت آنزیم و بیان ژن Bcl2 و افزایش چشمگیری بر مقدار MDA و میزان بیان ژن Bax نشان داد. مصرف رسوراترول در موشهای گروه اوارکتومی به کاهش قابلتوجه در مقدار MDA منجر شد و تأثیر چندانی بر بیان ژن Bcl2 و Bax و فعالیت آنزیم سوپراکسیددیسموتاز نداشت. درصورتیکه مصرف همزمان رسوراترول و روتنون در موشهای اوارکتومیشده به افزایش قابلتوجهی در فعالیت این آنزیم و میزان بیان ژن Bcl2 و همچنین کاهش مقدار MDA و بیان ژن Bax منجر شد. بهطور کلی، رسوراترول توانست اثر روتنون و نبود استروژن را در تغییرات ناشی از روتنون و اوارکتومی را در آپوپتوز و استرس اکسیداتیو اصلاح کند.
ازاینرو پژوهش حاضر نیز هم راستا با دیگر پژوهشها پیشنهاد میکند از رسوراترول برای بهبود بیومارکرهای کلیدی مؤثر در بیماریهای تخریب عصبی در افراد با ریسک بالای ابتلا به این بیماریها بهویژه کشاورزان و افراد منوپوز استفاده شود. همچنین جهت تکمیل و تداوم این کار تحقیقاتی، بررسی تغییرات پروتئینهای Nrf2 ،SIRT و NF-κB و مسیر پیامرسانی آنها و وابستگی و تأثیر آنها بر شاخصهای موردبررسی در پژوهش حاضر و همچنین بررسی تأثیر جایگزینی استروژن درمانی با غلظتهای مختلف به جای استروژن درونزا (ترشحشده از تخمدان) بر شاخصهای استرس اکسیداتیو و آپوپتوزی پیشنهاد میشود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه در کمیته اخلاق دانشگاه شهید چمران اهواز (EE.1400.3.02.10568) تصویب شد.
حامی مالی
این تحقیق هیچگونه کمک مالی از سازمانهای تأمین مالی در بخشهای عمومی، تجاری یا غیرانتفاعی دریافت نکرد.
مشارکت نویسندگان
مفهومسازی و طراحی مطالعه: حسین نجفزاده ورزی، احمدعلی معاضدی و محبوبه آقاگلزاده؛ تحلیل و تفسیر دادهها و تحلیل آماری: محبوبه آقاگلزاده و حسین نجفزاده ورزی؛ تهیه پیشنویس دستنوشته: محبوبه آقاگل زاده؛ جذب منابع مالی و حمایت اداری، فنی یا موادی: احمدعلی معاضدی و حسین نجفزاده ورزی؛ نظارت بر مطالعه: حسین نجفزاده ورزی، احمدعلی معاضدی، هادی پارسیان؛ بازبینی نقادانه دستنوشته:همه نویسندگان.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان از حمایتهای مادی و معنوی گروه زیستشناسی دانشگاه شهید چمران اهواز و معاونت پژوهشی دانشگاه شهید چمران اهواز برای تخصیص پژوهانه و دانشگاه علوم پزشکی بابل در مراحل اجرای این پژوهش قدردانی میکنند.
بیماریهای تحلیلبرنده عصبی نمایانگر مجموعهای از اختلالات ناهمگن است که میلیونها نفر را در سراسر جهان تحت تأثیر قرار میدهد. این بیماریها با از دست دادن پیشرونده و برگشتناپذیر عملکرد و یا مرگ نورونها در مناطق خاص مغز مشخص میشوند که به افت شدید شناختی و عملکردی منجر میشوند. شناختهشدهترین بیماریهای تخریبکننده عصبی عبارتاند از بیماریهای آلزایمر، پارکینسون، هانتینگتون و اسکلروز جانبی آمیوتروفیک که استرس اکسیداتیو و آپوپتوز از اصلیترین مکانیسمهای سلولی و مولکولی مشترک دخیل در این اختلالات عصبی میباشند [1-3]. علت دقیق شیوع و سیر افزایشی بیماریها بهطور واضح مشخص نیست، اما شواهد نشان دادند که یکی از دلایل تشدید و افزایش احتمال ابتلا به بیماریهای عصبی نوروتوکسینهای محیطی میباشند که در جوامع امروزی بهصورت کنترل نشده و بیرویه سلامت موجودات زنده را بهصورت مستقیم و یا غیرمستقیم تهدید میکنند و ریسک ابتلا به بیماریها را افزایش میدهند [4].
آفتکشها، نوروتوکسینهای محیطی هستند که قرار گرفتن در معرض آنها به افزایش خطر ابتلا به بیماریهای تحلیلبرنده عصبی منجر میشود [5، 6]. نوروتوکسین محیطی روتنون، حشرهکش و آفتکش طبیعی است که از گیاهان تیره لگومینوز استخراج میشود، بهعلت ویژگی لیپوفیلیک بالا بهراحتی و بدون نیاز به حاملها از تمام غشاهای بیولوژیک، ازجمله میتوکندری و سد خونی-مغزی عبور میکند [7-9]. مکانیسم اصلی سمیت عصبی القاشده توسط روتنون، مهار کمپلکسI زنجیره انتقال الکترون میتوکندری است. استرس اکسیداتیو، آپوپتوز و مهار اتوفاژی از نتایج کلیدی مهار کمپلکسI زنجیره انتقال الکترون میباشند. روتنون با مهار انتقال الکترونها از مراکز آهن ـ گوگرد در کمپلکسI به یوبیکوئینون در زنجیره انتقال الکترون به مهار فسفوریلاسیون اکسیداتیو و کاهش سطح آدنوزینتری فسفات (ATP) و بهطور همزمان افزایش تولید گونههای اکسیژن واکنشپذیر و درنتیجه استرس اکسیداتیو منجر میشود. افزایش گونههای اکسیژن واکنشپذیر و آسیب اکسیداتیو DNA ، لیپیدها و پروتئینها در تخریب سلولهای عصبی نقش دارند [10].
یارمحمدی و همکاران نشان دادند روتنون بهواسطه القای مسیر سیگنالینگJNK ،p38 MAPK و درنتیجه افزایش پروتئینهای پروآپوپتوز BAX و BAD به رهایی سیتوکروم C و فعالسازی کاسپازهای آغازگر و افکتور و نهایتاً القای آپوپتوز منجر میشود. ازطرفی روتنون بهواسطه سرکوب مسیر سیگنالینگ Akt/PI3K به تشدید آپوپتوز منجر میشود [11]. کاووری و همکاران نشان دادند تزریق درون صفاقی روتنون به تغییرات پارامترهای آنتی اکسیدانی و اکسیداتیو منجر شده است [12]. بنابراین بهخوبی مشخص شده است که رادیکالهای آزاد با تحریک استرس اکسیداتیو، آسیبهای عصبی را تشدید میکنند؛ ازاینرو نقش عمدهای در بیماریهای تحلیلبرنده عصبی ایفا میکنند. بنابراین میتوان تنظیم و تعدیل رادیکالهای آزاد بهواسطه تقویت آنتیاکسیدانهای درونزا و همچنین تنظیم بیان پروتئینهای آپوپتوزی را بهعنوان اهداف بالقوه عمل دارویی در مدیریت بیماریهای تحلیلبرنده عصبی به کار گرفت. سوپراکسید دیسموتاز آنزیمی است که نقش مهمی در محافظت از سلولها در برابر استرس اکسیداتیو ایفا میکند. در مغز سوپراکسید دیسموتاز، بهدلیل فعالیت متابولیک بالا و مصرف اکسیژن بالای نورونها که آنها را در برابر آسیب اکسیداتیو آسیبپذیرتر میکند، اهمیت ویژهای دارد. این آنزیم آنتیاکسیدانی با تبدیل رادیکالهای سوپراکسید به پراکسید هیدروژن و اکسیژن در محافظت از سلولها در برابر استرس اکسیداتیو نقش دارد [13].
مطالعات نشان دادهاند کاهش سطح یا فعالیت سوپراکسید دیسموتاز در مغز با افزایش استرس اکسیداتیو و تخریب عصبی مرتبط است. همانطور که در بیماری آلزایمر مشاهده شد، سطح این آنزیم در مناطق آسیبدیده مغز کاهش یافته است [14]. بهطور مشابه یان و همکاران در مطالعه مروری خود نقش سوپراکسید دیسموتاز را در شرایط مختلف پاتولوژیک در مطالعات انسانی و حیوانی متعددی بررسی کردهاند و اثرات مضر کاهش سطح و فعالیت سوپراکسید دیسموتاز در تشدید آسیبهای اکسیداتیو تحت شرایط بیماریهای مختلف را نشان دادند [15].
17بتا-استرادیول (E2، استروژن) هورمون استروئیدی است که بهعنوان محافظتکننده عصبی در برابر انواع بیماریهای تحلیلبرنده عصبی، ازجمله پارکینسون و آلزایمر نقش دارد [16-19]. استروژن بهدلیل وزن مولکولی پایین و خاصیت لیپوفیلی از سد خونی-مغزی عبور میکند و بهراحتی خود را به بافت عصبی میرساند [20]. وون و همکاران نشان دادند استروژن بیان پروتئینهای ضدآپوپتوز مانند Bcl-xL و Bcl2 را برای جلوگیری از تشکیل منافذ نفوذپذیر افزایش میدهد و با جلوگیری از انتقال پروتئینهای پروآپوپتوز مانند Bcl-xL و Bcl-2از سیتوزول به غشای میتوکندری مانع از رهایی سیتوکروم C القاشده توسط اختلالات عصبی میشود [21]. همچنین در مطالعه دیگر نشان دادند که استروژن از طریق فعالسازی مسیر Nrf2-ARE آنتیاکسیدانهای درونزا را تنظیم میکند [22]. شواهد نشان میدهد درمان طولانیمدت با استروژن در بسیاری از بیماریهای تحلیلبرنده عصبی، علاوهبر فواید خود با عوارض جانبی همراه است [23، 24].
مطالعات نشان دادهاند رژیم غذایی حاوی آنتیاکسیدان طبیعی بهدلیل خواص مهار رادیکال آزاد یا اکسیژن فعال بهطور بالقوه از آسیب اکسیداتیو و زوال شناختی جلوگیری میکند [25-28]. رسوراترول (3، 4، 5 تریهیدروکسی- ترانس استیل بن، استیل بنوئید) ترکیب پلیفنولی متعلق به گروه فیتوالکسین به نام استیلین است. رسوراترول در بسیاری از گونههای گیاهی شامل توت، زغال اخته، تمشک، بادام زمینی و بهخصوص پوست و هسته انگور قرمز وجود دارد [29-32]. رسوراترول دارای اثرات بیولوژیک متعدد است و در مدلهای آزمایشگاهی بیماری صرع، آلزایمر، پارکینسون و اسکلروز جانبی آمیوتروفیک اثرات مفیدی نشان داد [33-38]. رسوراترول در از بین بردن انواع اکسیدانها مانند آنیون سوپراکسید، پراکسید هیدروژن، رادیکال هیدروکسیل، اکسید نیتروژن و پراکسینیتریت بسیار مؤثر است. خواص آنتیاکسیدانی رسوراترول به وجود حلقههای فنلی با سه گروه هیدروکسیل در موقعیتهای3، 4 و 5 و پیوند دوگانه کونژوگه و همچنین پتانسیل جداسازی الکترون در ساختار مولکول مرتبط است. درواقع رسوراترول با تعدیل بیان SIRT1 و درنتیجه پروتئینهای غیرهیستونی مانند p53 ،NF-kB و PGC-1α نقش قابلتوجهی در دفاع آنتیاکسیدانی، ضدالتهابی و ضدآپوپتوتیک در برابر استرس اکسیداتیو ایفا میکند.
تروونگ و همکاران نشان دادند رسوراترول از طریق سرکوب فعالسازی IKKa و فسفوریلاسیون، تخریب IkBa و همچنین از طریق مهار فعالیتهای COX-2 و دکربوکسیلاز اورنیتین به مهار استرس اکسیداتیو و آپوپتوز منجر شده و درنتیجه از سلولها و بافتها محافظت میکند [39]. همچنین وانگ و همکاران نشان دادند رسوراترول از طریق فعالسازی مسیر سیگنالینگ SIRT1/Akt باعث سرکوب سمیت عصبی القاشده توسط روتنون شد [40].
بنابراین باتوجهبه افزایش فزاینده بیماریهای تحلیلبرنده عصبی و اختلالات تخریبکننده عصبی مرتبط با بسیاری از نوروتوکسینهای محیطی همانند روتنون و درک مسیرهای مختلف التهابی، آپوپتوزی و استرس اکسیداتیو در عملکرد روتنون و ازطرفی تعامل مسیرهای محافظتی ازجمله نقش محافظتی استروژن در این مسیرها و نقش تعدیلکننده رسوراترول بهعنوان پلیفنول شناختهشده با خواص ضدآپوپتوزی، ضدالتهابی و آنتیاکسیدانی در مطالعه حاضر، این فرایند با بهکارگیری حذف استروژن (برداشت تخمدان موشهای صحرایی) و تجویز روتنون بهعنوان سم کشاورزی در معرض مصرفکنندگان مواد غذایی و کشاورزان ارزیابی شد. ازنظر مولکولی بررسی تغییر بیان ژنهای Bcl2، Bax و فاکتور آنتیاکسیدانی سوپر اکسید دیسموتاز در هیپوکامپ موشها از اهداف مطالعه حاضر بود.
روشها
حیوانات
در این تحقیق از 30 سر موش صحرایی ماده نژاد ویستار از مرکز آزمایشگاهی حیوانات دانشگاه علوم پزشکی بابل به وزن تقریبی 20±170 گرم استفاده شد. حیوانات در شرایط استاندارد (12ساعت روشنایی و 12ساعت تاریکی، دسترسی آسان به آب و غذا و دمای اتاق 20-25 درجه سانتیگراد) نگهداری شدند. کلیه مراحل مطابق با دستور کمیته اخلاقی آزمایشهای حیوانی دانشگاه شهید چمران اهواز انجام شد.
گروهبندی
موشها بهطور تصادفی به 5 گروه و هر گروه شامل6 سر موش تقسیم شدند: گروه روتنون تزریق داخل صفاقی 5 میلیگرم بر کیلوگرم روتنون (سیگما آلدریچ)، گروه اوارکتومی (دوطرفه)،گروه اوارکتومی+رسوراترول، گروه اوارکتومی+روتنون، گروه اوارکتومی+ روتنون+رسوراترول، داروها روزانه بهمدت 3 هفته تجویز شدند. رسوراترول به مقدار 40 میلیگرم بر کیلوگرم گاواژ شد. در پایان موشها با تزریق داخل صفاقی کتامین80 میلیگرم بر کیلوگرم و زایلازین 5 میلیگرم بر کیلوگرم (آلفاسان هلند) بیهوش شدند. نمونههای بافت هیپوکامپ جدا شدند (تصویر شماره 1).

جراحی اوارکتومی
موشها با استفاده از تزریق داخل صفاقی مخلوط کتامین80 میلیگرم بر کیلوگرم و زایلازین 5 میلیگرم بر کیوگرم بیهوش شدند و توسط برش کوچکی در ناحیه میانی تحتانی شکم، تخمدانها خارج و انتهای لولههای فالوپ با استفاده از نخ بخیه بهطور کامل بسته شد. پس از بخیه فاشیا، عضلات و پوست، دوره ریکاوری بهمدت 10 روز سپری شد [41].
تزریق دارو
تزریق داروها 10 روز (دوره ریکاوری) بعد از انجام اوارکتومی انجام شد. روتنون با مقدار 5 میلیگرم بر کیلوگرم [42، 43] روزانه و بهمدت 21 روز بهصورت درون صفاقی تزریق شدند. رسوراترول بهصورت خوراکی بهمدت 21 روز، ساعت 8 تا 10 صبح با مقدار 40 میلیگرم بر کیلوگرم گاواژ شد [44].
جداسازی بافت هیپوکامپ
بهمنظور سنجش شاخصهای استرس اکسیداتیو و آپوپتوزی در بافت هیپوکامپ، موشها سربریده شدند و ناحیه هیپوکامپ مغز در دمای 80- درجه سانتیگراد تا زمان آزمایش نگهداری شد. به منظور سنجش شاخصهای آپوپتوزی به میکروتیوپ حاوی هیپوکامپ به میزان 200 میکرولیتر محلول RNAlater اضافه شد و بهمدت 48 ساعت در یخچال معمولی نگهداری شد. سپس با کمک سانتریفیوژ با دور 3500 بهمدت 10 دقیقه RNAlater از بافت هیپوکامپ جدا شد.
هموژن هیپوکامپ
جهت هموژن کردن بافت مغز با استفاده از ترازو بافت هیپوکامپ وزن شد و به میزان 3 برابر وزن نمونه به آن بافرفسفات سالین اضافه شد. سپس با استفاده از دستگاه هموژنایزر با دور 120 بهمدت 20 ثانیه بافتها هموژن شدند و با استفاده از دستگاه سانترفیوژ یخچالدار بهمدت 15 دقیقه در دمای 4 درجه سانتیگراد با دور 13000 مایع رویی جدا شد و تا زمان انجام آزمایش در یخچال 80- درجه سانتیگراد نگهداری شد.
اندازهگیری مقدار مالوندیآلدهید
جهت اندازهگیری مقدار مالوندیآلدهید در بافت هیپوکامپ از کیت سنجش مالوندیآلدهید شرکت طب پژوهان رازی استفاده شد. بهطور خلاصه در این روش مالوندیآلدهید موجود در نمونهها با اسید تیوباربیتوریک واکنش داده و به تولید ترکیب مالون دی آلدئید-تیوباربیتوریک اسید منجر میشود که به سادگی با روش رنگسنجی (530-540 نانومتر) اندازهگیری شد.
فعالیت آنزیم سوپراکسید دیسموتاز
سنجش میزان فعالیت آنزیم سوپراکسید دیسموتاز در بافت هیپوکمپ براساس درصد بازدارندگی این آنزیم در برابر اتواکسیداسیون پیروگالول برای هر نمونهها در مقایسه با نمونه بلانک محاسبه شد. تغییرات جذب در طول موج 40 نانومتر طی 3 دقیقه ثبت شد. بهطور خلاصه در این روش میزان بازدارندگی با اضافه کردن بافرسنجش به 760 میکرولیتر از سوپرناتانت بافت هیپوکامپ انجام شد.
روش تهیه بافرسنجش
به 50 سیسی از بافر سدیم فسفات (۵۰ میلیمولار) تهیه شده، 0/0018 گرم اتیلن دیآمین تترا استیک اسید (0/1 میلیمولار )و 0/003 گرم پیروگالول (0/48 میلیمولار) اضافه شد [45].
سنجش غلظت پروتئین
سنجش پروتئین در بافت هیپوکمپ براساس دستورالعمل یادشده در کیت سنجش پروتئین به روش برادفورد که از شرکت طب پژوهان رازی خریداری شده بود انجام شد. در این روش از تغییر رنگ کوماسی هنگام اتصال به پروتئین در محیط اسیدی استفاده میشود. بهطور خلاصه اندازهگیری پروتئین بدین روش انجام شد: ابتدا 10 میکرولیتر نمونه/استاندارد آلبومین سرم گاوی (بوین سرم آلبومین) به چاهک اضافه شد. سپس 190 میکرولیتر معرف تترا برومو فنول آبی به همه چاهکها اضافه شد و بهمدت 5 دقیقه در دمای اتاق انکوبه شود. درنهایت، بلافاصله جذب در طول موج 595 نانومتر خوانده شد.
اندازهگیری شاخصهای آپوپتوز
طراحی پرایمر
پس از دانلود فرمت FASTA توالی mRNA ژن BAX ،BCL2 و GAPDH موش صحرایی از پایگاه داده مرکز ملی اطلاعات بیوتکنولوژی، از نرمافزار الیگو برای طراحی پرایمر Forward و Reverse هریک از ژنها استفاده شد (جدول شماره 1). شرکت سیناژن سنتز پرایمرها را انجام شد. پرایمرهای لیوفیلیزه تهیهشده از شرکت سیناژن طبق دستورالعمل این شرکت با حجم مشخصی از آب دپس رقیق شد. پرایمر استوک اصلی با غلظت 100 پیکومول حاصل شد.

استخراج RNA
استخراج RNA از بافت هیپوکامپ براساس دستورالعمل یادشده در کیت استخراج RNA شرکت پارس توس انجام شد. بهطور خلاصه بدین روش انجام شد: ابتدا بافت هیپوکامپ با کمک اسکالپل به قطعات کوچک برش داده شد و20 میلیگرم از بافت به میکروتیوپ 1/5 میلیلیتری منتقل شد و 750 میکرولیتر محلول لیزکننده به آن اضافه شد. سپس بافت بهخوبی پیپتاژ شد و بعد 5 دقیقه انکوبه در دمای اتاق، 150 میکرولیتر کلروفرم به مخلوط اضافه شد و بهمدت 3 دقیقه در دمای اتاق انکوبه شد. سپس بهمدت 12 دقیقه در 13000 دور در دقیقه در دمای 4 درجه سانتیگراد سانتریفیوژ شد و فاز رویی به میکروتیوپ 1/5 میلیلیتری جدید منتقل شد و به میزان برابر اتانول70 درصد به آن اضافه شد. مخلوط به ستون چرخشی منتقل شد و بهمدت 1 دقیقه در 13000 دور در دقیقه در دمای 4 درجه سانتیگراد سانتریفیوژ شد. سپس محتویات کالکشن تیوپ تخلیه شد. در مرحله بعد 700 میکرولیتر محلول مراحل شستوشو اضافه و بهمدت 1 دقیقه در 13000 دور در دقیقه در دمای 4 درجه سانتیگراد سانتریفیوژ شد. محتویات کالکشن تیوپ تخلیه شد (مرحله 7 تکرار شد). بهمدت 2 دقیقه در 13000 دور در دقیقه در دمای 4 درجه سانتیگراد سانتریفیوژ شد و سپس Spin Column به میکروتیوپ 1/5 میلیلیتری جدید منتقل شد. در نهایت50 میکرولیتر آب دپس اضافه شد و 3 دقیقه در دمای اتاق انکوبه شد. بهمدت 1 دقیقه در 13000 دور در دقیقه در دمای 4 درجه سانتیگراد سانتریفیوژ شد و RNA استخراجشده در دمای 80- ذخیره شد.
سنجش کیفیت و کمیت استخراج RNA
به منظور بررسی کیفیت RNA استخراجشده و عدم آلودگی به پروتئین و DNA از دستگاه نانودراپ استفاده شد. در این روش 2 میکرولیتر از هر نمونه در مقابل بلانک خوانده شد. غلظت RNA برحسب نانوگرم، نسبت جذب 260/280 نانومتر (اگر اعداد حاصل از آن در حدود 0/15±2 باشد نشاندهنده خلوص بالای RNA میباشد)، نسبت جذب 260/230 نانومتر (اگر اعداد حاصل از آن در حدود 1/8تا 2/2 باشد درصد خلوص مناسب است) برای هر نمونه به دست آمد.
سنتز cDNA
به منظور سنتز cDNA از کیت استخراج RNA شرکت پارس توس مشهد استفاده شد. در این روش به کمک آنزیم ترانسکریپتاز معکوس از RNAهای استخراجشده در مراحل قبلی، مولکول DNA مکمل یا همان (Complementary DNA) که موسوم به cDNA است، ساخته شد. بهطور خلاصه ابتدا، نمونههای RNA استخراجشده اسپین شدند و به هر نمونه، مقدار مناسب مسترمیکس طبق دستورالعمل کیت اضافه شد و دوباره چرخانده شدند. در نهایت نمونهها به دستگاه ترموسایکلر منتقل شدند و به ترتیب در3 دمای مختلف قرار گرفتند. دمای 25 درجه سانتیگراد، جهت اتصال پرایمر، سپس اتصال آنزیم و سنتز cDNA است. دمای 85 درجه سانتیگراد، جهت غیرفعال کردن آنزیم است و دمای سوم جهت خنک کردن نمونه. پس از اتمام واکنش، نمونهها به فریز منفی 20 درجه سانتیگراد منتقل و در آنجا نگهداری شدند.
بررسی کارایی پرایمرها
جهت بررسی کارایی پرایمرها، رقت سریالی از cDNA نمونه با غلظت مشخص تهیه شد و Real-Time PCR این رقتها طبق پروتکل بیانشده در بخش Real-Time PCR انجام شد. با تنظیم دستگاه، نمودار استاندارد رسم شد. باتوجهبه شیب خط که دستگاه نشان داد و فرمول مربوط به کارایی، کارایی پرایمر محاسبه شد.
Real-Time PCR
بعد از سنتز cDNA از RNA استخراجشده به روشی که در سطور قبل بیان شد. به منظور تعیین میزان بیان ژنهای موردنظر از کیت سایبرگرین ریل تایم PCR شرکت SimBio استفاده شد. مواد موردنیاز برای هر نمونه طبق دستورالعمل کیت محاسبه شد. واکنشهای PCR با انکوباسیون 10 دقیقهای در دمای 95 درجه سانتیگراد آغاز شد و سپس 40 سیکل 95 درجه سانتیگراد بهمدت 15 ثانیه، 62 درجه سانتیگراد (برای Bcl-2) و 55 درجه سانتیگراد (برای Bax) برای 30 ثانیه و 72 درجه سانتیگراد بهمدت 30 ثانیه آغاز شد. جهت نرمال کردن دادهها از ژن کنترل داخلی گلیسرآلدئید3 فسفات دهیدروژناز (GAPDH) استفاده شد. روش پافل برای تجزیهوتحلیل دادههای واکنش زنجیرهای پلیمراز در استفاده شده است. وجود قله منفرد در منحنی ذوب هریک از نمونهها مؤید تکثیر اختصاصی محصول Real-Time PCR بود.
اندازهگیری میزان بیان ژن
بعد از انجام Real-Time PCR مقادیر CT بهدستآمده برای هریک از نمونهها و برای هریک از ژنهای BAX و Bcl2 و ژن کنترل داخلی (GAPDH) از دستگاه استخراج شد. جهت بررسی میزان بیان هریک از ژنها از فرمول پافل استفاده شد.
تحلیل آماری
دادههای حاصل از سنجشهای بیوشیمیایی در نرمافزار SPSS نسخه 20با آنالیز آزمون آنووا (آزمون توکی) بررسی شدند و سطح معنیدار آزمونها P کمتر از 0/05 درنظر گرفته شد.
یافتهها
مقدار مالوندیآلدهید
با حذف تخمدانها بیشترین مقدار مالوندیآلدهید در گروه اوارکتومی+روتنون (40/06±2/22 میکرومول بر گرم) ثبت شد که افزایش معنیداری را نسبت به گروه اوارکتومی (32/92±1/12 میکرومول بر گرم) نشان داد (0/001>P). مقدار مالوندیآلدهید در گروه اوارکتومی+رسوراترول (21/42±0/97 میکرومول بر گرم) نسبت به گروه اوارکتومی کاهش معنیداری نشان داد (0/001>P). رسوراترول به کاهش معنیدار مالوندیآلدهید در گروه اوارکتومی+روتنون+رسوراترول(22/35±1/91 میکرومول بر گرم) نسبت به گروه اوارکتومی+روتنون منجر شد (0/001>P) (تصویر شماره 2).

فعالیت آنزیم سوپراکسیددیسموتاز (SOD)
فعالیت آنزیم سوپراکسیددیسموتاز (16/36±0/61 واحد در میلیگرم) در گروه اوارکتومی+ روتنون کاهش معنیداری را نسبت به گروه اوارکتومی (70/69±1/58 واحد در میلیگرم) نشان داد (0/001≥P). دریافت رسوراترل در گروه اوارکتومی+رسوراترول به افزایش معنیدار فعالیت این آنزیم (77/02±2/2 واحد در میلیگرم) نسبت به گروه اوارکتومی منجر نشد. رسوراترول در گروه اوارکتومی+روتنون+رسوراترول نیز به افزایش معنیدار فعالیت آنزیم سوپراکسیددیسموتاز (57/9±1/94 واحد در میلیگرم) نسبت به گروه اوارکتومی+روتنون منجر شد (0/001>P) (تصویر شماره 3).

میزان بیان ژن BAX
باتوجهبه نتایج مندرج در تصویر شماره 4 بیشترین میزان بیان ژن BAX در گروه اوارکتومی+روتنون (5/9±0/05) ثبت شد که افزایش معنیداری را نسبت به گروه اوارکتومی (1/3±0/11)نشان داد (0/001>P). کاهش میزان بیان ژن BAX در گروه اوارکتومی+رسوراترول (1/2±0/11) نسبت به گروه اوارکتومی معنیدار نبود. رسوراترول به کاهش معنیدار میزان بیان ژن BAX در گروه اوارکتومی+ روتنون+رسوراترول (4/5±0/11) نسبت به گروه اوارکتومی+روتنون منجر شد (0/001>P).

میزان بیان ژن Bcl2
کمترین میزان بیان ژن Bcl2 در گروه اوارکتومی+روتنون (5/9±0/05) ثبت شد که کاهش معنیداری را نسبت به گروه اوارکتومی (0/93±0/05) نشان داد (0/001>P). میزان بیان ژن Bcl2 در گروه اوارکتومی+رسوراترول (1/13±0/03) به افزایش معنیدار این شاخص نسبت به گروه اوارکتومی منجر نشد. رسوراترول به افزایش معنیدار میزان بیان ژن Bcl2 در گروه اوارکتومی+روتنون+رسوراترول (0/78±0/05) نسبت به گروه اوارکتومی+روتنون منجر شد (0/001>P) (تصویر شماره 5).

بحث
در مطالعه حاضر از روتنون بهعنوان سم کشاورزی ایجادکننده اختلالات عصبی و از برداشتن تخمدان موشهای صحرایی(حذف استروژن) جهت ایجاد مدل تجربی منوپوز استفاده شد و اثر حمایتی رسوراترول در برابر این آسیب در هیپوکامپ ارزیابی شد. بررسی بیان ژنهای Bcl2 و Bax، فعالیت آنزیم سوپراکسید دیسموتازو مقدار مالوندیآلدئید در هیپوکامپ موشها از اهداف این مطالعه بود.
نتایج نشان داد روتنون در حضور استروژن بهطور قابلتوجهی به کاهش فعالیت سوپر اکسید دیسموتاز و همچنین بیان ژن Bcl2 و افزایش معنیدار مقدار مالوندیآلدهید و میزان بیان ژن BAX در هیپوکامپ منجر شد.
در همین راستا مطالعات یارمحمدی، پامیز و شیخپور نشان دادند روتنون باافزایش سطح بیومارکرهای استرس اکسیداتیو و کاهش پارامترهای آنتیاکسیدانی به ایجاد بیماری تحلیلبرنده عصبی پارکینسون در مدل حیوانی منجر شد. مواجهه با روتنون، مسیر پیامرسانی Keap1-Nrf2-ARE، عمدهترین مکانیسم دفاعی در برابر استرس اکسیداتیو را تحت تأثیر قرار میدهد [9-11].
بنابراین شاخصهای استرس اکسیداتیو و آپوپتوز یادشده در سطور قبل، برخی از نشانگرهای پاتولوژیک مواجهه با نوروتوکسین و در نتیجه ابتلای به بیماریهای تحلیلبرنده عصبی بود و تنظیم و بهبود این نشانگرها، اثرات سودمند و مفیدی در برابر تخریب عصبی ناشی از آسیب مغزی نشان داده است. باتوجهبه عدم منع مصرف روتنون و در معرض قرار گرفتن افراد بهطور غیرمستقیم و مستقیم بهویژه کشاورزان، به تقویت و استفاده از عوامل محافظتی در برابر این نوروتوکسین نیاز است. بنابراین، تصور میشود فعالسازی سیگنالینگ Nrf2 بهعنوان تنظیمکننده اصلی بسیاری از ژنهای دخیل در استرس آنتیاکسیدانی و درنهایت افزایش فعالیت آنتیاکسیدانهای درونزاد و همچنین تنظیم بیان ژنهای دخیل در مکانیسم آپوپتوز، استراتژی امیدوارکننده برای پیشگیری، درمان و یا جلوگیری از پیشرفت آسیب باشد. اثرات یائسگی بر تشدید بیماریهای تخریبکننده عصبی، بهخوبی در مدلهای سلولی، حیوانی و مطالعات بالینی نشان داده شده است [46].
براساس نتایج حاصل از مطالعه حاضر، حذف تخمدان در موشهای صحرایی بهطور قابلتوجهی به کاهش فعالیت آنزیم سوپراکسیددیسموتاز، بیان ژن Bcl2، افزایش معنیدار بیان ژن BAX و مقدار مالوندیآلدهید در هیپوکامپ منجر شد. از طرفی کاهش شاخص آنتیاکسیدانی و آنتیآپوپتوزی و افزایش شاخص پروآپوپتوزی یادشده در پژوهش حاضر گروههایی که تزریق روتنون همراه با حذف تخمدان بود، تغییرات بیشتری نسبت به گروههایی که در حضور تخمدان یا بهعبارتی در حضور استروژن در معرض روتنون قرار گرفتند داشتند و مؤید این مطلب است که حذف تخمدان بهواسطه کاهش استروژن به تشدید فاکتورهای استرس اکسیداتیو و آپوپتوز ناشی از آسیب در بافت هیپوکامپ مغز منجر میشود.
استروژن میتواند با بهبود فعالیت آنتیاکسیدانی درونزا و تنظیم بیان پروتئینهای دخیل در مرگ برنامهریزیشده سلول، استرس اکسیداتیو و آپوپتوز و درنتیجه تخریب عصبی را در مدل حیوانی SWI و مدل سمیت عصبی ناشی از روتنون و 6-هیدروکسی دوپامین را کاهش دهد [47-49].
باتوجهبه عملکرد شناختی و نقش محافظت عصبی استروژن حاصل از تخمدانها در دستگاه عصبی و نقش محافظتی آن در بیماریهای تحلیلبرنده عصبی ازجمله آلزایمر و پارکینسون، در چند دهه گذشته در استروژن درمانی استفاده میشود، اما عوارض جانبی ناشی از استفاده طولانیمدت آن که خطر ابتلا به برخی بیماریها را افزایش میدهد، بسیار نگرانکننده است [24]. باتوجهبه نقش محوری استرس اکسیداتیو در شروع و پیشرفت بیماریهای تحلیلبرنده عصبی و تشدید استرس اکسیداتیو در افراد منوپوز در معرض آفتکش روتنون، جستوجو برای ترکیبات با خواص آنتیاکسیدانی توجه بسیاری را به خود جلب میکند.
ترکیبهای طبیعی با افزایش فعالیت آنتیاکسیدانی و یا با جلوگیری از اثرات مضر ROS، استرساکسیداتیو ناشی از روتنون را کاهش میدهند. بنابراین آنتیاکسیدانهای طبیعی مانند رسوراترول میتواند در این شرایط مفید باشند. از اثرات بیولوژی رسوراترول شامل خواص آنتیاکسیدانی، ضدالتهابی، ضدآپوپتوزی و خواص اتوفاژیک و همچنین بهبود جریانخون مغزی و افزایش انعطافپذیری سیناپسی است [33]. درمجموع به واسطه خاصیت عبور از سد خونی-مغزی [50] و نقش تنظیمی رسوراترول در چندین مسیر سیگنالینگ عصبی، به انتخاب این آنتیاکسیدان بهعنوان کاندیدای اثر محافظت نورونی منجر شد.
در مطالعه حاضر رسوراترول فعالیت SOD و بیان ژن Bcl2 را در هیپوکامپ گروه اوارکتومی+روتنون+رسوراترول بهصورت معنیداری افزایش داد. علاوهبراین رسوراترول بیان ژن BAX و مقدار MDA را بهصورت معنیداری کاهش داد.
در راستای نقش محافظت نورونی رسوراترول، مطالعه کومار و همکاران در سال 2011 نشان داد تجویز رسوراترول با مهار ROS در مخچه و القای انتقال Nrf2 از سیتوپلاسم به هسته و تنظیم بیان و فعالیت ژنهای هدف پاییندست آن مانند سوپراکسیددیسموتاز، NADPH کوئینون اکسید و ردوکتاز 1 از آپوپتوز ناشی از اتانول جلوگیری میکند [51]، مسیر پیامرسانی Nrf2/ARE که از مسیرهای سرکوبشونده توسط نوروتوکسین روتنون بود و مکانیسم محافظتی استروژن میباشد و باتوجهبه آنچه در مطالب یادشده، رسوراترول نیز با تنظیم افزایشی این مسیر و افزایش آنزیمهای آنتیاکسیدانی نقش محافظت عصبی خود را ایفا میکند. بنابراین در پژوهش حاضر مسیر پیامرسانی Nrf2/ARE و بهویژه تنظیم بیان پروتئین Nrf2 میتواند مکانیسم احتمالی مشترکی باشد که بهواسطه آن رسوراترول و استروژن اثر خود را در گروههایی که در حضور استروژن و رسوراترول، تحت تأثیر روتنون قرار گرفتند اعمال کردند.
علاوهبراین سانگ و همکاران در سال2020 نشان دادند رسوراترول بهواسطه تنظیم افزایشی نسبت Bcl-2/Baxو تنظیم کاهشی بیان پروتئین Bax و سیتوکروم C باعث کاهش آپوپتوز ناشی از استرس اکسیداتیو در هیپوکامپ مدل پیری موش صحرایی میشود، همچنین رسوراترول به تنظیم سطوح SOD ،CAT و GSHو سطح MDA در هیپوکامپ منجر شد [18] که با تأثیر رسوراترول بر شاخص اکسیداتیوی و آپوپتوزی پژوهش حاضر مطابقت داشت. همچنین اوتی و همکاران در سال2022 نشان دادند رسوراترول با کاهش کاسپاز 3 و 9 و نسبت Bax/Bcl-2 میتواند بهعنوان آنتیاکسیدان و عامل درمانی در برابر استرس اکسیداتیو عصبی ناشی از هیپوکسی و بیماریهای تحلیلبرنده عصبی عمل کند [52] که تمام این مطالعات مشابه با نتایج پژوهش حاضر درمورد نقش محافظت نورونی رسوراترول بهواسطه تنظیم افزایشی شاخصهای آنتیاکسیدانی و آنتیآپوپتوزی و تنظیم کاهشی شاخص آپوپتوزی BAX بودند.
نتیجهگیری
بهطور خلاصه، اوارکتومی به کاهش فعالیت آنزیم سوپراکسیددیسموتاز، افزایش مقدار مالوندیآلدهید و بیان ژن Bax منجر شد اما تأثیری بر بیان ژن Bcl2 نداشت. روتنون همراه با اوارکتومی کاهش قابلتوجهی بر فعالیت آنزیم و بیان ژن Bcl2 و افزایش چشمگیری بر مقدار MDA و میزان بیان ژن Bax نشان داد. مصرف رسوراترول در موشهای گروه اوارکتومی به کاهش قابلتوجه در مقدار MDA منجر شد و تأثیر چندانی بر بیان ژن Bcl2 و Bax و فعالیت آنزیم سوپراکسیددیسموتاز نداشت. درصورتیکه مصرف همزمان رسوراترول و روتنون در موشهای اوارکتومیشده به افزایش قابلتوجهی در فعالیت این آنزیم و میزان بیان ژن Bcl2 و همچنین کاهش مقدار MDA و بیان ژن Bax منجر شد. بهطور کلی، رسوراترول توانست اثر روتنون و نبود استروژن را در تغییرات ناشی از روتنون و اوارکتومی را در آپوپتوز و استرس اکسیداتیو اصلاح کند.
ازاینرو پژوهش حاضر نیز هم راستا با دیگر پژوهشها پیشنهاد میکند از رسوراترول برای بهبود بیومارکرهای کلیدی مؤثر در بیماریهای تخریب عصبی در افراد با ریسک بالای ابتلا به این بیماریها بهویژه کشاورزان و افراد منوپوز استفاده شود. همچنین جهت تکمیل و تداوم این کار تحقیقاتی، بررسی تغییرات پروتئینهای Nrf2 ،SIRT و NF-κB و مسیر پیامرسانی آنها و وابستگی و تأثیر آنها بر شاخصهای موردبررسی در پژوهش حاضر و همچنین بررسی تأثیر جایگزینی استروژن درمانی با غلظتهای مختلف به جای استروژن درونزا (ترشحشده از تخمدان) بر شاخصهای استرس اکسیداتیو و آپوپتوزی پیشنهاد میشود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه در کمیته اخلاق دانشگاه شهید چمران اهواز (EE.1400.3.02.10568) تصویب شد.
حامی مالی
این تحقیق هیچگونه کمک مالی از سازمانهای تأمین مالی در بخشهای عمومی، تجاری یا غیرانتفاعی دریافت نکرد.
مشارکت نویسندگان
مفهومسازی و طراحی مطالعه: حسین نجفزاده ورزی، احمدعلی معاضدی و محبوبه آقاگلزاده؛ تحلیل و تفسیر دادهها و تحلیل آماری: محبوبه آقاگلزاده و حسین نجفزاده ورزی؛ تهیه پیشنویس دستنوشته: محبوبه آقاگل زاده؛ جذب منابع مالی و حمایت اداری، فنی یا موادی: احمدعلی معاضدی و حسین نجفزاده ورزی؛ نظارت بر مطالعه: حسین نجفزاده ورزی، احمدعلی معاضدی، هادی پارسیان؛ بازبینی نقادانه دستنوشته:همه نویسندگان.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان از حمایتهای مادی و معنوی گروه زیستشناسی دانشگاه شهید چمران اهواز و معاونت پژوهشی دانشگاه شهید چمران اهواز برای تخصیص پژوهانه و دانشگاه علوم پزشکی بابل در مراحل اجرای این پژوهش قدردانی میکنند.
References
- Babazadeh A, Vahed FM, Liu Q, Siddiqui SA, Kharazmi MS, Jafari SM. Natural bioactive molecules as neuromedicines for the treatment/prevention of neurodegenerative diseases. ACS Omega. 2023; 8(4):3667-83. [DOI:10.1021/acsomega.2c06098] [PMID]
- Davenport F, Gallacher J, Kourtzi Z, Koychev I, Matthews PM, Oxtoby NP, et al. Neurodegenerative disease of the brain: A survey of interdisciplinary approaches. Journal of the Royal Society Interface. 2023; 20(198):20220406. [DOI:10.1098/rsif.2022.0406] [PMID]
- Teleanu DM, Niculescu AG, Lungu II, Radu CI, Vladâcenco O, Roza E, et al. An overview of oxidative stress, neuroinflammation, and neurodegenerative diseases. International Journal of Molecular Sciences. 2022; 23(11):5938. [DOI:10.3390/ijms23115938] [PMID]
- Richardson JR, Fitsanakis V, Westerink RHS, Kanthasamy AG. Neurotoxicity of pesticides. Acta Neuropathologica. 2019; 138(3):343-62. [DOI:10.1007/s00401-019-02033-9] [PMID]
- Sivagurunathan N, Gnanasekaran P, Calivarathan L. Mitochondrial toxicant-induced neuronal apoptosis in Parkinson's Disease: What we know so far. Degenerative Neurological and Neuromuscular Disease. 2023; 13:1-13. [DOI:10.2147/DNND.S361526] [PMID]
- Oguh CE, Okpaka CO, Ubani CS, Okekeaji U, Joseph PS, Amadi EU. Natural pesticides (biopesticides) and uses in pest management-A critical review. Asian Journal of Biotechnology and Genetic Engineering. 2019; 2(3):1-18. [Link]
- Chiaradia E, Renzone G, Scaloni A, Caputo M, Costanzi E, Gambelunghe A, et al. Protein carbonylation in dopaminergic cells exposed to rotenone. Toxicology Letters. 2019; 309:20-32. [DOI:10.1016/j.toxlet.2019.04.002] [PMID]
- Lawana V, Cannon JR. Rotenone neurotoxicity: Relevance to Parkinson's disease. Advances in Neurotoxicology. 2020; 4:209-54. [DOI:10.1016/bs.ant.2019.11.004]
- Pamies D, Block K, Lau P, Gribaldo L, Pardo CA, Barreras P, et al. Rotenone exerts developmental neurotoxicity in a human brain spheroid model. Toxicology and Applied Pharmacology. 2018; 354:101-14. [DOI:10.1016/j.taap.2018.02.003] [PMID]
- Sheikhpour E, Mard SA, Farbood Y, Bavarsad K, Sarkaki A. The effects of gallic acid and vagotomy on motor function, intestinal transit, brain electrophysiology and oxidative stress alterations in a rat model of Parkinson's disease induced by rotenone. Life Sciences. 2023; 315:121356. [DOI:10.1016/j.lfs.2022.121356] [PMID]
- Yarmohammadi F, Wallace Hayes A, Najafi N, Karimi G. The protective effect of natural compounds against rotenone‐induced neurotoxicity. Journal of Biochemical and Molecular Toxicology. 2020; 34(12):e22605. [DOI:10.1002/jbt.22605] [PMID]
- Kavuri S, Sivanesan S, Rajagopalan V. Oxidative stress and antioxidant status in rotenone induced rat Model of Parkinson's Disease. International Journal of Research in Pharmaceutical Sciences. 2020; 11(1):1-5. [DOI:10.26452/ijrps.v11i1.1776]
- McCord JM, Edeas MA. SOD, oxidative stress and human pathologies: A brief history and a future vision. Biomedicine & Pharmacotherapy. 2005; 59(4):139-42. [DOI:10.1016/j.biopha.2005.03.005] [PMID]
- Aborode AT, Pustake M, Awuah WA, Alwerdani M, Shah P, Yarlagadda R, et al. Targeting oxidative stress mechanisms to treat Alzheimer's and Parkinson's disease: A critical review. Oxidative Medicine and Cellular Longevity. 2022; 2022:7934442. [DOI:10.1155/2022/7934442] [PMID]
- Yan W, Wu J, Song B, Luo Q, Xu Y. Retraction Note to: Treatment with a brain-selective prodrug of 17β-estradiol improves cognitive function in Alzheimer's disease mice by regulating klf5-NF-κB pathway. Naunyn-Schmiedeberg's Archives of Pharmacology. 2021; 394(9):1989. [DOI:10.1007/s00210-021-02121-2] [PMID]
- Makav M, Eroğlu HA. Recuperative effect of estrogen on rotenone-induced experimental model of Parkinson's disease in rats. Environmental Science and Pollution Research. 2021; 28(17):21266-75. [DOI:10.1007/s11356-020-11985-5] [PMID]
- Shvetcov A, Ruitenberg MJ, Delerue F, Gold WA, Brown DA, Finney CA. The neuroprotective effects of estrogen and estrogenic compounds in spinal cord injury. Neuroscience & Biobehavioral Reviews. 2023; 146:105074. [DOI:10.1016/j.neubiorev.2023.105074] [PMID]
- Song YJ, Li SR, Li XW, Chen X, Wei ZX, Liu QS, et al. The effect of estrogen replacement therapy on Alzheimer's disease and Parkinson's disease in postmenopausal women: A meta-analysis. Frontiers in Neuroscience. 2020; 14:157. [DOI:10.3389/fnins.2020.00157] [PMID]
- Vegeto E, Benedusi V, Maggi A. Estrogen anti-inflammatory activity in brain: A therapeutic opportunity for menopause and neurodegenerative diseases. Frontiers in Neuroendocrinology. 2008; 29(4):507-19. [DOI:10.1016/j.yfrne.2008.04.001] [PMID]
- Banks WA. Brain meets body: The blood-brain barrier as an endocrine interface. Endocrinology. 2012; 153(9):4111-9. [DOI:10.1210/en.2012-1435] [PMID]
- Won CK, Kim MO, Koh PO. Estrogen modulates Bcl-2 family proteins in ischemic brain injury. Journal of Veterinary Medical Science. 2006; 68(3):277-80. [DOI:10.1292/jvms.68.277] [PMID]
- Torrens-Mas M, Pons DG, Sastre-Serra J, Oliver J, Roca P. Sexual hormones regulate the redox status and mitochondrial function in the brain. Pathological implications. Redox Biology. 2020; 31:101505. [DOI:10.1016/j.redox.2020.101505] [PMID]
- Azam S, Lange T, Huynh S, Aro AR, von Euler-Chelpin M, Vejborg I, et al. Hormone replacement therapy, mammographic density, and breast cancer risk: A cohort study. Cancer Causes & Control. 2018; 29(6):495-505. [DOI:10.1007/s10552-018-1033-0] [PMID]
- Cagnacci A, Venier M. The controversial history of hormone replacement therapy. Medicina. 2019; 55(9):602. [DOI:10.3390/medicina55090602] [PMID]
- Acero N, Ortega T, Villagrasa V, Leon G, Muñoz‐Mingarro D, Castillo E, et al. Phytotherapeutic alternatives for neurodegenerative dementias: Scientific review, discussion and therapeutic proposal. Phytotherapy Research. 2023; 37(3):1176-211. [DOI:10.1002/ptr.7727] [PMID]
- Luthra R, Roy A. Role of medicinal plants against neurodegenerative diseases. Current Pharmaceutical Biotechnology. 2022; 23(1):123-39. [DOI:10.2174/1389201022666210211123539] [PMID]
- Rana K, Gautam P. A review on antioxidants as therapeutic in use of oxidative stress and neurodegenerative disease. International Journal of Pharmaceutical Quality Assurance. 2022; 13(1):77-82. [Link]
- Teleanu RI, Chircov C, Grumezescu AM, Volceanov A, Teleanu DM. Antioxidant therapies for neuroprotection-A review. Journal of Clinical Medicine. 2019; 8(10):1659. [DOI:10.3390/jcm8101659] [PMID]
- Fonseca-Santos B, Chorilli M. The uses of resveratrol for neurological diseases treatment and insights for nanotechnology based-drug delivery systems. International Journal of Pharmaceutics. 2020; 589:119832. [DOI:10.1016/j.ijpharm.2020.119832] [PMID]
- Meng T, Xiao D, Muhammed A, Deng J, Chen L, He J. Anti-inflammatory action and mechanisms of resveratrol. Molecules. 2021; 26(1):229. [DOI:10.3390/molecules26010229] [PMID]
- Gu J, Li Z, Chen H, Xu X, Li Y, Gui Y. Neuroprotective effect of trans-resveratrol in mild to moderate Alzheimer disease: A randomized, double-blind trial. Neurology and Therapy. 2021; 10(2):905-17. [DOI:10.1007/s40120-021-00271-2] [PMID]
- Jardim FR, de Rossi FT, Nascimento MX, da Silva Barros RG, Borges PA, Prescilio IC, et al. Resveratrol and brain mitochondria: A review. Molecular Neurobiology. 2018; 55(3):2085-101. [DOI:10.1007/s12035-017-0448-z] [PMID]
- Gomes BAQ, Silva JPB, Romeiro CFR, Dos Santos SM, Rodrigues CA, Gonçalves PR, et al. Neuroprotective mechanisms of resveratrol in Alzheimer's disease: Role of SIRT1. Oxidative Medicine and Cellular Longevity. 2018; 2018:8152373.[DOI:10.1155/2018/8152373] [PMID]
- Acungil ZK, Nacar T. Effect of resveratrol on a penicillin-induced epilepsy model in rats. Archives of Epilepsy. 2022; 28(2):78-84. [Link]
- Chinraj V, Raman S. Neuroprotection by resveratrol: A review on brain delivery strategies for Alzheimer's and Parkinson's disease. Journal of Applied Pharmaceutical Science. 2022; 12(7):001-17. [DOI:10.7324/JAPS.2022.120701]
- Kung HC, Lin KJ, Kung CT, Lin TK. Oxidative stress, mitochondrial dysfunction, and neuroprotection of polyphenols with respect to resveratrol in Parkinson's disease. Biomedicines. 2021; 9(8):918. [DOI:10.3390/biomedicines9080918] [PMID]
- Sarroca S, Gatius A, Rodríguez-Farré E, Vilchez D, Pallàs M, Griñán-Ferré C, et al. Resveratrol confers neuroprotection against high-fat diet in a mouse model of Alzheimer's disease via modulation of proteolytic mechanisms. The Journal of Nutritional Biochemistry. 2021; 89:108569. [DOI:10.1016/j.jnutbio.2020.108569]
- Zamora-Bello I, Rivadeneyra-Domínguez E, Rodríguez-Landa JF. Anticonvulsant effect of turmeric and resveratrol in lithium/pilocarpine-induced status epilepticus in wistar rats. Molecules. 2022; 27(12):3835. [DOI:10.3390/molecules27123835]
- Truong VL, Jun M, Jeong WS. Role of resveratrol in regulation of cellular defense systems against oxidative stress. Biofactors. 2018; 44(1):36-49. [DOI:10.1002/biof.1399] [PMID]
- Wang H, Dong X, Liu Z, Zhu S, Liu H, Fan W, et al. Resveratrol suppresses rotenone‐induced neurotoxicity through activation of SIRT1/Akt1 signaling pathway. The Anatomical Record. 2018; 301(6):1115-25. [DOI:10.1002/ar.23781] [PMID]
- Sharifi F, Reisi P, Malek M. The effects of estrogen on passive avoidance memory impairment induced by acute kidney injury in ovariectomized rats. Journal of Isfahan Medical School. 2019; 37(515):86-92. [DOI:10.22122/jims.v37i515.11140]
- Cannon JR, Tapias V, Na HM, Honick AS, Drolet RE, Greenamyre JT. A highly reproducible rotenone model of Parkinson's disease. Neurobiology of Disease. 2009; 34(2):279-90. [DOI:10.1016/j.nbd.2009.01.016] [PMID]
- Jiang XW, Qiao L, Feng XX, Liu L, Wei QW, Wang XW, et al. Rotenone induces nephrotoxicity in rats: Oxidative damage and apoptosis. Toxicology Mechanisms and Methods. 2017; 27(7):528-36. [DOI:10.1080/15376516.2017.1333553] [PMID]
- Abdu SB, Al-Bogami FM. Influence of resveratrol on liver fibrosis induced by dimethylnitrosamine in male rats. Saudi Journal of Biological Sciences. 2019; 26(1):201-9. [DOI:10.1016/j.sjbs.2017.09.003] [PMID]
- Genet S, Kale RK, Baquer NZ. Alterations in antioxidant enzymes and oxidative damage in experimental diabetic rat tissues: effect of vanadate and fenugreek (Trigonella foenum graecum). Molecular and Cellular Biochemistry. 2002; 236(1-2):7-12. [DOI:10.1023/A:1016103131408] [PMID]
- Cheng YJ, Lin CH, Lane HY. From menopause to neurodegeneration-molecular basis and potential therapy. International Journal of Molecular Sciences. 2021; 22(16):8654. [DOI:10.3390/ijms22168654] [PMID]
- Luine V, Frankfurt M. Estrogenic regulation of memory: The first 50 years. Hormones and Behavior. 2020; 121:104711. [DOI:10.1016/j.yhbeh.2020.104711] [PMID]
- Saeed K, Jo MH, Park JS, Alam SI, Khan I, Ahmad R, et al. 17β-Estradiol abrogates oxidative stress and neuroinflammation after cortical stab wound injury. Antioxidants. 2021; 10(11):1682. [DOI:10.3390/antiox10111682] [PMID]
- Shen D, Tian X, Zhang B, Song R. Mechanistic evaluation of neuroprotective effect of estradiol on rotenone and 6-OHDA induced Parkinson's disease. Pharmacological Reports. 2017; 69(6):1178-85. [DOI:10.1016/j.pharep.2017.06.008] [PMID]
- Baur JA, Sinclair DA. Therapeutic potential of resveratrol: The in vivo evidence. Nature Reviews Drug Discovery. 2006; 5(6):493-506. [DOI:10.1038/nrd2060] [PMID]
- Kumar A, Singh CK, LaVoie HA, DiPette DJ, Singh US. Resveratrol restores Nrf2 level and prevents ethanol-induced toxic effects in the cerebellum of a rodent model of fetal alcohol spectrum disorders. Molecular Pharmacology. 2011; 80(3):446-57. [DOI:10.1124/mol.111.071126] [PMID]
- Auti A, Alessio N, Ballini A, Dioguardi M, Cantore S, Scacco S, et al. Protective effect of resveratrol against hypoxia-induced neural oxidative stress. Journal of Personalized Medicine. 2022; 12(8):1202. [DOI:10.3390/jpm12081202] [PMID]
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |









