دوره 33، شماره 2 - ( 4-1403 )
جلد 33 شماره 2 صفحات 215-202 |
برگشت به فهرست نسخه ها
Research code: 2079
Ethics code: IR.GUMS>REC.1397.092
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Pourkazem S, Sharifi Rad M, Baghersalimi A, Salehi S, Enshaei M, Aminzadeh V, et al . Investigating the Effect of Iron Chelation Therapy With Deferasirox on Liver Aminotransferases Levels in Transfusion-dependent β-thalassemia Patients. JGUMS 2024; 33 (2) :202-215
URL: http://journal.gums.ac.ir/article-1-2621-fa.html
URL: http://journal.gums.ac.ir/article-1-2621-fa.html
پورکاظم شایان، شریفی راد محمدرضا، باقرسلیمی عادل، صالحی سوده، انشائی مرسده، امین زاده وحید، و همکاران.. تأثیر آهنزدایی با دفرازیروکس بر سطح آنزیمهای کبدی بیماران β-تالاسمی وابسته به تزریق خون. مجله علوم پزشکی گیلان. 1403; 33 (2) :202-215
شایان پورکاظم1 

 ، محمدرضا شریفی راد1
، محمدرضا شریفی راد1 

 ، عادل باقرسلیمی1
، عادل باقرسلیمی1 

 ، سوده صالحی1
، سوده صالحی1 

 ، مرسده انشائی1
، مرسده انشائی1 

 ، وحید امین زاده1
، وحید امین زاده1 

 ، بهرنگ معتمد2
، بهرنگ معتمد2 

 ، بهرام دربندی*1
، بهرام دربندی*1 




 ، محمدرضا شریفی راد1
، محمدرضا شریفی راد1 

 ، عادل باقرسلیمی1
، عادل باقرسلیمی1 

 ، سوده صالحی1
، سوده صالحی1 

 ، مرسده انشائی1
، مرسده انشائی1 

 ، وحید امین زاده1
، وحید امین زاده1 

 ، بهرنگ معتمد2
، بهرنگ معتمد2 

 ، بهرام دربندی*1
، بهرام دربندی*1 


1- مرکز تحقیقات بیماریهای کودکان، دانشگاه علومپزشکی گیلان، رشت، ایران.
2- گروه بیماریهای داخلی،دانشکده پزشکی، بیمارستان رازی، دانشگاه علومپزشکی گیلان، رشت، ایران.
2- گروه بیماریهای داخلی،دانشکده پزشکی، بیمارستان رازی، دانشگاه علومپزشکی گیلان، رشت، ایران.
متن کامل [PDF 6571 kb]
(344 دریافت)
| چکیده (HTML) (1839 مشاهده)
متن کامل: (569 مشاهده)
مقدمه
سندرمهای تالاسمی، اختلالاتی ارثی در تولید زنجیرههای گلوبین α و β موجود در ساختار تترامر هموگلوبین هستند. در بیماران β-تالاسمی، ساخت ناقص گلوبین β با ایجاد اختلال در تولید مقادیر کافی HbA، به تشکیل گلبولهای قرمز کوچک و حاوی مقادیر کم هموگلوبین منتهی میشود. از طرف دیگر، به دنبال اختلال ایجادشده در توازن مقدار زنجیرههای گلوبین α و β، زنجیرههای گلوبین α جفتنشده و مازاد جمع شده و با تشکیل رسوبات سمی، آسیب شدیدی را به غشای گلبولهای قرمز و پیشسازهای اریتروئید وارد میکنند. با هدف جبران آنمی ایجادشده در بدن به دنبال همین آسیب سلولهای خونی، اریتروپوئز نامؤثر پدید میآید که علاوهبر تولید معدود گلبولهای قرمز با طول عمر کوتاه، ازطریق افزایش جذب آهن غذایی سبب ایجاد بار اضافه آهن در بدن میشود. طبق آمار گزارششده از سازمان بهداشت جهانی در سال 2008، هر ساله حدود 40000 نوزاد مبتلا به β-تالاسمی متولد میشوند که 25500 نفر از آنان برای ادامه حیات خود به تزریق منظم خون وابسته هستند. تزریق خون درازمدت در بیماران β-تالاسمی ماژور، احتمال ایجاد اضافهبار آهن را در بدن این بیماران دوچندان میکند که در صورت عدم اقدام درمانی مناسب با شلاتورهای آهن (داروهای آهنزدا) ممکن است در اثر نارسایی قلب، غدد درونریز و کبد ناشی از هموکروماتوز ثانویه، به مرگ بیماران در دهه دوم یا سوم زندگی بینجامد. به دنبال شروع استفاده از شلاتورهای آهن، امید به زندگی در بیماران β-تالاسمی در سراسر دنیا به طرز چشمگیری افزایش پیدا کرده است؛ درنتیجه امروزه، شروع تزریق منظم خون برای بیماران β-تالاسمی ماژور، اغلب در طولانیمدت به تجویز شلاتور آهن میانجامد [1-5].
در حال حاضر، دفروکسامین، دفریپرون و دفرازیروکس 3 شلاتور مورد استفاده جهت درمان اضافهبار آهن محسوب میشوند.
دفروکسامین یک شلاتور آهن تزریقی (زیرجلدی یا داخل عروقی)، تقریباً غیرسمی و مشتق از فراورده باکتری pilosus Streptomyces بوده که از سال 1968 مورد استفاده قرار گرفته است. نیمه عمر دفروکسامین تنها 30 دقیقه بوده و دُز پیشنهادی آن، 30 تا 60 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز است. گاهی مصرف این دارو، عوارضی همچون آسیب شبکیه چشم، ناشنوایی و واکنشهای آلرژیک موضعی پوستی (از قبیل کهیر) را در پی دارد. دفریپرون یک شلاتور آهن خوراکی با نیمه عمر 3 ساعت است که از سال 1999 مورد استفاده قرار گرفته است. دُز توصیهشده این دارو 75 تا 100 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز است. عوارض گوارشی، آرترالژی، نوتروپنی و افزایش گذرای آنزیمهای کبدی در پی مصرف این دارو دیده شده است. دفرازیروکس شلاتور آهن خوراکی جدیدتری است که از سال 2005 در کودکان و بزرگسالان مبتلا به β-تالاسمی وابسته به تزریق خون طولانیمدت و حتی مبتلایان به آنمی داسیشکل، جهت کاهش غلظت آهن کبد ازطریق افزایش آهن مدفوع استفاده میشود. نیمه عمر دفرازیروکس 8 تا 16 ساعت بوده و دُز توصیهشده آن 20 تا 40 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز به فرم قرصهای سریع بازشونده و 14 تا 28 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز به فرم قرصهای دارای پوشش نازک است. این دارو علاوه بر عوارض سمی مشابه دفروکسامین، گاه میتواند منجر به افزایش خفیف آنزیمهای کبدی، پروتئینوری، افزایش نرخ فیلتراسیون گلومرولی و افزایش کراتینین سرم شود. شلاتورهای آهن به طور کلی در دوره بارداری منع مصرف دارند، اما در صورت لزوم میتوان از دفروکسامین پس از اتمام 3 ماهه دوم بارداری استفاده کرد [6, 7].
در این مطالعه، با هدف تعیین میزان تأثیر آهنزدایی با دفرازیروکس در بیماران β-تالاسمی تحت درمان با تزریق منظم خون، سطح فریتین و آمینوترنسفرازهای کبدی قبل و بعد از درمان با داروی مذکور (فارغ از برند دارویی) بررسی شده است.
روشها
در این مطالعه مقطعیتحلیلی، تغییرات سطح سرمی آنزیمهای کبدی بیماران β-تالاسمی دریافتکننده دفرازیروکس در بخش تالاسمی بیمارستان 17 شهریور و کلینیک تخصصی و فوقتخصصی بعثت رشت بهصورت گذشتهنگر بررسی شده است. بدین جهت، 104 بیمار β-تالاسمی وابسته به خونگیریهای منظم با سن بیش از 2 سال که حداقل به مدت 2 سال متوالی تحت درمان با دفرازیروکس بهعنوان شلاتور آهن بودهاند، انتخاب شدند. ابتدا دُز مصرفی این شلاتور آهن مشخص شد. تعداد دفعات خونگیری بیماران و متوسط زمان دریافت شلاتور آهن در طول مطالعه ثبت شد. سپس فهرستی از اطلاعات بیماران شامل سن، جنس، تاریخ اولین تزریق خون، تعداد دفعات تزریق خون و مدتزمان استفاده از دفرازیروکس و دُز مصرفی آن تهیه و سطح سرمی فریتین و آنزیمهای کبدی، شامل آسپارتات آمینوترانسفراز و آلانین آمینوترانسفراز طی دورههای قبل و بعد از آهنزدایی با دفرازیروکس ثبت شد. بیماران با سابقه ابتلا به هپاتیت ویروسی، مصرفکنندگان سایر شلاتورهای آهن و داروهای مؤثر بر سطح آنزیمهای کبدی (ازجمله داروهای ضدتشنج) و همچنین مصرفکنندگان دفرازیروکس به مدت کمتر از 2 سال (به دلیل احتمال اثربخشی ناچیز در مصرف کوتاهمدت) از روند این مطالعه خارج شدند.
به جهت تجزیهوتحلیل آماری از نرمافزار SPSS نسخه 16 استفاده شد. در این مطالعه، دادهها بهوسیله آمارهای توصیفی (تعداد، درصد، میانگین و انحراف معیار) گزارش شدهاند. بهطور خلاصه، نرمالیتی دادهها توسط آزمون کولموگروفاسمیرنف مورد بررسی قرار گرفت که درصورت نرمال بودن دادهها از آزمون تی جفتشده و درصورت عدم وجود نرمالیتی از آزمون یو منویتنی استفاده شده است. مقایسه متغیرهای کیفی توسط آزمون کایاسکوئر و درصورت لزوم توسط آزمون دقیق فیشر انجام شده است. 0/05>P بهعنوان اختلاف آماری معنیدار در نظر گرفته شد.
یافتهها
درمجموع 104 بیمار واردشده به مطالعه، 44 بیمار (42/3 درصد) پسر و 60 بیمار (57/7 درصد) دختر بودند که بهطورکلی در محدوده سنی 5 تا 46 سال قرار داشتند. 16 بیمار (15/4 درصد) در رده سنی کمتر از 15 سال، 63 بیمار (60/6 درصد) در رده سنی 15 تا 30 سال و 25 بیمار (24 درصد) در رده سنی 30 سال به بالا قرار گرفتند که میانگین سنی کلی آنان 8/79±24/25 سال محاسبه شد. تزریق خون برای 27 بیمار (26 درصد) با فواصل کمتر از 3 هفته و برای 77 بیمار (74 درصد) با فواصل بیشتر از 3 هفته انجام میشد که میانگین فواصل تزریق خون آنان 7/04±27/09 روز محاسبه شد. دفرازیروکس در 53 بیمار (51 درصد) به مدت 2 الی 5 سال و در 51 بیمار (49 درصد) به مدت بیشتر از 5 سال مصرف شده بود و میانگین طول مدتزمان درمان این بیماران با دفرازیروکس 1/45±5/54 سال محاسبه شد. دُز مصرفی دفرازیروکس در 38 بیمار (36/5 درصد) کمتر از 32 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز، در 66 بیمار (63/5 درصد) بیشتر از 32 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز و در کل بیماران بهطور میانگین 3/58±32/82 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز بود.
در این مطالعه، به لحاظ آماری تفاوت معنیداری در میزان کاهش سطح سرمی فریتین آنزیم آسپارتات آمینوترانسفراز (0/017=P)، (0/0001=P) و آلانین آمینوترانسفراز (0/015=P) در آخرین آزمایش خون پس از شروع درمان با دفرازیروکس، نسبت به سطح پایه آنها، مشاهده شد (جدول شماره 1).

در طول این مطالعه بهدنبال آهنزدایی با دفرازیروکس، کاهش سطح آنزیم آسپارتات آمینوترانسفراز و آلانین آمینوترانسفراز به ترتیب در 77 نفر (74 درصد) و 72 نفر (69/2 درصد) از بیماران β-تالاسمی دیده شد. (جدول شماره 2).

در ادامه، ارتباط میان برخی متغیرها با کاهش آمینوترانسفرازهای کبدی به دنبال 2 سال مصرف دفرازیروکس بررسی شد (جداول شماره 3 و 4).
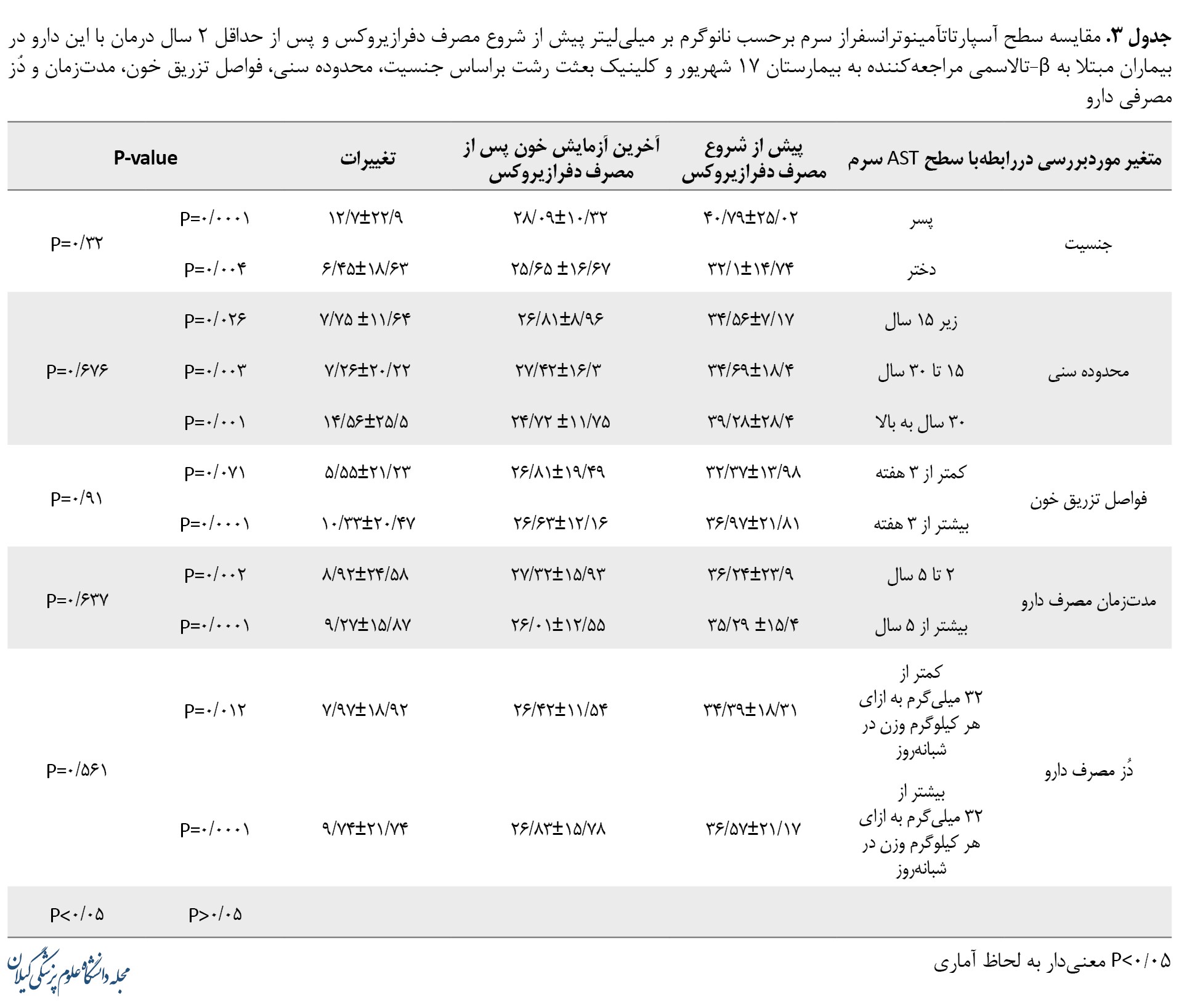

ازنظر جنسیت، تفاوت آماری معنیداری در میزان تغییرات سطح آسپارتات آمینوترانسفراز سرم در آخرین آزمایش خون پس از مصرف دارو نسبت به سطح آن پیش از شروع مصرف دارو، به تفکیک در بیماران پسر و دختر مبتلا به β-تالاسمی دیده شد (0/0001=P و 0/004=P)؛ درحالیکه تفاوت آماری براساس تغییرات سرمی آسپارتات آمینوترانسفراز، بین 2 گروه پسران و دختران معنیدار نبود (0/32=P). همچنین تفاوت آماری معنیداری در میزان تغییرات سطح آلانین آمینوترانسفراز سرم در آخرین آزمایش خون پس از مصرف دارو، نسبت به سطح آن پیش از شروع مصرف دارو به تفکیک در بیماران پسر و دختر مبتلا به β-تالاسمی مورد مطالعه مشاهده شد (0/006=P و 0/024=P)؛ درحالیکه تفاوت آماری براساس تغییرات سرمی آلانین آمینوترانسفراز، در مجموع بین 2 گروه پسران و دختران معنیدار نبود (0/6=P). بهطورکلی، ارتباط معنیداری میان کاهش سطح ترانس آمینازهای کبدی به دنبال مصرف دفرازیروکس با جنسیت بیماران β-تالاسمی موردمطالعه یافت نشد.
ازنظر محدوده سنی، تفاوت آماری معنیداری در میزان تغییرات سطح آسپارتات آمینوترانسفراز سرم در آخرین آزمایش خون پس از مصرف دارو، نسبت به سطح آن پیش از شروع مصرف دارو به تفکیک بیماران β-تالاسمی مورد مطالعه در ردههای سنی کمتر از 15 سال (0/026=P)، 15 تا 30 سال (0/003=P) و 30 سال به بالا (0/001=P) مشاهده شد؛ درحالیکه تفاوت آماری معنیداری در مقایسه تغییرات سطح سرمی آسپارتات آمینوترانسفراز میان این 3 گروه سنی با همدیگر دیده نشد (0/676=P). همچنین تفاوت آماری معنیداری در میزان تغییرات سطح آلانین آمینوترانسفراز سرم در آخرین آزمایش خون پس از مصرف دارو، نسبت به سطح آن پیش از شروع مصرف دارو به تفکیک بیماران β-تالاسمی موردمطالعه در ردههای سنی 15 تا 30 سال (0/04=P) و 30 سال به بالا (0/001=P) مشاهده شد؛ اما تغییرات سطح آلانین آمینوترانسفراز سرم قبل و پس از درمان با دفرازیروکس در رده سنی کمتر از 15 سال (0/587=P) معنیدار نبود. مقایسه تغییرات میان این سه گروه سنی با همدیگر (0/222=P) نیز معنیدار نبود. بهطورکلی، ارتباط معنیداری میان کاهش سطح ترانس آمینازهای کبدی به دنبال مصرف دفرازیروکس با سن بیماران β-تالاسمی موردمطالعه یافت نشد.
ازنظر فواصل تزریق خون، تفاوت آماری معنیداری در میزان تغییرات سطح آلانین آمینوترانسفراز سرم در آخرین آزمایش خون پس از مصرف دارو، نسبت به سطح آن پیش از شروع مصرف دارو در دریافتکنندگان خون با فواصل زمانی بیشتر از 3 هفته (P=0/0001) مشاهده شد؛ درحالیکه تغییرات سرمی آسپارتات آمینوترانسفراز در دریافتکنندگان خون با فواصل زمانی کمتر از 3 هفته (0/071=P) و مقایسه این دو گروه ازنظر فواصل زمانی دریافت خون (0/91=P) به لحاظ آماری معنیدار نبود. همچنین تفاوت آماری معنیداری در میزان تغییرات سطح آلانین آمینوترانسفراز سرم در آخرین آزمایش خون پس از مصرف دارو، نسبت به سطح آن پیش از شروع مصرف دارو در دریافتکنندگان خون با فواصل زمانی کمتر از 3 هفته (0/031=P) و بیشتر از 3 هفته (0/01=P) مشاهده شد؛ درحالیکه تفاوت تغییرات سرمی آلانین آمینوترانسفراز در مقایسه این 2 گروه بایکدیگر ازنظر فواصل زمانی دریافت خون (0/26=P) معنیدار نبود. بهطور کلی، ارتباط معنیداری میان کاهش سطح ترانس آمینازهای کبدی به دنبال مصرف دفرازیروکس با فواصل تزریق خون بیماران β-تالاسمی مورد مطالعه یافت نشد.
ازنظر مدتزمان مصرف دفرازیروکس، تفاوت آماری معنیداری در میزان تغییرات سطح آسپارتات آمینوترانسفراز سرم در آخرین آزمایش خون پس از مصرف دارو بهمدت کمتر از ۵ سال (0/002=P) و بیشتر از 5 سال (0/0001=P)، نسبت به سطح آن پیش از شروع مصرف دارو مشاهده شد؛ درحالیکه تفاوت تغییرات سرمی آسپارتات آمینوترانسفراز میان این دو گروه (0/637=P) معنیدار نبود. همچنین تفاوت آماری معنیداری در میزان تغییرات سطح آلانین آمینوترانسفراز سرم در آخرین آزمایش خون پس از مصرف دارو به مدت کمتر از 5 سال (0/016=P) و بیشتر از 5 سال (0/012=P)، نسبت به سطح آن پیش از شروع مصرف دارو مشاهده شد؛ درحالیکه تفاوت تغییرات سرمی آلانین آمینوترانسفراز میان این دو گروه (0/974=P) معنیدار نبود. بهطورکلی، ارتباط معنیداری میان کاهش سطح ترانس آمینازهای کبدی به دنبال مصرف دفرازیروکس با طول مدت تجویز این شلاتور آهن در بیماران β-تالاسمی موردمطالعه یافت نشد.
ازنظر دُز مصرفی دفرازیروکس، تفاوت آماری معنیداری در میزان تغییرات سطح آسپارتات آمینوترانسفراز سرم پس از مصرف دارو با دُز کمتر از 32 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز (0/012=P) و بیشتر از 32 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز (0/0001=P) نسبت به سطح آن پیش از شروع مصرف دارو مشاهده شد؛ درحالیکه مقایسه تغییرات سرمی آسپارتات آمینوترانسفراز میان این دو گروه (0/561=P) معنیدار نبود. همچنین، تفاوت آماری معنیداری در میزان تغییرات سطح آلانین آمینوترانسفراز سرم پس از مصرف دارو با دُز بیشتر از 32 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز نسبت به سطح آن پیش از شروع مصرف دارو (0/003=P) مشاهده شد؛ درحالیکه تغییرات سرمی آلانین آمینوترانسفراز پس از مصرف دارو با دُز کمتر از 32 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز نسبت به سطح آن پیش از شروع مصرف دارو (0/097=P) و مقایسه تغییرات میان این دو گروه ازنظر دُز مصرفی (0/338=P) معنیدار نبود. بهطورکلی ارتباط معنیداری میان کاهش سطح ترانس آمینازهای کبدی به دنبال مصرف دفرازیروکس با دُز مصرفی این شلاتور آهن در بیماران β-تالاسمی موردمطالعه یافت نشد.
بحث
بهطورکلی در این مطالعه، با هدف تعیین میزان تأثیر آهنزدایی با دفرازیروکس در بیماران β-تالاسمی وابسته به تزریق منظم خون، سطح فریتین و ترانس آمینازهای کبدی قبل و بعد از درمان با داروی مذکور (فارغ از برند دارویی) بررسی شد.
دفرازیروکس، بهعنوان یک شلاتور آهن خوراکی، بهمنظور کاهش نارسایی بافتهای قلب، غدد درونریز و کبد ناشی از اضافهبار آهن در بیماران β-تالاسمی وابسته به تزریق منظم خون تجویز میشود. دفرازیروکس اثربخشی بالایی در حفظ سلامت بافت قلب و کبد در برابر اضافهبار آهن از خود نشان داده، بهخوبی تحمل میشود و شایعترین عوارض آن (عوارض گوارشی، افزایش ترانس آمینازهای کبدی و اختلال کلیوی) بهندرت منجر به قطع مصرف دارو میشود [8].
البته تجویز شلاتورهای آهن میتواند کاربرد گستردهتری هم در درمان بیماران تالاسمی داشته باشد. همانطور که در مطالعه خالد مسّلم و همکاران و همکاران اشاره شده است، صرفنظر از تأثیر مضاعف تزریق خون مداوم، باتوجهبه اضافهبار آهن ناشی از اریرتروپوئز غیرمؤثر و افزایش جذب آهن غذایی در بیماران β-تالاسمی سطح فریتین سرم بالای 800 نانوگرم بر میلیلیتر، بهشدت با افزایش ریسک عوارض ناشی از اضافهبار آهن همراه بوده و میتواند اندیکاسیون شروع درمان با شلاتور آهن در بیماران β-تالاسمی غیروابسته به تزریق خون نیز باشد [9].
براساس متاآنالیز مریم سلطانی و همکاران و همکاران، نرخ بقای 10، 15، 20 و 30 ساله بیماران β-تالاسمی ماژور در سراسر جهان به ترتیب به 98/39، 95/07، 90/41 و 82/93 درصد رسیده است که سهم قابلتوجهی از این افزایش امید به زندگی، مربوط به درمان همزمان با تزریق منظم خون و تجویز شلاتورهای آهن است [10].
باتوجه به اهمیت اثربخشی و عوارض ناشی از مصرف شلاتورهای آهن، در این مطالعه، 104 بیمار β-تالاسمی ماژور مراجعهکننده به بیمارستان 17 شهریور و کلینیک بعثت رشت با سن بیش از دو سال که خونگیریهای منظم داشته و حداقل به مدت 2 سال متوالی تحت درمان با دفرازیروکس بودند، با در نظر گرفتن متغیرهایی چون سن، جنس، تاریخ اولین تزریق خون، تعداد دفعات تزریق خون و مدتزمان استفاده از دفرازیروکس و دُز مصرفی آن، ازنظر سطح فریتین و آمینوترانسفرازهای کبدی قبل و بعد از شروع درمان با این شلاتور آهن بررسی شدند.
در این مطالعه، تفاوت آماری معنیداری (P=0/017) بین مقادیر فریتین خون پیش از شروع مصرف دارو و پس از آن در آخرین آزمایش خون بیماران β-تالاسمی ماژور دیده شد؛ بهطوریکه میزان فریتین خون قبل از شروع مصرف دفرازیروکس 1243±1956/4 و پس از آن 1419/4±1741/4 بود (جدول شماره 1).
همچنین طی این مطالعه، به دنبال درمان با دفرازیروکس، کاهش سطح آنزیم آسپارتات آمینوترانسفراز و آلانین آمینوترانسفراز به ترتیب در 74 و69/2 درصد از بیماران β-تالاسمی مشاهده شد. درحالیکه گاه از افزایش خفیف آنزیمهای کبدی، بهعنوان یک عارضه دفرازیروکس یاد میشود، سطح آسپارتات آمینوترانسفراز و آلانین آمینوترانسفراز به ترتیب تنها در 26 و 30/8 درصد بیماران این مطالعه افزایش یافت. درمجموع به لحاظ آماری، اثربخشی دفرازیروکس بر تغییرات سطح سرمی ترانس آمینازهای کبدی بهصورت کاهشی (0/0001=P برای آسپارتات آمینوترانسفراز و 0/015=P برای آلانین آمینوترانسفراز) در بیماران موردمطالعه، معنیدار ارزیابی شد (جدول شماره 1 و 2).
براساس متغیرهای بررسیشده، بیشترین کاهش سطح آسپارتات آمینوترانسفراز و آلانین آمینوترانسفراز به دنبال مصرف دفرازیروکس در پسرها، گروه سنی بالای 30 سال، فواصل تزریق خون بیشتر از 3 هفته، مدتزمان مصرف داروی بیشتر از 5 سال و دُز مصرفی بیشتر از 32 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز رخ داد؛ اما بهطورکلی ازلحاظ آماری، میان کاهش سطح آسپارتات آمینوترانسفراز و آلانین آمینوترانسفراز و متغیرهای بررسیشده (شامل جنسیت، محدوده سنی، فواصل تزریق خون، مدتزمان و دُز مصرفی دفرازیروکس) ارتباط معنیداری در این مطالعه یافت نشد (جداول شماره 3 و 4).
مطالعات متعددی طی سالهای اخیر از جهاتی گوناگون، اثربخشی دفرازیروکس را بر سلامت عملکرد کبد و سایر اندامهای بدن در بیماران β-تالاسمی بررسی کردهاند.
در مطالعه ارندی و همکاران، 32 بیمار β-تالاسمی ماژور در شیراز، 2 روز در هفته تحت درمان ترکیبی با دفرازیروکس (با دُز 30 تا 40 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز) و دفروکسامین (با دُز 40 تا 50 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز) قرار گرفتند. پس از گذشت 12 ماه، کاهش چشمگیری در سطح فریتین سرم این بیماران از 1955±4031 نانوگرم بر میلیلیتر به 2416 نانوگرم بر میلیلیتر مشاهده شد (P<0/001). در این مطالعه، بین تغییرات سطح فریتین سرم ناشی از شلاتورهای آهن با سن و جنسیت بیماران ارتباط معنیداری یافت نشد. سطح آسپارتات آمینوترانسفراز به دنبال مصرف ترکیبی این شلاتورهای آهن، به طور متوسط از 19/29±33/68 به 31/99±37/5 و سطح آلانین آمینوترانسفراز از 51/14±45/18 به 44/58±41/59 رسیده بود که ازنظر آماری معنیدار ارزیابی نشد (به ترتیب 0/45=P و 0/567=P). همچنین افزایش معنیداری در تغییرات سطح نیتروژن اوره خون و کراتینین بیماران به دنبال درمان ترکیبی با دفرازیروکس و دفروکسامین مشاهده نشد (به ترتیب 0/623=P و 0/215=P) [11].
در کارآزمایی بالینی صالحیفر و همکاران، 21 بیمار β-تالاسمی ماژور که حداقل به مدت 6 ماه، 1 بار در روز دفرازیروکس مصرف میکردند، تحت درمان با این دارو بهصورت 2 بار در روز قرار گرفتند. میانگین آخرین سطح فریتین بیماران نسبت به مقادیر پایه، بهطور معنیداری از 922±1814 نانوگرم بر میلیلیتر به 907±1472 نانوگرم بر میلیلیتر کاهش یافت (0/02=P). البته در تغییر میزان کراتینین، آسپارتات آمینوترانسفراز و آلانین آمینوترانسفراز این بیماران نسبت به مقادیر پایه، اختلاف معنیداری مشاهده نشد (به ترتیب 0/87=P و 0/5=P و 0/62=P). این مطالعه درنهایت، اینطور نتیجهگیری کرد که مصرف دو بار در روز دفرازیروکس، با کمترین عوارض کبدی و کلیوی، بهطوری معنیدار میتواند موجب کاهش سطح فریتین سرم نسبت به مصرف 1 بار در روز آن شود [12].
در بررسی همزمان 2 مطالعه مذکور با مطالعه کنونی میتوان از دیدگاههای متفاوتی، تأثیر آهنزدایی با دفرازیروکس بر کاهش معنیدار سطح سرمی فریتین بیماران β-تالاسمی وابسته به تزریق خون را مشاهده کرد (جدول شماره 5).
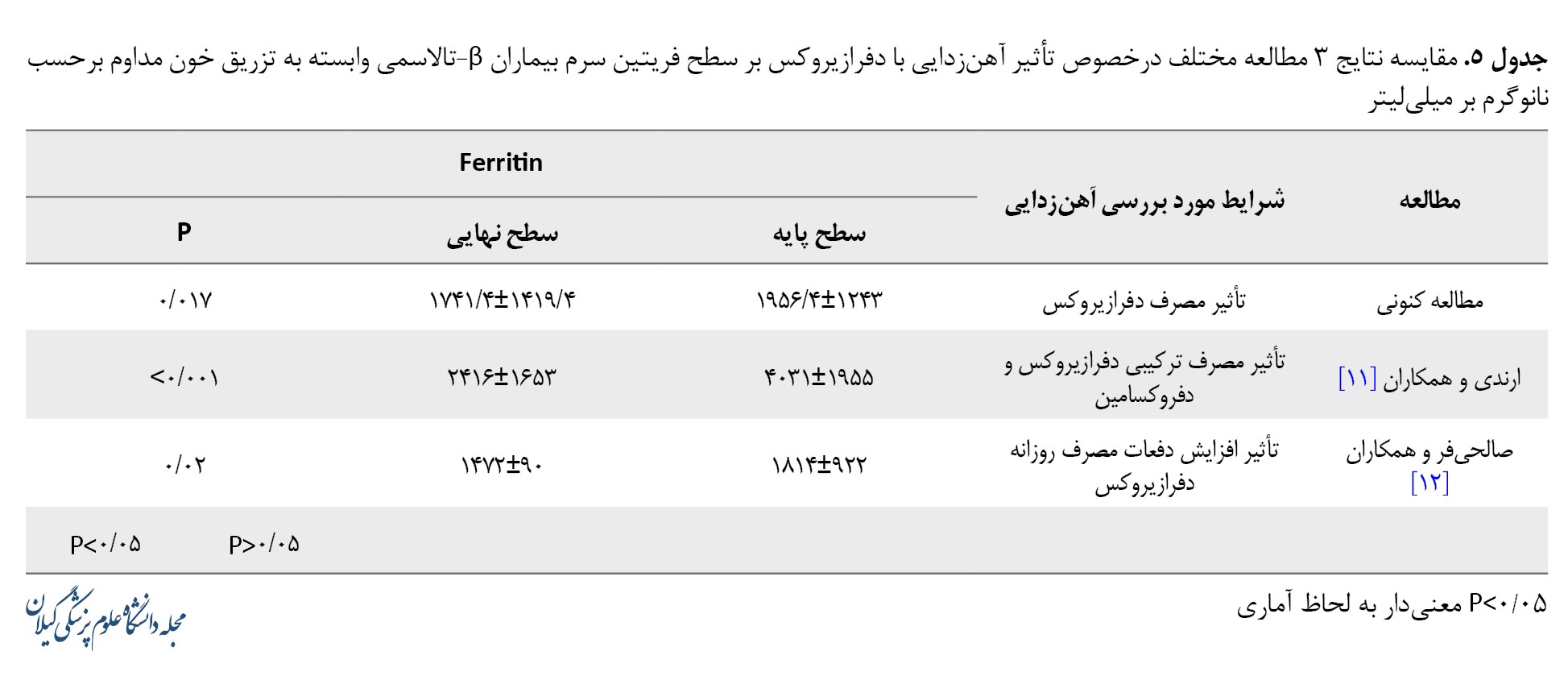
این مسئله باید درنظر گرفته شود که کاهش معنیدار فریتین در مطالعه ارندی و همکاران بر اثر درمان ترکیبی با دفرازیروکس و دفروکسامین، و در مطالعه صالحیفر و همکاران بر اثر افزایش دفعات مصرف روزانه دفرازیروکس (از 1 بار در روز به 2 بار در روز) ایجاد شده است. همچنین باید به این نکته اشاره کرده که حجم نمونه مطالعه کنونی (104 بیمار)، بهصورت قابلملاحظهای بیشتر از سایر این مطالعات است.
بررسی همزمان این 3 مطالعه، مشابهتها و تناقضهایی را در خصوص تأثیر آهنزدایی با دفرازیروکس بر سطح سرمی ترانس آمینازهای کبدی نشان میدهد (جدول شماره 6).

همسو با مطالعه صالحیفر و همکاران در دانشگاه علومپزشکی مازندران که در آن افزایش دفعات مصرف روزانه دفرازیروکس (از 1 بار در روز به 2 بار در روز) تفاوت معنیداری را در سطح نهایی ترانس آمینازهای کبدی سرم نسبت به سطح پایه آنها ایجاد نکرد، مطالعه کنونی نیز کاهش معنیدار وابسته به دُز مصرفی دفرازیروکس را در سطح این آنزیمهای کبدی نشان نمیدهد. به علاوه، درحالیکه درمان ترکیبی با دفرازیروکس و دفروکسامین در مطالعه ارندی و همکاران تغییر معنیداری را در سطح سرمی ترانس آمینازهای کبدی در پی نداشت، مطالعه کنونی کاهش معنیداری را در سطح این آنزیمهای کبدی به دنبال درمان تکدارویی با دفرازیروکس نشان میدهد.
در ادامه، با بررسی مطالعات مرتبط متنوعتر، به ابعاد گستردهتری از کارایی و عوارض دفرازیروکس اشاره میکنیم که میتواند برای انجام مطالعات مرتبط آینده توسط علاقهمندان در نظر گرفته شود.
در مطالعه کریمی و همکاران، بیماران β-تالاسمی اینترمدیای تحت درمان با دفرازیروکس، هر 2 ماه طی 1 سال ازنظر سطح فریتین سرم پایش شدند. این بیماران β-تالاسمی اینترمدیا درصورت وجود فریتین سرم 1000 تا 1500 نانوگرم بر میلیلیتر، 10 تا 20 میلیگرم به ازای هر کیلوگرم وزن در شبانهروزدفرازیروکس، فریتین سرم 1500 تا 2000 نانوگرم بر میلیلیتر، 20 تا 30 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز دفرازیروکس و فریتین سرم بالای 2000 نانوگرم بر میلیلیتر، 30 تا 40 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز دفرازیروکس دریافت میکردند. کاهش سطح فریتین سرم در 2 ماه ابتدایی، معنیدار نبود (0/88=P)؛ اما بعد از گذشت 4 ماه (0/01=P)، 6 ماه (0/001=P)، 8 ماه (P<0/001)، 10 ماه (P<0/001) و 12 ماه (P<0/001) از شروع درمان با دفرازیروکس، کاهشی معنیدار در سطح فریتین سرم آنان مشاهده شد [13].
در مطالعه سلیمان و همکاران در قطر، به دنبال درمان بیماران β-تالاسمی ماژور سرونگاتیو ازنظر هپاتیت، از سن 8 سالگی تا 18 سالگی با دفروکسامین و سپس 20 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز دفرازیروکس (از 1/5±13/8 سالگی)، کاهشی معنیدار در سطح سرمی فریتین، آسپارتات آمینوترانسفراز، آلانین آمینوترانسفراز و آلکالین فسفاتاز مشاهده شد. همچنین نویسنده این مقاله، افزایش سطح فاکتور رشد شبه انسولین 1 را در این بیماران به دنبال درمان با شلاتور آهن، نشانی از بهبود کارکرد کبد عنوان میکند [14].
همچنین برخی از مطالعات، میزان تأثیر داروهای آهنزدا بر آهن ذخیرهشده در بافتهای قلب و کبد بیماران β-تالاسمی ماژور را بهوسیله تصویربرداری رزونانس مغناطیسی T2 مورد بررسی قرار دادهاند. گفتنی است که دسترسی آسانتر و هزینه کمتر، از مزایای بررسی ترانس آمینازهای کبدی نسبت به MRI میباشد.
در مطالعه مرادویسی و همکاران بر پایه نتایج بررسی تصویربرداری رزونانس مغناطیسی T2 در 52 بیمار β-تالاسمی ماژور بیمارستان بعثت سنندج، دفرازیروکس نسبت به دفروکسامین تأثیر بیشتری بر کاهش آهن کبد و قلب از خود نشان داد. این اثر محافظتی دفرازیروکس، بر روی بافت قلب نسبت به بافت کبد بیشتر بود. در این مطالعه تفاوت معنادار آماری بین تأثیر دفرازیروکس و دفروکسامین بر آنزیمهای کبدی سرم (آسپارتات آمینوترانسفراز و آلانین آمینوترانسفراز) وجود نداشت. تنها در مصرفکنندگان دفروکسامین میان فریتین و آهن ذخیرهشده در کبد همبستگی معنیداری وجود داشت و برای مصرفکنندگان دفررازیروکس اینچنین نبود [15].
در مطالعه انصاری و همکاران بر روی 108 بیمار β-تالاسمی ماژور در تهران، درمان تکدارویی با دفرازیروکس و درمان ترکیبی با دفروکسامین و دفریپرون تأثیر قابلملاحظهای بر بهبود نتایج بررسی کبد و قلب با تصویربرداری رزونانس مغناطیسی T2 نسبت به درمان تکدارویی با دفروکسامین داشت [16].
در یک بررسی تحلیلیمروری، بولیش و همکاران به این نتیجه دست یافتند که دفرازیروکس میتواند بهعنوان شلاتور آهن انتخابی در خط اول درمان اضافهبار آهن ناشی از تالاسمی، خصوصاً در بیماران متمایل به مصرف دفرازیروکس خوراکی و بیماران با عدم تحمل مناسب دفروکسامین تزریقی، تجویز شود؛ زیرا در پی بررسیهای متعدد، مصرف دفرازیروکس در طولانیمدت اثربخشی مشابهی نسبت به دفروکسامین از خود نشان داده است [17].
در مطالعه الخبوری و همکاران، عوارض پدیدآمده در 72 بیمار β-تالاسمی ماژور و اینترمدیا در عمان که تحت درمان با دفرازیروکس بودند، بررسی شدند. علت قطع دفرازیروکس در 7 نفر اختلال عملکرد کلیه، 2 نفر احساس ناخوشایند عمومی، 2 نفر افزایش ترانس آمینازهای کبدی، 1 نفر حاملگی و 1 نفر اسهال شدید گزارش شد [18].
در مطالعه بادلی و همکاران، به دنبال درمان با دفرازیروکس افزایش معنیداری در سطح نیتروژن اوره خون سرم، لیپوکالین مرتبط با ژلاتیناز نوتروفیل ادرار، اینترلوکین 18 ادرار، آلبومین ادرار، نسبت لیپوکالین مرتبط با ژلاتیناز نوتروفیل ادرار به کراتینی و نسبت مولکول آسیب کلیه 1 ادرار به کراتینین در بیماران β-تالاسمی ماژور بیمارستان 17 شهریور مشاهده شد [19].
در مطالعه پوششدوست و همکاران، در 156 بیمار تالاسمی وابسته به تزریق خون و تحت درمان با دفرازیروکس، تغییر حدت بینایی و افت شنوایی حسیعصبی، به ترتیب تنها در 0/6 و 1/3 درصد از بیماران گزارش شده است [20].
نتیجهگیری
دفرازیروکس، بهعنوان یک شلاتور آهن خوراکی جهت مقابله با اضافهبار آهن بدن در بیماران β-تالاسمی ماژور و اینترمدیا، داروی مؤثر و نسبتاً ایمنی است. در این مطالعه مصرف دفرازیروکس، نهتنها بهندرت افزایش خفیف آنزیمهای کبدی را بههمراه داشت، بلکه درمجموع در بیماران β-تالاسمی وابسته به تزریق خون منجر به کاهش قابلملاحظهای در سطح سرمی فریتین و ترانس آمینازهای کبدی شد. بهنظر میرسد که مصرف دفرازیروکس بعد از گذشت چند ماه، بیشتر از ایجاد عوارض کبدی خفیف نادر، میتواند برای کبد نقشی محفاظتی در برابر اضافهبار آهن بدن ایفا کند و منجر به کاهش سطح آمینوترانسفرازهای کبدی شود. در این مطالعه، بیشترین کاهش سطح ترانسآمینازهای کبدی به دنبال مصرف دفرازیروکس در پسرها، گروه سنی بالای 30 سال، فواصل تزریق خون بیشتر از 3 هفته، مدتزمان مصرف داروی بیشتر از 5 سال و دُز مصرفی بیشتر از mg/kg/day 32 دیده شد؛ اما بهطورکلی در این بیماران، میزان اثربخشی آهنزدایی با این شلاتور آهن بر کاهش سطح آنزیمهای کبدی وابستگی معنیداری را به لحاظ آماری به سن، جنس، میزان تزریق خون، مدتزمان و دُز مصرف دفرازیروکس از خود نشان نداد. باتوجهبه برخی مغایرتهای اشارهشده میان مطالعات گوناگون، تعیین دقیقتر قابلیت روشهای تشخیصی غیرتهاجمی (ازجمله آمینوترانسفرازهای کبدی و MRI) در نمایان کردن اثرات مخرب اضافهبار آهن و دفرازیروکس بر کبد به بررسیهای مبتنی بر شواهد گستردهتری نیاز دارد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه توسط کمیته اخلاق در پژوهشهای زیست پزشکی دانشگاه علومپزشکی گیلان تأیید شده است (IR.GUMS.REC.1397.092).
حامی مالی
این پژوهش هیچگونه کمک مالی از سازمانهای تأمین مالی در بخشهای عمومی، تجاری یا غیرانتفاعی دریافت نکرده است.
مشارکت نویسندگان
مفهومسازی و روششناسی: بهرام دربندی، سوده صالحی، شایان پورکاظم و محمدرضا شریفی راد؛ اعتبارسنجی و تحلیل: عادل باقرسلیمی، مرسده انشائی و محمدرضا شریفی راد؛ تحقیق و بررسی منابع و بصریسازی: شایان پورکاظم؛ نگارش پیشنویس: محمدرضا شریفی راد و شایان پورکاظم؛ ویراستاری و نهاییسازی نوشته: بهرام دربندی و شایان پورکاظم؛ نظارت: وحید امینزاده، بهرنگ معتمد، عادل باقرسلیمی و بهرام دربندی؛ مدیریت پروژه: بهرام دربندی؛ تأمین مالی: محمدرضا شریفی راد.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان مراتب سپاس و قدردانی خود را از دکتر آفاق حسنزاده راد و آقای رضا بیات (همکاران محترم مرکز تحقیقات بیماریهای کودکان) اعلام میدارند.
سندرمهای تالاسمی، اختلالاتی ارثی در تولید زنجیرههای گلوبین α و β موجود در ساختار تترامر هموگلوبین هستند. در بیماران β-تالاسمی، ساخت ناقص گلوبین β با ایجاد اختلال در تولید مقادیر کافی HbA، به تشکیل گلبولهای قرمز کوچک و حاوی مقادیر کم هموگلوبین منتهی میشود. از طرف دیگر، به دنبال اختلال ایجادشده در توازن مقدار زنجیرههای گلوبین α و β، زنجیرههای گلوبین α جفتنشده و مازاد جمع شده و با تشکیل رسوبات سمی، آسیب شدیدی را به غشای گلبولهای قرمز و پیشسازهای اریتروئید وارد میکنند. با هدف جبران آنمی ایجادشده در بدن به دنبال همین آسیب سلولهای خونی، اریتروپوئز نامؤثر پدید میآید که علاوهبر تولید معدود گلبولهای قرمز با طول عمر کوتاه، ازطریق افزایش جذب آهن غذایی سبب ایجاد بار اضافه آهن در بدن میشود. طبق آمار گزارششده از سازمان بهداشت جهانی در سال 2008، هر ساله حدود 40000 نوزاد مبتلا به β-تالاسمی متولد میشوند که 25500 نفر از آنان برای ادامه حیات خود به تزریق منظم خون وابسته هستند. تزریق خون درازمدت در بیماران β-تالاسمی ماژور، احتمال ایجاد اضافهبار آهن را در بدن این بیماران دوچندان میکند که در صورت عدم اقدام درمانی مناسب با شلاتورهای آهن (داروهای آهنزدا) ممکن است در اثر نارسایی قلب، غدد درونریز و کبد ناشی از هموکروماتوز ثانویه، به مرگ بیماران در دهه دوم یا سوم زندگی بینجامد. به دنبال شروع استفاده از شلاتورهای آهن، امید به زندگی در بیماران β-تالاسمی در سراسر دنیا به طرز چشمگیری افزایش پیدا کرده است؛ درنتیجه امروزه، شروع تزریق منظم خون برای بیماران β-تالاسمی ماژور، اغلب در طولانیمدت به تجویز شلاتور آهن میانجامد [1-5].
در حال حاضر، دفروکسامین، دفریپرون و دفرازیروکس 3 شلاتور مورد استفاده جهت درمان اضافهبار آهن محسوب میشوند.
دفروکسامین یک شلاتور آهن تزریقی (زیرجلدی یا داخل عروقی)، تقریباً غیرسمی و مشتق از فراورده باکتری pilosus Streptomyces بوده که از سال 1968 مورد استفاده قرار گرفته است. نیمه عمر دفروکسامین تنها 30 دقیقه بوده و دُز پیشنهادی آن، 30 تا 60 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز است. گاهی مصرف این دارو، عوارضی همچون آسیب شبکیه چشم، ناشنوایی و واکنشهای آلرژیک موضعی پوستی (از قبیل کهیر) را در پی دارد. دفریپرون یک شلاتور آهن خوراکی با نیمه عمر 3 ساعت است که از سال 1999 مورد استفاده قرار گرفته است. دُز توصیهشده این دارو 75 تا 100 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز است. عوارض گوارشی، آرترالژی، نوتروپنی و افزایش گذرای آنزیمهای کبدی در پی مصرف این دارو دیده شده است. دفرازیروکس شلاتور آهن خوراکی جدیدتری است که از سال 2005 در کودکان و بزرگسالان مبتلا به β-تالاسمی وابسته به تزریق خون طولانیمدت و حتی مبتلایان به آنمی داسیشکل، جهت کاهش غلظت آهن کبد ازطریق افزایش آهن مدفوع استفاده میشود. نیمه عمر دفرازیروکس 8 تا 16 ساعت بوده و دُز توصیهشده آن 20 تا 40 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز به فرم قرصهای سریع بازشونده و 14 تا 28 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز به فرم قرصهای دارای پوشش نازک است. این دارو علاوه بر عوارض سمی مشابه دفروکسامین، گاه میتواند منجر به افزایش خفیف آنزیمهای کبدی، پروتئینوری، افزایش نرخ فیلتراسیون گلومرولی و افزایش کراتینین سرم شود. شلاتورهای آهن به طور کلی در دوره بارداری منع مصرف دارند، اما در صورت لزوم میتوان از دفروکسامین پس از اتمام 3 ماهه دوم بارداری استفاده کرد [6, 7].
در این مطالعه، با هدف تعیین میزان تأثیر آهنزدایی با دفرازیروکس در بیماران β-تالاسمی تحت درمان با تزریق منظم خون، سطح فریتین و آمینوترنسفرازهای کبدی قبل و بعد از درمان با داروی مذکور (فارغ از برند دارویی) بررسی شده است.
روشها
در این مطالعه مقطعیتحلیلی، تغییرات سطح سرمی آنزیمهای کبدی بیماران β-تالاسمی دریافتکننده دفرازیروکس در بخش تالاسمی بیمارستان 17 شهریور و کلینیک تخصصی و فوقتخصصی بعثت رشت بهصورت گذشتهنگر بررسی شده است. بدین جهت، 104 بیمار β-تالاسمی وابسته به خونگیریهای منظم با سن بیش از 2 سال که حداقل به مدت 2 سال متوالی تحت درمان با دفرازیروکس بهعنوان شلاتور آهن بودهاند، انتخاب شدند. ابتدا دُز مصرفی این شلاتور آهن مشخص شد. تعداد دفعات خونگیری بیماران و متوسط زمان دریافت شلاتور آهن در طول مطالعه ثبت شد. سپس فهرستی از اطلاعات بیماران شامل سن، جنس، تاریخ اولین تزریق خون، تعداد دفعات تزریق خون و مدتزمان استفاده از دفرازیروکس و دُز مصرفی آن تهیه و سطح سرمی فریتین و آنزیمهای کبدی، شامل آسپارتات آمینوترانسفراز و آلانین آمینوترانسفراز طی دورههای قبل و بعد از آهنزدایی با دفرازیروکس ثبت شد. بیماران با سابقه ابتلا به هپاتیت ویروسی، مصرفکنندگان سایر شلاتورهای آهن و داروهای مؤثر بر سطح آنزیمهای کبدی (ازجمله داروهای ضدتشنج) و همچنین مصرفکنندگان دفرازیروکس به مدت کمتر از 2 سال (به دلیل احتمال اثربخشی ناچیز در مصرف کوتاهمدت) از روند این مطالعه خارج شدند.
به جهت تجزیهوتحلیل آماری از نرمافزار SPSS نسخه 16 استفاده شد. در این مطالعه، دادهها بهوسیله آمارهای توصیفی (تعداد، درصد، میانگین و انحراف معیار) گزارش شدهاند. بهطور خلاصه، نرمالیتی دادهها توسط آزمون کولموگروفاسمیرنف مورد بررسی قرار گرفت که درصورت نرمال بودن دادهها از آزمون تی جفتشده و درصورت عدم وجود نرمالیتی از آزمون یو منویتنی استفاده شده است. مقایسه متغیرهای کیفی توسط آزمون کایاسکوئر و درصورت لزوم توسط آزمون دقیق فیشر انجام شده است. 0/05>P بهعنوان اختلاف آماری معنیدار در نظر گرفته شد.
یافتهها
درمجموع 104 بیمار واردشده به مطالعه، 44 بیمار (42/3 درصد) پسر و 60 بیمار (57/7 درصد) دختر بودند که بهطورکلی در محدوده سنی 5 تا 46 سال قرار داشتند. 16 بیمار (15/4 درصد) در رده سنی کمتر از 15 سال، 63 بیمار (60/6 درصد) در رده سنی 15 تا 30 سال و 25 بیمار (24 درصد) در رده سنی 30 سال به بالا قرار گرفتند که میانگین سنی کلی آنان 8/79±24/25 سال محاسبه شد. تزریق خون برای 27 بیمار (26 درصد) با فواصل کمتر از 3 هفته و برای 77 بیمار (74 درصد) با فواصل بیشتر از 3 هفته انجام میشد که میانگین فواصل تزریق خون آنان 7/04±27/09 روز محاسبه شد. دفرازیروکس در 53 بیمار (51 درصد) به مدت 2 الی 5 سال و در 51 بیمار (49 درصد) به مدت بیشتر از 5 سال مصرف شده بود و میانگین طول مدتزمان درمان این بیماران با دفرازیروکس 1/45±5/54 سال محاسبه شد. دُز مصرفی دفرازیروکس در 38 بیمار (36/5 درصد) کمتر از 32 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز، در 66 بیمار (63/5 درصد) بیشتر از 32 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز و در کل بیماران بهطور میانگین 3/58±32/82 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز بود.
در این مطالعه، به لحاظ آماری تفاوت معنیداری در میزان کاهش سطح سرمی فریتین آنزیم آسپارتات آمینوترانسفراز (0/017=P)، (0/0001=P) و آلانین آمینوترانسفراز (0/015=P) در آخرین آزمایش خون پس از شروع درمان با دفرازیروکس، نسبت به سطح پایه آنها، مشاهده شد (جدول شماره 1).

در طول این مطالعه بهدنبال آهنزدایی با دفرازیروکس، کاهش سطح آنزیم آسپارتات آمینوترانسفراز و آلانین آمینوترانسفراز به ترتیب در 77 نفر (74 درصد) و 72 نفر (69/2 درصد) از بیماران β-تالاسمی دیده شد. (جدول شماره 2).

در ادامه، ارتباط میان برخی متغیرها با کاهش آمینوترانسفرازهای کبدی به دنبال 2 سال مصرف دفرازیروکس بررسی شد (جداول شماره 3 و 4).


ازنظر جنسیت، تفاوت آماری معنیداری در میزان تغییرات سطح آسپارتات آمینوترانسفراز سرم در آخرین آزمایش خون پس از مصرف دارو نسبت به سطح آن پیش از شروع مصرف دارو، به تفکیک در بیماران پسر و دختر مبتلا به β-تالاسمی دیده شد (0/0001=P و 0/004=P)؛ درحالیکه تفاوت آماری براساس تغییرات سرمی آسپارتات آمینوترانسفراز، بین 2 گروه پسران و دختران معنیدار نبود (0/32=P). همچنین تفاوت آماری معنیداری در میزان تغییرات سطح آلانین آمینوترانسفراز سرم در آخرین آزمایش خون پس از مصرف دارو، نسبت به سطح آن پیش از شروع مصرف دارو به تفکیک در بیماران پسر و دختر مبتلا به β-تالاسمی مورد مطالعه مشاهده شد (0/006=P و 0/024=P)؛ درحالیکه تفاوت آماری براساس تغییرات سرمی آلانین آمینوترانسفراز، در مجموع بین 2 گروه پسران و دختران معنیدار نبود (0/6=P). بهطورکلی، ارتباط معنیداری میان کاهش سطح ترانس آمینازهای کبدی به دنبال مصرف دفرازیروکس با جنسیت بیماران β-تالاسمی موردمطالعه یافت نشد.
ازنظر محدوده سنی، تفاوت آماری معنیداری در میزان تغییرات سطح آسپارتات آمینوترانسفراز سرم در آخرین آزمایش خون پس از مصرف دارو، نسبت به سطح آن پیش از شروع مصرف دارو به تفکیک بیماران β-تالاسمی مورد مطالعه در ردههای سنی کمتر از 15 سال (0/026=P)، 15 تا 30 سال (0/003=P) و 30 سال به بالا (0/001=P) مشاهده شد؛ درحالیکه تفاوت آماری معنیداری در مقایسه تغییرات سطح سرمی آسپارتات آمینوترانسفراز میان این 3 گروه سنی با همدیگر دیده نشد (0/676=P). همچنین تفاوت آماری معنیداری در میزان تغییرات سطح آلانین آمینوترانسفراز سرم در آخرین آزمایش خون پس از مصرف دارو، نسبت به سطح آن پیش از شروع مصرف دارو به تفکیک بیماران β-تالاسمی موردمطالعه در ردههای سنی 15 تا 30 سال (0/04=P) و 30 سال به بالا (0/001=P) مشاهده شد؛ اما تغییرات سطح آلانین آمینوترانسفراز سرم قبل و پس از درمان با دفرازیروکس در رده سنی کمتر از 15 سال (0/587=P) معنیدار نبود. مقایسه تغییرات میان این سه گروه سنی با همدیگر (0/222=P) نیز معنیدار نبود. بهطورکلی، ارتباط معنیداری میان کاهش سطح ترانس آمینازهای کبدی به دنبال مصرف دفرازیروکس با سن بیماران β-تالاسمی موردمطالعه یافت نشد.
ازنظر فواصل تزریق خون، تفاوت آماری معنیداری در میزان تغییرات سطح آلانین آمینوترانسفراز سرم در آخرین آزمایش خون پس از مصرف دارو، نسبت به سطح آن پیش از شروع مصرف دارو در دریافتکنندگان خون با فواصل زمانی بیشتر از 3 هفته (P=0/0001) مشاهده شد؛ درحالیکه تغییرات سرمی آسپارتات آمینوترانسفراز در دریافتکنندگان خون با فواصل زمانی کمتر از 3 هفته (0/071=P) و مقایسه این دو گروه ازنظر فواصل زمانی دریافت خون (0/91=P) به لحاظ آماری معنیدار نبود. همچنین تفاوت آماری معنیداری در میزان تغییرات سطح آلانین آمینوترانسفراز سرم در آخرین آزمایش خون پس از مصرف دارو، نسبت به سطح آن پیش از شروع مصرف دارو در دریافتکنندگان خون با فواصل زمانی کمتر از 3 هفته (0/031=P) و بیشتر از 3 هفته (0/01=P) مشاهده شد؛ درحالیکه تفاوت تغییرات سرمی آلانین آمینوترانسفراز در مقایسه این 2 گروه بایکدیگر ازنظر فواصل زمانی دریافت خون (0/26=P) معنیدار نبود. بهطور کلی، ارتباط معنیداری میان کاهش سطح ترانس آمینازهای کبدی به دنبال مصرف دفرازیروکس با فواصل تزریق خون بیماران β-تالاسمی مورد مطالعه یافت نشد.
ازنظر مدتزمان مصرف دفرازیروکس، تفاوت آماری معنیداری در میزان تغییرات سطح آسپارتات آمینوترانسفراز سرم در آخرین آزمایش خون پس از مصرف دارو بهمدت کمتر از ۵ سال (0/002=P) و بیشتر از 5 سال (0/0001=P)، نسبت به سطح آن پیش از شروع مصرف دارو مشاهده شد؛ درحالیکه تفاوت تغییرات سرمی آسپارتات آمینوترانسفراز میان این دو گروه (0/637=P) معنیدار نبود. همچنین تفاوت آماری معنیداری در میزان تغییرات سطح آلانین آمینوترانسفراز سرم در آخرین آزمایش خون پس از مصرف دارو به مدت کمتر از 5 سال (0/016=P) و بیشتر از 5 سال (0/012=P)، نسبت به سطح آن پیش از شروع مصرف دارو مشاهده شد؛ درحالیکه تفاوت تغییرات سرمی آلانین آمینوترانسفراز میان این دو گروه (0/974=P) معنیدار نبود. بهطورکلی، ارتباط معنیداری میان کاهش سطح ترانس آمینازهای کبدی به دنبال مصرف دفرازیروکس با طول مدت تجویز این شلاتور آهن در بیماران β-تالاسمی موردمطالعه یافت نشد.
ازنظر دُز مصرفی دفرازیروکس، تفاوت آماری معنیداری در میزان تغییرات سطح آسپارتات آمینوترانسفراز سرم پس از مصرف دارو با دُز کمتر از 32 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز (0/012=P) و بیشتر از 32 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز (0/0001=P) نسبت به سطح آن پیش از شروع مصرف دارو مشاهده شد؛ درحالیکه مقایسه تغییرات سرمی آسپارتات آمینوترانسفراز میان این دو گروه (0/561=P) معنیدار نبود. همچنین، تفاوت آماری معنیداری در میزان تغییرات سطح آلانین آمینوترانسفراز سرم پس از مصرف دارو با دُز بیشتر از 32 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز نسبت به سطح آن پیش از شروع مصرف دارو (0/003=P) مشاهده شد؛ درحالیکه تغییرات سرمی آلانین آمینوترانسفراز پس از مصرف دارو با دُز کمتر از 32 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز نسبت به سطح آن پیش از شروع مصرف دارو (0/097=P) و مقایسه تغییرات میان این دو گروه ازنظر دُز مصرفی (0/338=P) معنیدار نبود. بهطورکلی ارتباط معنیداری میان کاهش سطح ترانس آمینازهای کبدی به دنبال مصرف دفرازیروکس با دُز مصرفی این شلاتور آهن در بیماران β-تالاسمی موردمطالعه یافت نشد.
بحث
بهطورکلی در این مطالعه، با هدف تعیین میزان تأثیر آهنزدایی با دفرازیروکس در بیماران β-تالاسمی وابسته به تزریق منظم خون، سطح فریتین و ترانس آمینازهای کبدی قبل و بعد از درمان با داروی مذکور (فارغ از برند دارویی) بررسی شد.
دفرازیروکس، بهعنوان یک شلاتور آهن خوراکی، بهمنظور کاهش نارسایی بافتهای قلب، غدد درونریز و کبد ناشی از اضافهبار آهن در بیماران β-تالاسمی وابسته به تزریق منظم خون تجویز میشود. دفرازیروکس اثربخشی بالایی در حفظ سلامت بافت قلب و کبد در برابر اضافهبار آهن از خود نشان داده، بهخوبی تحمل میشود و شایعترین عوارض آن (عوارض گوارشی، افزایش ترانس آمینازهای کبدی و اختلال کلیوی) بهندرت منجر به قطع مصرف دارو میشود [8].
البته تجویز شلاتورهای آهن میتواند کاربرد گستردهتری هم در درمان بیماران تالاسمی داشته باشد. همانطور که در مطالعه خالد مسّلم و همکاران و همکاران اشاره شده است، صرفنظر از تأثیر مضاعف تزریق خون مداوم، باتوجهبه اضافهبار آهن ناشی از اریرتروپوئز غیرمؤثر و افزایش جذب آهن غذایی در بیماران β-تالاسمی سطح فریتین سرم بالای 800 نانوگرم بر میلیلیتر، بهشدت با افزایش ریسک عوارض ناشی از اضافهبار آهن همراه بوده و میتواند اندیکاسیون شروع درمان با شلاتور آهن در بیماران β-تالاسمی غیروابسته به تزریق خون نیز باشد [9].
براساس متاآنالیز مریم سلطانی و همکاران و همکاران، نرخ بقای 10، 15، 20 و 30 ساله بیماران β-تالاسمی ماژور در سراسر جهان به ترتیب به 98/39، 95/07، 90/41 و 82/93 درصد رسیده است که سهم قابلتوجهی از این افزایش امید به زندگی، مربوط به درمان همزمان با تزریق منظم خون و تجویز شلاتورهای آهن است [10].
باتوجه به اهمیت اثربخشی و عوارض ناشی از مصرف شلاتورهای آهن، در این مطالعه، 104 بیمار β-تالاسمی ماژور مراجعهکننده به بیمارستان 17 شهریور و کلینیک بعثت رشت با سن بیش از دو سال که خونگیریهای منظم داشته و حداقل به مدت 2 سال متوالی تحت درمان با دفرازیروکس بودند، با در نظر گرفتن متغیرهایی چون سن، جنس، تاریخ اولین تزریق خون، تعداد دفعات تزریق خون و مدتزمان استفاده از دفرازیروکس و دُز مصرفی آن، ازنظر سطح فریتین و آمینوترانسفرازهای کبدی قبل و بعد از شروع درمان با این شلاتور آهن بررسی شدند.
در این مطالعه، تفاوت آماری معنیداری (P=0/017) بین مقادیر فریتین خون پیش از شروع مصرف دارو و پس از آن در آخرین آزمایش خون بیماران β-تالاسمی ماژور دیده شد؛ بهطوریکه میزان فریتین خون قبل از شروع مصرف دفرازیروکس 1243±1956/4 و پس از آن 1419/4±1741/4 بود (جدول شماره 1).
همچنین طی این مطالعه، به دنبال درمان با دفرازیروکس، کاهش سطح آنزیم آسپارتات آمینوترانسفراز و آلانین آمینوترانسفراز به ترتیب در 74 و69/2 درصد از بیماران β-تالاسمی مشاهده شد. درحالیکه گاه از افزایش خفیف آنزیمهای کبدی، بهعنوان یک عارضه دفرازیروکس یاد میشود، سطح آسپارتات آمینوترانسفراز و آلانین آمینوترانسفراز به ترتیب تنها در 26 و 30/8 درصد بیماران این مطالعه افزایش یافت. درمجموع به لحاظ آماری، اثربخشی دفرازیروکس بر تغییرات سطح سرمی ترانس آمینازهای کبدی بهصورت کاهشی (0/0001=P برای آسپارتات آمینوترانسفراز و 0/015=P برای آلانین آمینوترانسفراز) در بیماران موردمطالعه، معنیدار ارزیابی شد (جدول شماره 1 و 2).
براساس متغیرهای بررسیشده، بیشترین کاهش سطح آسپارتات آمینوترانسفراز و آلانین آمینوترانسفراز به دنبال مصرف دفرازیروکس در پسرها، گروه سنی بالای 30 سال، فواصل تزریق خون بیشتر از 3 هفته، مدتزمان مصرف داروی بیشتر از 5 سال و دُز مصرفی بیشتر از 32 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز رخ داد؛ اما بهطورکلی ازلحاظ آماری، میان کاهش سطح آسپارتات آمینوترانسفراز و آلانین آمینوترانسفراز و متغیرهای بررسیشده (شامل جنسیت، محدوده سنی، فواصل تزریق خون، مدتزمان و دُز مصرفی دفرازیروکس) ارتباط معنیداری در این مطالعه یافت نشد (جداول شماره 3 و 4).
مطالعات متعددی طی سالهای اخیر از جهاتی گوناگون، اثربخشی دفرازیروکس را بر سلامت عملکرد کبد و سایر اندامهای بدن در بیماران β-تالاسمی بررسی کردهاند.
در مطالعه ارندی و همکاران، 32 بیمار β-تالاسمی ماژور در شیراز، 2 روز در هفته تحت درمان ترکیبی با دفرازیروکس (با دُز 30 تا 40 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز) و دفروکسامین (با دُز 40 تا 50 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز) قرار گرفتند. پس از گذشت 12 ماه، کاهش چشمگیری در سطح فریتین سرم این بیماران از 1955±4031 نانوگرم بر میلیلیتر به 2416 نانوگرم بر میلیلیتر مشاهده شد (P<0/001). در این مطالعه، بین تغییرات سطح فریتین سرم ناشی از شلاتورهای آهن با سن و جنسیت بیماران ارتباط معنیداری یافت نشد. سطح آسپارتات آمینوترانسفراز به دنبال مصرف ترکیبی این شلاتورهای آهن، به طور متوسط از 19/29±33/68 به 31/99±37/5 و سطح آلانین آمینوترانسفراز از 51/14±45/18 به 44/58±41/59 رسیده بود که ازنظر آماری معنیدار ارزیابی نشد (به ترتیب 0/45=P و 0/567=P). همچنین افزایش معنیداری در تغییرات سطح نیتروژن اوره خون و کراتینین بیماران به دنبال درمان ترکیبی با دفرازیروکس و دفروکسامین مشاهده نشد (به ترتیب 0/623=P و 0/215=P) [11].
در کارآزمایی بالینی صالحیفر و همکاران، 21 بیمار β-تالاسمی ماژور که حداقل به مدت 6 ماه، 1 بار در روز دفرازیروکس مصرف میکردند، تحت درمان با این دارو بهصورت 2 بار در روز قرار گرفتند. میانگین آخرین سطح فریتین بیماران نسبت به مقادیر پایه، بهطور معنیداری از 922±1814 نانوگرم بر میلیلیتر به 907±1472 نانوگرم بر میلیلیتر کاهش یافت (0/02=P). البته در تغییر میزان کراتینین، آسپارتات آمینوترانسفراز و آلانین آمینوترانسفراز این بیماران نسبت به مقادیر پایه، اختلاف معنیداری مشاهده نشد (به ترتیب 0/87=P و 0/5=P و 0/62=P). این مطالعه درنهایت، اینطور نتیجهگیری کرد که مصرف دو بار در روز دفرازیروکس، با کمترین عوارض کبدی و کلیوی، بهطوری معنیدار میتواند موجب کاهش سطح فریتین سرم نسبت به مصرف 1 بار در روز آن شود [12].
در بررسی همزمان 2 مطالعه مذکور با مطالعه کنونی میتوان از دیدگاههای متفاوتی، تأثیر آهنزدایی با دفرازیروکس بر کاهش معنیدار سطح سرمی فریتین بیماران β-تالاسمی وابسته به تزریق خون را مشاهده کرد (جدول شماره 5).

این مسئله باید درنظر گرفته شود که کاهش معنیدار فریتین در مطالعه ارندی و همکاران بر اثر درمان ترکیبی با دفرازیروکس و دفروکسامین، و در مطالعه صالحیفر و همکاران بر اثر افزایش دفعات مصرف روزانه دفرازیروکس (از 1 بار در روز به 2 بار در روز) ایجاد شده است. همچنین باید به این نکته اشاره کرده که حجم نمونه مطالعه کنونی (104 بیمار)، بهصورت قابلملاحظهای بیشتر از سایر این مطالعات است.
بررسی همزمان این 3 مطالعه، مشابهتها و تناقضهایی را در خصوص تأثیر آهنزدایی با دفرازیروکس بر سطح سرمی ترانس آمینازهای کبدی نشان میدهد (جدول شماره 6).

همسو با مطالعه صالحیفر و همکاران در دانشگاه علومپزشکی مازندران که در آن افزایش دفعات مصرف روزانه دفرازیروکس (از 1 بار در روز به 2 بار در روز) تفاوت معنیداری را در سطح نهایی ترانس آمینازهای کبدی سرم نسبت به سطح پایه آنها ایجاد نکرد، مطالعه کنونی نیز کاهش معنیدار وابسته به دُز مصرفی دفرازیروکس را در سطح این آنزیمهای کبدی نشان نمیدهد. به علاوه، درحالیکه درمان ترکیبی با دفرازیروکس و دفروکسامین در مطالعه ارندی و همکاران تغییر معنیداری را در سطح سرمی ترانس آمینازهای کبدی در پی نداشت، مطالعه کنونی کاهش معنیداری را در سطح این آنزیمهای کبدی به دنبال درمان تکدارویی با دفرازیروکس نشان میدهد.
در ادامه، با بررسی مطالعات مرتبط متنوعتر، به ابعاد گستردهتری از کارایی و عوارض دفرازیروکس اشاره میکنیم که میتواند برای انجام مطالعات مرتبط آینده توسط علاقهمندان در نظر گرفته شود.
در مطالعه کریمی و همکاران، بیماران β-تالاسمی اینترمدیای تحت درمان با دفرازیروکس، هر 2 ماه طی 1 سال ازنظر سطح فریتین سرم پایش شدند. این بیماران β-تالاسمی اینترمدیا درصورت وجود فریتین سرم 1000 تا 1500 نانوگرم بر میلیلیتر، 10 تا 20 میلیگرم به ازای هر کیلوگرم وزن در شبانهروزدفرازیروکس، فریتین سرم 1500 تا 2000 نانوگرم بر میلیلیتر، 20 تا 30 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز دفرازیروکس و فریتین سرم بالای 2000 نانوگرم بر میلیلیتر، 30 تا 40 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز دفرازیروکس دریافت میکردند. کاهش سطح فریتین سرم در 2 ماه ابتدایی، معنیدار نبود (0/88=P)؛ اما بعد از گذشت 4 ماه (0/01=P)، 6 ماه (0/001=P)، 8 ماه (P<0/001)، 10 ماه (P<0/001) و 12 ماه (P<0/001) از شروع درمان با دفرازیروکس، کاهشی معنیدار در سطح فریتین سرم آنان مشاهده شد [13].
در مطالعه سلیمان و همکاران در قطر، به دنبال درمان بیماران β-تالاسمی ماژور سرونگاتیو ازنظر هپاتیت، از سن 8 سالگی تا 18 سالگی با دفروکسامین و سپس 20 میلیگرم به ازای هر کیلوگرم وزن در شبانهروز دفرازیروکس (از 1/5±13/8 سالگی)، کاهشی معنیدار در سطح سرمی فریتین، آسپارتات آمینوترانسفراز، آلانین آمینوترانسفراز و آلکالین فسفاتاز مشاهده شد. همچنین نویسنده این مقاله، افزایش سطح فاکتور رشد شبه انسولین 1 را در این بیماران به دنبال درمان با شلاتور آهن، نشانی از بهبود کارکرد کبد عنوان میکند [14].
همچنین برخی از مطالعات، میزان تأثیر داروهای آهنزدا بر آهن ذخیرهشده در بافتهای قلب و کبد بیماران β-تالاسمی ماژور را بهوسیله تصویربرداری رزونانس مغناطیسی T2 مورد بررسی قرار دادهاند. گفتنی است که دسترسی آسانتر و هزینه کمتر، از مزایای بررسی ترانس آمینازهای کبدی نسبت به MRI میباشد.
در مطالعه مرادویسی و همکاران بر پایه نتایج بررسی تصویربرداری رزونانس مغناطیسی T2 در 52 بیمار β-تالاسمی ماژور بیمارستان بعثت سنندج، دفرازیروکس نسبت به دفروکسامین تأثیر بیشتری بر کاهش آهن کبد و قلب از خود نشان داد. این اثر محافظتی دفرازیروکس، بر روی بافت قلب نسبت به بافت کبد بیشتر بود. در این مطالعه تفاوت معنادار آماری بین تأثیر دفرازیروکس و دفروکسامین بر آنزیمهای کبدی سرم (آسپارتات آمینوترانسفراز و آلانین آمینوترانسفراز) وجود نداشت. تنها در مصرفکنندگان دفروکسامین میان فریتین و آهن ذخیرهشده در کبد همبستگی معنیداری وجود داشت و برای مصرفکنندگان دفررازیروکس اینچنین نبود [15].
در مطالعه انصاری و همکاران بر روی 108 بیمار β-تالاسمی ماژور در تهران، درمان تکدارویی با دفرازیروکس و درمان ترکیبی با دفروکسامین و دفریپرون تأثیر قابلملاحظهای بر بهبود نتایج بررسی کبد و قلب با تصویربرداری رزونانس مغناطیسی T2 نسبت به درمان تکدارویی با دفروکسامین داشت [16].
در یک بررسی تحلیلیمروری، بولیش و همکاران به این نتیجه دست یافتند که دفرازیروکس میتواند بهعنوان شلاتور آهن انتخابی در خط اول درمان اضافهبار آهن ناشی از تالاسمی، خصوصاً در بیماران متمایل به مصرف دفرازیروکس خوراکی و بیماران با عدم تحمل مناسب دفروکسامین تزریقی، تجویز شود؛ زیرا در پی بررسیهای متعدد، مصرف دفرازیروکس در طولانیمدت اثربخشی مشابهی نسبت به دفروکسامین از خود نشان داده است [17].
در مطالعه الخبوری و همکاران، عوارض پدیدآمده در 72 بیمار β-تالاسمی ماژور و اینترمدیا در عمان که تحت درمان با دفرازیروکس بودند، بررسی شدند. علت قطع دفرازیروکس در 7 نفر اختلال عملکرد کلیه، 2 نفر احساس ناخوشایند عمومی، 2 نفر افزایش ترانس آمینازهای کبدی، 1 نفر حاملگی و 1 نفر اسهال شدید گزارش شد [18].
در مطالعه بادلی و همکاران، به دنبال درمان با دفرازیروکس افزایش معنیداری در سطح نیتروژن اوره خون سرم، لیپوکالین مرتبط با ژلاتیناز نوتروفیل ادرار، اینترلوکین 18 ادرار، آلبومین ادرار، نسبت لیپوکالین مرتبط با ژلاتیناز نوتروفیل ادرار به کراتینی و نسبت مولکول آسیب کلیه 1 ادرار به کراتینین در بیماران β-تالاسمی ماژور بیمارستان 17 شهریور مشاهده شد [19].
در مطالعه پوششدوست و همکاران، در 156 بیمار تالاسمی وابسته به تزریق خون و تحت درمان با دفرازیروکس، تغییر حدت بینایی و افت شنوایی حسیعصبی، به ترتیب تنها در 0/6 و 1/3 درصد از بیماران گزارش شده است [20].
نتیجهگیری
دفرازیروکس، بهعنوان یک شلاتور آهن خوراکی جهت مقابله با اضافهبار آهن بدن در بیماران β-تالاسمی ماژور و اینترمدیا، داروی مؤثر و نسبتاً ایمنی است. در این مطالعه مصرف دفرازیروکس، نهتنها بهندرت افزایش خفیف آنزیمهای کبدی را بههمراه داشت، بلکه درمجموع در بیماران β-تالاسمی وابسته به تزریق خون منجر به کاهش قابلملاحظهای در سطح سرمی فریتین و ترانس آمینازهای کبدی شد. بهنظر میرسد که مصرف دفرازیروکس بعد از گذشت چند ماه، بیشتر از ایجاد عوارض کبدی خفیف نادر، میتواند برای کبد نقشی محفاظتی در برابر اضافهبار آهن بدن ایفا کند و منجر به کاهش سطح آمینوترانسفرازهای کبدی شود. در این مطالعه، بیشترین کاهش سطح ترانسآمینازهای کبدی به دنبال مصرف دفرازیروکس در پسرها، گروه سنی بالای 30 سال، فواصل تزریق خون بیشتر از 3 هفته، مدتزمان مصرف داروی بیشتر از 5 سال و دُز مصرفی بیشتر از mg/kg/day 32 دیده شد؛ اما بهطورکلی در این بیماران، میزان اثربخشی آهنزدایی با این شلاتور آهن بر کاهش سطح آنزیمهای کبدی وابستگی معنیداری را به لحاظ آماری به سن، جنس، میزان تزریق خون، مدتزمان و دُز مصرف دفرازیروکس از خود نشان نداد. باتوجهبه برخی مغایرتهای اشارهشده میان مطالعات گوناگون، تعیین دقیقتر قابلیت روشهای تشخیصی غیرتهاجمی (ازجمله آمینوترانسفرازهای کبدی و MRI) در نمایان کردن اثرات مخرب اضافهبار آهن و دفرازیروکس بر کبد به بررسیهای مبتنی بر شواهد گستردهتری نیاز دارد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه توسط کمیته اخلاق در پژوهشهای زیست پزشکی دانشگاه علومپزشکی گیلان تأیید شده است (IR.GUMS.REC.1397.092).
حامی مالی
این پژوهش هیچگونه کمک مالی از سازمانهای تأمین مالی در بخشهای عمومی، تجاری یا غیرانتفاعی دریافت نکرده است.
مشارکت نویسندگان
مفهومسازی و روششناسی: بهرام دربندی، سوده صالحی، شایان پورکاظم و محمدرضا شریفی راد؛ اعتبارسنجی و تحلیل: عادل باقرسلیمی، مرسده انشائی و محمدرضا شریفی راد؛ تحقیق و بررسی منابع و بصریسازی: شایان پورکاظم؛ نگارش پیشنویس: محمدرضا شریفی راد و شایان پورکاظم؛ ویراستاری و نهاییسازی نوشته: بهرام دربندی و شایان پورکاظم؛ نظارت: وحید امینزاده، بهرنگ معتمد، عادل باقرسلیمی و بهرام دربندی؛ مدیریت پروژه: بهرام دربندی؛ تأمین مالی: محمدرضا شریفی راد.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان مراتب سپاس و قدردانی خود را از دکتر آفاق حسنزاده راد و آقای رضا بیات (همکاران محترم مرکز تحقیقات بیماریهای کودکان) اعلام میدارند.
References
1.Ali S, Mumtaz S, Shakir HA, Khan M, Tahir HM, Mumtaz S, et al. Current status of beta-thalassemia and its treatment strategies. Molecular Genetics & Genomic Medicine. 2021; 9(12):e1788. [DOI:10.1002/mgg3.1788] [PMID]
2.Rivella S. Ineffective erythropoiesis and thalassemias. Current Opinion in Hematology. 2009; 16(3):187-94. [DOI:10.1097/MOH.0b013e32832990a4] [PMID]
3.Shah FT, Sayani F, Trompeter S, Drasar E, Piga A. Challenges of blood transfusions in β-thalassemia. Blood Reviews. 2019; 37:100588. [DOI:10.1016/j.blre.2019.100588] [PMID]
4.Kattamis A, Forni GL, Aydinok Y, Viprakasit V. Changing patterns in the epidemiology of β-thalassemia. European Journal of Haematology. 2020; 105(6):692-703. [DOI:10.1111/ejh.13512] [PMID]
5.Ahmed MH, Ghatge MS, Safo MK. Hemoglobin: Structure, function and allostery. Sub-Cellular Biochemistry. 2020; 94:345-82. [DOI:10.1007/978-3-030-41769-7_14] [PMID]
6.Pinto VM, Forni GL. Management of iron overload in beta-thalassemia patients: Clinical practice update based on case series. International Journal of Molecular Sciences. 2020; 21(22):8771. [DOI:10.3390/ijms21228771] [PMID]
7.Qadah T. Deferasirox versus deferoxamine in managing iron overload in patients with Sickle Cell Anaemia: A systematic review and meta-analysis. Journal of International Medical Research. 2022; 50(12):03000605221143290. [DOI:10.1177/03000605221143290] [PMID]
8.Cassinerio E, Roghi A, Orofino N, Pedrotti P, Zanaboni L, Poggiali E, et al. A 5-year follow-up in deferasirox treatment: Improvement of cardiac and hepatic iron overload and amelioration in cardiac function in thalassemia major patients. Annals of Hematology. 2015; 94(6):939-45. [DOI:10.1007/s00277-014-2291-x] [PMID]
9.Musallam KM, Vitrano A, Meloni A, Pollina SA, Karimi M, El-Beshlawy A, et al. Risk of mortality from anemia and iron overload in nontransfusion-dependent β-thalassemia. American Journal of Hematology. 2022; 97(2):E78-80. [DOI:10.1002/ajh.26428] [PMID]
10.Soltani M, Hassanipour S, Veisani Y, Darbandi M, Rezaiean S. The global survival rate of patients with beta-thalassemia major: A systematic review and meta-analysis. Journal of Contemporary Medical Sciences. 2021; 7(2):80-5. [Link]
11.Arandi N, Haghpanah S, Safaei S, Zahedi Z, Ashrafi A, Eatemadfar P, et al. Combination therapy-deferasirox and deferoxamine-in thalassemia major patients in emerging countries with limited resources. Transfusion Medicine. 2015; 25(1):8-12. [DOI:10.1111/tme.12188] [PMID]
12.Salehifar E, Karami H, Kosaryan M, Masoudi H, Aliasgharian A, Mousavi M, et al. [Efficacy of oral deferasirox by twice-daily dosing in patients with transfusion-dependent beta thalassemia (Persian)]. Journal of Mazandaran University of Medical Sciences. 2015; 25(129):1-8. [Link]
13.Karimi M, Arandi N, Haghpanah S, Ansari S, Azarkeyvan A, Bordbar M, et al. Efficacy of deferasirox (Exjade®) in modulation of iron overload in patients with β-thalassemia intermedia. Hemoglobin. 2015; 39(5):327-9. [DOI:10.3109/03630269.2015.1057735] [PMID]
14.Soliman A, Yassin M, Al Yafei F, Al-Naimi L, Almarri N, Sabt A, et al. Longitudinal study on liver functions in patients with thalassemia major before and after deferasirox (DFX) therapy. Mediterranean Journal of Hematology and Infectious Diseases. 2014; 6(1):e2014025. [DOI:10.4084/mjhid.2014.025] [PMID]
15.Moradveisi B, Taghizadeh Sarvestani R, Ghaderi E, Kompany F. [Comparison of the heart and liver iron deposition status in Major β Thalassemia patients treated with two iron chelation drugs of "Deferoxamine and Deferasiroxon" using MRI T2* technique (Persian)]. The Scientific Journal of Iranian Blood Transfusion Organization. 2015; 12(1):55-62. [Link]
16.Ansari S, Azarkeivan A, Miri-Aliabad G, Yousefian S, Rostami T. Comparison of iron chelation effects of deferoxamine, deferasirox, and combination of deferoxamine and deferiprone on liver and cardiac T2* MRI in thalassemia maior. Caspian Journal of Internal Medicine. 2017; 8(3):159-64. [PMID]
17.Bollig C, Schell LK, Ruecker G, Allert R, Motschall E, Niemeyer CM, et al. Deferasirox for managing iron overload in people with thalassaemia. Cochrane Database of Systematic Reviews. 2017; 8(8):CD007476. [DOI:10.1002/14651858.CD007476.pub3] [PMID]
18.Al-Khabori M, Bhandari S, Al-Huneini M, Al-Farsi K, Panjwani V, Daar S. Side effects of deferasirox iron chelation in patients with beta thalassemia major or intermedia. Oman Medical Journal. 2013; 28(2):121-4. [DOI:10.5001/omj.2013.31] [PMID]
19.Badeli H, Baghersalimi A, Eslami S, Saadat F, Rad AH, Basavand R, et al. Early kidney damage markers after deferasirox treatment in patients with thalassemia major: A case-control study. Oxidative Medicine and Cellular Longevity. 2019; 2019:5461617. [DOI:10.1155/2019/5461617] [PMID]
20.Poosheshdoost P, Faraji N, Zeinali T, Baghersalimi A, Miremarati A, Darbandi B. Visual and auditory complications during deferasirox therapy in Beta-thalassemia. Iranian Journal of Pediatric Hematology & Oncology. 2022. [DOI:10.18502/ijpho.v12i4.10913]
2.Rivella S. Ineffective erythropoiesis and thalassemias. Current Opinion in Hematology. 2009; 16(3):187-94. [DOI:10.1097/MOH.0b013e32832990a4] [PMID]
3.Shah FT, Sayani F, Trompeter S, Drasar E, Piga A. Challenges of blood transfusions in β-thalassemia. Blood Reviews. 2019; 37:100588. [DOI:10.1016/j.blre.2019.100588] [PMID]
4.Kattamis A, Forni GL, Aydinok Y, Viprakasit V. Changing patterns in the epidemiology of β-thalassemia. European Journal of Haematology. 2020; 105(6):692-703. [DOI:10.1111/ejh.13512] [PMID]
5.Ahmed MH, Ghatge MS, Safo MK. Hemoglobin: Structure, function and allostery. Sub-Cellular Biochemistry. 2020; 94:345-82. [DOI:10.1007/978-3-030-41769-7_14] [PMID]
6.Pinto VM, Forni GL. Management of iron overload in beta-thalassemia patients: Clinical practice update based on case series. International Journal of Molecular Sciences. 2020; 21(22):8771. [DOI:10.3390/ijms21228771] [PMID]
7.Qadah T. Deferasirox versus deferoxamine in managing iron overload in patients with Sickle Cell Anaemia: A systematic review and meta-analysis. Journal of International Medical Research. 2022; 50(12):03000605221143290. [DOI:10.1177/03000605221143290] [PMID]
8.Cassinerio E, Roghi A, Orofino N, Pedrotti P, Zanaboni L, Poggiali E, et al. A 5-year follow-up in deferasirox treatment: Improvement of cardiac and hepatic iron overload and amelioration in cardiac function in thalassemia major patients. Annals of Hematology. 2015; 94(6):939-45. [DOI:10.1007/s00277-014-2291-x] [PMID]
9.Musallam KM, Vitrano A, Meloni A, Pollina SA, Karimi M, El-Beshlawy A, et al. Risk of mortality from anemia and iron overload in nontransfusion-dependent β-thalassemia. American Journal of Hematology. 2022; 97(2):E78-80. [DOI:10.1002/ajh.26428] [PMID]
10.Soltani M, Hassanipour S, Veisani Y, Darbandi M, Rezaiean S. The global survival rate of patients with beta-thalassemia major: A systematic review and meta-analysis. Journal of Contemporary Medical Sciences. 2021; 7(2):80-5. [Link]
11.Arandi N, Haghpanah S, Safaei S, Zahedi Z, Ashrafi A, Eatemadfar P, et al. Combination therapy-deferasirox and deferoxamine-in thalassemia major patients in emerging countries with limited resources. Transfusion Medicine. 2015; 25(1):8-12. [DOI:10.1111/tme.12188] [PMID]
12.Salehifar E, Karami H, Kosaryan M, Masoudi H, Aliasgharian A, Mousavi M, et al. [Efficacy of oral deferasirox by twice-daily dosing in patients with transfusion-dependent beta thalassemia (Persian)]. Journal of Mazandaran University of Medical Sciences. 2015; 25(129):1-8. [Link]
13.Karimi M, Arandi N, Haghpanah S, Ansari S, Azarkeyvan A, Bordbar M, et al. Efficacy of deferasirox (Exjade®) in modulation of iron overload in patients with β-thalassemia intermedia. Hemoglobin. 2015; 39(5):327-9. [DOI:10.3109/03630269.2015.1057735] [PMID]
14.Soliman A, Yassin M, Al Yafei F, Al-Naimi L, Almarri N, Sabt A, et al. Longitudinal study on liver functions in patients with thalassemia major before and after deferasirox (DFX) therapy. Mediterranean Journal of Hematology and Infectious Diseases. 2014; 6(1):e2014025. [DOI:10.4084/mjhid.2014.025] [PMID]
15.Moradveisi B, Taghizadeh Sarvestani R, Ghaderi E, Kompany F. [Comparison of the heart and liver iron deposition status in Major β Thalassemia patients treated with two iron chelation drugs of "Deferoxamine and Deferasiroxon" using MRI T2* technique (Persian)]. The Scientific Journal of Iranian Blood Transfusion Organization. 2015; 12(1):55-62. [Link]
16.Ansari S, Azarkeivan A, Miri-Aliabad G, Yousefian S, Rostami T. Comparison of iron chelation effects of deferoxamine, deferasirox, and combination of deferoxamine and deferiprone on liver and cardiac T2* MRI in thalassemia maior. Caspian Journal of Internal Medicine. 2017; 8(3):159-64. [PMID]
17.Bollig C, Schell LK, Ruecker G, Allert R, Motschall E, Niemeyer CM, et al. Deferasirox for managing iron overload in people with thalassaemia. Cochrane Database of Systematic Reviews. 2017; 8(8):CD007476. [DOI:10.1002/14651858.CD007476.pub3] [PMID]
18.Al-Khabori M, Bhandari S, Al-Huneini M, Al-Farsi K, Panjwani V, Daar S. Side effects of deferasirox iron chelation in patients with beta thalassemia major or intermedia. Oman Medical Journal. 2013; 28(2):121-4. [DOI:10.5001/omj.2013.31] [PMID]
19.Badeli H, Baghersalimi A, Eslami S, Saadat F, Rad AH, Basavand R, et al. Early kidney damage markers after deferasirox treatment in patients with thalassemia major: A case-control study. Oxidative Medicine and Cellular Longevity. 2019; 2019:5461617. [DOI:10.1155/2019/5461617] [PMID]
20.Poosheshdoost P, Faraji N, Zeinali T, Baghersalimi A, Miremarati A, Darbandi B. Visual and auditory complications during deferasirox therapy in Beta-thalassemia. Iranian Journal of Pediatric Hematology & Oncology. 2022. [DOI:10.18502/ijpho.v12i4.10913]
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






