دوره 33، شماره 1 - ( 1-1403 )
جلد 33 شماره 1 صفحات 65-52 |
برگشت به فهرست نسخه ها
Research code: 3205
Ethics code: IR.GUMS.REC.1400.124
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Hesari Z, Rohani M, Parvinroo S, Rafiei E. Prevalence of Microbial and Fungal Contamination in Four Medicinal Plants from the Lamiaceae Family in Herb Shops in Rasht, Iran. JGUMS 2024; 33 (1) :52-65
URL: http://journal.gums.ac.ir/article-1-2634-fa.html
URL: http://journal.gums.ac.ir/article-1-2634-fa.html
حصاری زهرا، روحانی معصومه، پروین رو شیرین، رفیعی الهه. بررسی شیوع آلودگی میکروبی 4 گونه گیاه دارویی از خانواده نعناییان در عطاریهای سطح شهر رشت. مجله علوم پزشکی گیلان. 1403; 33 (1) :52-65
زهرا حصاری1 

 ، معصومه روحانی2
، معصومه روحانی2 

 ، شیرین پروین رو*2
، شیرین پروین رو*2 

 ، الهه رفیعی3
، الهه رفیعی3 




 ، معصومه روحانی2
، معصومه روحانی2 

 ، شیرین پروین رو*2
، شیرین پروین رو*2 

 ، الهه رفیعی3
، الهه رفیعی3 


1- گروه فارماسیوتیکس، دانشکده داروسازی، دانشگاه علومپزشکی گیلان، رشت، ایران.
2- گروه فارماکوگنوزی، دانشکده داروسازی، دانشگاه علومپزشکی گیلان، رشت، ایران.
3- واحد توسعه تحقیقات بالینی رازی، دانشگاه علومپزشکی گیلان، رشت، ایران.
2- گروه فارماکوگنوزی، دانشکده داروسازی، دانشگاه علومپزشکی گیلان، رشت، ایران.
3- واحد توسعه تحقیقات بالینی رازی، دانشگاه علومپزشکی گیلان، رشت، ایران.
متن کامل [PDF 5296 kb]
(500 دریافت)
| چکیده (HTML) (1904 مشاهده)
References
متن کامل: (979 مشاهده)
مقدمه
طبق تعریف سازمان بهداشت جهانی، گیاه دارویی گیاهی است که در یک یا چند اندام خود حاوی موادی است که میتوان از آنها برای اهداف درمانی یا به عنوان پیشسازهای نیمه سنتتیک استفاده کرد. [1]
گیاهان دارویی تقریباً در همه فرهنگها برای درمان استفاده میشوند. اطمینان از ایمنی، کیفیت و اثربخشی گیاهان دارویی و داروهای گیاهی اخیراً به موضوعی اساسی در کشورهای صنعتی و درحالتوسعه تبدیل شده است. با استانداردسازی و ارزیابی سلامت ترکیبات فعال گیاهی، داروهای گیاهی میتوانند به ظهور دوره جدیدی از سیستم مراقبتهای بهداشتی برای درمان بیماریهای انسان در آینده کمک کنند. آگاهی از دانش سنتی و گیاهان دارویی میتواند نقشی اساسی در بهرهبرداری و کشف منابع طبیعی گیاهان داشته باشد [2].
به دلیل طبیعی بودن محصولات گیاهی آنها اغلب بیخطر تلقی میشوند، اما مطالعات نشان داده است که ممکن است حاوی میکروارگانیسمهای بیماریزا باشند [3]. آلودگی میکروبی گیاهان دارویی میتواند با طیف گستردهای از آلایندهها، اعم از باکتریها، قارچها و ویروسها مرتبط باشد [4]. در میان این میکروارگانیسمها ممکن است عوامل بیماریزا وجود داشته باشند و این واقعیت، به ویژه استفاده از این گیاهان را محدود میکند [5].
از جمله آلایندههایی که برای سلامت خطر جدی دارند، باکتریهای بیماریزا مانند سالمونلا، اشرشیا کلی، استافیلوکوکوس اورئوس ، گونههای شیگلا و سایر گونههای گرم مثبت و گرم منفی باکتریها هستند [6, 7, 8, 9, 10]. حضور باکتریهایی چون اشرشیا کلی و سالمونلا در گیاهان دارویی حاکی از آلودگی مدفوعی و شرایط بهداشتی ضعیف در فرایند تهیه و نگهداری آنهاست [11]. مواد اولیه جمعآوریشده با استفاده از روشهای غیرعلمی معمولاً در معرض بسیاری از آلایندههای بیماریزا قرار دارند و اغلب آنها قبل از برداشت محصول و همچنین هنگام حملونقل و نگهداری توسط میکروارگانیسمهای بیماریزا آلوده میشوند. شواهد نشان میدهد آلودگی گیاهان میتواند به انسان انتقال پیدا کند [11، 12].
بیشتر قارچها در طبیعت سمی هستند و برخی از گونههای غیرسمی دیگر ممکن است بو و طعم کپک را ایجاد کنند [13]. در مرحله قبل از برداشت، گیاهان دارویی مستعد ابتلا به قارچهای بومی در خاکی هستند که در آن کشت شدهاند. قسمت خشکشده گیاهان دارویی ممکن است پس از برداشت در معرض آلودگی قارچی قرار گیرد. گروههای متفاوتی از قارچها در نمونههای گیاهان دارویی جمعآوریشده از مناطق مختلف شناسایی شدهاند که نشان میدهد پنسیلیوم و آسپرژیلوس به عنوان غالبترین جنسها مطرح هستند [14-16]. بسیاری از گونههای 2 جنس مذکور به عنوان تولیدکنندگان اختصاصی میکوتوکسینها شناخته شدهاند که میتواند تهدید جدی برای سلامت عمومی محسوب شود [13].
آفلاتوکسینها (G1 ،B2 ،B1 و G2) خانوادهای از متابولیتهای ثانویه سمی هستند که بهطور عمده توسط سویههای خاصی از آسپرژیلوس فلاووس و آسپرژیلوس پارازیتیکوس تولید میشوند [17, 18]. آفلاتوکسین B1 در سال 1993 توسط سازمان بهداشت جهانی به عنوان یک عامل سرطانزای گروه یک طبقهبندی شده است [19]. استریگماتوسیستین، واسطه پایدار در مراحل نهایی بیوسنتز آفلاتوکسین در اوکراتوکسین آ توسط پنی سیلیوم وروکوزوم، پنی سیلیوم نوردیکم و آسپرژیلوس کربوناریوس به عنوان یک میکوتوکسین سرطانزا شناخته شده است [20]. میکوتوکسین دیگری به نام وکراتوکسین آ توسط پنی سیلیوم وروکوزوم، پنی سیلیوم نوردیکم و آسپرژیلوس کربوناریوس تولید میشود که میتواند باعث ایجاد یک سری اثرات نامطلوب، از جمله تراتوژنیسیته، سمیت ایمنی، سمیت ژنی و جهشزایی در حیوانات و انسان شود [21, 22, 23].
در ایران بیشتر گیاهان دارویی و ادویهای به صورت فلهای و خشکشده توسط عطاریها عرضه میشوند و از نظر بهداشتی، سلامت غذایی و دارویی ندارند، این در حالی است که تمایل روبهرشدی در استفاده از آنها بین مردم وجود دارد؛ بنابراین ارزیابی بهداشتی این گیاهان از اهمیت بالایی برخوردار است. هدف از این مطالعه، ارزیابی آلودگی میکروبی 4 گونه گیاه دارویی پرمصرف از خانواده نعناییان شامل نعنا، پونه، رزماری و بادرنجبویه در عطاریهای سطح رشت است.
روشها
جمعآوری نمونههای گیاهی
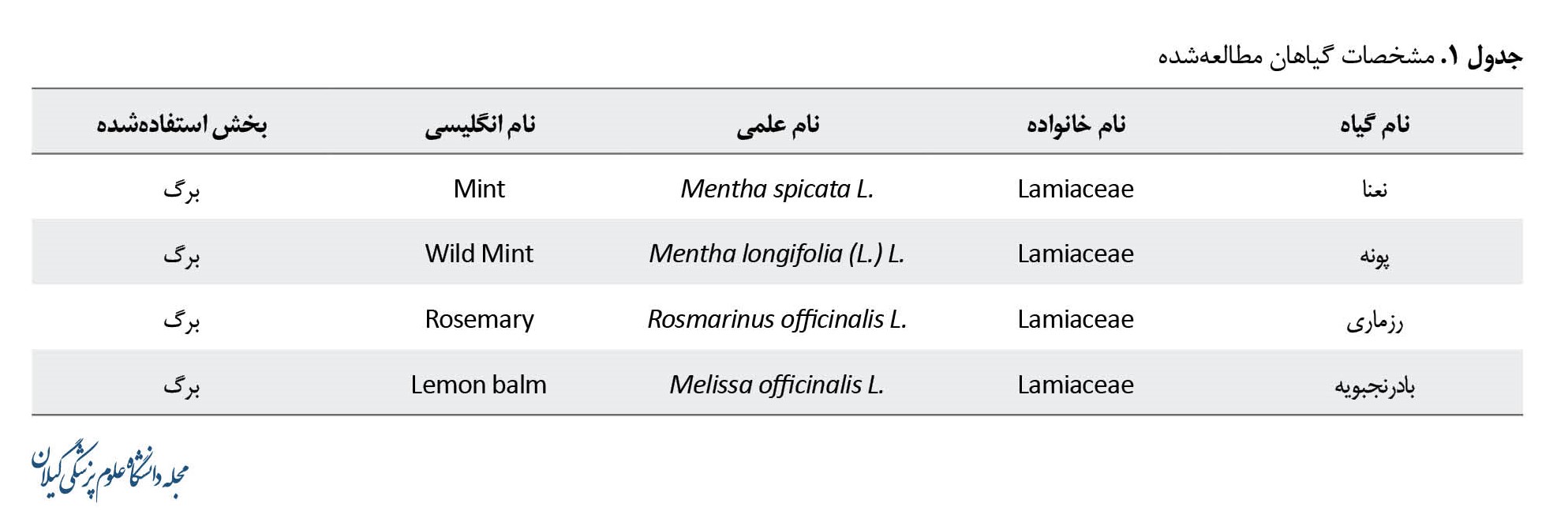
برای این مطالعه در مجموع 61 نمونه به صورت تصادفی از عطاریهای سطح شهر رشت در سال 1399 جمعآوری شد (15 نمونه از هر کدام از گیاهان نعنا، پونه، رزماری و 16 نمونه از گیاه بادرنجبویه) (جدول شماره 1).
حجم نمونه با کمک فرمول شماره 1 و آلودگی نمونههای پونه کوهی به سالمونلا برابر 50 درصد در مطالعه کاروانی و همکاران [24] با P 0/25=d و 0/05=α برابر با 61 نمونه برآورد شد.
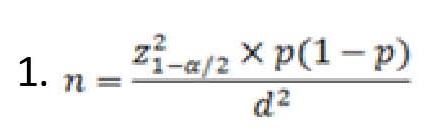
در این مطالعه، سطح شهر رشت به 5 منطقه تقسیمبندی شده و در هر منطقه به صورت تصادفی از 3 عطاری، گیاهان مورد نظر جمعآوری شد. نمونهها کدبندی شدند. نمونههای جمعآوریشده همگی شامل برگ گیاهان مطالعهشده بود.
آمادهسازی نمونهها
به منظور بررسی بار میکروبی نمونههای مطالعهشده، بر اساس دستورالعمل شماره 61 فارماکوپه ایالات متحده آمریکا [25] ابتدا رقت پایه10-1 گرم بر میلیلیتر از هر نمونه تهیه شد. بدین منظور مقدار 10 گرم از نمونهها در هاون کوبیده شد.
یک گرم از آن به لوله استریل حاوی 9 سیسی محیط کشت آمادهشده تریپتیک سوی براث منتقل شد. در لوله آزمایش بسته و به آرامی مخلوط شد. سپس نمونههای تهیهشده به مدت 1 ساعت در انکوباتور و در دمای 25 درجه سلسیوس قرار داده شد.
بررسی نمونهها از نظر میزان آلودگی باکتریایی
100 میکرولیتر از نمونه آمادهشده با سمپلر 100 در کنار شعله، به سطح محیط کشت جامد در پلیت برای بررسی آلودگیهای باکتریایی اضافه شد.
برای هر نمونه 2 پلیت تریپتیک سوی آگار در نظر گرفته شد. در نهایت، پلیتهای تریپتیک سوی آگار به مدت 18 تا 24 ساعت در دمای 35±2 درجه سلسیوس در انکوباتور قرار داده شد. بعد از 48 ساعت پلیتها به منظور بررسی میزان و نحوه رشد میکروارگانیسمها از انکوباتور خارج شد، کلونیهای سطح پلیت شمارش شد و با مقادیر استاندارد تعیینشده برای مواد غیراستریل استفادهشده در فراوردههای دارویی، توسط دستورالعمل شماره 1111 فارماکوپه [26] مقایسه شد.
بررسی نمونهها از نظر میزان آلودگی قارچ و مخمر
100 میکرولیتر از ترکیب تهیهشده با سمپلر 100 در کنار شعله، به سطح محیط کشت سابورو دکسترو آگار برای بررسی آلودگیهای قارچی و مخمر اضافه شد. برای هر نمونه 2 پلیت SDA در نظر گرفته شد. پلیتهای حاوی محیط کشت SDA به مدت 2 تا 3 روز در دمای 35±3 درجه سلسیوس انکوبه شدند.
کلونیهای رشدکرده در پلیتهای مک کانکی آگار، سابورو دکستروز آگارو تریپتیک سوی آگار با مقادیر استاندارد مقایسه شد. مطابق USP در فراوردههای غیراستریل خوراکی جامد (به جز آبی) مشاهده هر تعداد کلونی اشرشیا کلی بالاتر از حد مجاز در نظر گرفته میشود [26].
تشخیص افتراقی اشرشیا کلی
برای شناسایی اشرشیاکلی بر اساس دستورالعمل شماره 62 فارماکوپه ایالات متحده آمریکا [27] پس از آمادهسازی نمونه که پیشتر اشاره شد، نمونهها به مدت 24 ساعت با دمای 35 درجه سلسیوس در انکوباتور قرار داده شد. به میزان 1 میلیلیتر از هر نمونه به 100 میلیلیتر از محیط کشت مک کانکی براث در ظرف دردار اضافه شد. در این مرحله محلول مایع آمادهشده به مدت 24 تا 48 ساعت در دمای 42 تا 44 درجه سلسیوس انکوبه شد. از محلول تهیهشده به میزان 1 میلیلیتر در پلیت شمارهگذاریشده مربوط به آن نمونه ریخته شد. سپس از محیط کشت مک کانکی آگار به میزانی در پلیت ریخته شد که کف پلیت پر شود و با شیوه پورپلیت به آرامی روی سطح میز (به شکل 8) چرخانده شد و اجازه داده شد تا که محیط کشت جامد شود. پلیتها در انکوباتور به مدت 24 تا 48 ساعت قرار داده شد و پس از 24 تا 48 ساعت پلیتها از نظر ایجاد کلونیهای قرمز آجری بررسی شد.
آنالیز آماری
دادههای جمعآوریشده، کدبندیشده و وارد نرمافزار SPSS نسخه 16 شد. برای توصیف متغیرهای کمّی از میانگین، انحرافمعیار و میانه (چارک اول / چارک سوم) و حداقل / حداکثر استفاده شد. همچنین متغیرهای کیفی بر اساس تعداد و درصد توصیف شد. توزیع نرمال متغیرهای کمّی با استفاده از مقادیر کشیدگی و چولگی، نمودارQ-Q Plot و آزمون شاپیرو ویلک سنجیده شد. بر اساس جدول بخش 1111 USP مربوط به فراوردههای غیر استریل خوراکی جامد (غیرآبی) میزان cfu/g مجاز در TAMC برابر با 103 در TYMC برابر با 102 در نظر گرفته میشود [26]. برای مقایسه نتایج با استاندارد (فارماکوپه USP) از آزمون آزمون رتبه علامتدار ویلکاکسون استفاده شد. سطح معناداری آماری آزمونها 0/05>P در نظر گرفته شد.
یافتهها
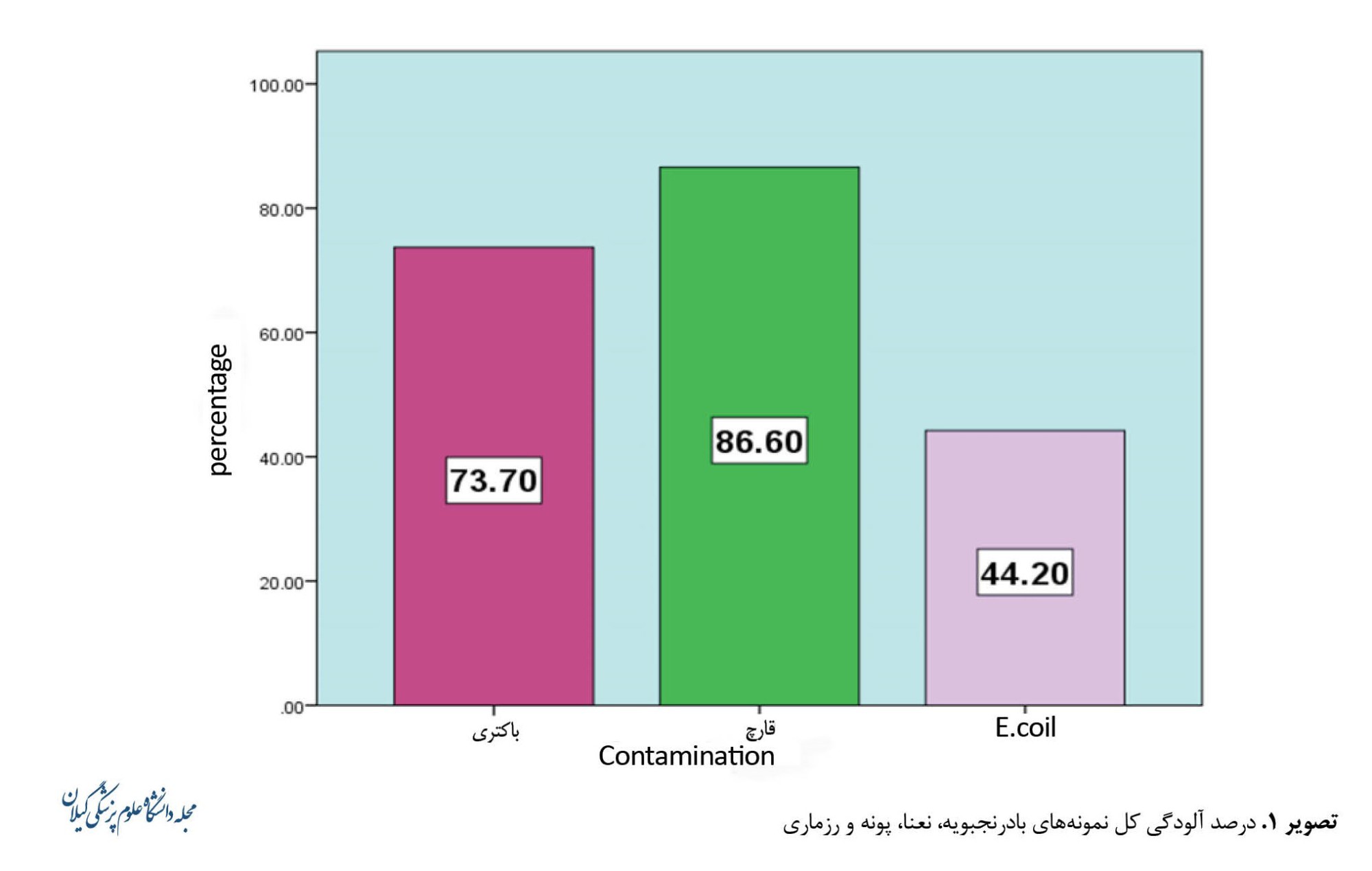
نتایج بررسیهای این مطالعه نشان میدهد نمونههای جمعآوریشده، حدود 73/7 درصد آلوده به باکتری، 86/6 درصد آلوده به قارچ و 44/2 درصد آلوده به اشرشیا کلی بودند (تصویر شماره 1).
طبق تعریف سازمان بهداشت جهانی، گیاه دارویی گیاهی است که در یک یا چند اندام خود حاوی موادی است که میتوان از آنها برای اهداف درمانی یا به عنوان پیشسازهای نیمه سنتتیک استفاده کرد. [1]
گیاهان دارویی تقریباً در همه فرهنگها برای درمان استفاده میشوند. اطمینان از ایمنی، کیفیت و اثربخشی گیاهان دارویی و داروهای گیاهی اخیراً به موضوعی اساسی در کشورهای صنعتی و درحالتوسعه تبدیل شده است. با استانداردسازی و ارزیابی سلامت ترکیبات فعال گیاهی، داروهای گیاهی میتوانند به ظهور دوره جدیدی از سیستم مراقبتهای بهداشتی برای درمان بیماریهای انسان در آینده کمک کنند. آگاهی از دانش سنتی و گیاهان دارویی میتواند نقشی اساسی در بهرهبرداری و کشف منابع طبیعی گیاهان داشته باشد [2].
به دلیل طبیعی بودن محصولات گیاهی آنها اغلب بیخطر تلقی میشوند، اما مطالعات نشان داده است که ممکن است حاوی میکروارگانیسمهای بیماریزا باشند [3]. آلودگی میکروبی گیاهان دارویی میتواند با طیف گستردهای از آلایندهها، اعم از باکتریها، قارچها و ویروسها مرتبط باشد [4]. در میان این میکروارگانیسمها ممکن است عوامل بیماریزا وجود داشته باشند و این واقعیت، به ویژه استفاده از این گیاهان را محدود میکند [5].
از جمله آلایندههایی که برای سلامت خطر جدی دارند، باکتریهای بیماریزا مانند سالمونلا، اشرشیا کلی، استافیلوکوکوس اورئوس ، گونههای شیگلا و سایر گونههای گرم مثبت و گرم منفی باکتریها هستند [6, 7, 8, 9, 10]. حضور باکتریهایی چون اشرشیا کلی و سالمونلا در گیاهان دارویی حاکی از آلودگی مدفوعی و شرایط بهداشتی ضعیف در فرایند تهیه و نگهداری آنهاست [11]. مواد اولیه جمعآوریشده با استفاده از روشهای غیرعلمی معمولاً در معرض بسیاری از آلایندههای بیماریزا قرار دارند و اغلب آنها قبل از برداشت محصول و همچنین هنگام حملونقل و نگهداری توسط میکروارگانیسمهای بیماریزا آلوده میشوند. شواهد نشان میدهد آلودگی گیاهان میتواند به انسان انتقال پیدا کند [11، 12].
بیشتر قارچها در طبیعت سمی هستند و برخی از گونههای غیرسمی دیگر ممکن است بو و طعم کپک را ایجاد کنند [13]. در مرحله قبل از برداشت، گیاهان دارویی مستعد ابتلا به قارچهای بومی در خاکی هستند که در آن کشت شدهاند. قسمت خشکشده گیاهان دارویی ممکن است پس از برداشت در معرض آلودگی قارچی قرار گیرد. گروههای متفاوتی از قارچها در نمونههای گیاهان دارویی جمعآوریشده از مناطق مختلف شناسایی شدهاند که نشان میدهد پنسیلیوم و آسپرژیلوس به عنوان غالبترین جنسها مطرح هستند [14-16]. بسیاری از گونههای 2 جنس مذکور به عنوان تولیدکنندگان اختصاصی میکوتوکسینها شناخته شدهاند که میتواند تهدید جدی برای سلامت عمومی محسوب شود [13].
آفلاتوکسینها (G1 ،B2 ،B1 و G2) خانوادهای از متابولیتهای ثانویه سمی هستند که بهطور عمده توسط سویههای خاصی از آسپرژیلوس فلاووس و آسپرژیلوس پارازیتیکوس تولید میشوند [17, 18]. آفلاتوکسین B1 در سال 1993 توسط سازمان بهداشت جهانی به عنوان یک عامل سرطانزای گروه یک طبقهبندی شده است [19]. استریگماتوسیستین، واسطه پایدار در مراحل نهایی بیوسنتز آفلاتوکسین در اوکراتوکسین آ توسط پنی سیلیوم وروکوزوم، پنی سیلیوم نوردیکم و آسپرژیلوس کربوناریوس به عنوان یک میکوتوکسین سرطانزا شناخته شده است [20]. میکوتوکسین دیگری به نام وکراتوکسین آ توسط پنی سیلیوم وروکوزوم، پنی سیلیوم نوردیکم و آسپرژیلوس کربوناریوس تولید میشود که میتواند باعث ایجاد یک سری اثرات نامطلوب، از جمله تراتوژنیسیته، سمیت ایمنی، سمیت ژنی و جهشزایی در حیوانات و انسان شود [21, 22, 23].
در ایران بیشتر گیاهان دارویی و ادویهای به صورت فلهای و خشکشده توسط عطاریها عرضه میشوند و از نظر بهداشتی، سلامت غذایی و دارویی ندارند، این در حالی است که تمایل روبهرشدی در استفاده از آنها بین مردم وجود دارد؛ بنابراین ارزیابی بهداشتی این گیاهان از اهمیت بالایی برخوردار است. هدف از این مطالعه، ارزیابی آلودگی میکروبی 4 گونه گیاه دارویی پرمصرف از خانواده نعناییان شامل نعنا، پونه، رزماری و بادرنجبویه در عطاریهای سطح رشت است.
روشها
جمعآوری نمونههای گیاهی
برای این مطالعه در مجموع 61 نمونه به صورت تصادفی از عطاریهای سطح شهر رشت در سال 1399 جمعآوری شد (15 نمونه از هر کدام از گیاهان نعنا، پونه، رزماری و 16 نمونه از گیاه بادرنجبویه) (جدول شماره 1).

حجم نمونه با کمک فرمول شماره 1 و آلودگی نمونههای پونه کوهی به سالمونلا برابر 50 درصد در مطالعه کاروانی و همکاران [24] با P 0/25=d و 0/05=α برابر با 61 نمونه برآورد شد.
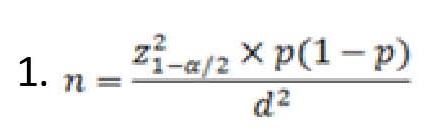
در این مطالعه، سطح شهر رشت به 5 منطقه تقسیمبندی شده و در هر منطقه به صورت تصادفی از 3 عطاری، گیاهان مورد نظر جمعآوری شد. نمونهها کدبندی شدند. نمونههای جمعآوریشده همگی شامل برگ گیاهان مطالعهشده بود.
آمادهسازی نمونهها
به منظور بررسی بار میکروبی نمونههای مطالعهشده، بر اساس دستورالعمل شماره 61 فارماکوپه ایالات متحده آمریکا [25] ابتدا رقت پایه10-1 گرم بر میلیلیتر از هر نمونه تهیه شد. بدین منظور مقدار 10 گرم از نمونهها در هاون کوبیده شد.
یک گرم از آن به لوله استریل حاوی 9 سیسی محیط کشت آمادهشده تریپتیک سوی براث منتقل شد. در لوله آزمایش بسته و به آرامی مخلوط شد. سپس نمونههای تهیهشده به مدت 1 ساعت در انکوباتور و در دمای 25 درجه سلسیوس قرار داده شد.
بررسی نمونهها از نظر میزان آلودگی باکتریایی
100 میکرولیتر از نمونه آمادهشده با سمپلر 100 در کنار شعله، به سطح محیط کشت جامد در پلیت برای بررسی آلودگیهای باکتریایی اضافه شد.
برای هر نمونه 2 پلیت تریپتیک سوی آگار در نظر گرفته شد. در نهایت، پلیتهای تریپتیک سوی آگار به مدت 18 تا 24 ساعت در دمای 35±2 درجه سلسیوس در انکوباتور قرار داده شد. بعد از 48 ساعت پلیتها به منظور بررسی میزان و نحوه رشد میکروارگانیسمها از انکوباتور خارج شد، کلونیهای سطح پلیت شمارش شد و با مقادیر استاندارد تعیینشده برای مواد غیراستریل استفادهشده در فراوردههای دارویی، توسط دستورالعمل شماره 1111 فارماکوپه [26] مقایسه شد.
بررسی نمونهها از نظر میزان آلودگی قارچ و مخمر
100 میکرولیتر از ترکیب تهیهشده با سمپلر 100 در کنار شعله، به سطح محیط کشت سابورو دکسترو آگار برای بررسی آلودگیهای قارچی و مخمر اضافه شد. برای هر نمونه 2 پلیت SDA در نظر گرفته شد. پلیتهای حاوی محیط کشت SDA به مدت 2 تا 3 روز در دمای 35±3 درجه سلسیوس انکوبه شدند.
کلونیهای رشدکرده در پلیتهای مک کانکی آگار، سابورو دکستروز آگارو تریپتیک سوی آگار با مقادیر استاندارد مقایسه شد. مطابق USP در فراوردههای غیراستریل خوراکی جامد (به جز آبی) مشاهده هر تعداد کلونی اشرشیا کلی بالاتر از حد مجاز در نظر گرفته میشود [26].
تشخیص افتراقی اشرشیا کلی
برای شناسایی اشرشیاکلی بر اساس دستورالعمل شماره 62 فارماکوپه ایالات متحده آمریکا [27] پس از آمادهسازی نمونه که پیشتر اشاره شد، نمونهها به مدت 24 ساعت با دمای 35 درجه سلسیوس در انکوباتور قرار داده شد. به میزان 1 میلیلیتر از هر نمونه به 100 میلیلیتر از محیط کشت مک کانکی براث در ظرف دردار اضافه شد. در این مرحله محلول مایع آمادهشده به مدت 24 تا 48 ساعت در دمای 42 تا 44 درجه سلسیوس انکوبه شد. از محلول تهیهشده به میزان 1 میلیلیتر در پلیت شمارهگذاریشده مربوط به آن نمونه ریخته شد. سپس از محیط کشت مک کانکی آگار به میزانی در پلیت ریخته شد که کف پلیت پر شود و با شیوه پورپلیت به آرامی روی سطح میز (به شکل 8) چرخانده شد و اجازه داده شد تا که محیط کشت جامد شود. پلیتها در انکوباتور به مدت 24 تا 48 ساعت قرار داده شد و پس از 24 تا 48 ساعت پلیتها از نظر ایجاد کلونیهای قرمز آجری بررسی شد.
آنالیز آماری
دادههای جمعآوریشده، کدبندیشده و وارد نرمافزار SPSS نسخه 16 شد. برای توصیف متغیرهای کمّی از میانگین، انحرافمعیار و میانه (چارک اول / چارک سوم) و حداقل / حداکثر استفاده شد. همچنین متغیرهای کیفی بر اساس تعداد و درصد توصیف شد. توزیع نرمال متغیرهای کمّی با استفاده از مقادیر کشیدگی و چولگی، نمودارQ-Q Plot و آزمون شاپیرو ویلک سنجیده شد. بر اساس جدول بخش 1111 USP مربوط به فراوردههای غیر استریل خوراکی جامد (غیرآبی) میزان cfu/g مجاز در TAMC برابر با 103 در TYMC برابر با 102 در نظر گرفته میشود [26]. برای مقایسه نتایج با استاندارد (فارماکوپه USP) از آزمون آزمون رتبه علامتدار ویلکاکسون استفاده شد. سطح معناداری آماری آزمونها 0/05>P در نظر گرفته شد.
یافتهها
نتایج بررسیهای این مطالعه نشان میدهد نمونههای جمعآوریشده، حدود 73/7 درصد آلوده به باکتری، 86/6 درصد آلوده به قارچ و 44/2 درصد آلوده به اشرشیا کلی بودند (تصویر شماره 1).
جدول شماره 2 به نتایج مربوط به شمارش تعداد کلونیهای حاوی باکتری و قارچ در یک گرم از گیاهان در پلیتهای مورد بررسی اشاره میکند، نتایج به صورت میانگین تعداد باکتریها و قارچهای شمارششده گزارش شده است.
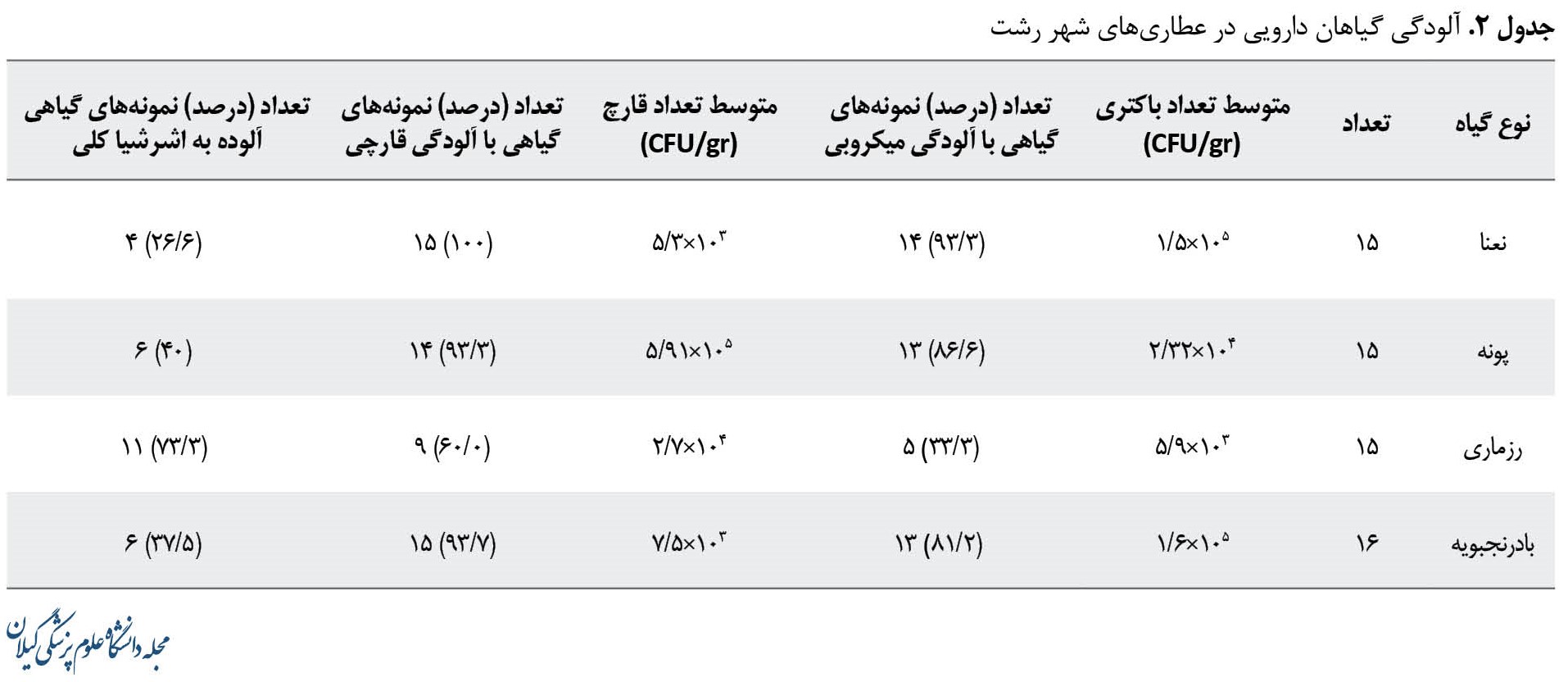
همچنین در جدول شماره 2 به تعداد نمونههای آلوده و درصد آلودگی هر کدام از گیاهان اشاره شده است، بهطوری که از 16 نمونه گیاه بادرنجبویه 13 نمونه (81/2 درصد) آلوده به باکتری بودند، 15 نمونه (93/7 درصد) بالاتر از حد مجاز آلودگی به قارچ و 6 نمونه (37/5 درصد) آلوده به اشرشیا کلی بود. از 15 نمونه گیاه رزماری 5 نمونه (33/3 درصد) آلوده به باکتری، 9 نمونه (60 درصد) آلوده به قارچ و 11 نمونه (73/3 درصد) از نظر آلودگی به اشرشیا کلی مثبت بود. از 15 نمونه گیاه نعنا 14 نمونه (93/3 درصد) آلودگی باکتریایی داشته و در تمام 15 نمونه (100 درصد) آلودگی به قارچ بالاتر از حد مجاز بود و 4 نمونه (26/6 درصد) از لحاظ آلودگی به اشرشیا کلی مثبت شد. از 15 نمونه گیاه پونه 13 نمونه (86/6 درصد) آلوده به باکتری و 14 نمونه (93/3 درصد) آلوده به قارچ و 6 نمونه (40 درصد) مثبت به اشرشیا کلی گزارش شد.
در بررسی آلودگی با اشرشیا کلی در مجموع 27 نمونه مثبت بودند و کلونیهای آجریرنگ بر سطح پلیت مشاهده شد. 34 نمونه منفی بودند که از این تعداد 26 نمونه تنها دچار تغییر رنگ شدند و 8 نمونه هیچگونه تغییر رنگ و کلونی در آنها ایجاد نشد. نتایج مربوط به تستهای اشرشیا کلی، بر اساس دستورالعمل شماره 62 فارماکوپه ایالات متحده آمریکا در صورت مشاهده کلونی به صورت مثبت و در صورت عدم تشکیل کلونی به صورت منفی گزارش شده است [27].
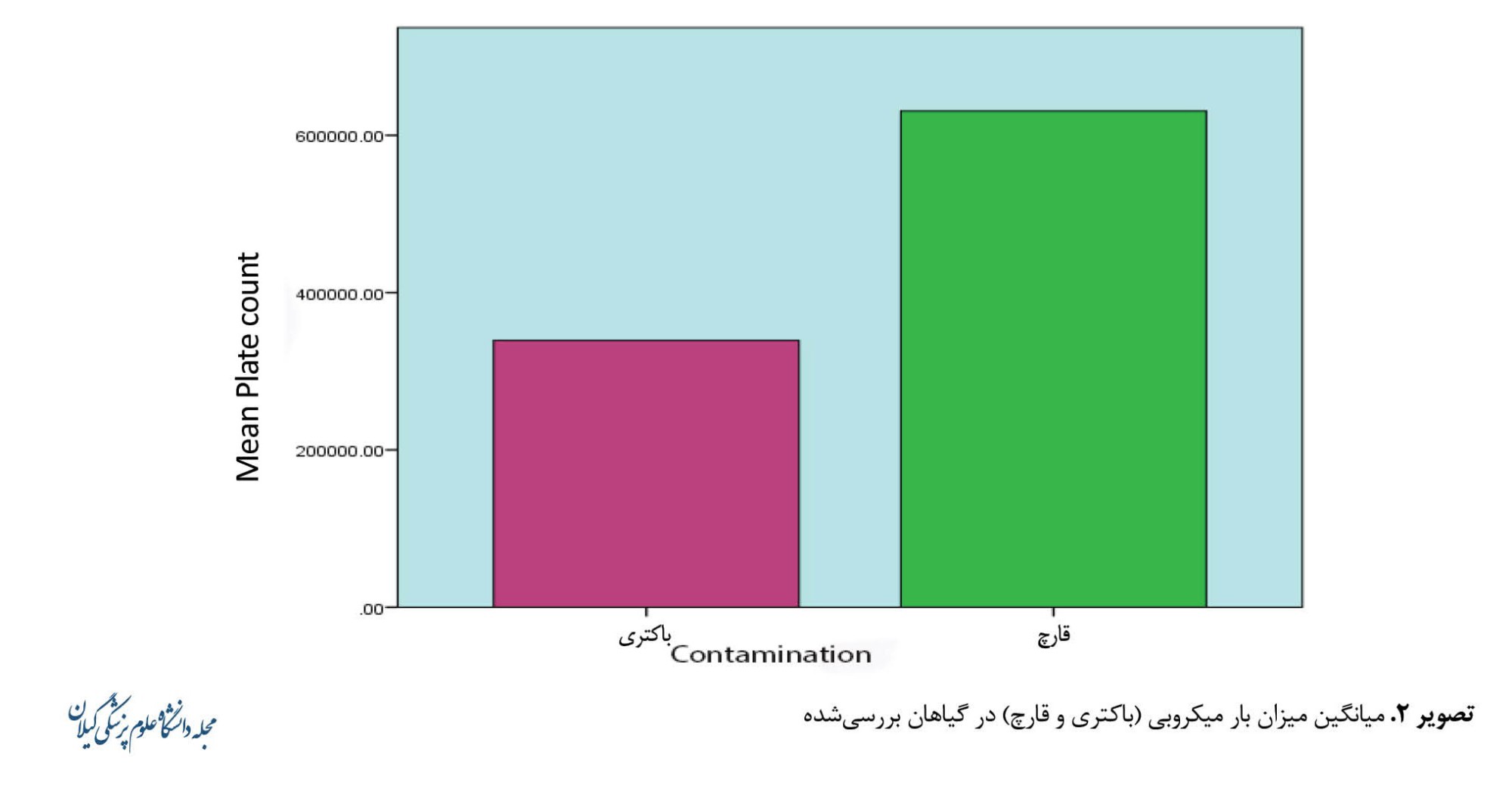
متوسط تعداد باکتری و قارچ در نمونههای گیاهان، به ترتیب برابر 105×3/39 و 105×6/3 به دست آمد (تصویر شماره 2).

همچنین در جدول شماره 2 به تعداد نمونههای آلوده و درصد آلودگی هر کدام از گیاهان اشاره شده است، بهطوری که از 16 نمونه گیاه بادرنجبویه 13 نمونه (81/2 درصد) آلوده به باکتری بودند، 15 نمونه (93/7 درصد) بالاتر از حد مجاز آلودگی به قارچ و 6 نمونه (37/5 درصد) آلوده به اشرشیا کلی بود. از 15 نمونه گیاه رزماری 5 نمونه (33/3 درصد) آلوده به باکتری، 9 نمونه (60 درصد) آلوده به قارچ و 11 نمونه (73/3 درصد) از نظر آلودگی به اشرشیا کلی مثبت بود. از 15 نمونه گیاه نعنا 14 نمونه (93/3 درصد) آلودگی باکتریایی داشته و در تمام 15 نمونه (100 درصد) آلودگی به قارچ بالاتر از حد مجاز بود و 4 نمونه (26/6 درصد) از لحاظ آلودگی به اشرشیا کلی مثبت شد. از 15 نمونه گیاه پونه 13 نمونه (86/6 درصد) آلوده به باکتری و 14 نمونه (93/3 درصد) آلوده به قارچ و 6 نمونه (40 درصد) مثبت به اشرشیا کلی گزارش شد.
در بررسی آلودگی با اشرشیا کلی در مجموع 27 نمونه مثبت بودند و کلونیهای آجریرنگ بر سطح پلیت مشاهده شد. 34 نمونه منفی بودند که از این تعداد 26 نمونه تنها دچار تغییر رنگ شدند و 8 نمونه هیچگونه تغییر رنگ و کلونی در آنها ایجاد نشد. نتایج مربوط به تستهای اشرشیا کلی، بر اساس دستورالعمل شماره 62 فارماکوپه ایالات متحده آمریکا در صورت مشاهده کلونی به صورت مثبت و در صورت عدم تشکیل کلونی به صورت منفی گزارش شده است [27].
متوسط تعداد باکتری و قارچ در نمونههای گیاهان، به ترتیب برابر 105×3/39 و 105×6/3 به دست آمد (تصویر شماره 2).
این تصویر نشان میدهد به صورت کلی میزان آلودگی نمونهها به قارچ بیشتر از باکتری است.
بر اساس دستورالعمل شماره 1111 USP معیار پذیرش برای کیفیت میکروبی مواد غیراستریل برای استفاده دارویی به این صورت است که حداکثر بار میکروبی باکتریهای هوازی CFU/ml یاCFU/gr 103 و برای مخمر و قارچ حداکثر CFU/ml یا CFU/gr 102 است [26]. نتایج مربوط به مقایسه آلودگی باکتریایی با حداقل استاندارد (فارماکوپه USP) در جدول شماره 3 آورده شده است.
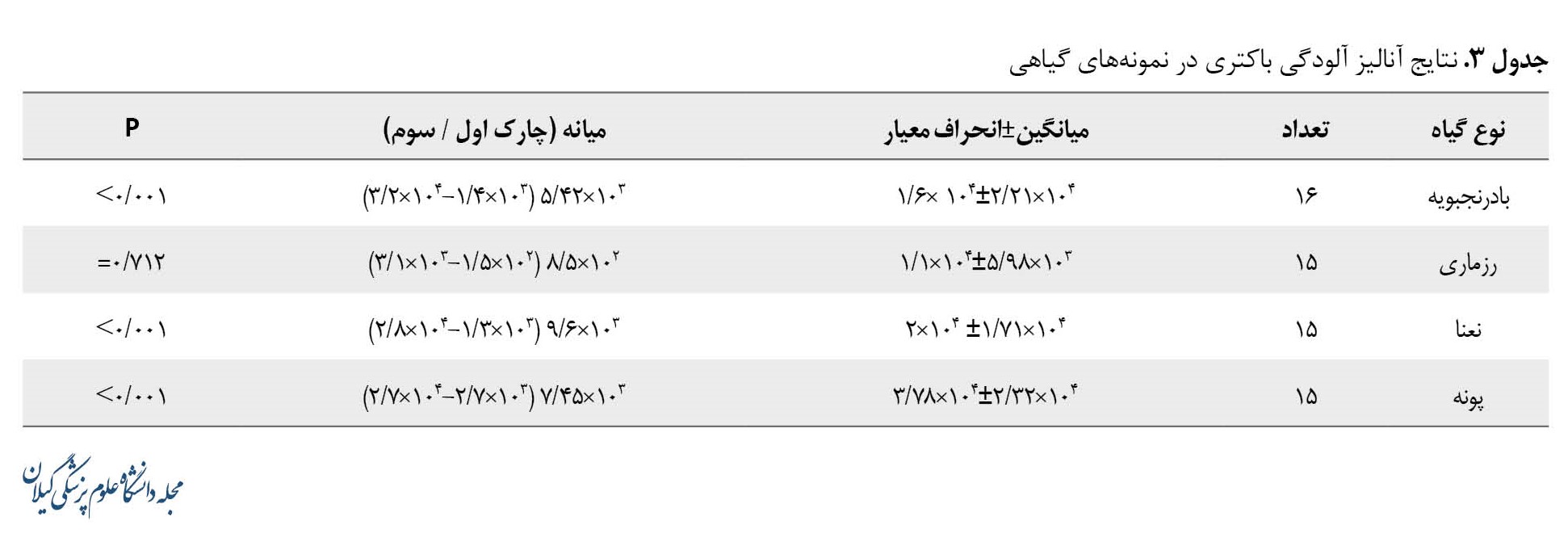
میانه تعداد باکتریهای جداشده از گیاه بادرنجبویه 103×5/42 تعیین شد که با حداقل استاندارد 103 اختلاف معناداری داشت (0/001>P). میانه تعداد باکتریهای جداشده از گیاه نعنا 103×9/6 به دست آمد که با حداقل استاندارد 103 اختلاف معناداری داشت (0/001>P). میانه تعداد باکتریهای جداشده از گیاه پونه 103×7/45 بود که اختلاف معنادار با حداقل استاندارد 103 داشت (0/001>P). در این مطالعه، اختلاف معناداری از نظر تعداد باکتریهای جداشده از گیاه رزماری با حداقل استاندارد 103 مشاهده نشد
(0/712=P).
نتایج مربوط به مقایسه آلودگی قارچی با حداقل استاندارد (فارماکوپه USP) در جدول شماره 4 آورده شده است.
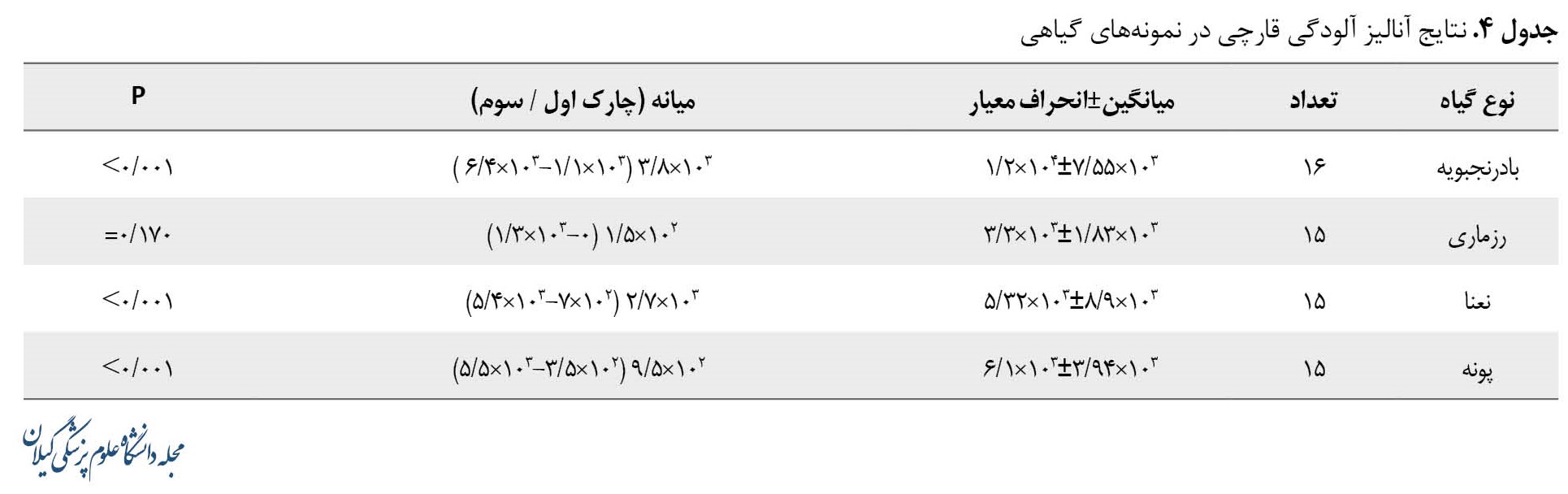
میانه تعداد قارچهای جداشده از گیاه بادرنجبویه 103×3/8 تعیین شد که با حداقل استاندارد 102 اختلاف معناداری داشت (0/001>P). میانه تعداد قارچهای جداشده از گیاه نعنا 103×2/7 بود که با حداقل استاندارد 102 اختلاف معناداری داشت (0/001>P). میانه تعداد قارچهای جداشده از گیاه پونه 102×9/5 بود که اختلاف معناداری با حداقل استاندارد 102 مشاهده شد (0/001>P).
در این مطالعه اختلاف معناداری از نظر تعداد قارچهای جداشده از گیاه رزماری با حداقل استاندارد 102 مشاهده نشد (0/170=P).
بحث
جمعآوری و استفاده از گیاهان دارویی همیشه در شرایط بهداشتی انجام نمیشود. بیشتر گیاهان در معرض هوا خشک میشوند که این امر منجر به گسترش آلودگیهای ناشی از باکتریها و قارچهای موجود در هوا و خاک در گیاهان میشود. آلودگی میکروبی گیاهان میزان استفاده آنها در محصولات غذایی، دارویی و آرایشی را محدود میکند [19]. به همین منظور و برای بررسی امکان آلودگی ادویههای فلهای بازار، 4 گونه گیاهی پرمصرف در شهر رشت انتخاب و به صورت تصادفی از نقاط مختلف شهر تهیه شد. در این تحقیق شمارش کلی تعداد باکتری و قارچ و همچنین وجود اشرشیا کلی بررسی شد.
نتایج بهدستآمده در این تحقیق نشان داد، تقریباً تمام نمونههای بررسیشده آلودگی باکتریایی و قارچی داشتند. میانگین کل باکتریهای شمارش شده در 61 نمونه برابر با CFU/gr 105×3/39 و میانگین کل قارچهای شمارششده CFU/gr 105×6/3 بود. این اعداد نشاندهنده این است که گیاهان بررسیشده از لحاظ بار میکروبی بالاتر از حد مجاز اعلامشده توسط فارماکوپه هستند.
مطالعات متعددی در کشورهای مختلف برای بررسی آلودگی فراوردههای گیاهی انجام شده است. در سال 2002 در مجموع 154 نمونه از 27 نوع ادویه از مغازههای خردهفروشی 20 ایالت هند از نظر وضعیت میکروبی بررسی شد. با توجه به تعداد کل باکتریهای مزوفیلی هوازی مشخص شد که 51 درصد نمونهها، در سطح غیرقابل قبول (CFU/gr 106<) بودند. در حالی که در 97 درصد نمونهها کپک تشخیص داده شد، مخمر فقط در یکی از آنها یافت شد. باسیلوس سرئوس، کلستریدیوم پرفنژنس، استافیلوکوکوس اورئوس و انتروباکتریاسه، به ترتیب در 85، 59، 11 و 85 درصد نمونهها مشاهده شد. کلی فرمها و کلی فرمهای مدفوع، به ترتیب در 33 و 15 درصد از انواع یافت شد. اشرشیا کلی در یک نمونه سیر تشخیص داده شد. سالمونلا و شیگلا تنها در 2/6 درصد نمونهها یافت شد [28].
مطالعهای دیگر روی 75 نمونه ادویه در شهر کَرس ترکیه (2008) روی گیاهان فلفل قرمز، فلفل سیاه، دارچین، زیره و فلفل دلمهای درصد آلودگی اشرشیا کلی به صورت کلی حدود 87 درصد گزارش شد، در حالی که همه نمونهها آلوده به باکتری، مخمرها و کپکهای هوازی و بیهوازی بودند [29]. بررسی 150 مورد فراورده گیاهی در کادونا در نیجریه (2009)، سطح وسیعی از آلودگی به میکروارگانیسمهای مختلف، از جمله اشرشیا کلی را نشان داد. حدود 58/67 درصد نمونهها آلوده به اشرشیا کلی بودند.
این نتیجه سطح بیشتری از آلودگی به این میکروارگانیسم خاص را نسبت به نتایج بهدستآمده در پژوهش حاضر نشان میدهد. همچنین در شمارش میکروارگانیسمهای هوازی روی پلیت، میزان آلودگی در 89 فراورده بیشتر از CFU/gr 107×5 بود، میانگین تعداد کلونیها در 42 نمونه برابر یا کمتر از این میزان بود و در 19 نمونه باکتری یافت نشد. بهطور کلی میزان آلودگی میکروبی مطالعه فوق بسیار بالاتر از پژوهش حاضر بود. از جمله دلایل بیانشده برای مشاهده تعداد بالای میکروارگانیسم در مطالعه شهر کادونا میتوان به روشهای تهیه فراوردههای گیاهی یا تجهیزات و مواد استفادهشده در تهیه آنها اشاره کرد.همچنین آلودگی گیاهان توسط پرسنل هنگام فرایند برداشت، خشک کردن، ذخیرهسازی و حملونقل بر کیفیت کلی آمادهسازی فراوردههای گیاهی تأثیر میگذارد [30].
بررسی روی 30 گیاه و ادویه استفادهشده در غذاهای آماده مصرف بازار ایرلند (2011) نشان داد در 20 درصد نمونهها تعداد کل باکتریهای مزوفیل هوازی (TAMB) بیش از CFU/gr 106 بود. این حد میکروبی بالاتر از میزان بهدستآمده در پژوهش حاضر است. این موضوع نشاندهنده این مطلب است که مراحل گرمادهی که در روند تولید غذاهای آماده مصرف سرد انجام میشود برای از بین بردن باکتریها کافی نیست [31].
نتایج مطالعه سالاری و همکاران در خراسان روی 36 نمونه فلفل قرمز تند،42 درصد از نمونههای این گیاه را آلوده به ای کلای و 94 درصد آلوده به میکروارگانیسم نشان داد [32]. نتیجه میزان آلودگی به اشرشیا کلی مطابق با نتیجه پژوهش حاضر است و آلودگی به میکروارگانیسم در سطح پایینتری قرار دارد. کائوم و همکاران در بررسی کیفیت میکروبی گیاهان دارویی در نایروبی کنیا دریافتند میزان آلودگی به اشرشیا کلی بین1×5 متغیر بود. در واقع25 درصد از نمونهها آلوده به اشرشیا کلی بودند. این یافته نشان میدهد که شرایط در طول برداشت یا پس از برداشت غیربهداشتی بوده است [33].
در مطالعه کوهیکمالی دهکردی و همکاران، کیفیت میکروبیولوژیکی 351 نمونه از 9 نوع ادویهجات، از جمله فلفل سیاه، زیره سیاه، دارچین، گلپر، پودر کاری، پودر سیر، فلفل قرمز، سماق و زردچوبه که در سال 2007 از فروشگاههای خردهفروشی در تهران جمعآوری شده بود، تعیین شد. تعداد باکتریهای مزوفیل هوازی، اشرشیا کلی و کپکهای قارچی از حد استاندارد ملی ایران فراتر بود و به ترتیب در نمونههای مطالعهشده 63/2 درصد، 23/4 درصد و 21/9 درصد مشاهده شد. آلودگی کلی فرم در 24/8 درصد از نمونهها بیش از MPN/gr 103 بود [34].
در مطالعه نامداری و همکاران، 64 نمونه از 8 نوع عصاره گیاهی خردهفروشی در بازارهای اصفهان بهطور تصادفی خریداری و تعداد کل باکتریها، آلودگی به کلی فرمها، کلستریدیوم احیاکننده سولفیت، انتروکوک، سودوموناس آئروژینوزا، کپکها و مخمرها بر اساس پروتکلهای استاندارد ملی ایران (شماره 5272) ارزیابی شد. نتایج این مطالعه حاکی از این بود که 37 درصد نمونهها قابل قبول و مناسب مصرف نیستند [35].
در مطالعه باناچ و همکاران، در اروپا میزان آلودگی به باکتری و اشرشیا کلی در گیاه نعنا به ترتیب 5 درصد و 18 درصد بود [36]. آلودگی باکتریایی نعنا در پژوهش ما بسیار فراتر از این مطالعه بود و حدود 93 درصد و همچنین آلودگی به اشرشیا کلی 26/6 درصد بود. در مطالعه کاروانی و همکاران روی گیاهان عطاریهای ارومیه میزان شمارش کل آلودگی میکروبی نیز در نمونه کشتشده (نعنای خوراکی) بیشتر از نمونه طبیعی (پونه کوهی) بود. این نتیجه مطابق با نتیجه مطالعه حاضر بود، علت این امر به نحوه انجام عملیات مختلف همچون برداشت، انبارداری، جابهجایی و نیز کیفیت مراحل مختلف کشت و ویژگیهای خاک مرتبط است.
نتایج مطالعه کاروانی و همکاران نشان داد در نمونههای نعنا خوراکی و پونه کوهی همه میکروبهای سالمونلا، استافیلو کوکوس اورئوس، کلی فرم و اشرشیا کلی مشاهده شدند، میزان آلودگی باکتریایی مشاهده شده در نمونه نعنای مطالعه مذکور به صورت کلی 109×5/58 بود که در مقایسه با نتایج مطالعه حاضر (105×3/39) حاکی از میزان آلودگی بیشتری است [24].
در یک مطالعه در شهر ماکاپای برزیل از 132 گیاه جمعآوریشده 31/8 درصد آلوده به باکتری 23/5 درصد آلوده به قارچ و 25/8 درصد آلوده به اشرشیا کلی بودند [11]. همچنین مطالعه عبدالقانعی و همکاران روی 80 نمونه گیاه در اهواز حاکی از آلودگی باکتریایی در 45 درصد و آلودگی به اشرشیا کلی در 31/2 درصد نمونهها بود [37]، اما نتایج پژوهش حاضر حاکی از میزان آلودگی بسیار بیشتر از مطالعههای ذکرشده است، بهطوری که 73/7 درصد نمونهها آلوده به باکتری 86/6 درصد آلوده به قارچ و 44/2 درصد آلوده به اشرشیا کلی بودند. این تفاوت و آلودگی بالا، به ویژه آلودگی قارچی در مطالعه حاضر را میتوان تا حدودی با شرایط جغرافیایی استان گیلان و میزان رطوبت بالا مرتبط دانست.
اختلاف در نتایج مطالعات مختلف ممکن است ناشی از تنوع جغرافیایی کشور تولیدکننده ادویه و گیاهان و میزان رعایت استانداردهای بهداشتی در کشورهای مبدأ باشد. آلودگی میکروبی میتواند هنگام برداشت گیاهان دارویی، جمعآوری، فرایند بعد از برداشت محصول، حمل و توزیع به دلیل شرایط غیربهداشتی و فرایندهای ناایمن اتفاق بیفتد [11, 12]. گیاهان به دلیل قرارگرفتن در معرض هوای آزاد به راحتی در معرض آلودگی قرار گرفته و مطمئناً در شرایطی که عطاریها، نمونههای گیاهی را به صورت سنتی و بدون بستهبندی نگهداری میکنند، میزان آلودگی افزایش خواهد یافت.
در تحقیق حاضر، نمونههای نعنا بالاترین درصد آلودگی باکتریایی و قارچی را داشتند، در حالی که کمترین درصد آلودگی باکتریایی و قارچی مربوط به نمونههای رزماری بود. علاوه بر شرایط کشت، برداشت، خشک کردن و نگهداری وجود برخی مواد مانند ترکیبات فنلی در گیاهان میتواند مانع از رشد میکروارگانیسمها شود [38].
امکان آلودگی گیاهان دارویی در هر زمان در مراحل مختلف کشت و آمادهسازی وجود دارد. برای جلوگیری از آلودگیهای میکروبی، گیاهان دارویی باید تحت مقررات سختگیرانه بستهبندی شوند. همچنین با توجه به گزارشاتی که از عدم وجود برخی سویهها مانند استافیلوکوکوس، باسیلوس و کلستریدیوم در جوشاندههای نمونههای گیاهی در مقایسه با گیاه خشک وجود دارد، استفاده از روش جوشاندن میتواند راهحل مناسبی برای کاهش بار میکروبی گیاهان دارویی استفادهشده باشد. فرایند خشک کردن صحیح گیاهان دارویی نیز اهمیت بسیاری دارد تا از گسترش آلایندههایی مانند آسپرژیلوس در طول ذخیرهسازی جلوگیری شود، این میتواند با استفاده از روشهای صحیح خشک کردن مانند خشک کردن در دمای مناسب و با استفاده از تجهیزات صحیح انجام شود. همچنین نگهداری در شرایط خشک و تهویه مناسب نیز به حفظ کیفیت گیاهان دارویی کمک میکند [39].
در شرایط نگهداری نامناسب، میکروبیوتای موجود در محصولات گیاهی ممکن است افزایش یابد و برای مصرفکنندگان، به ویژه افرادی که سیستم ایمنی ضعیف دارند مانند سالمندان و کودکان، خطرات بهداشتی ایجاد کند؛ بنابراین حداقلسازی میکروبیوتا با شستوشو یا حرارت و رعایت بهداشت در آمادهسازی بسیار مهم است. همچنین توصیه میشود دمای نگهداری را در سطح پایین نگه داشته و زمان نگهداری به حداقل ممکن کاهش داده شود [40].
نتیجهگیری
نتایج این مطالعه نشان میدهد آلودگی میکروبی بیشتر نمونههای گیاهان بررسیشده بسیار بالاتر از حد مجاز اعلام شده است. لازم است سیاست های نظارتی دقیقتری توسط مسئولین ناظر بر سلامت فراوردههای طبیعی عطاریها لحاظ شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه توسط کمیته اخلاق دانشگاه علومپزشکی گیلان با کد اخلاق به شمارهIR.GUMS.REC.1400.124 تصویب شد.
حامی مالی
ایﻦ ﻣﻄﺎﻟﻌﻪ ﺗﺤﺖ ﺣﻤﺎیﺖ ﻣﺎلی نویسنده دوم اﻧﺠﺎم ﺷﺪه است.
مشارکت نویسندگان
مفهومسازی، طراحی مطالعه و تهیه پیشنویس دستنوشته: شیرین پروینرو؛ کسب، تحلیل و تفسیر دادهها: الهه رفیعی، معصومه روحانی؛ بازبینی نقادانه دستنوشته برای محتوای فکری مهم: زهرا حصاری، شیرین پروینرو، الهه رفیعی و معصومه روحانی؛ تحلیل آماری: الهه رفیعی؛ جذب منابع مالی: معصومه روحانی و شیرین پروینرو؛ حمایت اداری، فنی یا موادی و نظارت بر مطالعه: شیرین پروینرو و زهراحصاری.
تعارض منافع
بنا بر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان بر خود لازم میدانند از دانشکده داروسازی دانشگاه علومپزشکی گیلان که در این پژوهش ما را همراهی کردند، تشکر و قدردانی کنند.
بر اساس دستورالعمل شماره 1111 USP معیار پذیرش برای کیفیت میکروبی مواد غیراستریل برای استفاده دارویی به این صورت است که حداکثر بار میکروبی باکتریهای هوازی CFU/ml یاCFU/gr 103 و برای مخمر و قارچ حداکثر CFU/ml یا CFU/gr 102 است [26]. نتایج مربوط به مقایسه آلودگی باکتریایی با حداقل استاندارد (فارماکوپه USP) در جدول شماره 3 آورده شده است.

میانه تعداد باکتریهای جداشده از گیاه بادرنجبویه 103×5/42 تعیین شد که با حداقل استاندارد 103 اختلاف معناداری داشت (0/001>P). میانه تعداد باکتریهای جداشده از گیاه نعنا 103×9/6 به دست آمد که با حداقل استاندارد 103 اختلاف معناداری داشت (0/001>P). میانه تعداد باکتریهای جداشده از گیاه پونه 103×7/45 بود که اختلاف معنادار با حداقل استاندارد 103 داشت (0/001>P). در این مطالعه، اختلاف معناداری از نظر تعداد باکتریهای جداشده از گیاه رزماری با حداقل استاندارد 103 مشاهده نشد
(0/712=P).
نتایج مربوط به مقایسه آلودگی قارچی با حداقل استاندارد (فارماکوپه USP) در جدول شماره 4 آورده شده است.

میانه تعداد قارچهای جداشده از گیاه بادرنجبویه 103×3/8 تعیین شد که با حداقل استاندارد 102 اختلاف معناداری داشت (0/001>P). میانه تعداد قارچهای جداشده از گیاه نعنا 103×2/7 بود که با حداقل استاندارد 102 اختلاف معناداری داشت (0/001>P). میانه تعداد قارچهای جداشده از گیاه پونه 102×9/5 بود که اختلاف معناداری با حداقل استاندارد 102 مشاهده شد (0/001>P).
در این مطالعه اختلاف معناداری از نظر تعداد قارچهای جداشده از گیاه رزماری با حداقل استاندارد 102 مشاهده نشد (0/170=P).
بحث
جمعآوری و استفاده از گیاهان دارویی همیشه در شرایط بهداشتی انجام نمیشود. بیشتر گیاهان در معرض هوا خشک میشوند که این امر منجر به گسترش آلودگیهای ناشی از باکتریها و قارچهای موجود در هوا و خاک در گیاهان میشود. آلودگی میکروبی گیاهان میزان استفاده آنها در محصولات غذایی، دارویی و آرایشی را محدود میکند [19]. به همین منظور و برای بررسی امکان آلودگی ادویههای فلهای بازار، 4 گونه گیاهی پرمصرف در شهر رشت انتخاب و به صورت تصادفی از نقاط مختلف شهر تهیه شد. در این تحقیق شمارش کلی تعداد باکتری و قارچ و همچنین وجود اشرشیا کلی بررسی شد.
نتایج بهدستآمده در این تحقیق نشان داد، تقریباً تمام نمونههای بررسیشده آلودگی باکتریایی و قارچی داشتند. میانگین کل باکتریهای شمارش شده در 61 نمونه برابر با CFU/gr 105×3/39 و میانگین کل قارچهای شمارششده CFU/gr 105×6/3 بود. این اعداد نشاندهنده این است که گیاهان بررسیشده از لحاظ بار میکروبی بالاتر از حد مجاز اعلامشده توسط فارماکوپه هستند.
مطالعات متعددی در کشورهای مختلف برای بررسی آلودگی فراوردههای گیاهی انجام شده است. در سال 2002 در مجموع 154 نمونه از 27 نوع ادویه از مغازههای خردهفروشی 20 ایالت هند از نظر وضعیت میکروبی بررسی شد. با توجه به تعداد کل باکتریهای مزوفیلی هوازی مشخص شد که 51 درصد نمونهها، در سطح غیرقابل قبول (CFU/gr 106<) بودند. در حالی که در 97 درصد نمونهها کپک تشخیص داده شد، مخمر فقط در یکی از آنها یافت شد. باسیلوس سرئوس، کلستریدیوم پرفنژنس، استافیلوکوکوس اورئوس و انتروباکتریاسه، به ترتیب در 85، 59، 11 و 85 درصد نمونهها مشاهده شد. کلی فرمها و کلی فرمهای مدفوع، به ترتیب در 33 و 15 درصد از انواع یافت شد. اشرشیا کلی در یک نمونه سیر تشخیص داده شد. سالمونلا و شیگلا تنها در 2/6 درصد نمونهها یافت شد [28].
مطالعهای دیگر روی 75 نمونه ادویه در شهر کَرس ترکیه (2008) روی گیاهان فلفل قرمز، فلفل سیاه، دارچین، زیره و فلفل دلمهای درصد آلودگی اشرشیا کلی به صورت کلی حدود 87 درصد گزارش شد، در حالی که همه نمونهها آلوده به باکتری، مخمرها و کپکهای هوازی و بیهوازی بودند [29]. بررسی 150 مورد فراورده گیاهی در کادونا در نیجریه (2009)، سطح وسیعی از آلودگی به میکروارگانیسمهای مختلف، از جمله اشرشیا کلی را نشان داد. حدود 58/67 درصد نمونهها آلوده به اشرشیا کلی بودند.
این نتیجه سطح بیشتری از آلودگی به این میکروارگانیسم خاص را نسبت به نتایج بهدستآمده در پژوهش حاضر نشان میدهد. همچنین در شمارش میکروارگانیسمهای هوازی روی پلیت، میزان آلودگی در 89 فراورده بیشتر از CFU/gr 107×5 بود، میانگین تعداد کلونیها در 42 نمونه برابر یا کمتر از این میزان بود و در 19 نمونه باکتری یافت نشد. بهطور کلی میزان آلودگی میکروبی مطالعه فوق بسیار بالاتر از پژوهش حاضر بود. از جمله دلایل بیانشده برای مشاهده تعداد بالای میکروارگانیسم در مطالعه شهر کادونا میتوان به روشهای تهیه فراوردههای گیاهی یا تجهیزات و مواد استفادهشده در تهیه آنها اشاره کرد.همچنین آلودگی گیاهان توسط پرسنل هنگام فرایند برداشت، خشک کردن، ذخیرهسازی و حملونقل بر کیفیت کلی آمادهسازی فراوردههای گیاهی تأثیر میگذارد [30].
بررسی روی 30 گیاه و ادویه استفادهشده در غذاهای آماده مصرف بازار ایرلند (2011) نشان داد در 20 درصد نمونهها تعداد کل باکتریهای مزوفیل هوازی (TAMB) بیش از CFU/gr 106 بود. این حد میکروبی بالاتر از میزان بهدستآمده در پژوهش حاضر است. این موضوع نشاندهنده این مطلب است که مراحل گرمادهی که در روند تولید غذاهای آماده مصرف سرد انجام میشود برای از بین بردن باکتریها کافی نیست [31].
نتایج مطالعه سالاری و همکاران در خراسان روی 36 نمونه فلفل قرمز تند،42 درصد از نمونههای این گیاه را آلوده به ای کلای و 94 درصد آلوده به میکروارگانیسم نشان داد [32]. نتیجه میزان آلودگی به اشرشیا کلی مطابق با نتیجه پژوهش حاضر است و آلودگی به میکروارگانیسم در سطح پایینتری قرار دارد. کائوم و همکاران در بررسی کیفیت میکروبی گیاهان دارویی در نایروبی کنیا دریافتند میزان آلودگی به اشرشیا کلی بین
در مطالعه کوهیکمالی دهکردی و همکاران، کیفیت میکروبیولوژیکی 351 نمونه از 9 نوع ادویهجات، از جمله فلفل سیاه، زیره سیاه، دارچین، گلپر، پودر کاری، پودر سیر، فلفل قرمز، سماق و زردچوبه که در سال 2007 از فروشگاههای خردهفروشی در تهران جمعآوری شده بود، تعیین شد. تعداد باکتریهای مزوفیل هوازی، اشرشیا کلی و کپکهای قارچی از حد استاندارد ملی ایران فراتر بود و به ترتیب در نمونههای مطالعهشده 63/2 درصد، 23/4 درصد و 21/9 درصد مشاهده شد. آلودگی کلی فرم در 24/8 درصد از نمونهها بیش از MPN/gr 103 بود [34].
در مطالعه نامداری و همکاران، 64 نمونه از 8 نوع عصاره گیاهی خردهفروشی در بازارهای اصفهان بهطور تصادفی خریداری و تعداد کل باکتریها، آلودگی به کلی فرمها، کلستریدیوم احیاکننده سولفیت، انتروکوک، سودوموناس آئروژینوزا، کپکها و مخمرها بر اساس پروتکلهای استاندارد ملی ایران (شماره 5272) ارزیابی شد. نتایج این مطالعه حاکی از این بود که 37 درصد نمونهها قابل قبول و مناسب مصرف نیستند [35].
در مطالعه باناچ و همکاران، در اروپا میزان آلودگی به باکتری و اشرشیا کلی در گیاه نعنا به ترتیب 5 درصد و 18 درصد بود [36]. آلودگی باکتریایی نعنا در پژوهش ما بسیار فراتر از این مطالعه بود و حدود 93 درصد و همچنین آلودگی به اشرشیا کلی 26/6 درصد بود. در مطالعه کاروانی و همکاران روی گیاهان عطاریهای ارومیه میزان شمارش کل آلودگی میکروبی نیز در نمونه کشتشده (نعنای خوراکی) بیشتر از نمونه طبیعی (پونه کوهی) بود. این نتیجه مطابق با نتیجه مطالعه حاضر بود، علت این امر به نحوه انجام عملیات مختلف همچون برداشت، انبارداری، جابهجایی و نیز کیفیت مراحل مختلف کشت و ویژگیهای خاک مرتبط است.
نتایج مطالعه کاروانی و همکاران نشان داد در نمونههای نعنا خوراکی و پونه کوهی همه میکروبهای سالمونلا، استافیلو کوکوس اورئوس، کلی فرم و اشرشیا کلی مشاهده شدند، میزان آلودگی باکتریایی مشاهده شده در نمونه نعنای مطالعه مذکور به صورت کلی 109×5/58 بود که در مقایسه با نتایج مطالعه حاضر (105×3/39) حاکی از میزان آلودگی بیشتری است [24].
در یک مطالعه در شهر ماکاپای برزیل از 132 گیاه جمعآوریشده 31/8 درصد آلوده به باکتری 23/5 درصد آلوده به قارچ و 25/8 درصد آلوده به اشرشیا کلی بودند [11]. همچنین مطالعه عبدالقانعی و همکاران روی 80 نمونه گیاه در اهواز حاکی از آلودگی باکتریایی در 45 درصد و آلودگی به اشرشیا کلی در 31/2 درصد نمونهها بود [37]، اما نتایج پژوهش حاضر حاکی از میزان آلودگی بسیار بیشتر از مطالعههای ذکرشده است، بهطوری که 73/7 درصد نمونهها آلوده به باکتری 86/6 درصد آلوده به قارچ و 44/2 درصد آلوده به اشرشیا کلی بودند. این تفاوت و آلودگی بالا، به ویژه آلودگی قارچی در مطالعه حاضر را میتوان تا حدودی با شرایط جغرافیایی استان گیلان و میزان رطوبت بالا مرتبط دانست.
اختلاف در نتایج مطالعات مختلف ممکن است ناشی از تنوع جغرافیایی کشور تولیدکننده ادویه و گیاهان و میزان رعایت استانداردهای بهداشتی در کشورهای مبدأ باشد. آلودگی میکروبی میتواند هنگام برداشت گیاهان دارویی، جمعآوری، فرایند بعد از برداشت محصول، حمل و توزیع به دلیل شرایط غیربهداشتی و فرایندهای ناایمن اتفاق بیفتد [11, 12]. گیاهان به دلیل قرارگرفتن در معرض هوای آزاد به راحتی در معرض آلودگی قرار گرفته و مطمئناً در شرایطی که عطاریها، نمونههای گیاهی را به صورت سنتی و بدون بستهبندی نگهداری میکنند، میزان آلودگی افزایش خواهد یافت.
در تحقیق حاضر، نمونههای نعنا بالاترین درصد آلودگی باکتریایی و قارچی را داشتند، در حالی که کمترین درصد آلودگی باکتریایی و قارچی مربوط به نمونههای رزماری بود. علاوه بر شرایط کشت، برداشت، خشک کردن و نگهداری وجود برخی مواد مانند ترکیبات فنلی در گیاهان میتواند مانع از رشد میکروارگانیسمها شود [38].
امکان آلودگی گیاهان دارویی در هر زمان در مراحل مختلف کشت و آمادهسازی وجود دارد. برای جلوگیری از آلودگیهای میکروبی، گیاهان دارویی باید تحت مقررات سختگیرانه بستهبندی شوند. همچنین با توجه به گزارشاتی که از عدم وجود برخی سویهها مانند استافیلوکوکوس، باسیلوس و کلستریدیوم در جوشاندههای نمونههای گیاهی در مقایسه با گیاه خشک وجود دارد، استفاده از روش جوشاندن میتواند راهحل مناسبی برای کاهش بار میکروبی گیاهان دارویی استفادهشده باشد. فرایند خشک کردن صحیح گیاهان دارویی نیز اهمیت بسیاری دارد تا از گسترش آلایندههایی مانند آسپرژیلوس در طول ذخیرهسازی جلوگیری شود، این میتواند با استفاده از روشهای صحیح خشک کردن مانند خشک کردن در دمای مناسب و با استفاده از تجهیزات صحیح انجام شود. همچنین نگهداری در شرایط خشک و تهویه مناسب نیز به حفظ کیفیت گیاهان دارویی کمک میکند [39].
در شرایط نگهداری نامناسب، میکروبیوتای موجود در محصولات گیاهی ممکن است افزایش یابد و برای مصرفکنندگان، به ویژه افرادی که سیستم ایمنی ضعیف دارند مانند سالمندان و کودکان، خطرات بهداشتی ایجاد کند؛ بنابراین حداقلسازی میکروبیوتا با شستوشو یا حرارت و رعایت بهداشت در آمادهسازی بسیار مهم است. همچنین توصیه میشود دمای نگهداری را در سطح پایین نگه داشته و زمان نگهداری به حداقل ممکن کاهش داده شود [40].
نتیجهگیری
نتایج این مطالعه نشان میدهد آلودگی میکروبی بیشتر نمونههای گیاهان بررسیشده بسیار بالاتر از حد مجاز اعلام شده است. لازم است سیاست های نظارتی دقیقتری توسط مسئولین ناظر بر سلامت فراوردههای طبیعی عطاریها لحاظ شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه توسط کمیته اخلاق دانشگاه علومپزشکی گیلان با کد اخلاق به شمارهIR.GUMS.REC.1400.124 تصویب شد.
حامی مالی
ایﻦ ﻣﻄﺎﻟﻌﻪ ﺗﺤﺖ ﺣﻤﺎیﺖ ﻣﺎلی نویسنده دوم اﻧﺠﺎم ﺷﺪه است.
مشارکت نویسندگان
مفهومسازی، طراحی مطالعه و تهیه پیشنویس دستنوشته: شیرین پروینرو؛ کسب، تحلیل و تفسیر دادهها: الهه رفیعی، معصومه روحانی؛ بازبینی نقادانه دستنوشته برای محتوای فکری مهم: زهرا حصاری، شیرین پروینرو، الهه رفیعی و معصومه روحانی؛ تحلیل آماری: الهه رفیعی؛ جذب منابع مالی: معصومه روحانی و شیرین پروینرو؛ حمایت اداری، فنی یا موادی و نظارت بر مطالعه: شیرین پروینرو و زهراحصاری.
تعارض منافع
بنا بر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان بر خود لازم میدانند از دانشکده داروسازی دانشگاه علومپزشکی گیلان که در این پژوهش ما را همراهی کردند، تشکر و قدردانی کنند.
References
1.Ghisleni DD, Braga Mde S, Kikuchi IS, Braşoveanu M, Nemţanu MR, Dua K, et al. The microbial quality aspects and decontamination approaches for the herbal medicinal plants and products: An in-depth review. Current Pharmaceutical Design. 2016; 22(27):4264-87. [DOI:10.2174/1381612822666160623070829] [PMID]
2.Jamshidi-Kia F, Lorigooini Z, Amini-Khoei H. Medicinal plants: Past history and future perspective. Journal of Herbmed Pharmacology. 2018; 7(1):1-7. [DOI:10.15171/jhp.2018.01]
3.Ideh JE, Ogunkunle ATJ. User frequency and microbial contaminants of traditional oral powdered herbal formulations in Ogbomoso, Nigeria. Journal of Medicinal Plants for Economic Development. 2019; 3(1):a67. [DOI:10.4102/jomped.v3i1.67]
4.Kneifel W, Czech E, Kopp B. Microbial contamination of medicinal plants--a review. Planta Medica. 2002; 68(1):5-15. [DOI:10.1055/s-2002-20060] [PMID]
5.Czech E, Kneifel W, Kopp B. Microbiological status of commercially available medicinal herbal drugs--a screening study. Planta Medica. 2001; 67(3):263-9. [DOI:10.1055/s-2001-12007] [PMID]
6.Adeleye IA, Okogi G, Ojo EO. Microbial contamination of herbal preparations in Lagos, Nigeria. Journal of Health, Population and Nutrition. 2005; 23(3):296-7. [Link]
7.Arias ML, Chaves C, Alfaro LD. Microbiological analysis of some herbal infusions used as medicines. Revista Biomédica. 1999; 10(1):1-6. [DOI:10.32776/revbiomed.v10i1.181]
8.Stević T, Pavlović S, Stanković S, Šavikin K. Pathogenic microorganisms of medicinal herbal drugs. Archives of Biological Sciences. 2012; 64(1):49-58. [DOI:10.2298/ABS1201049S]
9.Martins HM, Martins M, Dias MI, Bernardo F. Evaluation of microbiological quality of medicinal plants used in natural infusions. International Journal of Food Microbiology. 2001; 68(1-2):149-53. [DOI:10.1016/S0168-1605(01)00480-9]
10.Okunlola A, Adewoyin BA, Odeku OA. Evaluation of pharmaceutical and microbial qualities of some herbal medicinal products in south western Nigeria. Tropical Journal of Pharmaceutical Research. 2007; 6(1):661-70. [DOI:10.4314/tjpr.v6i1.14644]
11.de Sousa Lima CM, Fujishima MA, de Paula Lima B, Mastroianni PC, de Sousa FF, da Silva JO. Microbial contamination in herbal medicines: A serious health hazard to elderly consumers. BMC Complementary Medicine and Therapies. 2020; 20(1):17. [DOI:10.1186/s12906-019-2723-1] [PMID]
12.Noor R, Huda N, Rahman F, Bashar T, Munshi SK. Microbial contamination in herbal medicines available in Bangladesh. Bangladesh Medical Research Council Bulletin. 2013; 39(3):124-9. [DOI:10.3329/bmrcb.v39i3.20313] [PMID]
13.Sekar P, Yamnam N, Ponmurugan K. Screening and characterization of mycotoxin producing fungi from dried fruits and grains. Advanced Biotech. 2008; 7(1):12-5. [Link]
14.Aziz NH, Youssef YA, El-Fouly MZ, Moussa LA. Contamination of some common medicinal plant samples and spices by fungi and their mycotoxins. Botanical Bulletin of Academia Sinica. 1998; 39:279-85. [Link]
15.Bugno A, Almodovar AAB, Pereira TC, Pinto T de JA, Sabino M. Occurrence of toxigenic fungi in herbal drugs. Brazilian Journal of Microbiology. 2006; 37(1):47-51. [DOI:10.1590/S1517-83822006000100009]
16.Hashem M, Alamri S. Contamination of common spices in Saudi Arabia markets with potential mycotoxin-producing fungi. Saudi Journal of Biological Sciences. 2010; 17(2):167-75. [DOI:10.1016/j.sjbs.2010.02.011]
17.Kim DM, Chung SH, Chun HS. Multiplex PCR assay for the detection of aflatoxigenic and non-aflatoxigenic fungi in meju, a Korean fermented soybean food starter. Food Microbiology. 2011; 28(7):1402-8. [DOI:10.1016/j.fm.2011.06.017] [PMID]
18.Mateo EM, Gil-Serna J, Patiño B, Jiménez M. Aflatoxins and ochratoxin A in stored barley grain in Spain and impact of PCR-based strategies to assess the occurrence of aflatoxigenic and ochratoxigenic aspergillus spp. International Journal of Food Microbiology. 2011; 149(2):118-26. [DOI:10.1016/j.ijfoodmicro.2011.06.006] [PMID]
19.International Agency for Research on Cancer (IARC). Some naturally occurring substances: Food items and constituents, heterocyclic aromatic amines and mycotoxins. Lyon: IARC Press; 1993. [PMID]
20.Yu J, Chang PK, Cary JW, Wright M, Bhatnagar D, Cleveland TE, et al. Comparative mapping of aflatoxin pathway gene clusters in aspergillus parasiticus and aspergillus flavus. Applied and Environmental Microbiology. 1995; 61(6):2365-71. [DOI:10.1128/aem.61.6.2365-2371.1995] [PMID]
21.Kuiper-Goodman T, Scott PM. Risk assessment of the mycotoxin ochratoxin A. Biomedical and Environmental Sciences: BES. 1989; 2(3):179-248. [PMID]
22.O'Brien E, Dietrich DR. Ochratoxin A: The continuing enigma. Critical Reviews in Toxicology. 2005; 35(1):33-60. [DOI:10.1080/10408440590905948] [PMID]
23.Pfohl-Leszkowicz A, Manderville RA. Ochratoxin A: An overview on toxicity and carcinogenicity in animals and humans. Molecular Nutrition & Food Research. 2007; 51(1):61-99. [DOI:10.1002/mnfr.200600137] [PMID]
24.Carvani V, Mojarrad Ashena Abad M. [Investigation of microbial contamination of spice plants presented in Urmia Herbs markets (Persian)]. Journal of Biosafety. 2019; 11(2):110-22. [Link]
25.Tidswell EC, Tirumalai RS, Gross DD. Clarifications on the Intended Use of USP< 61> Microbiological examination of nonsterile products: Microbial Enumeration Tests. PDA Journal of Pharmaceutical Science and Technology. 2023; 7(6):1-2. [DOI:10.5731/pdajpst.2023.012855]
26.Parenteral Drug Association (PDA). Microbiological examination of nonsterile products: Acceptance criteria for pharmaceutical preparations and substances for pharmaceuti. PDA Journal of Pharmaceutical Science and Technology. 2016; 33(2):1-2. [Link]
27.Parenteral Drug Association (PDA). Microbiological examination of non-sterile products/<62> tests for specified microorganisms. 2016; 34(6):1-12. [Link]
28.Banerjee M, Sarkar PK. Microbiological quality of some retail spices in India. Food Research International. 2003;36(5):469-74. [DOI:10.1016/S0963-9969(02)00194-1]
29.Beki̇I, Ulukanli Z. Enumeration of microorganisms and detection of some pathogens in commonly used spices sold openly from retail stores in Kars. Gazi University Journal of Science. 2008; 21(3):79-85. [Link]
30.Abba D, Inabo HI, Yakubu SE, Olonitola OS. Contamination of herbal medicinal products marketed in Kaduna metropolis with selected pathogenic bacteria. African Journal of Traditional, Complementary, and Alternative Medicines: AJTCAM. 2008; 6(1):70-7. [DOI:10.4314/ajtcam.v6i1.57076] [PMID]
31.Witkowska AM, Hickey DK, Alonso-Gomez M, Wilkinson MG. The microbiological quality of commercial herb and spice preparations used in the formulation of a chicken supreme ready meal and microbial survival following a simulated industrial heating process. Food Control. 2011; 22(3-4):616-25. [DOI:10.1016/j.foodcont.2010.10.014]
32.Salari R, Habibi Najafi MB, Boroushaki MT, Mortazavi SA, Fathi Najafi M. Assessment of the microbiological quality and mycotoxin contamination of Iranian red pepper spice. Journal of Agricultural Science and Technology. 2012; 14(7):1511-21. [Link]
33.Kaume L, Foote J, Gbur E. Microbial contamination of herbs marketed to HIV-infected people in Nairobi (Kenya). South African Journal of Science. 2012; 108(9/10):1-4. [DOI:10.4102/sajs.v108i9/10.563]
34.Koohy-Kamaly-Dehkordy P, Nikoopour H, Siavoshi F, Koushki M, Abadi A. Microbiological quality of retail spices in Tehran, Iran. Journal of Food Protection. 2013; 76(5):843-8. [DOI:10.4315/0362-028X.JFP-12-180] [PMID]
35.Namdari F, Eghbali B, Bahmani M, Rafieian-Kopaei M, Hassanzadazar H, Moghimi-Monfared O, et al. A survey on microbial quality of herbal distillates in Isfahan, central of Iran. Studia Universitatis Vasile Goldis Arad, Seria Stiintele Vietii. 2014; 24(4):407-11. [Link]
36.Banach J, Stratakou I, Van der Fels-Klerx H, Den Besten H, Zwietering M. European alerting and monitoring data as inputs for the risk assessment of microbiological and chemical hazards in spices and herbs. Food Control. 2016; 69:237-49. [DOI:10.1016/j.foodcont.2016.04.010]
37.Abdolghani A, Maryam E, Sara S. Microbial indices of industrial and traditional medicinal herbs in Ahvaz, Iran. Foods and Raw Materials. 2020; 8(1):134-40. [DOI:10.21603/2308-4057-2020-1-134-139]
38.Heydari Starq M, Meftahi Zadeh H. Investigating the microbial contamination of some dry medicinal plants in the Groceries of Yazd. Journal of Applied Biology. 2019; 9 (34):110-21. [Link]
39.Ting A, Chow Y, Tan W. Microbial and heavy metal contamination in commonly consumed traditional Chinese herbal medicines. Journal of Traditional Chinese Medicine = Chung i tsa chih ying wen pan. 2013; 33(1):119-24. [DOI:10.1016/S0254-6272(13)60112-0] [PMID]
2.Jamshidi-Kia F, Lorigooini Z, Amini-Khoei H. Medicinal plants: Past history and future perspective. Journal of Herbmed Pharmacology. 2018; 7(1):1-7. [DOI:10.15171/jhp.2018.01]
3.Ideh JE, Ogunkunle ATJ. User frequency and microbial contaminants of traditional oral powdered herbal formulations in Ogbomoso, Nigeria. Journal of Medicinal Plants for Economic Development. 2019; 3(1):a67. [DOI:10.4102/jomped.v3i1.67]
4.Kneifel W, Czech E, Kopp B. Microbial contamination of medicinal plants--a review. Planta Medica. 2002; 68(1):5-15. [DOI:10.1055/s-2002-20060] [PMID]
5.Czech E, Kneifel W, Kopp B. Microbiological status of commercially available medicinal herbal drugs--a screening study. Planta Medica. 2001; 67(3):263-9. [DOI:10.1055/s-2001-12007] [PMID]
6.Adeleye IA, Okogi G, Ojo EO. Microbial contamination of herbal preparations in Lagos, Nigeria. Journal of Health, Population and Nutrition. 2005; 23(3):296-7. [Link]
7.Arias ML, Chaves C, Alfaro LD. Microbiological analysis of some herbal infusions used as medicines. Revista Biomédica. 1999; 10(1):1-6. [DOI:10.32776/revbiomed.v10i1.181]
8.Stević T, Pavlović S, Stanković S, Šavikin K. Pathogenic microorganisms of medicinal herbal drugs. Archives of Biological Sciences. 2012; 64(1):49-58. [DOI:10.2298/ABS1201049S]
9.Martins HM, Martins M, Dias MI, Bernardo F. Evaluation of microbiological quality of medicinal plants used in natural infusions. International Journal of Food Microbiology. 2001; 68(1-2):149-53. [DOI:10.1016/S0168-1605(01)00480-9]
10.Okunlola A, Adewoyin BA, Odeku OA. Evaluation of pharmaceutical and microbial qualities of some herbal medicinal products in south western Nigeria. Tropical Journal of Pharmaceutical Research. 2007; 6(1):661-70. [DOI:10.4314/tjpr.v6i1.14644]
11.de Sousa Lima CM, Fujishima MA, de Paula Lima B, Mastroianni PC, de Sousa FF, da Silva JO. Microbial contamination in herbal medicines: A serious health hazard to elderly consumers. BMC Complementary Medicine and Therapies. 2020; 20(1):17. [DOI:10.1186/s12906-019-2723-1] [PMID]
12.Noor R, Huda N, Rahman F, Bashar T, Munshi SK. Microbial contamination in herbal medicines available in Bangladesh. Bangladesh Medical Research Council Bulletin. 2013; 39(3):124-9. [DOI:10.3329/bmrcb.v39i3.20313] [PMID]
13.Sekar P, Yamnam N, Ponmurugan K. Screening and characterization of mycotoxin producing fungi from dried fruits and grains. Advanced Biotech. 2008; 7(1):12-5. [Link]
14.Aziz NH, Youssef YA, El-Fouly MZ, Moussa LA. Contamination of some common medicinal plant samples and spices by fungi and their mycotoxins. Botanical Bulletin of Academia Sinica. 1998; 39:279-85. [Link]
15.Bugno A, Almodovar AAB, Pereira TC, Pinto T de JA, Sabino M. Occurrence of toxigenic fungi in herbal drugs. Brazilian Journal of Microbiology. 2006; 37(1):47-51. [DOI:10.1590/S1517-83822006000100009]
16.Hashem M, Alamri S. Contamination of common spices in Saudi Arabia markets with potential mycotoxin-producing fungi. Saudi Journal of Biological Sciences. 2010; 17(2):167-75. [DOI:10.1016/j.sjbs.2010.02.011]
17.Kim DM, Chung SH, Chun HS. Multiplex PCR assay for the detection of aflatoxigenic and non-aflatoxigenic fungi in meju, a Korean fermented soybean food starter. Food Microbiology. 2011; 28(7):1402-8. [DOI:10.1016/j.fm.2011.06.017] [PMID]
18.Mateo EM, Gil-Serna J, Patiño B, Jiménez M. Aflatoxins and ochratoxin A in stored barley grain in Spain and impact of PCR-based strategies to assess the occurrence of aflatoxigenic and ochratoxigenic aspergillus spp. International Journal of Food Microbiology. 2011; 149(2):118-26. [DOI:10.1016/j.ijfoodmicro.2011.06.006] [PMID]
19.International Agency for Research on Cancer (IARC). Some naturally occurring substances: Food items and constituents, heterocyclic aromatic amines and mycotoxins. Lyon: IARC Press; 1993. [PMID]
20.Yu J, Chang PK, Cary JW, Wright M, Bhatnagar D, Cleveland TE, et al. Comparative mapping of aflatoxin pathway gene clusters in aspergillus parasiticus and aspergillus flavus. Applied and Environmental Microbiology. 1995; 61(6):2365-71. [DOI:10.1128/aem.61.6.2365-2371.1995] [PMID]
21.Kuiper-Goodman T, Scott PM. Risk assessment of the mycotoxin ochratoxin A. Biomedical and Environmental Sciences: BES. 1989; 2(3):179-248. [PMID]
22.O'Brien E, Dietrich DR. Ochratoxin A: The continuing enigma. Critical Reviews in Toxicology. 2005; 35(1):33-60. [DOI:10.1080/10408440590905948] [PMID]
23.Pfohl-Leszkowicz A, Manderville RA. Ochratoxin A: An overview on toxicity and carcinogenicity in animals and humans. Molecular Nutrition & Food Research. 2007; 51(1):61-99. [DOI:10.1002/mnfr.200600137] [PMID]
24.Carvani V, Mojarrad Ashena Abad M. [Investigation of microbial contamination of spice plants presented in Urmia Herbs markets (Persian)]. Journal of Biosafety. 2019; 11(2):110-22. [Link]
25.Tidswell EC, Tirumalai RS, Gross DD. Clarifications on the Intended Use of USP< 61> Microbiological examination of nonsterile products: Microbial Enumeration Tests. PDA Journal of Pharmaceutical Science and Technology. 2023; 7(6):1-2. [DOI:10.5731/pdajpst.2023.012855]
26.Parenteral Drug Association (PDA). Microbiological examination of nonsterile products: Acceptance criteria for pharmaceutical preparations and substances for pharmaceuti. PDA Journal of Pharmaceutical Science and Technology. 2016; 33(2):1-2. [Link]
27.Parenteral Drug Association (PDA). Microbiological examination of non-sterile products/<62> tests for specified microorganisms. 2016; 34(6):1-12. [Link]
28.Banerjee M, Sarkar PK. Microbiological quality of some retail spices in India. Food Research International. 2003;36(5):469-74. [DOI:10.1016/S0963-9969(02)00194-1]
29.Beki̇I, Ulukanli Z. Enumeration of microorganisms and detection of some pathogens in commonly used spices sold openly from retail stores in Kars. Gazi University Journal of Science. 2008; 21(3):79-85. [Link]
30.Abba D, Inabo HI, Yakubu SE, Olonitola OS. Contamination of herbal medicinal products marketed in Kaduna metropolis with selected pathogenic bacteria. African Journal of Traditional, Complementary, and Alternative Medicines: AJTCAM. 2008; 6(1):70-7. [DOI:10.4314/ajtcam.v6i1.57076] [PMID]
31.Witkowska AM, Hickey DK, Alonso-Gomez M, Wilkinson MG. The microbiological quality of commercial herb and spice preparations used in the formulation of a chicken supreme ready meal and microbial survival following a simulated industrial heating process. Food Control. 2011; 22(3-4):616-25. [DOI:10.1016/j.foodcont.2010.10.014]
32.Salari R, Habibi Najafi MB, Boroushaki MT, Mortazavi SA, Fathi Najafi M. Assessment of the microbiological quality and mycotoxin contamination of Iranian red pepper spice. Journal of Agricultural Science and Technology. 2012; 14(7):1511-21. [Link]
33.Kaume L, Foote J, Gbur E. Microbial contamination of herbs marketed to HIV-infected people in Nairobi (Kenya). South African Journal of Science. 2012; 108(9/10):1-4. [DOI:10.4102/sajs.v108i9/10.563]
34.Koohy-Kamaly-Dehkordy P, Nikoopour H, Siavoshi F, Koushki M, Abadi A. Microbiological quality of retail spices in Tehran, Iran. Journal of Food Protection. 2013; 76(5):843-8. [DOI:10.4315/0362-028X.JFP-12-180] [PMID]
35.Namdari F, Eghbali B, Bahmani M, Rafieian-Kopaei M, Hassanzadazar H, Moghimi-Monfared O, et al. A survey on microbial quality of herbal distillates in Isfahan, central of Iran. Studia Universitatis Vasile Goldis Arad, Seria Stiintele Vietii. 2014; 24(4):407-11. [Link]
36.Banach J, Stratakou I, Van der Fels-Klerx H, Den Besten H, Zwietering M. European alerting and monitoring data as inputs for the risk assessment of microbiological and chemical hazards in spices and herbs. Food Control. 2016; 69:237-49. [DOI:10.1016/j.foodcont.2016.04.010]
37.Abdolghani A, Maryam E, Sara S. Microbial indices of industrial and traditional medicinal herbs in Ahvaz, Iran. Foods and Raw Materials. 2020; 8(1):134-40. [DOI:10.21603/2308-4057-2020-1-134-139]
38.Heydari Starq M, Meftahi Zadeh H. Investigating the microbial contamination of some dry medicinal plants in the Groceries of Yazd. Journal of Applied Biology. 2019; 9 (34):110-21. [Link]
39.Ting A, Chow Y, Tan W. Microbial and heavy metal contamination in commonly consumed traditional Chinese herbal medicines. Journal of Traditional Chinese Medicine = Chung i tsa chih ying wen pan. 2013; 33(1):119-24. [DOI:10.1016/S0254-6272(13)60112-0] [PMID]
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |