دوره 34، شماره 1 - ( 1-1404 )
جلد 34 شماره 1 صفحات 27-8 |
برگشت به فهرست نسخه ها
Research code: IR.IAU.SRB.REC.1401.161
Ethics code: IR.IAU.SRB.REC.1401.161
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
hajati Ziabari A, jahandideh A, akbarzadeh A, mortazavi P. A Review Study on the Fabrication and Use of Bioscaffolds and Biologically Simulated Bone Materials in Bone Regeneration. JGUMS 2025; 34 (1) :8-27
URL: http://journal.gums.ac.ir/article-1-2681-fa.html
URL: http://journal.gums.ac.ir/article-1-2681-fa.html
حاجتی ضیابری امیررضا، جهاندیده علیرضا، اکبرزاده ابوالفضل، مرتضوی پژمان. مروری بر ساخت و استفاده از داربستهای زیستی و مواد استخوانی شبیهسازیشده بیولوژیکی در ترمیم استخوان. مجله علوم پزشکی گیلان. 1404; 34 (1) :8-27
مروری بر ساخت و استفاده از داربستهای زیستی و مواد استخوانی شبیهسازیشده بیولوژیکی در ترمیم استخوان
1- گروه علوم بالینی، دانشکده علوم و فناوری های پزشکی، واحد علوم و تحقیقات، دانشگاه آزاد اسلامی، تهران، ایران.
2- گروه نانوتکنولوژی پزشکی، دانشکده علوم نوین پزشکی، دانشگاه علوم پزشکی تبریز، تبریز، ایران.
3- گروه پاتوبیولوژی، دانشکده علوم تخصصی دامپزشکی، واحد علوم و تحقیقات، دانشگاه آزاد اسلامی،تهران، ایران.
2- گروه نانوتکنولوژی پزشکی، دانشکده علوم نوین پزشکی، دانشگاه علوم پزشکی تبریز، تبریز، ایران.
3- گروه پاتوبیولوژی، دانشکده علوم تخصصی دامپزشکی، واحد علوم و تحقیقات، دانشگاه آزاد اسلامی،تهران، ایران.
متن کامل [PDF 9953 kb]
(519 دریافت)
| چکیده (HTML) (1423 مشاهده)
داربستهای استخوانی با کنترل نوریحرارتی
اخیراً درمان نوریحرارتی برای از بین بردن تومورها و تحریک بازسازی بافت مورد استفاده قرار گرفته است. درمان نوریحرارتی و رادیوتراپی بهطور گسترده در درمان بالینی استفاده میشود که در تلفیق با نانوپزشکی موفقیتآمیز بوده است. مواد زیستی مختلفی با اثرات نوریحرارتی در چند سال گذشته گزارش شدهاند که شامل نانوذرات طلا و نانومواد کربنی هستند. در این میان، اکسید گرافن به دلیل توانایی جذب نور مادون قرمز نزدیک، با عملکرد تبدیل نور حرارتی و زیستسازگاری بالا اثربخشی خوبی از خود نشان داده است. گزارش شده است که یک نانولوله کربنی تحت اثر نوریحرارتی فعالشده با نور مادون قرمز نزدیک، بیان ژن استخوانی را در پیشساز استئوبلاستها افزایش میدهد [61, 62]. داربست کیتوزانی دوکاره پوشیدهشده با درصد نانو هیدروکسی آپاتیت و اکسید گرافن طراحی شده است که توانایی از بین بردن سلولهای استئوسارکوم و بهبود سلولهای استئوبلاستی را داشته و همچنین اثرات مثبت تابش نور مادون قرمز نزدیک بر تکثیر و تمایز سلولهای مزانشیمی مغز استخوان انسانی را نشان داد. مشخص شد نسبت 30 درصد نانو هیدروکسی آپاتیت و اکسید گرافن سازگاری زیستی را بهبود بخشید و یک اثر حرارتی بسیار خوبی در حذف سلولهای استئوسارکوم و تحریک تمایز سلولهای مزانشیمی مغز استخوان انسانی نشان داد. برای ارزیابی بازسازی بافت درونتنی، نتایج حاصل از تصاویر میکرو سیتیاسکن و رنگآمیزی بافت نشان داد داربست کیتوزانی دوکاره پوشیدهشده با درصد نانو هیدروکسی آپاتیت و اکسید گرافن، تشکیل استخوان جدید را بهطور قابلتوجهی در مقایسه با گروه کنترل افزایش داد [63, 64]. علاوهبر داربستهای دو عملکردی با اثر نوریحرارتی، داربستهای پلی اکریلیک اسید ـ کلسیم با انرژی بالا نیز منجر به کانیسازی در نواحی شکاف دارای کمبود کلاژن میشوند. این داربستها با ویژگیهای ساختاری و عملکردی مشابه بافت استخوانی، یک ریزمحیط مفید برای لانهگزینی سلولی و تمایز چندگانه فراهم کرده و همزمان سلولهای بنیادی را نیز برای ترمیم نقص استخوانی به کار میگیرند [65، 66].
داربستهای استخوانی با هدایت الکتریکی و مغناطیسی
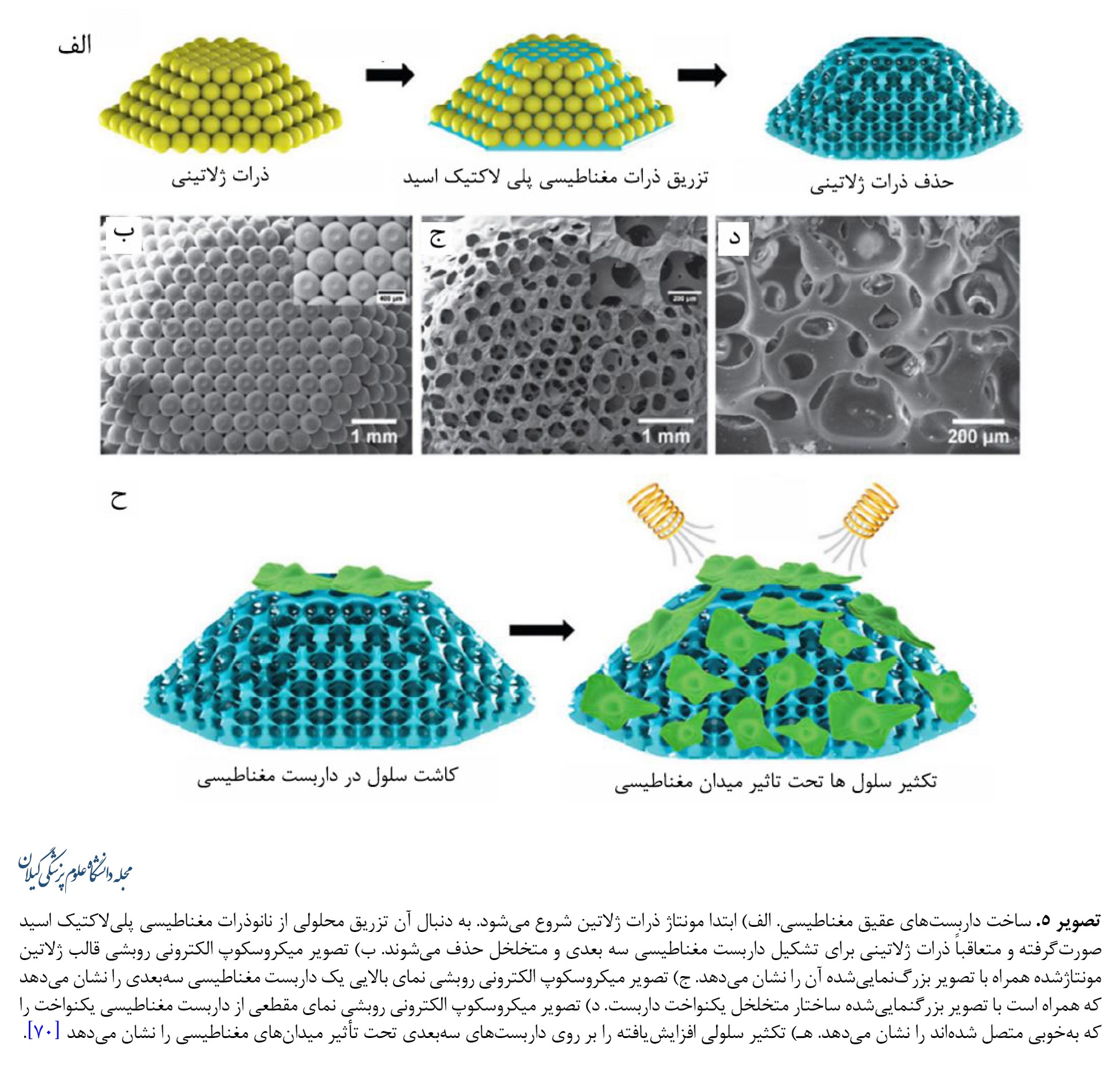
یافتههای اخیر نشان دادهاند محرکهای الکتریکی میتوانند سلولهای استخوانی را به مهاجرت، تکثیر و تمایز در مکانهای خاص در شرایط دروناندامی سوق دهند. نتایج بالینی همچنین نشان دادهاند محرکهای الکتریکی میتوانند ترمیم استخوان را ازطریق برهمکنش بین بیوالکتریکها و بیومولکولهای باردار تقویت کنند. ازآنجاییکه ترمیم زخم تحریکشده توسط ریزمحیط الکتریکی بهعنوان نشانهای برای بازسازی استخوان مطرح شدهاست، به نظر میرسد بازیابی ریزمحیط بالقوه فیزیولوژیکی آسیبدیده یک استراتژی مؤثر برای بازسازی استخوان باشد. غشاهای نانوکامپوزیت ریزمحیط الکتریکی شبیهسازیشده بیولوژیکی با پراکندگی همگن نانوذرات فروالکتریک تیتانات باریم در داربست پلیوینیلیدین فلوریدتری فلوئورواتیلن طراحی شده است. ازآنجاییکه غشاهای نانوکامپوزیتی، مانند پریوستوم محل نقص استخوان را میپوشانند، سلولهای مزانشیمی مغز استخوان اطراف میتوانند توسط گالوانوتاکسی جذب شده و ازطریق پتانسیل بیوالکتریک تولیدشده توسط غشاهای کامپوزیت به استئوبلاستها تمایز داده شوند [67-69]. مواد پیزوالکتریک مختلفی نظیر پلیوینیلیدین فلوراید، پلیال لاکتید اپال زیستتخریبپذیر و باریم تیتانات وجود دارند که برای ساختن داربستهایی با ظرفیت سلولهای تحریک الکتریکی تحت تنش مکانیکی (بهویژه نانو زیستمواد پیزوالکتریک) استفاده شدهاند. علاوهبراین، استفاده از میدانهای مغناطیسی برای فعالسازی داربستهای پیزوالکتریک اخیراً به دلیل ویژگی کمتهاجمی و سادگی تهیه آنها مورد توجه قرار گرفته است. اثرات محرکهای الکتریکی ناشی از میدان مغناطیسی بر تکثیر سلولهای استئوبلاست با استفاده از غشاهای دوبعدی و داربستهای سهبعدی به اثبات رسیده است (تصویر شماره 5).
ارائه استراتژیها و چالشهای کارآزمایی بالینی ترمیم استخوان
روش جاری در درمان بالینی استفاده از پیوندهای استخوان خودی، غیرخودی و یا از گونه دیگر است که با مواد زیستی مصنوعی تلفیق شدهاند. استخوان خاصره بهعنوان منبع اصلی اتوگرافت است. استخوان اسفنجی را میتوان در حین عمل برداشت کرد و برای تهیه بلوکهای استخوانی یا تراشههای استخوانی برای پر کردن نقیصه استخوانی استفاده کرد. برای غلبه بر مشکل عروق، یک اتوگرافت عروقی برای بازسازی نقایص بزرگ استخوانی تولید شده است [92]. از فلپ فیبولای آزاد در بازسازی فک پایین و فک بالا استفاده شده است. آلوگرافتهای استخوان، بهعنوان جایگزینی برای اتوگرافت، معمولاً از اهداکنندگان زنده یا جسد جمعآوری میشوند که پس از عملآوری پیوند به بیمار دیگر انجام میشود. آلوگرافتهای استخوان به دلیل در دسترس بودن آسان در اندازهها و اشکال مختلف مفید هستند. علاوهبر کاربرد آلوگرافت بهتنهایی، ترکیب آنها با سلولهای مغز استخوان متمرکز اتولوگ نیز گزارش شده است. زنوگرافت استحصالشده از گونههای مختلف در درمان بالینی به دلیل در دسترس بودن و تخلخل سازگار برای رشد بافت استخوان و خواص مکانیکی مشابه با استخوان گیرنده مورد استفاده قرار گرفتهاند. استخوان اسفنجی گاو نیز در مدیریت شکستگی استخوان درشت نی در بیماران مسن گزارش شده و نتایج خوبی از خود نشان داده است. با وجود این، استفاده از زنوگرافت به دلیل مسائلی مانند رد پیوند و شکست در یکپارچگی بافت با مشکل مواجه است. به غیر از گرافتهای مذکور، داربستهای مصنوعی بهطور گستردهای مورد استفاده قرار گرفتهاند. داربستهای هیدروکسی آپاتیت با سلولهای بنیادی مزانشیمی بارگذاری شده، توانایی استخوانسازی قابلتوجهی بدون پاسخ نامطلوب پس از کورتاژ تومور نشان دادهاند. هیدروکسی آپاتیت کلسیم متخلخل بههمپیوسته بارگذاریشده با سلولهای تکهستهای مغز استخوان در ترمیم استئونکروز مؤثر بوده است. استفاده از چاپ سهبعدی، بهویژه داربستهای سرامیکی پرینت سهبعدی، میتواند از ساختارهای آناتومیک پیچیده بیمار تقلید و بازسازی استخوان را تسهیل کند [92 ,93].
اگرچه تحقیقات زیادی درمورد بازسازی بافت استخوانی منتشر شده است، اما هنوز چند عامل مانع از کاربرد تحقیقات پایه در سطح بالینی میشود. این چالشها شامل چالشهای علمی و فناوری زیر است:
مناسبترین نوع سلول برای استفاده در درمان بازسازی استخوان هنوز مشخص نیست. اگرچه سلولهای بنیادی مزانشیمی بهصورت بالینی و تجربی به کار گرفته شدهاند، خطرات استفاده از سلولها همچنان وجود دارد. سلولهای بنیادی پرتوان جنینی و القایی در ترمیم بافت بالغ ضروری هستند و علاوهبراین همچنان به دستکاریهای آزمایشگاهی بیشتری نیاز دارند. عروق کافی برای بقای سلولها و ترمیم بعدی استخوان موردنیاز است. بااینحال تشکیل عروق جدید اغلب فاقد عمق نفوذ مناسبی هستند. این امر اندازه ساختارهای استخوانی قابلکاشت را محدود میکند [92]. کنترل تخریب داربست نیاز به اصلاح دقیق دارد. اگر داربست بهسرعت تخریب شود، مانند آنچه در خصوص هیدروژلهای نانوکامپوزیت وجود دارد [94]، ممکن است خرابی مکانیکی رخ دهد [92]. برعکس، اگر داربست بهآرامی تخریب شود، ممکن است یک واکنش التهابی فعال پایدار رخ دهد که مانع از ترمیم بافت شود. ازاینرو تعادل بین تخریب داربستها و تشکیل استخوان جدید ضروری است و چالش مهمی به شمار میآید [92]. اگرچه تکنیکهای ساخت سهبعدی فعلی نظیر داربستهای کامپوزیتی بتا تریکلسیم فسفات [95] را میتوان برای ساخت مدلهای نقیصه استخوانی در بیمار مورد استفاده قرار داد، اما بیوسرامیکهای سهبعدی چالشهایی ازجمله شکنندگی، نامناسب بودن برای درمان بالینی به دلیل اثرات مضر بالقوه حلالهای سمی و تأثیر بر زندهمانی سلول را با خود به همراه دارند. علاوهبراین، پرینترهای زیستی سهبعدی فعلی فاقد ظرفیت شناسایی منافذ داخلی هستند که برای بهینهسازی بیشتر به کارآزمایی بالینی نیاز دارند [92]. بهبود ویژگیهای مکانیکی داربست پیشتر مورد بحث قرار گرفت. سازگار کردن فردی عملکرد مکانیکی کافی نیست و عملکرد مکانیکی رضایتبخش نیاز به توجه به یکسری عوامل در ساخت داربست، ازجمله اصلاح مقاومت فشاری، کششی، الاستیک و خستگی داربست دارد. ترکیب این عوامل با سایر خواص ممکن است برای کمک به تحریک استخوانزایی مفید باشد. داربستها با رویکردهای پرینت زیستی با دقت بالا تنها برای نقایص استخوانی در مقیاس کوچکتر مفید هستند [92 ,93].
بحث
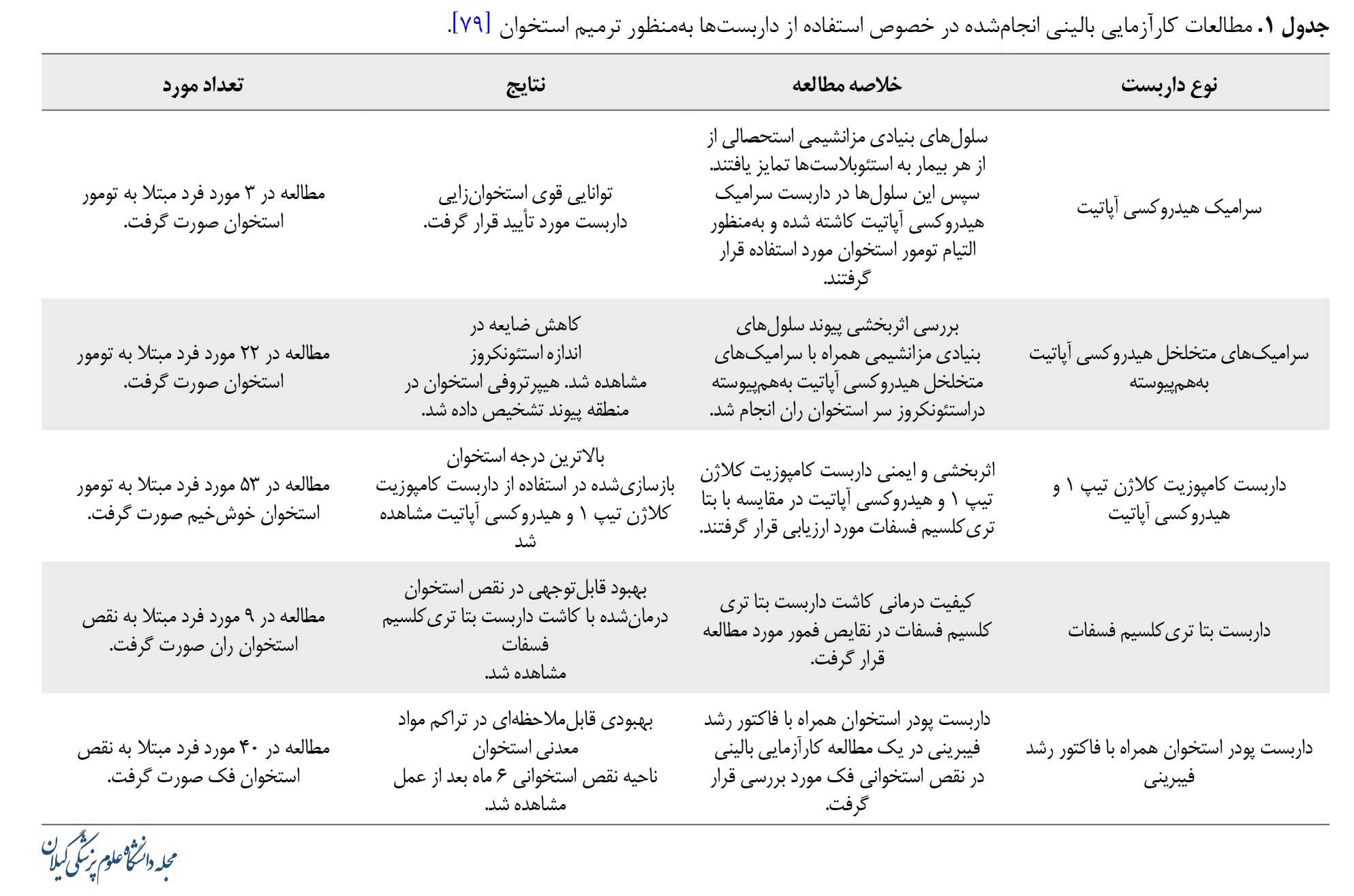
همانطور که توضیح داده شد، تلاشهای قابلتوجهی برای بازسازی بافت استخوان ازطریق روشهای شبیهسازی زیستی که چندین استراتژی شبیهسازی سلولی را پوشش میدهد، انجام شده است. جدول شماره 1 جمعبندی و خلاصهای از مطالعات ذکرشده را نشان میدهد.
این پیشرفتها با تلفیقی از طراحی ساختاری، اصلاح سطح و استفاده از محرکهای فیزیکی خارجی، پتانسیل زیادی برای بازسازی بافت استخوانی ایجاد کردهاند. بااینحال هنوز چالشهای مهمی در شبیهسازی ساختارهای بافت استخوانی و کاربرد وسیع داربستهای بدون سلول و یا سلولزداییشده بهمنظور تسهیل ترمیم بافت استخوانی وجود دارد. پرواضح است که فاکتورهای رشد، هورمونها و کموکاینها میتوانند پاسخهای بیولوژیکی را در بدن انسان تنظیم کنند، اما عوارض جانبی، هزینه بالا و پایداری آنها مانع از کاربرد آنها در سطح بالینی میشود.
نتیجهگیری
پیشرفتهای اخیر نشان دادهاند بازسازی استخوان در داخل بدن ممکن است ازطریق تلفیق شبیهسازی ساختاری بافتی و تحریک فیزیکی خارجی میسر شود، بنابراین وابستگی به سلولهای اگزوژن و فاکتورهای بیوشیمیایی در مهندسی بافت استخوان کاهش مییابد. علاوهبراین درمانهای مهندسی بافت استخوان مبتنی بر داربست که ایمن، راحت و مهمتر از همه مقرونبهصرفه هستند، مزایای قابلتوجهی در کاربرد بالینی دارد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه مصوب شورای پژوهشی دانشگاه آزاد اسلامی واحد علوم و تحقیقات با شناسه IR.IAU.SRB.REC.1401.161 می باشد.
حامی مالی
این مطالعه حاصل پایاننامه دوره دستیاری دامپزشکی امیررضا حاجتی ضیابری در گروه علوم بالینی، دانشکده علوم تخصصی دامپزشکی، واحد علوم و تحقیقات، دانشگاه آزاد اسلامی، می باشد.
مشارکت نویسندگان
مفهومسازی: علیرضا جهاندیده و امیررضا حاجتی ضیابری؛ تحقیق و بررسی: تمام نویسندگان؛ ویرایش اولیه: امیررضا حاجتی ضیابری؛ ویراستاری و نهاییسازی نوشته: علیرضا جهاندیده.
تعارض منافع
بنابر اظهار نویسندگان این مقاله تعارض منافع ندارد.
References
1.McAllister TN, Dusserre N, Maruszewski M, L'heureux N. Cell-based therapeutics from an economic perspective: Primed for a commercial success or a research sinkhole? Regenerative Medicine. 2008; 3(6):925-37. [DOI:10.2217/17460751.3.6.925] [PMID]
2.Mummery CL, Davis RP, Krieger JE. Challenges in using stem cells for cardiac repair. Science Translational Medicine. 2010; 2(27):27ps17. [DOI:10.1126/scitranslmed.3000558] [PMID]
3.Burdick JA, Mauck RL, Gorman JH 3rd, Gorman RC. Acellular biomaterials: An evolving alternative to cell-based therapies. Science Translational Medicine. 2013; 5(176):176ps4. [DOI:10.1126/scitranslmed.3003997] [PMID] [PMCID]
4.Harrison JH. Synthetic materials as vascular prostheses. I. A comparative study in small vessels of nylon, dacron, orlon, ivalon sponge and teflon. American Journal of Surgery. 1958; 95(1):3-15. [DOI:10.1016/0002-9610(58)90735-9] [PMID]
5.Same S, Navidi G, Samee G, Abedi F, Aghazadeh M, Milani M, et al. Gentamycin-loaded halloysite-based hydrogel nanocomposites for bone tissue regeneration: Fabrication, evaluation of the antibacterial activity and cell response. Biomedical Materials. 2022; 17(6):065018. [DOI:10.1088/1748-605X/ac94ad] [PMID]
6.Javadian N, Veshkini A, Jahandideh A, Akbarzadeh A, Asghari A. Ultrasonographic evaluation of effect of zeolite and zeolite/collagen nanocomposite scaffolds on healing of femurbone defect in rabbits. Veterinary Research & Biological Products. 2021; 34(3):114-20. [DOI:10.22092/vj.2020.341723.1686]
7.Rad F, Davaran S, Babazadeh M, Akbarzadeh, Pazoki-Toroudi5 H. Biodegradable electrospun polyester-urethane nanofiber scaffold: Codelivery investigation of doxorubicin-ezetimibe and its synergistic effect on prostate cancer cell line. Journal of Nanomaterials. 2022; 2022(1):8818139.[DOI:10.1155/2022/8818139]
8.Sagart A, Jahandideh A, Asghari A, Akbarzadeh A, Mortazavi P. [Investigating the regenerative effects of PRP and polycaprolactone-hydroxyapatite zeolite nanocomposites on wound healing after tooth extraction (Persian)]. Journal of Comparative Pathology. 2023; 19(2):3873-82. [DOI:10.30495/jcp.2022.21491]
9.Same S, Kadkhoda J, Navidi G, Abedi F, Aghazadeh M, Milani M, et al. The fabrication of halloysite nanotube-based multicomponent hydrogel scaffolds for bone healing. Journal of Applied Biomaterials & Functional Materials. 2022; 20:22808000221111875. [DOI:10.1177/22808000221111875] [PMID]
10.Saghebasl S, Akbarzadeh A, Gorabi AM, Nikzamir N, SeyedSadjadi M, Mostafavi E. Biodegradable functional macromolecules as promising scaffolds for cardiac tissue engineering. Polymers for Advanced Technologies. 2022; 33(7):2044-68. [DOI:10.1002/pat.5669]
11.Neščáková Z, Zheng K, Liverani L, Nawaz Q, Galusková D, Kaňková H, et al. Multifunctional zinc ion doped sol - Gel derived mesoporous bioactive glass nanoparticles for biomedical applications. Bioactive Materials. 2019; 4:312-21. [DOI:10.1016/j.bioactmat.2019.10.002] [PMID] [PMCID]
12.Kim B, Ventura R, Lee BT. Functionalization of porous BCP scaffold by generating cell-derived extracellular matrix from rat bone marrow stem cells culture for bone tissue engineering. Journal of Tissue Engineering and Regenerative Medicine. 2018; 12(2):e1256-67. [DOI:10.1002/term.2529] [PMID]
13.Shih YV, Varghese S. Tissue engineered bone mimetics to study bone disorders ex vivo: Role of bioinspired materials. Biomaterials. 2019; 198:107-21. [DOI:10.1016/j.biomaterials.2018.06.005] [PMID] [PMCID]
14.Asadi N, Del Bakhshayesh AR, Sadeghzadeh H, Asl AN, Kaamyabi S, Akbarzadeh A. Nanocomposite electrospun scaffold based on polyurethane/polycaprolactone incorporating gold nanoparticles and soybean oil for tissue engineering applications. Journal of Bionic Engineering. 2023; 20(4):1712-22. [DOI:10.1007/s42235-023-00345-x]
15.Du Y, Guo JL, Wang J, Mikos AG, Zhang S. Hierarchically designed bone scaffolds: From internal cues to external stimuli. Biomaterials. 2019; 218:119334. [DOI:10.1016/j.biomaterials.2019.119334] [PMID] [PMCID]
16.O'Neill E, Awale G, Daneshmandi L, Umerah O, Lo KW. The roles of ions on bone regeneration. Drug Discovery Today. 2018; 23(4):879-890. [DOI:10.1016/j.drudis.2018.01.049] [PMID]
17.Mao Z, Gu YF, Zhang J, Shu WW, Cui YQ, Xu T. Superior biological performance and osteoinductive activity of Si-containing bioactive bone regeneration particles for alveolar bone reconstruction. Ceramics International. 2020; 46(1):353-64. [DOI:10.1016/j.ceramint.2019.08.269]
18.Javadian N, Veshkini A, Jahandideh A, Akbarzadeh A, Asghari A. Ultrasonographic and radiographic evaluation of zeolite/collagen nanocomposite scaffolds compared with nanohydroxyapatite on experimental bone defect healing in rabbit femur. Crescent Journal of Medical and Biological Sciences. 2023; 10(1):49-55. [DOI:10.34172/cjmb.2023.08]
19.Faraji D, Jahandideh A, Asghari A, Akbarzadeh A, Hesaraki S. Effect of zeolite and zeolite/collagen nanocomposite scaffolds on healing of segmental femur bone defect in rabbits. Iranian Journal of Veterinary Surgery. 2017; 12(2):63-70. [DOI:10.22034/ivsa.2018.112807.1133]
20.Faraji D, Jahandideh A, Asghari A, Akbarzadeh A, Hesaraki S. Evaluation of influence of zeolite/collagen nanocomposite (ZC) and hydroxyapatite (HA) on bone healing: A study on rabbits. Archives of Razi Institute. 2019; 74(4):395-403. [DOI:10.22092/ari.2018.121308.1211]
21.Sagart A, Jahandideh A, Asghari A, Akbarzadeh A, Mortazavi P. The comparative effects of platelet-rich plasma and polycaprolactone-hydroxyapatite zeolite nanocomposites on wound healing after tooth extraction. Crescent Journal of Medical & Biological Sciences. 2024; 11(4):395-403. [DOI:10.34172/cjmb.2023.33]
22.Çelikbaş İ, Mavi E, Hepokur C. The evaluation of the effects of natural zeolite (Clinoptilolite) in diabetic rats on bone healing in dental extracting socket. Journal of Oral Biology and Craniofacial Research. 2023; 13(1):36-40. [PMID]
23.Mohammadi R, Amini K. Guided bone regeneration of mandibles using chitosan scaffold seeded with characterized uncultured omental adipose-derived stromal vascular fraction: An animal study. The International Journal of Oral & Maxillofacial Implants. 2015; 30(1):216-22. [DOI:10.11607/jomi.3542] [PMID]
24.Hung CC, Chaya A, Liu K, Verdelis K, Sfeir C. The role of magnesium ions in bone regeneration involves the canonical Wnt signaling pathway. Acta Biomaterialia. 2019; 98:246-55. [DOI:10.1016/j.actbio.2019.06.001] [PMID]
25.Wagner AS, Glenske K, Henß A, Kruppke B, Rößler S, Hanke T, et al. Cell behavior of human mesenchymal stromal cells in response to silica/collagen based xerogels and calcium deficient culture conditions. Biomedical Materials. 2017; 12(4):045003. [DOI:10.1088/1748-605X/aa6e29] [PMID]
26.Wagner AS, Glenske K, Wolf V, Fietz D, Mazurek S, Hanke T, et al. Osteogenic differentiation capacity of human mesenchymal stromal cells in response to extracellular calcium with special regard to connexin 43. Annals of Anatomy. 2017; 209:18-24. [DOI:10.1016/j.aanat.2016.09.005] [PMID]
27.Eliaz N, Metoki N. Calcium phosphate bioceramics: A review of their history, structure, properties, coating technologies and biomedical applications. Materials. 2017; 10(4):334. [DOI:10.3390/ma10040334] [PMID] [PMCID]
28.Glenske K, Donkiewicz P, Köwitsch A, Milosevic-Oljaca N, Rider P, Rofall S, et al. Applications of metals for bone regeneration. International Journal of Molecular Sciences. 2018; 19(3):826. [DOI:10.3390/ijms19030826] [PMID] [PMCID]
29.Sonbolekar H, Alireza J, Ahmad A, Hesaraki S, Akbarzadeh A. Assessment of tricalcium phosphate/titanium dioxide (TCP/TiO2) nanocomposite scaffold compared with bone autograft and hydroxyapatite (HA) on the healing of segmental femur bone defect in rabbits. Journal of Materials Science. 2022; 33(12):80. [DOI:10.1007/s10856-022-06694-z] [PMID] [PMCID]
30.Qing T, Mahmood M, Zheng Y, Biris AS, Shi L, Casciano DA. A genomic characterization of the influence of silver nanoparticles on bone differentiation in MC3T3-E1 cells. Journal of Applied Toxicology. 2018; 38(2):172-179. [DOI:10.1002/jat.3528] [PMID]
31.Weng W, Li X, Nie W, Liu H, Liu S, Huang J, et al. One-step preparation of an AgNP-nHA@RGO three-dimensional porous scaffold and its application in infected bone defect treatment. International Journal of Nanomedicine. 2020; 15:5027-42. [DOI:10.2147/IJN.S241859] [PMID] [PMCID]
32.Wang Q, Chen B, Cao M, Sun J, Wu H, Zhao P, et al. Response of MAPK pathway to iron oxide nanoparticles in vitro treatment promotes osteogenic differentiation of hBMSCs. Biomaterials. 2016; 86:11-20. [DOI:10.1016/j.biomaterials.2016.02.004] [PMID]
33.Zhao GY, Zhao LP, He YF, Li GF, Gao C, Li K, et al. A comparison of the biological activities of human osteoblast hFOB1.19 between iron excess and iron deficiency. Biological Trace Element Research. 2012; 150(1-3):487-95. [DOI:10.1007/s12011-012-9511-9] [PMID]
34.Benders KE, van Weeren PR, Badylak SF, Saris DB, Dhert WJ, Malda J. Extracellular matrix scaffolds for cartilage and bone regeneration. Trends Biotechnol. 2013; 31(3):169-76. [DOI:10.1016/j.tibtech.2012.12.004] [PMID]
35.Madhurakkat Perikamana SK, Lee J, Lee YB, Shin YM, Lee EJ, Mikos AG, et al. Materials from Mussel-Inspired Chemistry for Cell and Tissue Engineering Applications. Biomacromolecules. 2015; 16(9):2541-55. [DOI:10.1021/acs.biomac.5b00852] [PMID]
36.Eftekhari H, Jahandideh A, Asghari A, Akbarzadeh A. [Evaluation of β-tricalciumphosphate (β-TCP) nanocomposite granules compared with nanocomposite hydroxyapatite (HA) on healing of segmental femur bone defect in rabbits (Persian)]. Journal of Comparative Pathobiology. 2018; 15(4):2635-44. [Link]
37.Eftekhari H, Jahandideh A, Asghari A, Akbarzadeh A, Hesaraki S. Histopathological Evaluation of Polycaprolactone Nanocomposite Compared with Tricalcium Phosphate in Bone Healing. Journal of Veterinary Research. 2018; 62(3):385-94. [DOI:10.2478/jvetres-2018-0055] [PMID] [PMCID]
38.Mohseni M, Jahandideh A, Abedi G, Akbarzadeh A, Hesaraki S. Assessment of tricalcium phosphate/collagen (TCP/collagene)nanocomposite scaffold compared with hydroxyapatite (HA) on healing of segmental femur bone defect in rabbits. Artificial Cells, Nanomedicine, and Biotechnology. 2018; 46(2):242-9. [DOI:10.1080/21691401.2017.1324463] [PMID]
39.Farahi H, Mashhadi-Rafie S, Jahandideh A, Asghari A, Shirazi-Beheshtiha SH. Evaluation of possible beneficial effect of tricalcium phosphate/collagen (TCP/Collagen) nanocomposite scaffold on bone healing in rabbits: Biochemical assessments. Iranian Journal of Veterinary Surgery. 2019; 14(2):162-72. [Link]40.Wang X, Yu T, Chen G, Zou J, Li J, Yan J. Preparation and characterization of a chitosan/gelatin/extracellular matrix scaffold and its application in tissue engineering. Tissue Engineering. 2017; 23(3):169-79. [DOI:10.1089/ten.tec.2016.0511] [PMID]
41.Chi H, Song X, Song C, Zhao W, Chen G, Jiang A, et al. Chitosan-gelatin scaffolds incorporating decellularized platelet-rich fibrin promote bone regeneration. ACS Biomaterials Science & Engineering. 2019; 5(10):5305-15. [DOI:10.1021/acsbiomaterials.9b00788] [PMID]
42.Miron RJ, Zhang Y. Autologous liquid platelet rich fibrin: A novel drug delivery system. Acta Biomaterialia. 2018; 75:35-51. [DOI:10.1016/j.actbio.2018.05.021] [PMID]
43.Thorat M, Pradeep AR, Pallavi B. Clinical effect of autologous platelet-rich fibrin in the treatment of intra-bony defects: A controlled clinical trial. Journal of Clinical Periodontology. 2011; 38(10):925-32. [DOI:10.1111/j.1600-051X.2011.01760.x] [PMID]
44.Faot F, Deprez S, Vandamme K, Camargos GV, Pinto N, Wouters J, et al. The effect of L-PRF membranes on bone healing in rabbit tibiae bone defects: Micro-CT and biomarker results. Scientific Reports. 2017; 7:46452. [DOI:10.1038/srep46452] [PMID] [PMCID]
45.Hajati Ziabari A, Asadi Heris M, Mohammad Doodmani S, Jahandideh A, Koorehpaz K, Mohammadi R. Cinnamon nanoparticles loaded on chitosan- gelatin nanoparticles enhanced burn wound healing in diabetic foot ulcers in rats. The International Journal of Lower Extremity Wounds. 2022; 15347346221101245. [DOI:10.1177/15347346221101245] [PMID]
46.Zhang Y, Yang F, Liu K, Shen H, Zhu Y, Zhang W, et al. The impact of PLGA scaffold orientation on in vitro cartilage regeneration. Biomaterials. 2012; 33(10):2926-35. [DOI:10.1016/j.biomaterials.2012.01.006] [PMID]
47.Shin YM, Shin HJ, Yang DH, Koh YJ, Shin H, Chun HJ. Advanced capability of radially aligned fibrous scaffolds coated with polydopamine for guiding directional migration of human mesenchymal stem cells. Journal of Materials Chemistry. 2017; 5(44):8725-37. [DOI:10.1039/C7TB01758H] [PMID]
48.Zhu C, Pongkitwitoon S, Qiu J, Thomopoulos S, Xia Y. Design and fabrication of a hierarchically structured scaffold for tendon-to-bone repair. Advanced Materials. 2018; 30(16):e1707306. [DOI:10.1002/adma.201707306] [PMID] [PMCID]
49.Woodard LN, Kmetz KT, Roth AA, Page VM, Grunlan MA. Porous poly(ε-caprolactone)-poly(l-lactic acid) semi-interpenetrating networks as superior, defect-specific scaffolds with potential for cranial bone defect repair. Biomacromolecules. 2017; 18(12):4075-83. [DOI:10.1021/acs.biomac.7b01155] [PMID] [PMCID]
50.Wang L, Qiu Y, Lv H, Si Y, Liu L, Zhang Q, et al. 3D superelastic scaffolds constructed from flexible inorganic nanofibers with self-fitting capability and tailorable gradient for bone regeneration. Advanced Functional Materials. 2019; 29(31):1901407. [DOI:10.1002/adfm.201901407]
51.Nair AK, Gautieri A, Chang SW, Buehler MJ. Molecular mechanics of mineralized collagen fibrils in bone. Nature Communications. 2013; 4:1724. [DOI:10.1038/ncomms2720] [PMID] [PMCID]
52.Martinez LR, Mihu MR, Han G, Frases S, Cordero RJ, Casadevall A, et al. The use of chitosan to damage Cryptococcus neoformans biofilms. Biomaterials. 2010; 31(4):669-79. [DOI:10.1016/j.biomaterials.2009.09.087] [PMID] [PMCID]
53.Nabavi S, Jahandideh A, Akbarzadeh A. [Evaluation of polycaprolactone (PCL) based nanogel containing tetracycline on experimental wound infected with staphylococcus aureus bacteria healing on rat’s skin (Persian)]. Veterinary Research & Biological Products. 2023; 36(3):24-35. [DOI:10.22092/vj.2022.359948.2008]
54.Correia CO, Mano JF. Chitosan scaffolds with a shape memory effect induced by hydration. Journal of Materials Chemistry. 2014; 2(21):3315-23. [DOI:10.1039/C4TB00226A] [PMID]
55.Wang L, Qiu Y, Guo Y, Si Y, Liu L, Cao J, et al. Smart, Elastic, and nanofiber-based 3D scaffolds with self-deploying capability for osteoporotic bone regeneration. Nano Letters. 2019; 19(12):9112-20. [DOI:10.1021/acs.nanolett.9b04313] [PMID]
56.Hao J, Zhang Y, Jing D, Shen Y, Tang G, Huang S, et al. Mechanobiology of mesenchymal stem cells: Perspective into mechanical induction of MSC fate. Acta Biomaterialia. 2015; 20:1-9.[DOI:10.1016/j.actbio.2015.04.008] [PMID]
57.Balint R, Cassidy NJ, Cartmell SH. Electrical stimulation: A novel tool for tissue engineering. Tissue Engineering. Part B, Reviews. 2013; 19(1):48-57. [DOI:10.1089/ten.teb.2012.0183] [PMID]
58.Hamedfar H, Zivari-Ghader T, Akbarzadeh A, Davaran S. Physicochemical characteristics of chitosan–alginate scaffold containing atorvastatin. Advances in Polymer Technology. 2023; 2023(1):9452164. [DOI:10.1155/2023/9452164]
59.Farahi H, Rafie SM, Jahandideh A, Asghari A, Shirazi-Beheshtiha SH. Safety evaluation of tricalcium phosphate/collagen nanocomposite scaffold in bone defect in New Zealand white rabbit model. Crescent Journal of Medical & Biological Sciences. 2019; 6(4):449-54. [Link]
60.Eftekhari H, Jahandideh A, Asghari A, Akbarzadeh A, Hesaraki S. Assessment of polycaprolacton (PCL) nanocomposite scaffold compared with hydroxyapatite (HA) on healing of segmental femur bone defect in rabbits. Artificial Cells, Nanomedicine, and Biotechnology. 2017; 45(5):961-8. [DOI:10.1080/21691401.2016.1198360] [PMID]
61.Dang W, Li T, Li B, Ma H, Zhai D, Wang X, et al. A bifunctional scaffold with CuFeSe2 nanocrystals for tumor therapy and bone reconstruction. Biomaterials. 2018; 160:92-106. [DOI:10.1016/j.biomaterials.2017.11.020] [PMID]
62.Yanagi T, Kajiya H, Kawaguchi M, Kido H, Fukushima T. Photothermal stress triggered by near infrared-irradiated carbon nanotubes promotes bone deposition in rat calvarial defects. Journal of Biomaterials Applications. 2015; 29(8):1109-18.[DOI:10.1177/0885328214556913] [PMID]
63.Ma H, Luo J, Sun Z, Xia L, Shi M, Liu M, et al. 3D printing of biomaterials with mussel-inspired nanostructures for tumor therapy and tissue regeneration. Biomaterials. 2016; 111:138-48. [DOI:10.1016/j.biomaterials.2016.10.005] [PMID]
64.Einhorn TA, Gerstenfeld LC. Fracture healing: Mechanisms and interventions. Nature Reviews. Rheumatology. 2015; 11(1):45-54. [DOI:10.1038/nrrheum.2014.164] [PMID] [PMCID]
65.Liu Y, Luo D, Yu M, Yu Wang, Shanshan Jin, Zixin Li, et al. Thermodynamically controlled self-assembly of hierarchically staggered architecture as an osteoinductive alternative to bone autografts. Advanced Functional Materials. 2019; 29(10):1806445. [DOI:10.1002/adfm.201806445]
66.Ma L, Feng X, Liang H, Yu Song, Lei Tan, Bingjin Wang, et al. A novel photothermally controlled multifunctional scaffold for clinical treatment of osteosarcoma and tissue regeneration. Materials Today. 2020; 36:48-62. [DOI:10.1016/j.mattod.2019.12.005]
67.Zhang X, Zhang C, Lin Y, Hu P, Shen Y, Wang K, et al. Nanocomposite membranes enhance bone regeneration through restoring physiological electric microenvironment. ACS Nano. 2016; 10(8):7279-86. [DOI:10.1021/acsnano.6b02247] [PMID]
68.Mobini S, Leppik L, Thottakkattumana Parameswaran V, Barker JH. In vitro effect of direct current electrical stimulation on rat mesenchymal stem cells. PeerJ. 2017; 5:e2821.[DOI:10.7717/peerj.2821] [PMID] [PMCID]
69.Bandyopadhyay A, Shivaram A, Mitra I, Bose S. Electrically polarized TiO2 nanotubes on Ti implants to enhance early-stage osseointegration. Acta Biomaterialia. 2019; 96:686-93. [DOI:10.1016/j.actbio.2019.07.028] [PMID] [PMCID]
70.Mushtaq F, Torlakcik H, Vallmajo-Martin Q, Siringil EC, Zhang J, Röhrig C, et al. Magnetoelectric 3D scaffolds for enhanced bone cell proliferation. Applied Materials Today. 2019; 16:290-300. [DOI:10.1016/j.apmt.2019.06.004]
71.Kapat K, Shubhra QT, Zhou M, Leeuwenburgh S. Piezoelectric nano-biomaterials for biomedicine and tissue regeneration. Advanced Functional Materials. 2020; 30(44):1909045.[DOI:10.1002/adfm.201909045]
72.Zhu Y, Yang Q, Yang M, Zhan X, Lan F, He J, et al. Protein corona of magnetic hydroxyapatite scaffold improves cell proliferation via activation of mitogen-activated protein kinase signaling pathway. ACS Nano. 2017; 11(4):3690-704. [DOI:10.1021/acsnano.6b08193] [PMID]
73.Xu HY, Gu N. Magnetic responsive scaffolds and magnetic fields in bone repair and regeneration. Frontiers of Materials Science. 2014; 8:20-31. [DOI:10.1007/s11706-014-0232-1]
74.Sapir-Lekhovitser Y, Rotenberg MY, Jopp J, Friedman G, Polyak B, Cohen S. Magnetically actuated tissue engineered scaffold: Insights into mechanism of physical stimulation. Nanoscale. 2016; 8(6):3386-99. [DOI:10.1039/C5NR05500H] [PMID] [PMCID]
75.Chaudhuri O, Koshy ST, Branco da Cunha C, Shin JW, Verbeke CS, Allison KH, et al. Extracellular matrix stiffness and composition jointly regulate the induction of malignant phenotypes in mammary epithelium. Nature Materials. 2014; 13(10):970-8. [DOI:10.1038/nmat4009] [PMID]
76.Steinmetz NJ, Aisenbrey EA, Westbrook KK, Qi HJ, Bryant SJ. Mechanical loading regulates human MSC differentiation in a multi-layer hydrogel for osteochondral tissue engineering. Acta Biomaterialia. 2015; 21:142-53. [DOI:10.1016/j.actbio.2015.04.015] [PMID]
77.Hu Q, Liu M, Chen G, Xu Z, Lv Y. Demineralized bone scaffolds with tunable matrix stiffness for efficient bone integration. ACS Applied Materials & Interfaces. 2018; 10(33):27669-80. [DOI:10.1021/acsami.8b08668] [PMID]
78.Papachroni KK, Karatzas DN, Papavassiliou KA, Basdra EK, Papavassiliou AG. Mechanotransduction in osteoblast regulation and bone disease. Trends in Molecular Medicine. 2009; 15(5):208-16. [DOI:10.1016/j.molmed.2009.03.001] [PMID]
79.Jiang S, Wang M, He J. A review of biomimetic scaffolds for bone regeneration: Toward a cell-free strategy. Bioengineering & Translational Medicine. 2020; 6(2):e10206. [DOI:10.1002/btm2.10206] [PMID] [PMCID]
80.Stewart C, Akhavan B, Wise SG, Bilek MM. A review of biomimetic surface functionalization for bone-integrating orthopedic implants: Mechanisms, current approaches, and future directions. Progress in Materials Science. 2019; 106:100588. [DOI:10.1016/j.pmatsci.2019.100588]
81.Kossover O, Cohen N, Lewis JA, Berkovitch Y, Peled E, Seliktar D. Growth factor delivery for the repair of a critical size tibia defect using an acellular, biodegradable polyethylene glycol-albumin hydrogel implant. ACS Biomaterials Science & Engineering. 2020; 6(1):100-11. [DOI:10.1021/acsbiomaterials.9b00672] [PMID]
82.Sonbolekar H, Jahandideh A, Asghari A, Hesaraki S, Akbarzadeh, A. [Evaluation of the performance of titanium dioxide nanocomposite scaffold compared to hydroxyapatite on the healing of rabbit femoral bone defects (Persian)]. Journal of Comparative Pathology. 2023; 20(1):4011-8. [Link]
83.Yazdanian A, Jahandideh A, Hesaraki S. The effect of green synthesis of TiO2 nanoparticles/collagen/HA scaffold in bone regeneration: As an animal study. Veterinary Medicine and Science. 2023; 9(5):2342-51. [DOI:10.1002/vms3.1222] [PMID] [PMCID]
84.Zhang L, Dong Y, Xue Y, Shi J, Zhang X, Liu Y, et al. Multifunctional triple-layered composite scaffolds combining platelet-rich fibrin promote bone regeneration. ACS Biomaterials Science & Engineering. 2019; 5(12):6691-702. [DOI:10.1021/acsbiomaterials.9b01022] [PMID]
85.Yassin MA, Fuoco T, Mohamed-Ahmed S, Mustafa K, Finne-Wistrand A. 3D and porous RGDC-functionalized polyester-based scaffolds as a niche to induce osteogenic differentiation of human bone marrow stem cells. Macromolecular Bioscience. 2019; 19(6):e1900049. [DOI:10.1002/mabi.201900049] [PMID]
86.Dos Santos BP, Garbay B, Fenelon M, Rosselin M, Garanger E, Lecommandoux S, et al. Development of a cell-free and growth factor-free hydrogel capable of inducing angiogenesis and innervation after subcutaneous implantation. Acta Biomaterialia. 2019; 99:154-67. [DOI:10.1016/j.actbio.2019.08.028] [PMID]
87.Zeng Y, Shih YR, Baht GS, Varghese S. In vivo sequestration of innate small molecules to promote bone healing. Advanced Materials. 2020; 32(8):1906022. [DOI:10.1002/adma.201906022]
88.Wang Y, Hu X, Dai J, Wang J, Tan Y, Yang X, et al. A 3D graphene coated bioglass scaffold for bone defect therapy based on the molecular targeting approach. Journal of Materials Chemistry. 2017; 5(33):6794-800. [DOI:10.1039/C7TB01515A] [PMID]
89.Eckhart KE, Holt BD, Laurencin MG, Sydlik SA. Covalent conjugation of bioactive peptides to graphene oxide for biomedical applications. Biomaterials Science. 2019; 7(9):3876-85. [DOI:10.1039/C9BM00867E] [PMID]
90.Yan S, Yin J, Cui L, Yang Y, Chen X. Apatite-forming ability of bioactive poly(l-lactic acid)/grafted silica nanocomposites in simulated body fluid. Colloids and Surfaces. B, Biointerfaces. 2011; 86(1):218-24. [DOI:10.1016/j.colsurfb.2011.04.004] [PMID]
91.Wang SJ, Jiang D, Zhang ZZ, Chen YR, Yang ZD, Zhang JY, et al. Biomimetic Nanosilica-Collagen Scaffolds for In Situ Bone Regeneration: Toward a cell-free, one-step surgery. Advanced Materials. 2019; 31(49):e1904341. [DOI:10.1002/adma.201904341] [PMID]
92.Lodoso-Torrecilla I, van Gestel NAP, Diaz-Gomez L, Grosfeld EC, Laperre K, Wolke JGC, et al. Multimodal pore formation in calcium phosphate cements. Journal of Biomedical Materials Research. Part A. 2018; 106(2):500-9. [DOI:10.1002/jbm.a.36245] [PMID] [PMCID]
93.Wubneh A, Tsekoura EK, Ayranci C, Uludağ H. Current state of fabrication technologies and materials for bone tissue engineering. Acta Biomaterialia. 2018; 80:1-30. [DOI:10.1016/j.actbio.2018.09.031] [PMID]
94.Ding W, Ge Y, Zhang T, Zhang C, Yin X. Advanced construction strategies to obtain nanocomposite hydrogels for bone repair and regeneration. NPG Asia Materials. 2024; 16(1):14.[DOI:10.1038/s41427-024-00533-z]
95.Wang B, Ye X, Chen G, Zhang Y, Zeng Z, Liu C, et al. Fabrication and properties of PLA/β-TCP scaffolds using liquid crystal display (LCD) photocuring 3D printing for bone tissue engineering. Frontiers in Bioengineering and Biotechnology. 2024; 12:1273541. [DOI:10.3389/fbioe.2024.1273541] [PMID] [PMCID]
متن کامل: (1615 مشاهده)
مقدمه
بهرغم چشمانداز امیدوارکننده درمانهای سلولی، کاربرد مهندسی بافت و سلولهای بنیادی هنوز به واقعیت بالینی دست نیافته است. در بسیاری از موارد، ازجمله انتخاب، تحویل، زنده ماندن و پایداری سلولها، وقت گیر بودن درمان، مسائل نظارتی و هزینههای بالا و اخذ مجوزهای دستگاههای نظارتی بهداشتی برای رعایت اخلاق در پزشکی محدودیتهایی را برای این شاخه درمانی ایجاد کردهاند [1-3]. با این اوصاف، زمینه زیست موادهای بدون سلول در حال پیشرفت و در حال تبدیل شدن به یک جایگزین عملی برای درمانهای مبتنی بر سلول است. پیش از این، مواد بدون سلول تنها بهعنوان پرکنندهای برای نقایص بافتی در نظر گرفته میشدند، اما اکنون میتوان آنها را در داربستهایی استفاده کرد که با سلولها و بافتهای اطراف تعامل کنند تا فرایندهای بهبودی سنتی ناشی از بیماری یا تروما را تغییر دهند. بررسی رویکرد بدون سلولی با استفاده از بیومواد بدون سلول ازطریق استراتژیهای فیزیکی و شیمیایی اصلاح شده و استفاده از ظرفیت بازسازی بافت ازطریق تعامل با سلولهای بنیادی و بافتهای اطراف میتواند به ارتقای کیفیت ترمیمی قابلقبولی منجر شود [4].
روشها
در این مطالعه جستوجوی مقالات با استفاده از کلید واژههای bioscaffold, bone materials, biological materials, bone repair در بانکهای اطلاعاتی وبآوساینس، پابمد، اسکوپوس و گوگلاسکالر و از سال 2008 تا 2023 انجام شد و نهایتاً 95 مقاله انتخاب و مورد بررسی قرار گرفت.
یافتهها
ماتریکس استخوان از اجزای معدنی (هیدروکسی آپاتیت) و اجزای آلی تشکیل شده است که میتوانند با زیستسازگاری فوقالعادهای که دارند در سامانههای شبیهسازیشده بهطور گستردهای مورد استفاده قرار گیرند. یونهایی مثل Zn2+ و Sr2+،Si4+ یا مواد طبیعی یا پلیمری دیگر و یا حتی مواد بیوسرامیک، میتوانند در هیدروکسی آپاتیت کاشته شوند. این عمل بهطور مؤثری فرایند کانیسازی استخوان طبیعی را تقلید میکند و ازاینرو باعث تحریک روند هدایت استخوانی میشود. گزارش شده است که سلولزدایی از ماتریکس خارجسلولی و کاشت آن در داربست فسفات کلسیم در تحریک فعالیت زیست داربستها و ایجاد ریزمحیط مناسب برای بازسازی بافت، بهویژه استخوانسازی مؤثر بوده است [5-10]. با فناوری چاپ سهبعدی میتوان ویژگیهای توپولوژیکی مواد تشکیلدهنده زیست داربستها را کنترل کرد. با این شیوه میتوان زیست داربستهای مختلفی با تغییرات در زبری سطح و تراز رشتهها و ساختارهای منفذی بههمپیوسته را که دارای مهندسی سهبعدی پیچیدهای هستند، تولید کرد. با تقلید از ویژگیهای میکرو / نانو ساختاری بافتهای استخوانی، وقایع سلولی مانند مهاجرت، چسبندگی، تکثیر و همچنین تمایز سلولی را میتوان تنظیم و بازسازی استخوان را بیشتر کرد. علاوهبر سیگنالهای بیوشیمیایی، محرکهای فیزیکی محیطی، مانند عوامل الکتریکی و مغناطیسی نیز میتوانند بر سلولها تأثیر بگذارند و باعث بازسازی بیشتر استخوان شوند. براساس گزارشهای قبلی، بافت استخوانی که دارای خواص پیزوالکتریک است، میتواند پتانسیلهایی را در پاسخ به محرکهای مکانیکی ایجاد کرده و ظرفیت رشد استخوان را افزایش دهد. هیدروژلهایی که دارای تنشهای انعطافپذیر و قابلتنظیم هستند میتوانند به رفتار سلولها جهت بدهند. مشخص شده است که در سلولهای کشتشده در ژلها انتشار سلولهای بنیادی مزانشیمی سریعتر بوده و همچنین تکثیر و تمایز استخوانی سلولها تقویت میشوند. فاکتورهای ذاتی رشد را میتوان با نیروهایی که سبب فراخوانی سلولها میشوند تحریک کرد. در فناوری تولید آپتامر انعطافپذیر از این ویژگی برای شبیهسازی کمپلکس فاکتور رشد ـ بتا استفاده شده است. بنابراین نیروهای فراخواننده سلولی میتوانند بهعنوان محرکهایی عمل کنند که پاسخهای بیولوژیکی خاصی را فعال میکنند و ازاینرو کاربردهای بالقوهای در تحقیقات زیستی و پزشکی بازساختی دارند [11-14]. در سالهای اخیر، مواد زیست تخریبپذیر اصلاح شده ازنظر حرارتی، ترمودینامیکی کنترلشده و فوتولومینسانس توسط محققان طراحی شدهاند. بازسازی بافت به بیوانرژتیکهای سلولی وابسته است که در داخل داربستهای دارای مواد فعال بیوانرژیک، پتانسیل غشای میتوکندری را برای ایجاد سطوح بیوانرژیک بالا برده و سبب تسریع بیشتر و بهبود کیفیت ترمیم استخوان میشوند. ازنظر بالینی برای درمان همزمان استئوسارکوم و بازسازی بافت استخوانی، یک داربست چندمنظوره ابتکاری با ویژگیهای کنترلشده دما گزارش شدهاست که میتواند بهطور مؤثر سلولهای استئوسارکوم انسانی را در دمای 48 درجه سانتیگراد از بین ببرد، درحالیکه استخوانزایی سلولهای بنیادی مزانشیمی را در دمای 42/5±0 درجه سانتیگراد با استفاده از تابش نور مادون قرمز با طول موج 808 نانومتر افزایش دهد [5، 6، 14].
هدف از این مطالعه مروری، توصیف ساخت و استفاده از داربستهای زیستی و مواد استخوانی شبیهسازیشده بیولوژیکی ازجمله روشهای مختلف مورداستفاده و ساختار آنها، از مقیاس میکرو تا مقیاس بزرگ است که بهمنظور ارتقای اصلاح فیزیکی و شیمیایی ویژگیهای سطح ساختاری، برای تنظیم رشد استخوان طراحی شدهاند. آخرین پیشرفتها در استراتژیهای شبیهسازیشده بیولوژیکی، ازجمله کاشت یونی، سلولزدایی ماتریکس خارجسلولی و تحریک فیزیکی محیط، از مقیاس میکرو / نانو تا مقیاس ماکرو و همچنین مزایای دیگر مواد داربست مورد بحث و بررسی قرار گرفته است. پاسخهای سلولی به این داربستها در شرایط آزمایشگاهی و همچنین فرایند دروناندامی تشکیل استخوان جدید تولیدشده توسط این استراتژیها نیز مورد بحث قرار گرفتهاند. با شناخت دقیق از پیشرفتهای اخیر در این زمینهها، میتوان استراتژیهای لازم برای جهتگیریهای آتی بهمنظور طراحی مواد داربستی شبیهسازیشده بیولوژیکی با هدف ارتقای تغییرات رفتاری سلولی در بهینهسازی فرایند بازسازی بافت استخوانی را تعریف کرد [15].
داربستهای با عملکرد یون شبیهسازیشده بیولوژیکی
چندین یون معدنی کمیاب کشف شدهاند که به بازسازی بافت استخوان کمک میکنند. این امر محققان را بر آن داشته است تا محصولات مختلف زیستفعال شیشهای، روشهای دوپه کردن، تولید هیدروکسی آپاتیت مصنوعی و سایر مواد شامل مواد طبیعی/پلیمری را مورد بررسی قرار دهند. در مقایسه با سایر روشهای تحریک استخوانزایی، برتری استفاده از یونهای معدنی برای تسهیل ترمیم ترومای استخوانی از چندین جهت مورد توجه است که ازجمله به مقرونبهصرفه بودن، پایداری و سادگی در تولید و استفاده و اثربخشی فوقالعاده در غلظتهای پایین میتوان اشاره کرد [11].
نانو کامپوزیتهای دوپه شده با یون
محققین با استفاده از سیستم SiO2-CaO با یونهای Zn2+ که در نانوذرات شیشهای زیستفعال آلایش شده بودند، نانوذرات شیشهای زیستفعال متخلخل ساختند. این نانوذرات بهتدریج یونهای روی را به محیط آزاد کرده و همچنین توانایی بالایی برای جذب پروتئینها دارند. در میان یونهای مختلف فلزی زیستفعال آزمایششده، استرانسیوم به دلیل شباهت ساختاری و فیزیکوشیمیایی آن به کلسیم و تقویت بازسازی استخوان و مهار تحلیل استخوان، بهطور گستردهای درزمینه ترمیم استخوان مورد بررسی قرار گرفته است. دانشمندان یک داربست کیتوزانی نانوهیبریدی SrHAP با فناوری خشک کردن انجمادی ابداع کردهاند. نانوکریستالهای SrHAP میتوانند بهطور یکنواخت در داربستها پراکنده شوند و با آزادسازی یونهای Sr2+، تکثیر سلولی و تمایز استخوانی را بهبود بخشند [16]. مائو و همکاران (2019) با استفاده از کلسیم فسفات آمورف و یک زیستشیشه متشکل از بتا تریکلسیم فسفات و سیلیکات کلسیم، ذرات زیستفعال ترمیم استخوانی را ساختند که توانست بازسازی استخوان را افزایش دهد [17]. ذرات زیستفعال ترمیم استخوانی، ازجمله زئولیتها سبب القای استخوانی و هدایت استخوانی مشخصی در روند ترمیم استخوان آلوئول شدهاند [18-23]. از میان اثرات یون منیزیم، تأثیر مستقیم آن بر استخوانزایی قابلتوجه است. یوشیوازا و همکاران دریافتند که Mg2+ کانیسازی ماتریکس خارجسلولی را در سلولهای مزانشیمی مغز استخوان انسان بهبود میبخشد و بیان کلاژن-X و فاکتور رشد اندوتلیال عروقی را افزایش میدهد [24]. هانگ و همکاران نشان دادند Mg2+ قبل از ایجاد تمایز سلولهای مزانشیمی مغز استخوان به استئوبلاستها، یک اثر استخوانزایی در مغز استخوان ایجاد میکند [24]. مشخص شده است محصولات زیستفعال یونی اثرات مفیدی بر فعالیتهای سلولی دارند که نشان میدهد یونهای کلسیم و فسفات آزاد ممکن است تمایز استخوانی استئوبلاستها را تقویت کنند [24-29]. کوئینگ و همکاران (2017) دریافتند نانوذرات نقره میتوانند تکثیر و تمایز سلولهای استئوبلاستی را تسهیل کنند و به تنظیم مثبت ساختار استخوان و نشانگرهای تنظیمی کمک کنند. همچنین براساس مطالعات دیگر این داربستهای نانوکامپوزیتی بهطور مؤثری عفونت را از بین میبرند و از تشکیل بیوفیلم جلوگیری کرده و ترمیم استخوان را تسهیل میکنند [30-32]. آزمایشهای بروناندامی نشان دادند قرار گرفتن سلولهای مزانشیمی مغز استخوان در معرض غلظتهای بالای آهن ممکن است اثرات منفی مانند اختلال در تمایز نسبت به دودمان استخوانی داشته باشد. در مقابل، اثرات مثبت نانوذرات اکسید آهن بر تمایز استخوانی سلولهای مزانشیمی مغز استخوان انسانی در شرایط آزمایشگاهی گزارش شده است [32]. علاوهبراین ژائو و همکاران (2012) اثرات غلظت کم و زیاد آهن بر روی استئوبلاستها را گزارش دادند و دریافتند تمایز استئوبلاستی به دلیل افزایش غلظت آهن به روشی وابسته به غلظت مهار میشود درحالیکه کمبود آهن خفیف باعث افزایش فعالیت سلولی میشود [33].
پتانسیل داربستهای ماتریکس خارجسلولی بدون سلول
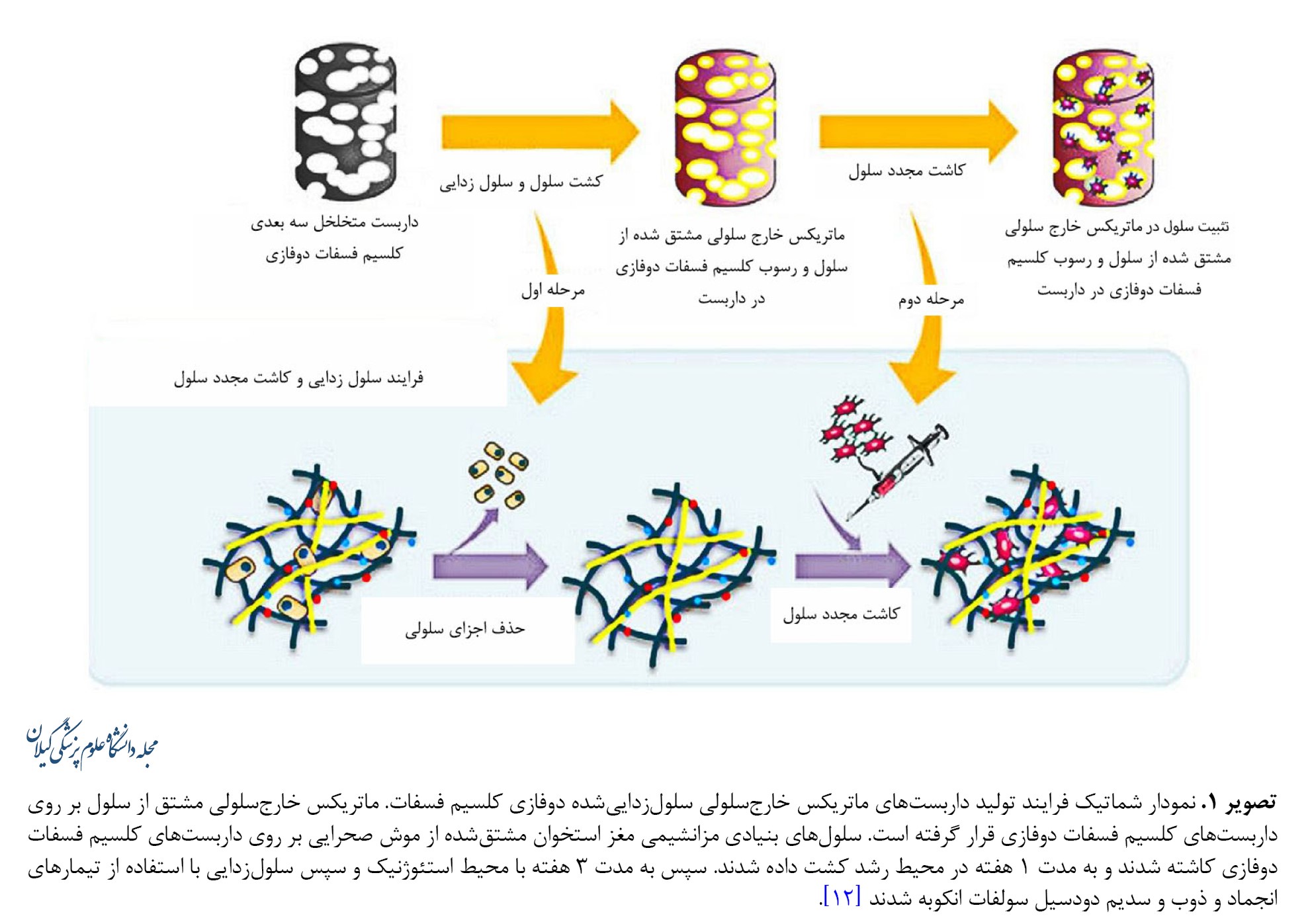
ماتریکس خارجسلولی شبکه پیچیدهای از مولکولهای ساختاری و عملکردی است که توسط سلولها ترشح میشود. تمام بافتها و اندامها عمدتاً از سلولها و ماتریکس خارجسلولی تشکیل شدهاند. پروتئوگلیکانها و گلیکوزآمینوگلیکانها، پروتئینهای رشتهای، مانند کلاژن و الاستین و پروتئینهای چسبنده مانند لامینین، ویترونکتین و فیبرونکتین اجزای اصلی ماتریکس خارجسلولی را تشکیل میدهند. ماتریکس خارجسلولی استخوان دارای هر دو ترکیب معدنی و آلی است. بخش معدنی، متشکل از کلسیم، کربنات کلسیم و فسفات است که با نام هیدروکسی آپاتیت شناخته میشود و منبع استحکام استخوان است. درحالیکه بخش آلی که بیشتر از کلاژن نوع I تشکیل شده است، به ترتیب انعطافپذیری و چسبندگی را برای بافت و سلول فراهم میکند. استخوان سلولزداییشده به دلیل توانایی در حذف اجزای سلولی و آنتیژن و خواص استخوانزایی و بیومکانیکی و همچنین شباهت فیزیولوژیکی به ماتریکس استخوان، اغلب بهعنوان یک داربست در مهندسی بافت استخوان مورد استفاده قرار میگیرد [34، 35]. اثرات مفید و مؤثر داربست فسفات کلسیم دوفازی همراه با ماتریکس خارجسلولی بدون سلول در مهندسی بافت استخوان گزارش شده است [36-39]. سلولهای مزانشیمی مغز استخوان موش به مدت 3 هفته روی داربستهای متخلخل فسفات کلسیم دوفازی کشت داده شدند و برای مطالعه در شرایط آزمایشگاهی مورد استفاده قرار گرفتند. نتایج نشان داد این داربست فعالیت زیستی را افزایش داده و همچنین یک ریزمحیط پایدار برای استخوانزایی فراهم میکند (تصویر شماره 1).
بهرغم چشمانداز امیدوارکننده درمانهای سلولی، کاربرد مهندسی بافت و سلولهای بنیادی هنوز به واقعیت بالینی دست نیافته است. در بسیاری از موارد، ازجمله انتخاب، تحویل، زنده ماندن و پایداری سلولها، وقت گیر بودن درمان، مسائل نظارتی و هزینههای بالا و اخذ مجوزهای دستگاههای نظارتی بهداشتی برای رعایت اخلاق در پزشکی محدودیتهایی را برای این شاخه درمانی ایجاد کردهاند [1-3]. با این اوصاف، زمینه زیست موادهای بدون سلول در حال پیشرفت و در حال تبدیل شدن به یک جایگزین عملی برای درمانهای مبتنی بر سلول است. پیش از این، مواد بدون سلول تنها بهعنوان پرکنندهای برای نقایص بافتی در نظر گرفته میشدند، اما اکنون میتوان آنها را در داربستهایی استفاده کرد که با سلولها و بافتهای اطراف تعامل کنند تا فرایندهای بهبودی سنتی ناشی از بیماری یا تروما را تغییر دهند. بررسی رویکرد بدون سلولی با استفاده از بیومواد بدون سلول ازطریق استراتژیهای فیزیکی و شیمیایی اصلاح شده و استفاده از ظرفیت بازسازی بافت ازطریق تعامل با سلولهای بنیادی و بافتهای اطراف میتواند به ارتقای کیفیت ترمیمی قابلقبولی منجر شود [4].
روشها
در این مطالعه جستوجوی مقالات با استفاده از کلید واژههای bioscaffold, bone materials, biological materials, bone repair در بانکهای اطلاعاتی وبآوساینس، پابمد، اسکوپوس و گوگلاسکالر و از سال 2008 تا 2023 انجام شد و نهایتاً 95 مقاله انتخاب و مورد بررسی قرار گرفت.
یافتهها
ماتریکس استخوان از اجزای معدنی (هیدروکسی آپاتیت) و اجزای آلی تشکیل شده است که میتوانند با زیستسازگاری فوقالعادهای که دارند در سامانههای شبیهسازیشده بهطور گستردهای مورد استفاده قرار گیرند. یونهایی مثل Zn2+ و Sr2+،Si4+ یا مواد طبیعی یا پلیمری دیگر و یا حتی مواد بیوسرامیک، میتوانند در هیدروکسی آپاتیت کاشته شوند. این عمل بهطور مؤثری فرایند کانیسازی استخوان طبیعی را تقلید میکند و ازاینرو باعث تحریک روند هدایت استخوانی میشود. گزارش شده است که سلولزدایی از ماتریکس خارجسلولی و کاشت آن در داربست فسفات کلسیم در تحریک فعالیت زیست داربستها و ایجاد ریزمحیط مناسب برای بازسازی بافت، بهویژه استخوانسازی مؤثر بوده است [5-10]. با فناوری چاپ سهبعدی میتوان ویژگیهای توپولوژیکی مواد تشکیلدهنده زیست داربستها را کنترل کرد. با این شیوه میتوان زیست داربستهای مختلفی با تغییرات در زبری سطح و تراز رشتهها و ساختارهای منفذی بههمپیوسته را که دارای مهندسی سهبعدی پیچیدهای هستند، تولید کرد. با تقلید از ویژگیهای میکرو / نانو ساختاری بافتهای استخوانی، وقایع سلولی مانند مهاجرت، چسبندگی، تکثیر و همچنین تمایز سلولی را میتوان تنظیم و بازسازی استخوان را بیشتر کرد. علاوهبر سیگنالهای بیوشیمیایی، محرکهای فیزیکی محیطی، مانند عوامل الکتریکی و مغناطیسی نیز میتوانند بر سلولها تأثیر بگذارند و باعث بازسازی بیشتر استخوان شوند. براساس گزارشهای قبلی، بافت استخوانی که دارای خواص پیزوالکتریک است، میتواند پتانسیلهایی را در پاسخ به محرکهای مکانیکی ایجاد کرده و ظرفیت رشد استخوان را افزایش دهد. هیدروژلهایی که دارای تنشهای انعطافپذیر و قابلتنظیم هستند میتوانند به رفتار سلولها جهت بدهند. مشخص شده است که در سلولهای کشتشده در ژلها انتشار سلولهای بنیادی مزانشیمی سریعتر بوده و همچنین تکثیر و تمایز استخوانی سلولها تقویت میشوند. فاکتورهای ذاتی رشد را میتوان با نیروهایی که سبب فراخوانی سلولها میشوند تحریک کرد. در فناوری تولید آپتامر انعطافپذیر از این ویژگی برای شبیهسازی کمپلکس فاکتور رشد ـ بتا استفاده شده است. بنابراین نیروهای فراخواننده سلولی میتوانند بهعنوان محرکهایی عمل کنند که پاسخهای بیولوژیکی خاصی را فعال میکنند و ازاینرو کاربردهای بالقوهای در تحقیقات زیستی و پزشکی بازساختی دارند [11-14]. در سالهای اخیر، مواد زیست تخریبپذیر اصلاح شده ازنظر حرارتی، ترمودینامیکی کنترلشده و فوتولومینسانس توسط محققان طراحی شدهاند. بازسازی بافت به بیوانرژتیکهای سلولی وابسته است که در داخل داربستهای دارای مواد فعال بیوانرژیک، پتانسیل غشای میتوکندری را برای ایجاد سطوح بیوانرژیک بالا برده و سبب تسریع بیشتر و بهبود کیفیت ترمیم استخوان میشوند. ازنظر بالینی برای درمان همزمان استئوسارکوم و بازسازی بافت استخوانی، یک داربست چندمنظوره ابتکاری با ویژگیهای کنترلشده دما گزارش شدهاست که میتواند بهطور مؤثر سلولهای استئوسارکوم انسانی را در دمای 48 درجه سانتیگراد از بین ببرد، درحالیکه استخوانزایی سلولهای بنیادی مزانشیمی را در دمای 42/5±0 درجه سانتیگراد با استفاده از تابش نور مادون قرمز با طول موج 808 نانومتر افزایش دهد [5، 6، 14].
هدف از این مطالعه مروری، توصیف ساخت و استفاده از داربستهای زیستی و مواد استخوانی شبیهسازیشده بیولوژیکی ازجمله روشهای مختلف مورداستفاده و ساختار آنها، از مقیاس میکرو تا مقیاس بزرگ است که بهمنظور ارتقای اصلاح فیزیکی و شیمیایی ویژگیهای سطح ساختاری، برای تنظیم رشد استخوان طراحی شدهاند. آخرین پیشرفتها در استراتژیهای شبیهسازیشده بیولوژیکی، ازجمله کاشت یونی، سلولزدایی ماتریکس خارجسلولی و تحریک فیزیکی محیط، از مقیاس میکرو / نانو تا مقیاس ماکرو و همچنین مزایای دیگر مواد داربست مورد بحث و بررسی قرار گرفته است. پاسخهای سلولی به این داربستها در شرایط آزمایشگاهی و همچنین فرایند دروناندامی تشکیل استخوان جدید تولیدشده توسط این استراتژیها نیز مورد بحث قرار گرفتهاند. با شناخت دقیق از پیشرفتهای اخیر در این زمینهها، میتوان استراتژیهای لازم برای جهتگیریهای آتی بهمنظور طراحی مواد داربستی شبیهسازیشده بیولوژیکی با هدف ارتقای تغییرات رفتاری سلولی در بهینهسازی فرایند بازسازی بافت استخوانی را تعریف کرد [15].
داربستهای با عملکرد یون شبیهسازیشده بیولوژیکی
چندین یون معدنی کمیاب کشف شدهاند که به بازسازی بافت استخوان کمک میکنند. این امر محققان را بر آن داشته است تا محصولات مختلف زیستفعال شیشهای، روشهای دوپه کردن، تولید هیدروکسی آپاتیت مصنوعی و سایر مواد شامل مواد طبیعی/پلیمری را مورد بررسی قرار دهند. در مقایسه با سایر روشهای تحریک استخوانزایی، برتری استفاده از یونهای معدنی برای تسهیل ترمیم ترومای استخوانی از چندین جهت مورد توجه است که ازجمله به مقرونبهصرفه بودن، پایداری و سادگی در تولید و استفاده و اثربخشی فوقالعاده در غلظتهای پایین میتوان اشاره کرد [11].
نانو کامپوزیتهای دوپه شده با یون
محققین با استفاده از سیستم SiO2-CaO با یونهای Zn2+ که در نانوذرات شیشهای زیستفعال آلایش شده بودند، نانوذرات شیشهای زیستفعال متخلخل ساختند. این نانوذرات بهتدریج یونهای روی را به محیط آزاد کرده و همچنین توانایی بالایی برای جذب پروتئینها دارند. در میان یونهای مختلف فلزی زیستفعال آزمایششده، استرانسیوم به دلیل شباهت ساختاری و فیزیکوشیمیایی آن به کلسیم و تقویت بازسازی استخوان و مهار تحلیل استخوان، بهطور گستردهای درزمینه ترمیم استخوان مورد بررسی قرار گرفته است. دانشمندان یک داربست کیتوزانی نانوهیبریدی SrHAP با فناوری خشک کردن انجمادی ابداع کردهاند. نانوکریستالهای SrHAP میتوانند بهطور یکنواخت در داربستها پراکنده شوند و با آزادسازی یونهای Sr2+، تکثیر سلولی و تمایز استخوانی را بهبود بخشند [16]. مائو و همکاران (2019) با استفاده از کلسیم فسفات آمورف و یک زیستشیشه متشکل از بتا تریکلسیم فسفات و سیلیکات کلسیم، ذرات زیستفعال ترمیم استخوانی را ساختند که توانست بازسازی استخوان را افزایش دهد [17]. ذرات زیستفعال ترمیم استخوانی، ازجمله زئولیتها سبب القای استخوانی و هدایت استخوانی مشخصی در روند ترمیم استخوان آلوئول شدهاند [18-23]. از میان اثرات یون منیزیم، تأثیر مستقیم آن بر استخوانزایی قابلتوجه است. یوشیوازا و همکاران دریافتند که Mg2+ کانیسازی ماتریکس خارجسلولی را در سلولهای مزانشیمی مغز استخوان انسان بهبود میبخشد و بیان کلاژن-X و فاکتور رشد اندوتلیال عروقی را افزایش میدهد [24]. هانگ و همکاران نشان دادند Mg2+ قبل از ایجاد تمایز سلولهای مزانشیمی مغز استخوان به استئوبلاستها، یک اثر استخوانزایی در مغز استخوان ایجاد میکند [24]. مشخص شده است محصولات زیستفعال یونی اثرات مفیدی بر فعالیتهای سلولی دارند که نشان میدهد یونهای کلسیم و فسفات آزاد ممکن است تمایز استخوانی استئوبلاستها را تقویت کنند [24-29]. کوئینگ و همکاران (2017) دریافتند نانوذرات نقره میتوانند تکثیر و تمایز سلولهای استئوبلاستی را تسهیل کنند و به تنظیم مثبت ساختار استخوان و نشانگرهای تنظیمی کمک کنند. همچنین براساس مطالعات دیگر این داربستهای نانوکامپوزیتی بهطور مؤثری عفونت را از بین میبرند و از تشکیل بیوفیلم جلوگیری کرده و ترمیم استخوان را تسهیل میکنند [30-32]. آزمایشهای بروناندامی نشان دادند قرار گرفتن سلولهای مزانشیمی مغز استخوان در معرض غلظتهای بالای آهن ممکن است اثرات منفی مانند اختلال در تمایز نسبت به دودمان استخوانی داشته باشد. در مقابل، اثرات مثبت نانوذرات اکسید آهن بر تمایز استخوانی سلولهای مزانشیمی مغز استخوان انسانی در شرایط آزمایشگاهی گزارش شده است [32]. علاوهبراین ژائو و همکاران (2012) اثرات غلظت کم و زیاد آهن بر روی استئوبلاستها را گزارش دادند و دریافتند تمایز استئوبلاستی به دلیل افزایش غلظت آهن به روشی وابسته به غلظت مهار میشود درحالیکه کمبود آهن خفیف باعث افزایش فعالیت سلولی میشود [33].
پتانسیل داربستهای ماتریکس خارجسلولی بدون سلول
ماتریکس خارجسلولی شبکه پیچیدهای از مولکولهای ساختاری و عملکردی است که توسط سلولها ترشح میشود. تمام بافتها و اندامها عمدتاً از سلولها و ماتریکس خارجسلولی تشکیل شدهاند. پروتئوگلیکانها و گلیکوزآمینوگلیکانها، پروتئینهای رشتهای، مانند کلاژن و الاستین و پروتئینهای چسبنده مانند لامینین، ویترونکتین و فیبرونکتین اجزای اصلی ماتریکس خارجسلولی را تشکیل میدهند. ماتریکس خارجسلولی استخوان دارای هر دو ترکیب معدنی و آلی است. بخش معدنی، متشکل از کلسیم، کربنات کلسیم و فسفات است که با نام هیدروکسی آپاتیت شناخته میشود و منبع استحکام استخوان است. درحالیکه بخش آلی که بیشتر از کلاژن نوع I تشکیل شده است، به ترتیب انعطافپذیری و چسبندگی را برای بافت و سلول فراهم میکند. استخوان سلولزداییشده به دلیل توانایی در حذف اجزای سلولی و آنتیژن و خواص استخوانزایی و بیومکانیکی و همچنین شباهت فیزیولوژیکی به ماتریکس استخوان، اغلب بهعنوان یک داربست در مهندسی بافت استخوان مورد استفاده قرار میگیرد [34، 35]. اثرات مفید و مؤثر داربست فسفات کلسیم دوفازی همراه با ماتریکس خارجسلولی بدون سلول در مهندسی بافت استخوان گزارش شده است [36-39]. سلولهای مزانشیمی مغز استخوان موش به مدت 3 هفته روی داربستهای متخلخل فسفات کلسیم دوفازی کشت داده شدند و برای مطالعه در شرایط آزمایشگاهی مورد استفاده قرار گرفتند. نتایج نشان داد این داربست فعالیت زیستی را افزایش داده و همچنین یک ریزمحیط پایدار برای استخوانزایی فراهم میکند (تصویر شماره 1).
وانگ و همکاران (2017) نشان دادند ماتریکس خارجسلولی مشتق از چربی میتواند با کیتوزان / ژلاتین ترکیب شود و منجر به فراخوانی و رشد سلولهای مزانشیمی مغز استخوان شود. بنابراین برای داربستهای ماتریکس خارجسلولی با خواص مکانیکی ضعیف، ارتباط کیتوزان / ژلاتین با ماتریکس میتواند نهتنها استحکام داربست را افزایش دهد، بلکه فعالیت زیستی داربستهای کامپوزیتی را نیز ارتقا بخشد، این در حالی است که بهطور همزمان توانایی استخوانزایی کیتوزان نیز افزایش مییابد [40]. برخلاف داربستهای ماتریکس خارجسلولی سلولزداییشده، فیبرین غنی از پلاکت که بهعنوان یک حامل فاکتور رشد عمل میکند، بهطور گستردهای درزمینه بازسازی بافت نرم و سخت استفاده شده است. بااینحال، پایداری فعال زیستی فیبرین غنی از پلاکت سلولزداییشده ناشناخته است. چی و همکاران (2019) نشان دادند با ادغام فیبرین غنی از پلاکت سلولزداییشده در داربست کیتوزان / ژلاتین بهطور همافزایی فعالیت زیست داربست کیتوزان / ژلاتین افزایش یافت. همچنین به دلیل خواص زیست سازگار و مکانیکی مناسب داربست کیتوزان / ژلاتین، استحکام فیبرین غنی از پلاکت افزایش یافت [41]. فیبرین غنی از پلاکت سلولزداییشده میتواند چسبندگی، تکثیر و تمایز استخوانی مزانشیمی مغز استخوان را با ایجاد یک ریزمحیط مناسب تقویت کرده و به تبع آن ترمیم استخوان را تسریع کند [42-46].
داربستهای متخلخل سهبعدی با منافذ منظم و همجهت
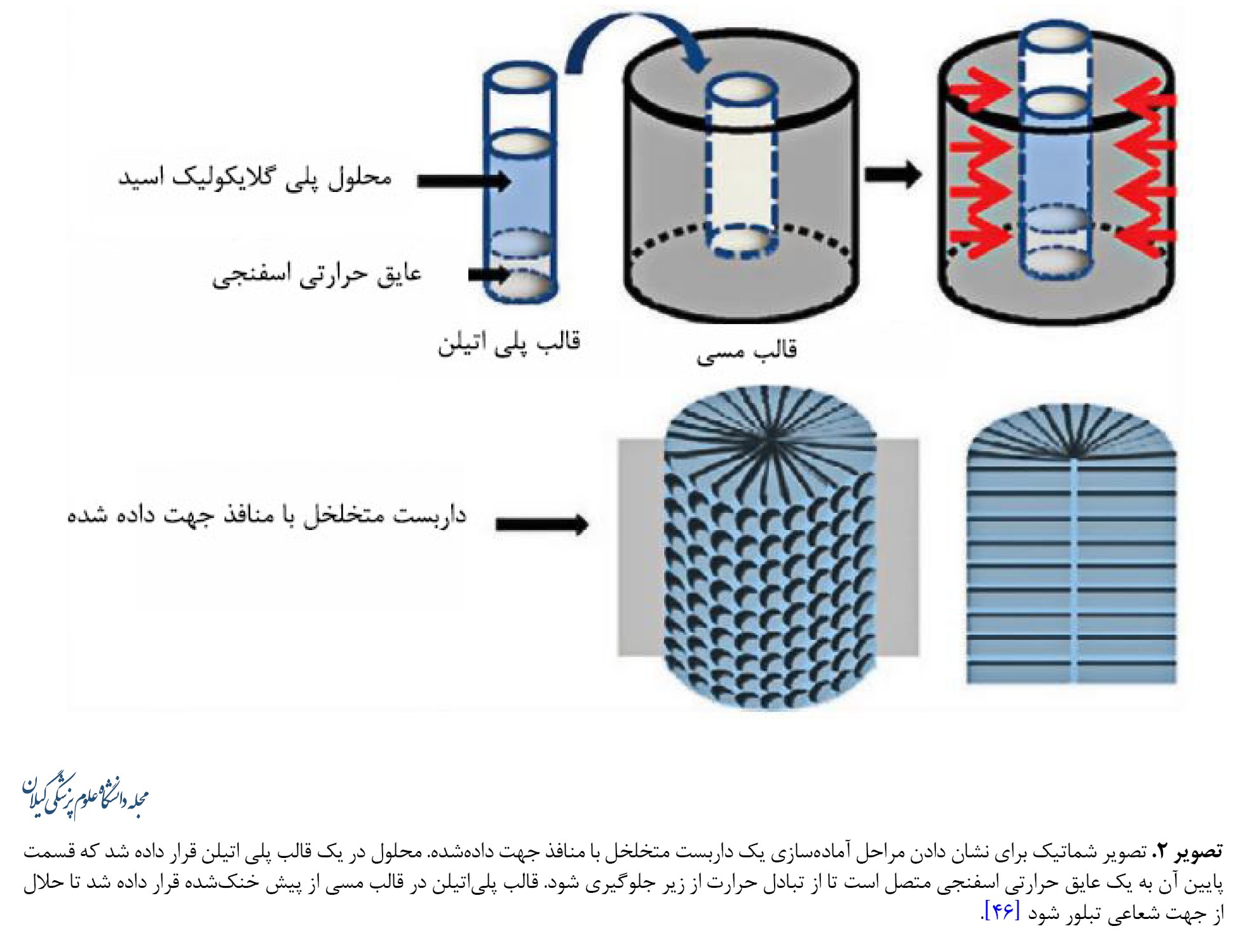
اکثر مطالعات سطوحی را توصیف میکنند که فقط اجازه هدایت یکطرفه را میدهند که منجر به مهاجرت عرضی یا طولی سلولها و ترمیم نامتقارن نقص بافت میشود. بنابراین یک ضرورت برای بازسازی متقارن، تسهیل مهاجرت سلولها به مرکز داربست است. مشخص شده است که داربستهایی با ساختارهای متخلخل جهتدار در این زمینه مؤثر هستند، زیرا منافذ جهتدار قادر به ترویج نفوذ سلولی هستند که امکان بازسازی بافت را هم در داخل بدن و هم در شرایط آزمایشگاهی فراهم میکند. دای و همکاران یک داربست با منافذ شعاعی تهیهشده از نوعی پلیمر پلی گلایکولیک اسید پیشنهاد کردند (تصویر شماره 2).
داربستهای متخلخل سهبعدی با منافذ منظم و همجهت
اکثر مطالعات سطوحی را توصیف میکنند که فقط اجازه هدایت یکطرفه را میدهند که منجر به مهاجرت عرضی یا طولی سلولها و ترمیم نامتقارن نقص بافت میشود. بنابراین یک ضرورت برای بازسازی متقارن، تسهیل مهاجرت سلولها به مرکز داربست است. مشخص شده است که داربستهایی با ساختارهای متخلخل جهتدار در این زمینه مؤثر هستند، زیرا منافذ جهتدار قادر به ترویج نفوذ سلولی هستند که امکان بازسازی بافت را هم در داخل بدن و هم در شرایط آزمایشگاهی فراهم میکند. دای و همکاران یک داربست با منافذ شعاعی تهیهشده از نوعی پلیمر پلی گلایکولیک اسید پیشنهاد کردند (تصویر شماره 2).
شین و همکاران[47] نشان دادند داربستهای فیبری با پلی دوپامین پوشش دادهشده با پلی لاکتیک اسید با تشویق مهاجرت سلولهای بنیادی مزانشیمی انسانی، سبب بهبود کیفیت ترمیم میشود. داربستها با فیبرهای شعاعی از الیافی تشکیل شدهاند که بهصورت شعاعی از محیط به مرکز کشیده میشوند و با پوشش پلیدوپامینی که دارند باعث افزایش مهاجرت سلولی میشوند. این نوع آرایش فیبرها مهاجرت سلولهای بنیادی مزانشیمی انسانی را تشویق کرده و سبب کشیده شدن آنها به سمت مرکز داربست میشوند [47].
داربستهای سهبعدی با ساختارهای نامنظم
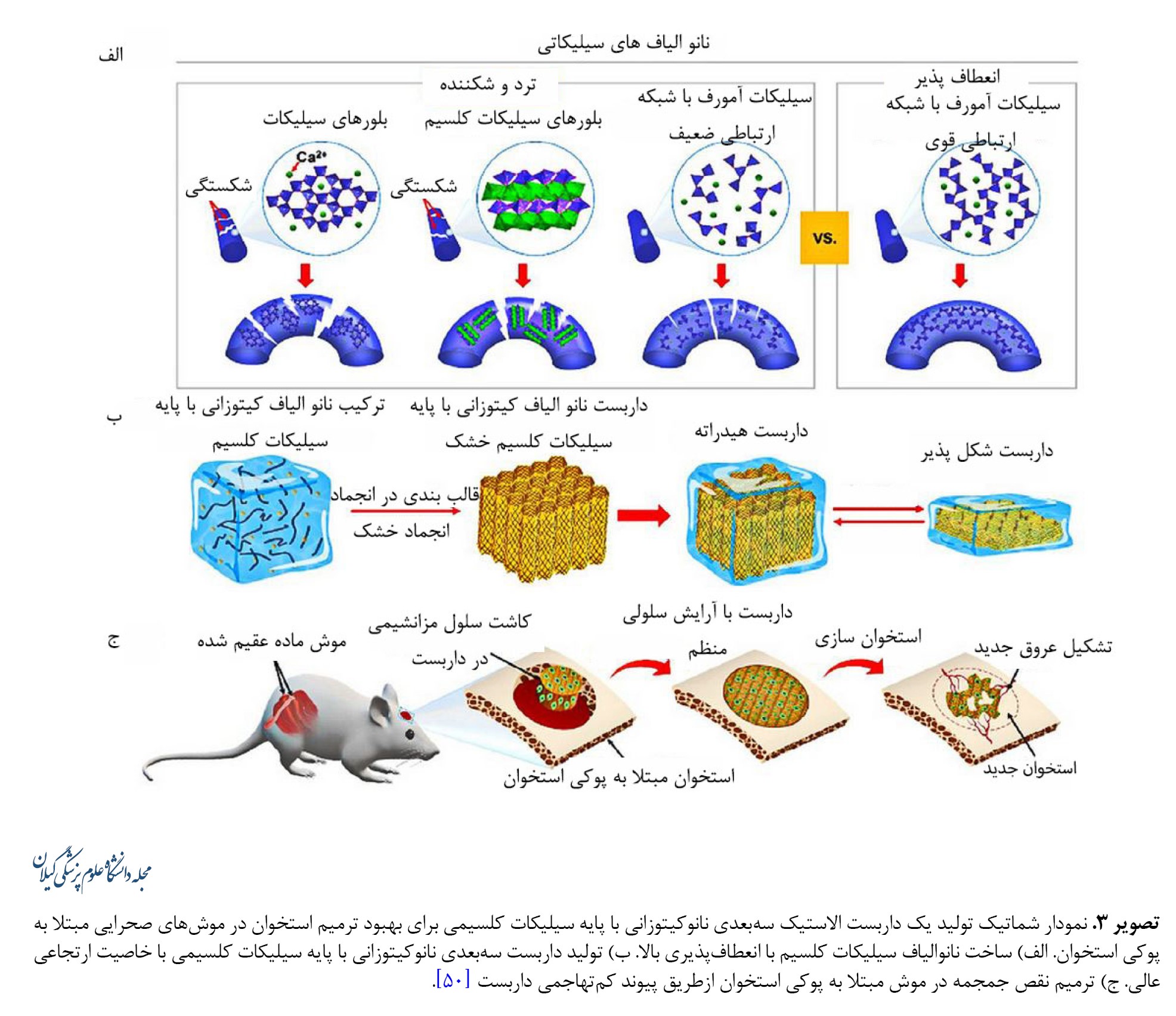
درمان نقایص استخوانی پیچیده و نامنظم و عوارضهای استخوانی همچنان یک چالش بالینی است. اگرچه محصولات متنوعی ازجمله فیلترهای خالی استخوان و داربستهای موقت و همچنین گزارشهایی از بیومواد جدید وجود دارد، اما بسیاری از این محصولات دارای کاستیهای تکنیکی، فنی و ساخت هستند. شواهد نشان میدهد تماس ناکافی با بافت استخوان میزبان بر روی استئواینتگراسیون تأثیر منفی میگذارد. سرامیکها و سیمانها، چه طبیعی و چه مصنوعی، اغلب برای درمان بالینی نقایص استخوانی استفاده میشوند. بااینحال، ماشینکاری سرامیکهای سفت و سخت دشوار است و این نشان میدهد سازههای سرامیکی را نمیتوان بهسادگی در درمان بالینی استفاده و تنظیم کرد تا محل نقص را بهطور صحیح بپوشاند. علاوهبراین ماهیت شکننده سرامیکها کاربرد آنها را محدود کرده است [48, 49]. داربستهای سوپرالاستیک سهبعدی متشکل از نانوالیاف غیرآلی انعطافپذیر که قابلیت خودچسبندگی را دارند تولید شدهاند. در این داربستها نانوالیاف انعطافپذیر سیلیکاتی با لایههای کیتوزانی کپسوله شدهاند. کیتوزان دارای مزایای زیستسازگاری، زیستتخریبپذیری و ضدباکتریایی بوده و بهطور گسترده در مهندسی بافت استفاده میشود. داربستهای نانوکیتوزانی با پایه سیلیکاتی انعطافپذیری، خاصیت ارتجاعی و مقاومت خوبی در برابر خستگی نشان میدهند. نشان داده شده است که این داربستها در ارتقای تمایز سلولهای بنیادی مزانشیمی در شرایط درونتنی و همچنین در محلهای نقص استخوان و ترویج بازسازی استخوان در داخل بدن مؤثر هستند. نانوالیاف شیشهای سیلیکات کلسیم دارای انعطافپذیری و فعالیت زیستی بسیار خوبی ازطریق توانایی خود در تعدیل کریستالیزاسیون و پیکربندی زنجیرهای و غلبه بر شکنندگی ذاتی آنها هستند (تصویر شماره 3).
داربستهای سهبعدی با ساختارهای نامنظم
درمان نقایص استخوانی پیچیده و نامنظم و عوارضهای استخوانی همچنان یک چالش بالینی است. اگرچه محصولات متنوعی ازجمله فیلترهای خالی استخوان و داربستهای موقت و همچنین گزارشهایی از بیومواد جدید وجود دارد، اما بسیاری از این محصولات دارای کاستیهای تکنیکی، فنی و ساخت هستند. شواهد نشان میدهد تماس ناکافی با بافت استخوان میزبان بر روی استئواینتگراسیون تأثیر منفی میگذارد. سرامیکها و سیمانها، چه طبیعی و چه مصنوعی، اغلب برای درمان بالینی نقایص استخوانی استفاده میشوند. بااینحال، ماشینکاری سرامیکهای سفت و سخت دشوار است و این نشان میدهد سازههای سرامیکی را نمیتوان بهسادگی در درمان بالینی استفاده و تنظیم کرد تا محل نقص را بهطور صحیح بپوشاند. علاوهبراین ماهیت شکننده سرامیکها کاربرد آنها را محدود کرده است [48, 49]. داربستهای سوپرالاستیک سهبعدی متشکل از نانوالیاف غیرآلی انعطافپذیر که قابلیت خودچسبندگی را دارند تولید شدهاند. در این داربستها نانوالیاف انعطافپذیر سیلیکاتی با لایههای کیتوزانی کپسوله شدهاند. کیتوزان دارای مزایای زیستسازگاری، زیستتخریبپذیری و ضدباکتریایی بوده و بهطور گسترده در مهندسی بافت استفاده میشود. داربستهای نانوکیتوزانی با پایه سیلیکاتی انعطافپذیری، خاصیت ارتجاعی و مقاومت خوبی در برابر خستگی نشان میدهند. نشان داده شده است که این داربستها در ارتقای تمایز سلولهای بنیادی مزانشیمی در شرایط درونتنی و همچنین در محلهای نقص استخوان و ترویج بازسازی استخوان در داخل بدن مؤثر هستند. نانوالیاف شیشهای سیلیکات کلسیم دارای انعطافپذیری و فعالیت زیستی بسیار خوبی ازطریق توانایی خود در تعدیل کریستالیزاسیون و پیکربندی زنجیرهای و غلبه بر شکنندگی ذاتی آنها هستند (تصویر شماره 3).
علاوهبراین نانوالیاف الاستیک سیلیکات کلسیم با استفاده از همگنسازی و لیوفیلیزاسیون در داربستهای متخلخل سهبعدی که در کیتوزان پلیمری طبیعی پیچیده شدهاند، تقسیم و مونتاژ میشوند (تصویر شماره 3). داربستهای نانوکیتوزانی با پایه سیلیکاتی الاستیک هستند و امکان بازیابی تصویر و زیست کانیسازی را فراهم میکنند. این ویژگیها منجر به افزایش قابلیت بازسازی استخوان میشود که در تحقیقات درونتنی گزارش شده است. داربستهای نانوکیتوزانی با پایه سیلیکاتی الاستیک، بازسازی استخوان و عروقزایی را افزایش میدهند [50-55].
عوامل فیزیکی و داربستهای واکنشی القایی
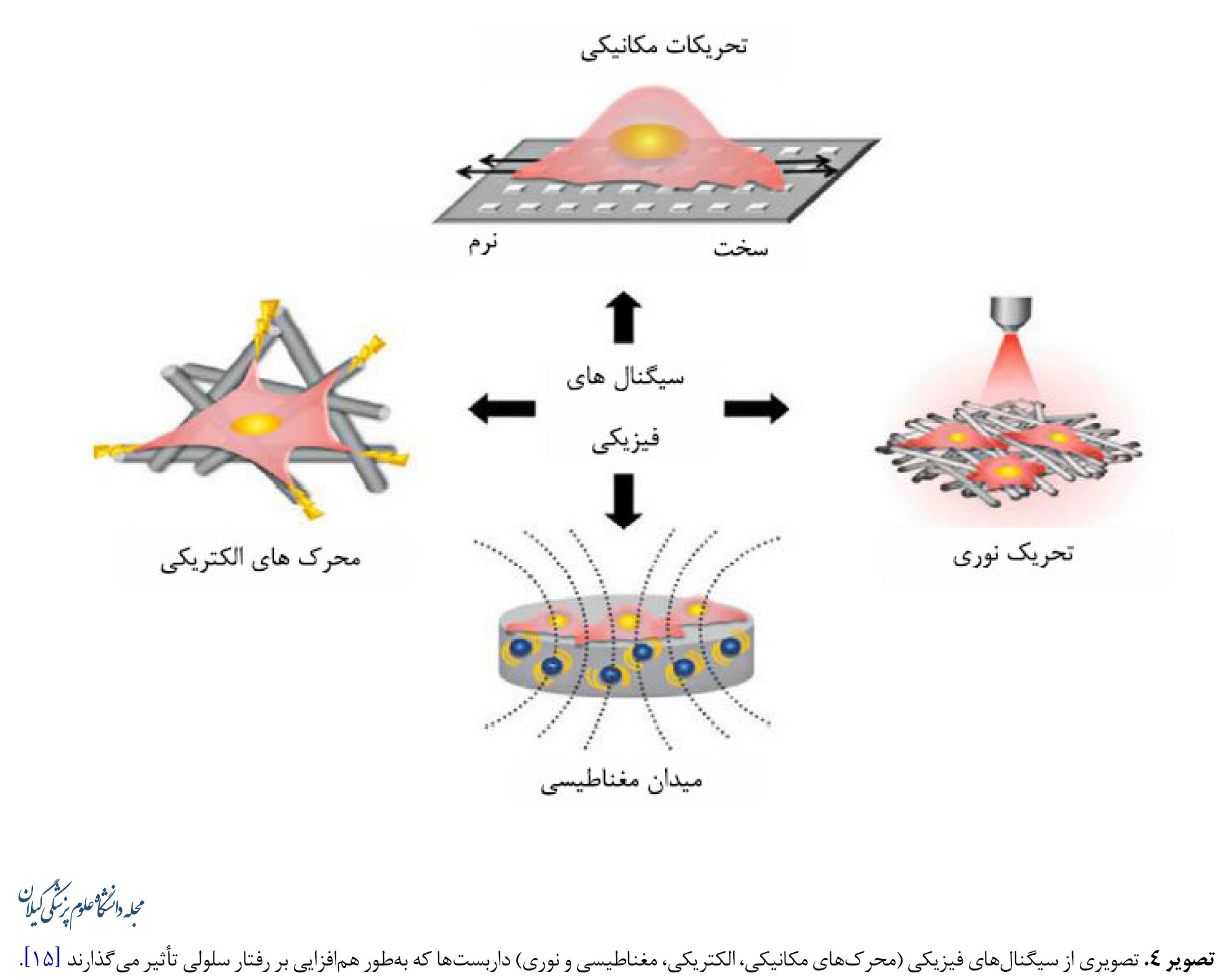
استراتژیهای ساخت داربستها میتوانند بر فرایندهای بیولوژیکی ازجمله بازسازی استخوان تأثیر بگذارند. بنابراین همافزایی ترمیم استخوان در ترکیب محرکهای فیزیکی خارجی با ساختارهای داخلی داربستها، بهویژه ویژگیهایی که به محرکها پاسخ میدهند باید در نظر گرفته شود (تصویر شماره 4) [56-60].
عوامل فیزیکی و داربستهای واکنشی القایی
استراتژیهای ساخت داربستها میتوانند بر فرایندهای بیولوژیکی ازجمله بازسازی استخوان تأثیر بگذارند. بنابراین همافزایی ترمیم استخوان در ترکیب محرکهای فیزیکی خارجی با ساختارهای داخلی داربستها، بهویژه ویژگیهایی که به محرکها پاسخ میدهند باید در نظر گرفته شود (تصویر شماره 4) [56-60].
داربستهای استخوانی با کنترل نوریحرارتی
اخیراً درمان نوریحرارتی برای از بین بردن تومورها و تحریک بازسازی بافت مورد استفاده قرار گرفته است. درمان نوریحرارتی و رادیوتراپی بهطور گسترده در درمان بالینی استفاده میشود که در تلفیق با نانوپزشکی موفقیتآمیز بوده است. مواد زیستی مختلفی با اثرات نوریحرارتی در چند سال گذشته گزارش شدهاند که شامل نانوذرات طلا و نانومواد کربنی هستند. در این میان، اکسید گرافن به دلیل توانایی جذب نور مادون قرمز نزدیک، با عملکرد تبدیل نور حرارتی و زیستسازگاری بالا اثربخشی خوبی از خود نشان داده است. گزارش شده است که یک نانولوله کربنی تحت اثر نوریحرارتی فعالشده با نور مادون قرمز نزدیک، بیان ژن استخوانی را در پیشساز استئوبلاستها افزایش میدهد [61, 62]. داربست کیتوزانی دوکاره پوشیدهشده با درصد نانو هیدروکسی آپاتیت و اکسید گرافن طراحی شده است که توانایی از بین بردن سلولهای استئوسارکوم و بهبود سلولهای استئوبلاستی را داشته و همچنین اثرات مثبت تابش نور مادون قرمز نزدیک بر تکثیر و تمایز سلولهای مزانشیمی مغز استخوان انسانی را نشان داد. مشخص شد نسبت 30 درصد نانو هیدروکسی آپاتیت و اکسید گرافن سازگاری زیستی را بهبود بخشید و یک اثر حرارتی بسیار خوبی در حذف سلولهای استئوسارکوم و تحریک تمایز سلولهای مزانشیمی مغز استخوان انسانی نشان داد. برای ارزیابی بازسازی بافت درونتنی، نتایج حاصل از تصاویر میکرو سیتیاسکن و رنگآمیزی بافت نشان داد داربست کیتوزانی دوکاره پوشیدهشده با درصد نانو هیدروکسی آپاتیت و اکسید گرافن، تشکیل استخوان جدید را بهطور قابلتوجهی در مقایسه با گروه کنترل افزایش داد [63, 64]. علاوهبر داربستهای دو عملکردی با اثر نوریحرارتی، داربستهای پلی اکریلیک اسید ـ کلسیم با انرژی بالا نیز منجر به کانیسازی در نواحی شکاف دارای کمبود کلاژن میشوند. این داربستها با ویژگیهای ساختاری و عملکردی مشابه بافت استخوانی، یک ریزمحیط مفید برای لانهگزینی سلولی و تمایز چندگانه فراهم کرده و همزمان سلولهای بنیادی را نیز برای ترمیم نقص استخوانی به کار میگیرند [65، 66].
داربستهای استخوانی با هدایت الکتریکی و مغناطیسی
یافتههای اخیر نشان دادهاند محرکهای الکتریکی میتوانند سلولهای استخوانی را به مهاجرت، تکثیر و تمایز در مکانهای خاص در شرایط دروناندامی سوق دهند. نتایج بالینی همچنین نشان دادهاند محرکهای الکتریکی میتوانند ترمیم استخوان را ازطریق برهمکنش بین بیوالکتریکها و بیومولکولهای باردار تقویت کنند. ازآنجاییکه ترمیم زخم تحریکشده توسط ریزمحیط الکتریکی بهعنوان نشانهای برای بازسازی استخوان مطرح شدهاست، به نظر میرسد بازیابی ریزمحیط بالقوه فیزیولوژیکی آسیبدیده یک استراتژی مؤثر برای بازسازی استخوان باشد. غشاهای نانوکامپوزیت ریزمحیط الکتریکی شبیهسازیشده بیولوژیکی با پراکندگی همگن نانوذرات فروالکتریک تیتانات باریم در داربست پلیوینیلیدین فلوریدتری فلوئورواتیلن طراحی شده است. ازآنجاییکه غشاهای نانوکامپوزیتی، مانند پریوستوم محل نقص استخوان را میپوشانند، سلولهای مزانشیمی مغز استخوان اطراف میتوانند توسط گالوانوتاکسی جذب شده و ازطریق پتانسیل بیوالکتریک تولیدشده توسط غشاهای کامپوزیت به استئوبلاستها تمایز داده شوند [67-69]. مواد پیزوالکتریک مختلفی نظیر پلیوینیلیدین فلوراید، پلیال لاکتید اپال زیستتخریبپذیر و باریم تیتانات وجود دارند که برای ساختن داربستهایی با ظرفیت سلولهای تحریک الکتریکی تحت تنش مکانیکی (بهویژه نانو زیستمواد پیزوالکتریک) استفاده شدهاند. علاوهبراین، استفاده از میدانهای مغناطیسی برای فعالسازی داربستهای پیزوالکتریک اخیراً به دلیل ویژگی کمتهاجمی و سادگی تهیه آنها مورد توجه قرار گرفته است. اثرات محرکهای الکتریکی ناشی از میدان مغناطیسی بر تکثیر سلولهای استئوبلاست با استفاده از غشاهای دوبعدی و داربستهای سهبعدی به اثبات رسیده است (تصویر شماره 5).
مطالعات آزمایشگاهی مشخص کردهاند میدانهای مغناطیسی میتوانند تمایز استئوبلاستها را تقویت کرده و ترمیم استخوان را بهبود بخشند. مکانیسمهای اساسی پاسخ متقابل بین داربستهای مغناطیسی و سلولها یا بافتها هنوز کاملاً روشن نشدهاند. یک فرضیه این است که نانوذرات مغناطیسی خواص فیزیکی مانند ویژگیهای مکانیکی، آبدوستی و سرعت تخریب را بهبود میبخشند، بنابراین چسبندگی سلولی و بازسازی استخوان را افزایش میدهند. دلیل احتمالی دیگر ممکن است ایجاد یک میدان مغناطیسی داخلی ناشی از ترکیب نانوذرات مغناطیسی باشد که در نتیجه بر رفتار سلول تأثیر میگذارند [70-72]. بااینحال، مکانیسمهای اساسی درمورد اینکه چگونه میدانهای مغناطیسی خارجی باعث ایجاد استخوانزایی و رگزایی میشوند هنوز ناشناخته باقی مانده و فرض بر این است که تغییر تصویرهای کوچک ناشی از داربستهای مغناطیسی ممکن است نیروهای خمشی و کششی ایجاد کند و بتواند سلولها را بهطور مکانیکی تحریک کند [73, 74].
داربستهای استخوانی مکانیکی
اثر نشانههای مکانیکی بر رفتار سلول برای حفظ هموستاز بافت استخوان مهم است. مشخص شده است هیدروژلها میتوانند تحت تأثیر عوامل مکانیکی و خارجی بهعنوان یک بستر مزانشیمی برای تبادل مواد معدنی و کلاژنها در ترمیم استخوان عمل کنند. بنابراین ویژگی حساسیت مکانیکی سلول به بستر ازطریق اعمال استرس، یک پارامتر مفید برای مواد زیستی در ترمیم استخوان است [75]. مطالعه دیگری نشان داد محرکهای مکانیکی در شرایط درونتنی میتوانند باعث تشکیل استخوان با درجه معدنی شدن بالا شوند. تمایز سلولهای بنیادی مزانشیمی انسان را میتوان با محرکهای مکانیکی که باعث بیان کلاژن نوع 1 و همچنین تشکیل رسوبات معدنی در لایه استخوانی یک هیدروژل استئوکندرال میشود، تنظیم کرد [76]. داربستهایی که سیگنالهای مکانیکی مفیدی را ازطریق نشانههای فیزیکی، مانند سختی و سایر خواص مکانیکی نشان میدهند، میتوانند نیروهای مکانیکی داخلی را برای تسهیل تمایز سلول ایجاد کنند. بهعنوان مثال سلولها وقتی روی بسترهای سفتتر (20 تا 80 کیلو پاسکال) رشد کردند، احتمال بیشتری برای تبدیل شدن به سلولهای استخوانی داشتند. در یک مطالعه با هدف بررسی اثر سفتی نانو داربستهای سهبعدی بر استرس و کانیسازی در سلولهای شبهاستئوبلاست، داربستهای سهبعدی با سطوح پوشش دادهشده با تیتانیوم تحت شرایط ریزمحیطی بهینه، رشد سلول را تسهیل کردند. هم آزمایشهای برونتنی با سلولها و هم آزمایشهای درونتنی با کاشت زیرجلدی در موشها نشان داد داربستهای با تحریک مکانیکی میتوانند استخوانزایی و بازسازی استخوان را تقویت کنند. اگرچه مشخص است که سلولهای بنیادی مزانشیمی و استئوبلاستها هم به توپوگرافی و هم به سفتی بستر پاسخ میدهند، ولی مکانیسم دقیق هنوز در حال بررسی است [77, 78].
سایر داربستهای استخوان بدون سلول
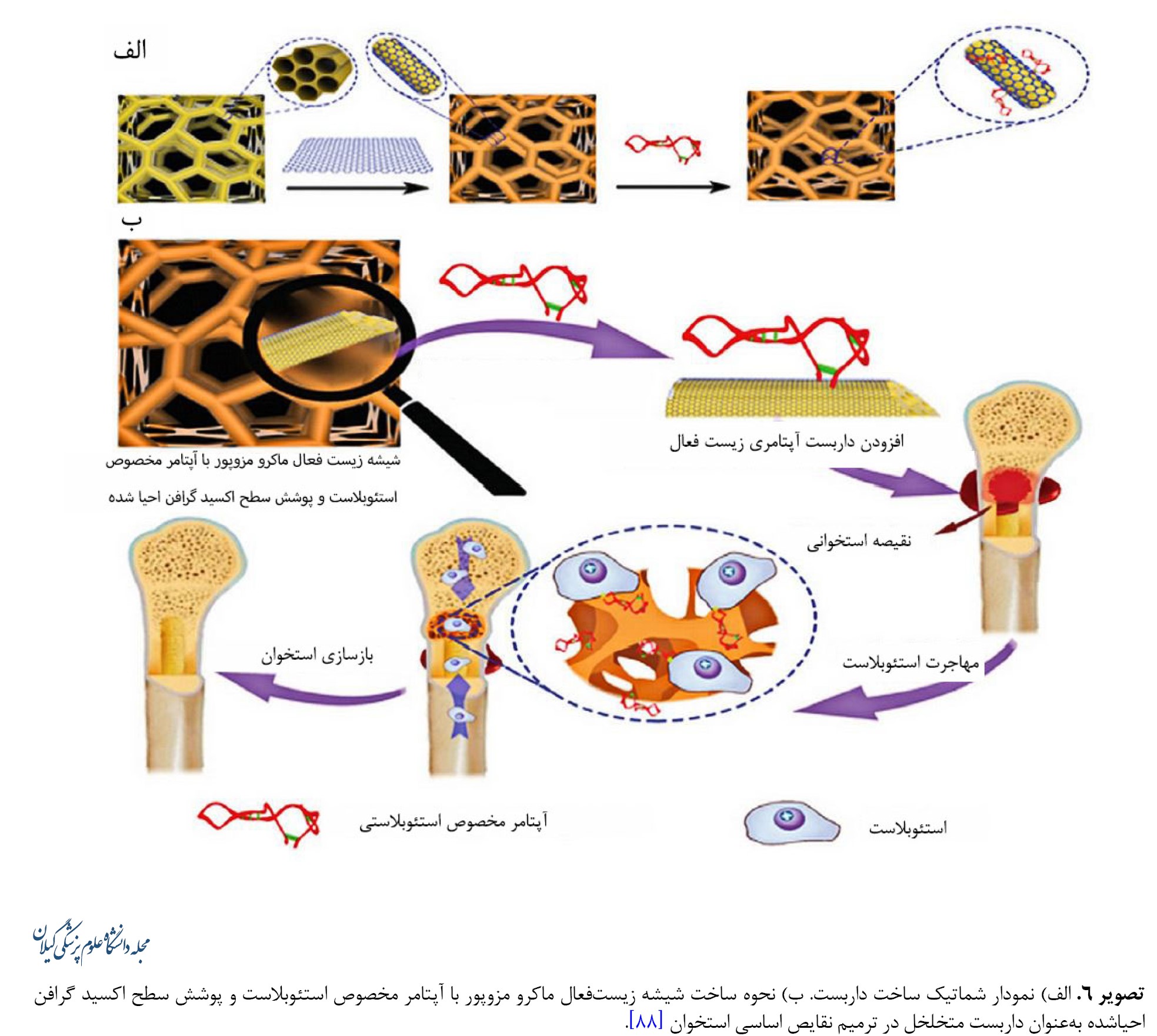
روشهای بدون سلول با داربست دارای عملکرد سطحی میتوانند با بهکارگیری استئوبلاستهای درونزا برای بهبود ترمیم نقص استخوان، بازسازی استخوان را تقویت کنند. تثبیت پروتئین که ابتدا بر روی بسترهای شیشهای انجام شد، از تثبیت پپتید به دست میآید. پروتئین مورفوژنیک استخوانی در استخوانسازی و متابولیسم آن مفید است، اما نگرانیهایی در این مورد در خصوص کاربرد بالینی آنها وجود دارد. دُزهای بالای فیزیولوژیک پروتئین مورفوژنیک استخوانی ممکن است اثرات نامطلوبی ازجمله واکنشهای ایمنی، ادم و تشکیل استخوان هتروتوپیک ایجاد کنند، اما این پروتئین برای استخوانزایی ضروری است [79]. بهمنظور غلبه بر محدودیتهای نیمه عمر کوتاه و پاکسازی سریع ناشی از دُزهای بالای فیزیولوژیک، یک زیست ماده ناقل جدید متشکل از میکروذرات هپارین و هیدروژلهای آلژینات احاطهشده توسط شبکه نانوالیاف پلیکاپرولاکتون ساخته شده است. شبکه نانو الیاف پلیکاپرولاکتون میتواند فیلتراسیون اولیه بافت و سلول را به داخل منافذ تحریک کند. درحالیکه هیدروژلهای آلژینات بهعنوان حاملی برای میکروذرات هپارین بهمنظور تسهیل اتصال و نفوذ سلولی، افزایش فعالیت فاکتور رشد و تخریب هیدرولیتیک عمل میکنند. فیبرین غنی از پلاکت که یک کنسانتره پلاکتی مشتقشده از خون کامل است، حاوی انواع سلولهای ایمنی و فاکتورهای رشد است که مقرونبهصرفه بوده و در درمان بالینی در مقایسه با فاکتورهای رشد تجاری موجود در بازار رایج شده است. فیبرین غنی از پلاکت تحریک بازسازی قدرتمندی در بازسازی استخوان دارد. فیلمهای نانوالیافی طراحیشده از پلیکاپرولاکتون / ژلاتین بهعنوان مانعی در برابر نفوذ بافت فیبری در نقیصههای استخوانی عمل میکنند[80, 81]. برای حفظ حیات و عملکرد سلول در مواد، تثبیت لیگاندهای زیستفعال روی داربستهای سهبعدی برای تعامل با سلولهای بنیادی ضروری است. اخیراً یک لیگاند سطحی با یک توالی اسید آمینه خاص (تریپپتید آرژنین ـ گلیسین ـ اسپارتیک اسید) با پروتئینهای چسبنده سلولی برای بهبود چسبندگی سلولی به ماتریکس خارجسلولی اضافه شده است. موتیف تری پپتید آرژنین ـ گلیسین ـ اسپارتیک اسید یک توالی قابلتشخیص توسط سلول است که در پروتئینهای متعدد ماتریکس خارجسلولی و پروتئینهای خون کشف شده است. نتایج نشان دادهاند استفاده از داربستهای با عملکرد تریپپتید آرژنین ـ گلیسین ـ اسپارتیک اسید باعث افزایش فعالیت آلکالین فسفاتاز و افزایش استئوکلسین شدهاند [82-88]. گرافن، آلوتروپ جدید کربن با شبکه لانه زنبوری دوبعدی، همراه با مشتقاتش درزمینه علم مواد مورد توجه زیادی قرار گرفته است. گرافن با توانایی تسریع تمایز در سلولهای بنیادی مزانشیمی و استئوبلاستها برای مهندسی بافت استخوان توجه محققین را به خود جلب کرده است. علاوهبراین به دلیل خواص مکانیکی برتر و زیستسازگاری، گرافن پتانسیل ادغام با سایر مواد داربست را برای تشدید ویژگیهای مکانیکی و ارتقای فعالیت زیستی آنها دارد. علاوهبراین اکسید گرافن احیاشده که بهعنوان گرافن اصلاحشده شیمیایی نیز شناخته میشود، دارای گروههای کربوکسیل متعددی بر روی سطح خود است که میتوان آنها را اصلاح کرد تا عملکرد زیستفعالی را برای شناسایی اهداف خاص ایجاد کند. بهعنوان مثال میتوان به آپتامرهای الیگونوکلئوتیدی تکرشتهای که میتوانند به مولکولهای هدف با ویژگی و میل ترکیبی بالا متصل شوند اشاره کرد. در این رابطه، یک شیشه زیستفعال ماکرو مزوپور با آپتامر مخصوص استئوبلاست و پوشش سطح اکسید گرافن احیاشده بهعنوان داربست متخلخل زیستفعال سهبعدی جدید تهیه شده است (تصویر شماره 6) [89-91].
داربستهای استخوانی مکانیکی
اثر نشانههای مکانیکی بر رفتار سلول برای حفظ هموستاز بافت استخوان مهم است. مشخص شده است هیدروژلها میتوانند تحت تأثیر عوامل مکانیکی و خارجی بهعنوان یک بستر مزانشیمی برای تبادل مواد معدنی و کلاژنها در ترمیم استخوان عمل کنند. بنابراین ویژگی حساسیت مکانیکی سلول به بستر ازطریق اعمال استرس، یک پارامتر مفید برای مواد زیستی در ترمیم استخوان است [75]. مطالعه دیگری نشان داد محرکهای مکانیکی در شرایط درونتنی میتوانند باعث تشکیل استخوان با درجه معدنی شدن بالا شوند. تمایز سلولهای بنیادی مزانشیمی انسان را میتوان با محرکهای مکانیکی که باعث بیان کلاژن نوع 1 و همچنین تشکیل رسوبات معدنی در لایه استخوانی یک هیدروژل استئوکندرال میشود، تنظیم کرد [76]. داربستهایی که سیگنالهای مکانیکی مفیدی را ازطریق نشانههای فیزیکی، مانند سختی و سایر خواص مکانیکی نشان میدهند، میتوانند نیروهای مکانیکی داخلی را برای تسهیل تمایز سلول ایجاد کنند. بهعنوان مثال سلولها وقتی روی بسترهای سفتتر (20 تا 80 کیلو پاسکال) رشد کردند، احتمال بیشتری برای تبدیل شدن به سلولهای استخوانی داشتند. در یک مطالعه با هدف بررسی اثر سفتی نانو داربستهای سهبعدی بر استرس و کانیسازی در سلولهای شبهاستئوبلاست، داربستهای سهبعدی با سطوح پوشش دادهشده با تیتانیوم تحت شرایط ریزمحیطی بهینه، رشد سلول را تسهیل کردند. هم آزمایشهای برونتنی با سلولها و هم آزمایشهای درونتنی با کاشت زیرجلدی در موشها نشان داد داربستهای با تحریک مکانیکی میتوانند استخوانزایی و بازسازی استخوان را تقویت کنند. اگرچه مشخص است که سلولهای بنیادی مزانشیمی و استئوبلاستها هم به توپوگرافی و هم به سفتی بستر پاسخ میدهند، ولی مکانیسم دقیق هنوز در حال بررسی است [77, 78].
سایر داربستهای استخوان بدون سلول
روشهای بدون سلول با داربست دارای عملکرد سطحی میتوانند با بهکارگیری استئوبلاستهای درونزا برای بهبود ترمیم نقص استخوان، بازسازی استخوان را تقویت کنند. تثبیت پروتئین که ابتدا بر روی بسترهای شیشهای انجام شد، از تثبیت پپتید به دست میآید. پروتئین مورفوژنیک استخوانی در استخوانسازی و متابولیسم آن مفید است، اما نگرانیهایی در این مورد در خصوص کاربرد بالینی آنها وجود دارد. دُزهای بالای فیزیولوژیک پروتئین مورفوژنیک استخوانی ممکن است اثرات نامطلوبی ازجمله واکنشهای ایمنی، ادم و تشکیل استخوان هتروتوپیک ایجاد کنند، اما این پروتئین برای استخوانزایی ضروری است [79]. بهمنظور غلبه بر محدودیتهای نیمه عمر کوتاه و پاکسازی سریع ناشی از دُزهای بالای فیزیولوژیک، یک زیست ماده ناقل جدید متشکل از میکروذرات هپارین و هیدروژلهای آلژینات احاطهشده توسط شبکه نانوالیاف پلیکاپرولاکتون ساخته شده است. شبکه نانو الیاف پلیکاپرولاکتون میتواند فیلتراسیون اولیه بافت و سلول را به داخل منافذ تحریک کند. درحالیکه هیدروژلهای آلژینات بهعنوان حاملی برای میکروذرات هپارین بهمنظور تسهیل اتصال و نفوذ سلولی، افزایش فعالیت فاکتور رشد و تخریب هیدرولیتیک عمل میکنند. فیبرین غنی از پلاکت که یک کنسانتره پلاکتی مشتقشده از خون کامل است، حاوی انواع سلولهای ایمنی و فاکتورهای رشد است که مقرونبهصرفه بوده و در درمان بالینی در مقایسه با فاکتورهای رشد تجاری موجود در بازار رایج شده است. فیبرین غنی از پلاکت تحریک بازسازی قدرتمندی در بازسازی استخوان دارد. فیلمهای نانوالیافی طراحیشده از پلیکاپرولاکتون / ژلاتین بهعنوان مانعی در برابر نفوذ بافت فیبری در نقیصههای استخوانی عمل میکنند[80, 81]. برای حفظ حیات و عملکرد سلول در مواد، تثبیت لیگاندهای زیستفعال روی داربستهای سهبعدی برای تعامل با سلولهای بنیادی ضروری است. اخیراً یک لیگاند سطحی با یک توالی اسید آمینه خاص (تریپپتید آرژنین ـ گلیسین ـ اسپارتیک اسید) با پروتئینهای چسبنده سلولی برای بهبود چسبندگی سلولی به ماتریکس خارجسلولی اضافه شده است. موتیف تری پپتید آرژنین ـ گلیسین ـ اسپارتیک اسید یک توالی قابلتشخیص توسط سلول است که در پروتئینهای متعدد ماتریکس خارجسلولی و پروتئینهای خون کشف شده است. نتایج نشان دادهاند استفاده از داربستهای با عملکرد تریپپتید آرژنین ـ گلیسین ـ اسپارتیک اسید باعث افزایش فعالیت آلکالین فسفاتاز و افزایش استئوکلسین شدهاند [82-88]. گرافن، آلوتروپ جدید کربن با شبکه لانه زنبوری دوبعدی، همراه با مشتقاتش درزمینه علم مواد مورد توجه زیادی قرار گرفته است. گرافن با توانایی تسریع تمایز در سلولهای بنیادی مزانشیمی و استئوبلاستها برای مهندسی بافت استخوان توجه محققین را به خود جلب کرده است. علاوهبراین به دلیل خواص مکانیکی برتر و زیستسازگاری، گرافن پتانسیل ادغام با سایر مواد داربست را برای تشدید ویژگیهای مکانیکی و ارتقای فعالیت زیستی آنها دارد. علاوهبراین اکسید گرافن احیاشده که بهعنوان گرافن اصلاحشده شیمیایی نیز شناخته میشود، دارای گروههای کربوکسیل متعددی بر روی سطح خود است که میتوان آنها را اصلاح کرد تا عملکرد زیستفعالی را برای شناسایی اهداف خاص ایجاد کند. بهعنوان مثال میتوان به آپتامرهای الیگونوکلئوتیدی تکرشتهای که میتوانند به مولکولهای هدف با ویژگی و میل ترکیبی بالا متصل شوند اشاره کرد. در این رابطه، یک شیشه زیستفعال ماکرو مزوپور با آپتامر مخصوص استئوبلاست و پوشش سطح اکسید گرافن احیاشده بهعنوان داربست متخلخل زیستفعال سهبعدی جدید تهیه شده است (تصویر شماره 6) [89-91].
ارائه استراتژیها و چالشهای کارآزمایی بالینی ترمیم استخوان
روش جاری در درمان بالینی استفاده از پیوندهای استخوان خودی، غیرخودی و یا از گونه دیگر است که با مواد زیستی مصنوعی تلفیق شدهاند. استخوان خاصره بهعنوان منبع اصلی اتوگرافت است. استخوان اسفنجی را میتوان در حین عمل برداشت کرد و برای تهیه بلوکهای استخوانی یا تراشههای استخوانی برای پر کردن نقیصه استخوانی استفاده کرد. برای غلبه بر مشکل عروق، یک اتوگرافت عروقی برای بازسازی نقایص بزرگ استخوانی تولید شده است [92]. از فلپ فیبولای آزاد در بازسازی فک پایین و فک بالا استفاده شده است. آلوگرافتهای استخوان، بهعنوان جایگزینی برای اتوگرافت، معمولاً از اهداکنندگان زنده یا جسد جمعآوری میشوند که پس از عملآوری پیوند به بیمار دیگر انجام میشود. آلوگرافتهای استخوان به دلیل در دسترس بودن آسان در اندازهها و اشکال مختلف مفید هستند. علاوهبر کاربرد آلوگرافت بهتنهایی، ترکیب آنها با سلولهای مغز استخوان متمرکز اتولوگ نیز گزارش شده است. زنوگرافت استحصالشده از گونههای مختلف در درمان بالینی به دلیل در دسترس بودن و تخلخل سازگار برای رشد بافت استخوان و خواص مکانیکی مشابه با استخوان گیرنده مورد استفاده قرار گرفتهاند. استخوان اسفنجی گاو نیز در مدیریت شکستگی استخوان درشت نی در بیماران مسن گزارش شده و نتایج خوبی از خود نشان داده است. با وجود این، استفاده از زنوگرافت به دلیل مسائلی مانند رد پیوند و شکست در یکپارچگی بافت با مشکل مواجه است. به غیر از گرافتهای مذکور، داربستهای مصنوعی بهطور گستردهای مورد استفاده قرار گرفتهاند. داربستهای هیدروکسی آپاتیت با سلولهای بنیادی مزانشیمی بارگذاری شده، توانایی استخوانسازی قابلتوجهی بدون پاسخ نامطلوب پس از کورتاژ تومور نشان دادهاند. هیدروکسی آپاتیت کلسیم متخلخل بههمپیوسته بارگذاریشده با سلولهای تکهستهای مغز استخوان در ترمیم استئونکروز مؤثر بوده است. استفاده از چاپ سهبعدی، بهویژه داربستهای سرامیکی پرینت سهبعدی، میتواند از ساختارهای آناتومیک پیچیده بیمار تقلید و بازسازی استخوان را تسهیل کند [92 ,93].
اگرچه تحقیقات زیادی درمورد بازسازی بافت استخوانی منتشر شده است، اما هنوز چند عامل مانع از کاربرد تحقیقات پایه در سطح بالینی میشود. این چالشها شامل چالشهای علمی و فناوری زیر است:
مناسبترین نوع سلول برای استفاده در درمان بازسازی استخوان هنوز مشخص نیست. اگرچه سلولهای بنیادی مزانشیمی بهصورت بالینی و تجربی به کار گرفته شدهاند، خطرات استفاده از سلولها همچنان وجود دارد. سلولهای بنیادی پرتوان جنینی و القایی در ترمیم بافت بالغ ضروری هستند و علاوهبراین همچنان به دستکاریهای آزمایشگاهی بیشتری نیاز دارند. عروق کافی برای بقای سلولها و ترمیم بعدی استخوان موردنیاز است. بااینحال تشکیل عروق جدید اغلب فاقد عمق نفوذ مناسبی هستند. این امر اندازه ساختارهای استخوانی قابلکاشت را محدود میکند [92]. کنترل تخریب داربست نیاز به اصلاح دقیق دارد. اگر داربست بهسرعت تخریب شود، مانند آنچه در خصوص هیدروژلهای نانوکامپوزیت وجود دارد [94]، ممکن است خرابی مکانیکی رخ دهد [92]. برعکس، اگر داربست بهآرامی تخریب شود، ممکن است یک واکنش التهابی فعال پایدار رخ دهد که مانع از ترمیم بافت شود. ازاینرو تعادل بین تخریب داربستها و تشکیل استخوان جدید ضروری است و چالش مهمی به شمار میآید [92]. اگرچه تکنیکهای ساخت سهبعدی فعلی نظیر داربستهای کامپوزیتی بتا تریکلسیم فسفات [95] را میتوان برای ساخت مدلهای نقیصه استخوانی در بیمار مورد استفاده قرار داد، اما بیوسرامیکهای سهبعدی چالشهایی ازجمله شکنندگی، نامناسب بودن برای درمان بالینی به دلیل اثرات مضر بالقوه حلالهای سمی و تأثیر بر زندهمانی سلول را با خود به همراه دارند. علاوهبراین، پرینترهای زیستی سهبعدی فعلی فاقد ظرفیت شناسایی منافذ داخلی هستند که برای بهینهسازی بیشتر به کارآزمایی بالینی نیاز دارند [92]. بهبود ویژگیهای مکانیکی داربست پیشتر مورد بحث قرار گرفت. سازگار کردن فردی عملکرد مکانیکی کافی نیست و عملکرد مکانیکی رضایتبخش نیاز به توجه به یکسری عوامل در ساخت داربست، ازجمله اصلاح مقاومت فشاری، کششی، الاستیک و خستگی داربست دارد. ترکیب این عوامل با سایر خواص ممکن است برای کمک به تحریک استخوانزایی مفید باشد. داربستها با رویکردهای پرینت زیستی با دقت بالا تنها برای نقایص استخوانی در مقیاس کوچکتر مفید هستند [92 ,93].
بحث
همانطور که توضیح داده شد، تلاشهای قابلتوجهی برای بازسازی بافت استخوان ازطریق روشهای شبیهسازی زیستی که چندین استراتژی شبیهسازی سلولی را پوشش میدهد، انجام شده است. جدول شماره 1 جمعبندی و خلاصهای از مطالعات ذکرشده را نشان میدهد.

این پیشرفتها با تلفیقی از طراحی ساختاری، اصلاح سطح و استفاده از محرکهای فیزیکی خارجی، پتانسیل زیادی برای بازسازی بافت استخوانی ایجاد کردهاند. بااینحال هنوز چالشهای مهمی در شبیهسازی ساختارهای بافت استخوانی و کاربرد وسیع داربستهای بدون سلول و یا سلولزداییشده بهمنظور تسهیل ترمیم بافت استخوانی وجود دارد. پرواضح است که فاکتورهای رشد، هورمونها و کموکاینها میتوانند پاسخهای بیولوژیکی را در بدن انسان تنظیم کنند، اما عوارض جانبی، هزینه بالا و پایداری آنها مانع از کاربرد آنها در سطح بالینی میشود.
نتیجهگیری
پیشرفتهای اخیر نشان دادهاند بازسازی استخوان در داخل بدن ممکن است ازطریق تلفیق شبیهسازی ساختاری بافتی و تحریک فیزیکی خارجی میسر شود، بنابراین وابستگی به سلولهای اگزوژن و فاکتورهای بیوشیمیایی در مهندسی بافت استخوان کاهش مییابد. علاوهبراین درمانهای مهندسی بافت استخوان مبتنی بر داربست که ایمن، راحت و مهمتر از همه مقرونبهصرفه هستند، مزایای قابلتوجهی در کاربرد بالینی دارد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه مصوب شورای پژوهشی دانشگاه آزاد اسلامی واحد علوم و تحقیقات با شناسه IR.IAU.SRB.REC.1401.161 می باشد.
حامی مالی
این مطالعه حاصل پایاننامه دوره دستیاری دامپزشکی امیررضا حاجتی ضیابری در گروه علوم بالینی، دانشکده علوم تخصصی دامپزشکی، واحد علوم و تحقیقات، دانشگاه آزاد اسلامی، می باشد.
مشارکت نویسندگان
مفهومسازی: علیرضا جهاندیده و امیررضا حاجتی ضیابری؛ تحقیق و بررسی: تمام نویسندگان؛ ویرایش اولیه: امیررضا حاجتی ضیابری؛ ویراستاری و نهاییسازی نوشته: علیرضا جهاندیده.
تعارض منافع
بنابر اظهار نویسندگان این مقاله تعارض منافع ندارد.
References
1.McAllister TN, Dusserre N, Maruszewski M, L'heureux N. Cell-based therapeutics from an economic perspective: Primed for a commercial success or a research sinkhole? Regenerative Medicine. 2008; 3(6):925-37. [DOI:10.2217/17460751.3.6.925] [PMID]
2.Mummery CL, Davis RP, Krieger JE. Challenges in using stem cells for cardiac repair. Science Translational Medicine. 2010; 2(27):27ps17. [DOI:10.1126/scitranslmed.3000558] [PMID]
3.Burdick JA, Mauck RL, Gorman JH 3rd, Gorman RC. Acellular biomaterials: An evolving alternative to cell-based therapies. Science Translational Medicine. 2013; 5(176):176ps4. [DOI:10.1126/scitranslmed.3003997] [PMID] [PMCID]
4.Harrison JH. Synthetic materials as vascular prostheses. I. A comparative study in small vessels of nylon, dacron, orlon, ivalon sponge and teflon. American Journal of Surgery. 1958; 95(1):3-15. [DOI:10.1016/0002-9610(58)90735-9] [PMID]
5.Same S, Navidi G, Samee G, Abedi F, Aghazadeh M, Milani M, et al. Gentamycin-loaded halloysite-based hydrogel nanocomposites for bone tissue regeneration: Fabrication, evaluation of the antibacterial activity and cell response. Biomedical Materials. 2022; 17(6):065018. [DOI:10.1088/1748-605X/ac94ad] [PMID]
6.Javadian N, Veshkini A, Jahandideh A, Akbarzadeh A, Asghari A. Ultrasonographic evaluation of effect of zeolite and zeolite/collagen nanocomposite scaffolds on healing of femurbone defect in rabbits. Veterinary Research & Biological Products. 2021; 34(3):114-20. [DOI:10.22092/vj.2020.341723.1686]
7.Rad F, Davaran S, Babazadeh M, Akbarzadeh, Pazoki-Toroudi5 H. Biodegradable electrospun polyester-urethane nanofiber scaffold: Codelivery investigation of doxorubicin-ezetimibe and its synergistic effect on prostate cancer cell line. Journal of Nanomaterials. 2022; 2022(1):8818139.[DOI:10.1155/2022/8818139]
8.Sagart A, Jahandideh A, Asghari A, Akbarzadeh A, Mortazavi P. [Investigating the regenerative effects of PRP and polycaprolactone-hydroxyapatite zeolite nanocomposites on wound healing after tooth extraction (Persian)]. Journal of Comparative Pathology. 2023; 19(2):3873-82. [DOI:10.30495/jcp.2022.21491]
9.Same S, Kadkhoda J, Navidi G, Abedi F, Aghazadeh M, Milani M, et al. The fabrication of halloysite nanotube-based multicomponent hydrogel scaffolds for bone healing. Journal of Applied Biomaterials & Functional Materials. 2022; 20:22808000221111875. [DOI:10.1177/22808000221111875] [PMID]
10.Saghebasl S, Akbarzadeh A, Gorabi AM, Nikzamir N, SeyedSadjadi M, Mostafavi E. Biodegradable functional macromolecules as promising scaffolds for cardiac tissue engineering. Polymers for Advanced Technologies. 2022; 33(7):2044-68. [DOI:10.1002/pat.5669]
11.Neščáková Z, Zheng K, Liverani L, Nawaz Q, Galusková D, Kaňková H, et al. Multifunctional zinc ion doped sol - Gel derived mesoporous bioactive glass nanoparticles for biomedical applications. Bioactive Materials. 2019; 4:312-21. [DOI:10.1016/j.bioactmat.2019.10.002] [PMID] [PMCID]
12.Kim B, Ventura R, Lee BT. Functionalization of porous BCP scaffold by generating cell-derived extracellular matrix from rat bone marrow stem cells culture for bone tissue engineering. Journal of Tissue Engineering and Regenerative Medicine. 2018; 12(2):e1256-67. [DOI:10.1002/term.2529] [PMID]
13.Shih YV, Varghese S. Tissue engineered bone mimetics to study bone disorders ex vivo: Role of bioinspired materials. Biomaterials. 2019; 198:107-21. [DOI:10.1016/j.biomaterials.2018.06.005] [PMID] [PMCID]
14.Asadi N, Del Bakhshayesh AR, Sadeghzadeh H, Asl AN, Kaamyabi S, Akbarzadeh A. Nanocomposite electrospun scaffold based on polyurethane/polycaprolactone incorporating gold nanoparticles and soybean oil for tissue engineering applications. Journal of Bionic Engineering. 2023; 20(4):1712-22. [DOI:10.1007/s42235-023-00345-x]
15.Du Y, Guo JL, Wang J, Mikos AG, Zhang S. Hierarchically designed bone scaffolds: From internal cues to external stimuli. Biomaterials. 2019; 218:119334. [DOI:10.1016/j.biomaterials.2019.119334] [PMID] [PMCID]
16.O'Neill E, Awale G, Daneshmandi L, Umerah O, Lo KW. The roles of ions on bone regeneration. Drug Discovery Today. 2018; 23(4):879-890. [DOI:10.1016/j.drudis.2018.01.049] [PMID]
17.Mao Z, Gu YF, Zhang J, Shu WW, Cui YQ, Xu T. Superior biological performance and osteoinductive activity of Si-containing bioactive bone regeneration particles for alveolar bone reconstruction. Ceramics International. 2020; 46(1):353-64. [DOI:10.1016/j.ceramint.2019.08.269]
18.Javadian N, Veshkini A, Jahandideh A, Akbarzadeh A, Asghari A. Ultrasonographic and radiographic evaluation of zeolite/collagen nanocomposite scaffolds compared with nanohydroxyapatite on experimental bone defect healing in rabbit femur. Crescent Journal of Medical and Biological Sciences. 2023; 10(1):49-55. [DOI:10.34172/cjmb.2023.08]
19.Faraji D, Jahandideh A, Asghari A, Akbarzadeh A, Hesaraki S. Effect of zeolite and zeolite/collagen nanocomposite scaffolds on healing of segmental femur bone defect in rabbits. Iranian Journal of Veterinary Surgery. 2017; 12(2):63-70. [DOI:10.22034/ivsa.2018.112807.1133]
20.Faraji D, Jahandideh A, Asghari A, Akbarzadeh A, Hesaraki S. Evaluation of influence of zeolite/collagen nanocomposite (ZC) and hydroxyapatite (HA) on bone healing: A study on rabbits. Archives of Razi Institute. 2019; 74(4):395-403. [DOI:10.22092/ari.2018.121308.1211]
21.Sagart A, Jahandideh A, Asghari A, Akbarzadeh A, Mortazavi P. The comparative effects of platelet-rich plasma and polycaprolactone-hydroxyapatite zeolite nanocomposites on wound healing after tooth extraction. Crescent Journal of Medical & Biological Sciences. 2024; 11(4):395-403. [DOI:10.34172/cjmb.2023.33]
22.Çelikbaş İ, Mavi E, Hepokur C. The evaluation of the effects of natural zeolite (Clinoptilolite) in diabetic rats on bone healing in dental extracting socket. Journal of Oral Biology and Craniofacial Research. 2023; 13(1):36-40. [PMID]
23.Mohammadi R, Amini K. Guided bone regeneration of mandibles using chitosan scaffold seeded with characterized uncultured omental adipose-derived stromal vascular fraction: An animal study. The International Journal of Oral & Maxillofacial Implants. 2015; 30(1):216-22. [DOI:10.11607/jomi.3542] [PMID]
24.Hung CC, Chaya A, Liu K, Verdelis K, Sfeir C. The role of magnesium ions in bone regeneration involves the canonical Wnt signaling pathway. Acta Biomaterialia. 2019; 98:246-55. [DOI:10.1016/j.actbio.2019.06.001] [PMID]
25.Wagner AS, Glenske K, Henß A, Kruppke B, Rößler S, Hanke T, et al. Cell behavior of human mesenchymal stromal cells in response to silica/collagen based xerogels and calcium deficient culture conditions. Biomedical Materials. 2017; 12(4):045003. [DOI:10.1088/1748-605X/aa6e29] [PMID]
26.Wagner AS, Glenske K, Wolf V, Fietz D, Mazurek S, Hanke T, et al. Osteogenic differentiation capacity of human mesenchymal stromal cells in response to extracellular calcium with special regard to connexin 43. Annals of Anatomy. 2017; 209:18-24. [DOI:10.1016/j.aanat.2016.09.005] [PMID]
27.Eliaz N, Metoki N. Calcium phosphate bioceramics: A review of their history, structure, properties, coating technologies and biomedical applications. Materials. 2017; 10(4):334. [DOI:10.3390/ma10040334] [PMID] [PMCID]
28.Glenske K, Donkiewicz P, Köwitsch A, Milosevic-Oljaca N, Rider P, Rofall S, et al. Applications of metals for bone regeneration. International Journal of Molecular Sciences. 2018; 19(3):826. [DOI:10.3390/ijms19030826] [PMID] [PMCID]
29.Sonbolekar H, Alireza J, Ahmad A, Hesaraki S, Akbarzadeh A. Assessment of tricalcium phosphate/titanium dioxide (TCP/TiO2) nanocomposite scaffold compared with bone autograft and hydroxyapatite (HA) on the healing of segmental femur bone defect in rabbits. Journal of Materials Science. 2022; 33(12):80. [DOI:10.1007/s10856-022-06694-z] [PMID] [PMCID]
30.Qing T, Mahmood M, Zheng Y, Biris AS, Shi L, Casciano DA. A genomic characterization of the influence of silver nanoparticles on bone differentiation in MC3T3-E1 cells. Journal of Applied Toxicology. 2018; 38(2):172-179. [DOI:10.1002/jat.3528] [PMID]
31.Weng W, Li X, Nie W, Liu H, Liu S, Huang J, et al. One-step preparation of an AgNP-nHA@RGO three-dimensional porous scaffold and its application in infected bone defect treatment. International Journal of Nanomedicine. 2020; 15:5027-42. [DOI:10.2147/IJN.S241859] [PMID] [PMCID]
32.Wang Q, Chen B, Cao M, Sun J, Wu H, Zhao P, et al. Response of MAPK pathway to iron oxide nanoparticles in vitro treatment promotes osteogenic differentiation of hBMSCs. Biomaterials. 2016; 86:11-20. [DOI:10.1016/j.biomaterials.2016.02.004] [PMID]
33.Zhao GY, Zhao LP, He YF, Li GF, Gao C, Li K, et al. A comparison of the biological activities of human osteoblast hFOB1.19 between iron excess and iron deficiency. Biological Trace Element Research. 2012; 150(1-3):487-95. [DOI:10.1007/s12011-012-9511-9] [PMID]
34.Benders KE, van Weeren PR, Badylak SF, Saris DB, Dhert WJ, Malda J. Extracellular matrix scaffolds for cartilage and bone regeneration. Trends Biotechnol. 2013; 31(3):169-76. [DOI:10.1016/j.tibtech.2012.12.004] [PMID]
35.Madhurakkat Perikamana SK, Lee J, Lee YB, Shin YM, Lee EJ, Mikos AG, et al. Materials from Mussel-Inspired Chemistry for Cell and Tissue Engineering Applications. Biomacromolecules. 2015; 16(9):2541-55. [DOI:10.1021/acs.biomac.5b00852] [PMID]
36.Eftekhari H, Jahandideh A, Asghari A, Akbarzadeh A. [Evaluation of β-tricalciumphosphate (β-TCP) nanocomposite granules compared with nanocomposite hydroxyapatite (HA) on healing of segmental femur bone defect in rabbits (Persian)]. Journal of Comparative Pathobiology. 2018; 15(4):2635-44. [Link]
37.Eftekhari H, Jahandideh A, Asghari A, Akbarzadeh A, Hesaraki S. Histopathological Evaluation of Polycaprolactone Nanocomposite Compared with Tricalcium Phosphate in Bone Healing. Journal of Veterinary Research. 2018; 62(3):385-94. [DOI:10.2478/jvetres-2018-0055] [PMID] [PMCID]
38.Mohseni M, Jahandideh A, Abedi G, Akbarzadeh A, Hesaraki S. Assessment of tricalcium phosphate/collagen (TCP/collagene)nanocomposite scaffold compared with hydroxyapatite (HA) on healing of segmental femur bone defect in rabbits. Artificial Cells, Nanomedicine, and Biotechnology. 2018; 46(2):242-9. [DOI:10.1080/21691401.2017.1324463] [PMID]
39.Farahi H, Mashhadi-Rafie S, Jahandideh A, Asghari A, Shirazi-Beheshtiha SH. Evaluation of possible beneficial effect of tricalcium phosphate/collagen (TCP/Collagen) nanocomposite scaffold on bone healing in rabbits: Biochemical assessments. Iranian Journal of Veterinary Surgery. 2019; 14(2):162-72. [Link]40.Wang X, Yu T, Chen G, Zou J, Li J, Yan J. Preparation and characterization of a chitosan/gelatin/extracellular matrix scaffold and its application in tissue engineering. Tissue Engineering. 2017; 23(3):169-79. [DOI:10.1089/ten.tec.2016.0511] [PMID]
41.Chi H, Song X, Song C, Zhao W, Chen G, Jiang A, et al. Chitosan-gelatin scaffolds incorporating decellularized platelet-rich fibrin promote bone regeneration. ACS Biomaterials Science & Engineering. 2019; 5(10):5305-15. [DOI:10.1021/acsbiomaterials.9b00788] [PMID]
42.Miron RJ, Zhang Y. Autologous liquid platelet rich fibrin: A novel drug delivery system. Acta Biomaterialia. 2018; 75:35-51. [DOI:10.1016/j.actbio.2018.05.021] [PMID]
43.Thorat M, Pradeep AR, Pallavi B. Clinical effect of autologous platelet-rich fibrin in the treatment of intra-bony defects: A controlled clinical trial. Journal of Clinical Periodontology. 2011; 38(10):925-32. [DOI:10.1111/j.1600-051X.2011.01760.x] [PMID]
44.Faot F, Deprez S, Vandamme K, Camargos GV, Pinto N, Wouters J, et al. The effect of L-PRF membranes on bone healing in rabbit tibiae bone defects: Micro-CT and biomarker results. Scientific Reports. 2017; 7:46452. [DOI:10.1038/srep46452] [PMID] [PMCID]
45.Hajati Ziabari A, Asadi Heris M, Mohammad Doodmani S, Jahandideh A, Koorehpaz K, Mohammadi R. Cinnamon nanoparticles loaded on chitosan- gelatin nanoparticles enhanced burn wound healing in diabetic foot ulcers in rats. The International Journal of Lower Extremity Wounds. 2022; 15347346221101245. [DOI:10.1177/15347346221101245] [PMID]
46.Zhang Y, Yang F, Liu K, Shen H, Zhu Y, Zhang W, et al. The impact of PLGA scaffold orientation on in vitro cartilage regeneration. Biomaterials. 2012; 33(10):2926-35. [DOI:10.1016/j.biomaterials.2012.01.006] [PMID]
47.Shin YM, Shin HJ, Yang DH, Koh YJ, Shin H, Chun HJ. Advanced capability of radially aligned fibrous scaffolds coated with polydopamine for guiding directional migration of human mesenchymal stem cells. Journal of Materials Chemistry. 2017; 5(44):8725-37. [DOI:10.1039/C7TB01758H] [PMID]
48.Zhu C, Pongkitwitoon S, Qiu J, Thomopoulos S, Xia Y. Design and fabrication of a hierarchically structured scaffold for tendon-to-bone repair. Advanced Materials. 2018; 30(16):e1707306. [DOI:10.1002/adma.201707306] [PMID] [PMCID]
49.Woodard LN, Kmetz KT, Roth AA, Page VM, Grunlan MA. Porous poly(ε-caprolactone)-poly(l-lactic acid) semi-interpenetrating networks as superior, defect-specific scaffolds with potential for cranial bone defect repair. Biomacromolecules. 2017; 18(12):4075-83. [DOI:10.1021/acs.biomac.7b01155] [PMID] [PMCID]
50.Wang L, Qiu Y, Lv H, Si Y, Liu L, Zhang Q, et al. 3D superelastic scaffolds constructed from flexible inorganic nanofibers with self-fitting capability and tailorable gradient for bone regeneration. Advanced Functional Materials. 2019; 29(31):1901407. [DOI:10.1002/adfm.201901407]
51.Nair AK, Gautieri A, Chang SW, Buehler MJ. Molecular mechanics of mineralized collagen fibrils in bone. Nature Communications. 2013; 4:1724. [DOI:10.1038/ncomms2720] [PMID] [PMCID]
52.Martinez LR, Mihu MR, Han G, Frases S, Cordero RJ, Casadevall A, et al. The use of chitosan to damage Cryptococcus neoformans biofilms. Biomaterials. 2010; 31(4):669-79. [DOI:10.1016/j.biomaterials.2009.09.087] [PMID] [PMCID]
53.Nabavi S, Jahandideh A, Akbarzadeh A. [Evaluation of polycaprolactone (PCL) based nanogel containing tetracycline on experimental wound infected with staphylococcus aureus bacteria healing on rat’s skin (Persian)]. Veterinary Research & Biological Products. 2023; 36(3):24-35. [DOI:10.22092/vj.2022.359948.2008]
54.Correia CO, Mano JF. Chitosan scaffolds with a shape memory effect induced by hydration. Journal of Materials Chemistry. 2014; 2(21):3315-23. [DOI:10.1039/C4TB00226A] [PMID]
55.Wang L, Qiu Y, Guo Y, Si Y, Liu L, Cao J, et al. Smart, Elastic, and nanofiber-based 3D scaffolds with self-deploying capability for osteoporotic bone regeneration. Nano Letters. 2019; 19(12):9112-20. [DOI:10.1021/acs.nanolett.9b04313] [PMID]
56.Hao J, Zhang Y, Jing D, Shen Y, Tang G, Huang S, et al. Mechanobiology of mesenchymal stem cells: Perspective into mechanical induction of MSC fate. Acta Biomaterialia. 2015; 20:1-9.[DOI:10.1016/j.actbio.2015.04.008] [PMID]
57.Balint R, Cassidy NJ, Cartmell SH. Electrical stimulation: A novel tool for tissue engineering. Tissue Engineering. Part B, Reviews. 2013; 19(1):48-57. [DOI:10.1089/ten.teb.2012.0183] [PMID]
58.Hamedfar H, Zivari-Ghader T, Akbarzadeh A, Davaran S. Physicochemical characteristics of chitosan–alginate scaffold containing atorvastatin. Advances in Polymer Technology. 2023; 2023(1):9452164. [DOI:10.1155/2023/9452164]
59.Farahi H, Rafie SM, Jahandideh A, Asghari A, Shirazi-Beheshtiha SH. Safety evaluation of tricalcium phosphate/collagen nanocomposite scaffold in bone defect in New Zealand white rabbit model. Crescent Journal of Medical & Biological Sciences. 2019; 6(4):449-54. [Link]
60.Eftekhari H, Jahandideh A, Asghari A, Akbarzadeh A, Hesaraki S. Assessment of polycaprolacton (PCL) nanocomposite scaffold compared with hydroxyapatite (HA) on healing of segmental femur bone defect in rabbits. Artificial Cells, Nanomedicine, and Biotechnology. 2017; 45(5):961-8. [DOI:10.1080/21691401.2016.1198360] [PMID]
61.Dang W, Li T, Li B, Ma H, Zhai D, Wang X, et al. A bifunctional scaffold with CuFeSe2 nanocrystals for tumor therapy and bone reconstruction. Biomaterials. 2018; 160:92-106. [DOI:10.1016/j.biomaterials.2017.11.020] [PMID]
62.Yanagi T, Kajiya H, Kawaguchi M, Kido H, Fukushima T. Photothermal stress triggered by near infrared-irradiated carbon nanotubes promotes bone deposition in rat calvarial defects. Journal of Biomaterials Applications. 2015; 29(8):1109-18.[DOI:10.1177/0885328214556913] [PMID]
63.Ma H, Luo J, Sun Z, Xia L, Shi M, Liu M, et al. 3D printing of biomaterials with mussel-inspired nanostructures for tumor therapy and tissue regeneration. Biomaterials. 2016; 111:138-48. [DOI:10.1016/j.biomaterials.2016.10.005] [PMID]
64.Einhorn TA, Gerstenfeld LC. Fracture healing: Mechanisms and interventions. Nature Reviews. Rheumatology. 2015; 11(1):45-54. [DOI:10.1038/nrrheum.2014.164] [PMID] [PMCID]
65.Liu Y, Luo D, Yu M, Yu Wang, Shanshan Jin, Zixin Li, et al. Thermodynamically controlled self-assembly of hierarchically staggered architecture as an osteoinductive alternative to bone autografts. Advanced Functional Materials. 2019; 29(10):1806445. [DOI:10.1002/adfm.201806445]
66.Ma L, Feng X, Liang H, Yu Song, Lei Tan, Bingjin Wang, et al. A novel photothermally controlled multifunctional scaffold for clinical treatment of osteosarcoma and tissue regeneration. Materials Today. 2020; 36:48-62. [DOI:10.1016/j.mattod.2019.12.005]
67.Zhang X, Zhang C, Lin Y, Hu P, Shen Y, Wang K, et al. Nanocomposite membranes enhance bone regeneration through restoring physiological electric microenvironment. ACS Nano. 2016; 10(8):7279-86. [DOI:10.1021/acsnano.6b02247] [PMID]
68.Mobini S, Leppik L, Thottakkattumana Parameswaran V, Barker JH. In vitro effect of direct current electrical stimulation on rat mesenchymal stem cells. PeerJ. 2017; 5:e2821.[DOI:10.7717/peerj.2821] [PMID] [PMCID]
69.Bandyopadhyay A, Shivaram A, Mitra I, Bose S. Electrically polarized TiO2 nanotubes on Ti implants to enhance early-stage osseointegration. Acta Biomaterialia. 2019; 96:686-93. [DOI:10.1016/j.actbio.2019.07.028] [PMID] [PMCID]
70.Mushtaq F, Torlakcik H, Vallmajo-Martin Q, Siringil EC, Zhang J, Röhrig C, et al. Magnetoelectric 3D scaffolds for enhanced bone cell proliferation. Applied Materials Today. 2019; 16:290-300. [DOI:10.1016/j.apmt.2019.06.004]
71.Kapat K, Shubhra QT, Zhou M, Leeuwenburgh S. Piezoelectric nano-biomaterials for biomedicine and tissue regeneration. Advanced Functional Materials. 2020; 30(44):1909045.[DOI:10.1002/adfm.201909045]
72.Zhu Y, Yang Q, Yang M, Zhan X, Lan F, He J, et al. Protein corona of magnetic hydroxyapatite scaffold improves cell proliferation via activation of mitogen-activated protein kinase signaling pathway. ACS Nano. 2017; 11(4):3690-704. [DOI:10.1021/acsnano.6b08193] [PMID]
73.Xu HY, Gu N. Magnetic responsive scaffolds and magnetic fields in bone repair and regeneration. Frontiers of Materials Science. 2014; 8:20-31. [DOI:10.1007/s11706-014-0232-1]
74.Sapir-Lekhovitser Y, Rotenberg MY, Jopp J, Friedman G, Polyak B, Cohen S. Magnetically actuated tissue engineered scaffold: Insights into mechanism of physical stimulation. Nanoscale. 2016; 8(6):3386-99. [DOI:10.1039/C5NR05500H] [PMID] [PMCID]
75.Chaudhuri O, Koshy ST, Branco da Cunha C, Shin JW, Verbeke CS, Allison KH, et al. Extracellular matrix stiffness and composition jointly regulate the induction of malignant phenotypes in mammary epithelium. Nature Materials. 2014; 13(10):970-8. [DOI:10.1038/nmat4009] [PMID]
76.Steinmetz NJ, Aisenbrey EA, Westbrook KK, Qi HJ, Bryant SJ. Mechanical loading regulates human MSC differentiation in a multi-layer hydrogel for osteochondral tissue engineering. Acta Biomaterialia. 2015; 21:142-53. [DOI:10.1016/j.actbio.2015.04.015] [PMID]
77.Hu Q, Liu M, Chen G, Xu Z, Lv Y. Demineralized bone scaffolds with tunable matrix stiffness for efficient bone integration. ACS Applied Materials & Interfaces. 2018; 10(33):27669-80. [DOI:10.1021/acsami.8b08668] [PMID]
78.Papachroni KK, Karatzas DN, Papavassiliou KA, Basdra EK, Papavassiliou AG. Mechanotransduction in osteoblast regulation and bone disease. Trends in Molecular Medicine. 2009; 15(5):208-16. [DOI:10.1016/j.molmed.2009.03.001] [PMID]
79.Jiang S, Wang M, He J. A review of biomimetic scaffolds for bone regeneration: Toward a cell-free strategy. Bioengineering & Translational Medicine. 2020; 6(2):e10206. [DOI:10.1002/btm2.10206] [PMID] [PMCID]
80.Stewart C, Akhavan B, Wise SG, Bilek MM. A review of biomimetic surface functionalization for bone-integrating orthopedic implants: Mechanisms, current approaches, and future directions. Progress in Materials Science. 2019; 106:100588. [DOI:10.1016/j.pmatsci.2019.100588]
81.Kossover O, Cohen N, Lewis JA, Berkovitch Y, Peled E, Seliktar D. Growth factor delivery for the repair of a critical size tibia defect using an acellular, biodegradable polyethylene glycol-albumin hydrogel implant. ACS Biomaterials Science & Engineering. 2020; 6(1):100-11. [DOI:10.1021/acsbiomaterials.9b00672] [PMID]
82.Sonbolekar H, Jahandideh A, Asghari A, Hesaraki S, Akbarzadeh, A. [Evaluation of the performance of titanium dioxide nanocomposite scaffold compared to hydroxyapatite on the healing of rabbit femoral bone defects (Persian)]. Journal of Comparative Pathology. 2023; 20(1):4011-8. [Link]
83.Yazdanian A, Jahandideh A, Hesaraki S. The effect of green synthesis of TiO2 nanoparticles/collagen/HA scaffold in bone regeneration: As an animal study. Veterinary Medicine and Science. 2023; 9(5):2342-51. [DOI:10.1002/vms3.1222] [PMID] [PMCID]
84.Zhang L, Dong Y, Xue Y, Shi J, Zhang X, Liu Y, et al. Multifunctional triple-layered composite scaffolds combining platelet-rich fibrin promote bone regeneration. ACS Biomaterials Science & Engineering. 2019; 5(12):6691-702. [DOI:10.1021/acsbiomaterials.9b01022] [PMID]
85.Yassin MA, Fuoco T, Mohamed-Ahmed S, Mustafa K, Finne-Wistrand A. 3D and porous RGDC-functionalized polyester-based scaffolds as a niche to induce osteogenic differentiation of human bone marrow stem cells. Macromolecular Bioscience. 2019; 19(6):e1900049. [DOI:10.1002/mabi.201900049] [PMID]
86.Dos Santos BP, Garbay B, Fenelon M, Rosselin M, Garanger E, Lecommandoux S, et al. Development of a cell-free and growth factor-free hydrogel capable of inducing angiogenesis and innervation after subcutaneous implantation. Acta Biomaterialia. 2019; 99:154-67. [DOI:10.1016/j.actbio.2019.08.028] [PMID]
87.Zeng Y, Shih YR, Baht GS, Varghese S. In vivo sequestration of innate small molecules to promote bone healing. Advanced Materials. 2020; 32(8):1906022. [DOI:10.1002/adma.201906022]
88.Wang Y, Hu X, Dai J, Wang J, Tan Y, Yang X, et al. A 3D graphene coated bioglass scaffold for bone defect therapy based on the molecular targeting approach. Journal of Materials Chemistry. 2017; 5(33):6794-800. [DOI:10.1039/C7TB01515A] [PMID]
89.Eckhart KE, Holt BD, Laurencin MG, Sydlik SA. Covalent conjugation of bioactive peptides to graphene oxide for biomedical applications. Biomaterials Science. 2019; 7(9):3876-85. [DOI:10.1039/C9BM00867E] [PMID]
90.Yan S, Yin J, Cui L, Yang Y, Chen X. Apatite-forming ability of bioactive poly(l-lactic acid)/grafted silica nanocomposites in simulated body fluid. Colloids and Surfaces. B, Biointerfaces. 2011; 86(1):218-24. [DOI:10.1016/j.colsurfb.2011.04.004] [PMID]
91.Wang SJ, Jiang D, Zhang ZZ, Chen YR, Yang ZD, Zhang JY, et al. Biomimetic Nanosilica-Collagen Scaffolds for In Situ Bone Regeneration: Toward a cell-free, one-step surgery. Advanced Materials. 2019; 31(49):e1904341. [DOI:10.1002/adma.201904341] [PMID]
92.Lodoso-Torrecilla I, van Gestel NAP, Diaz-Gomez L, Grosfeld EC, Laperre K, Wolke JGC, et al. Multimodal pore formation in calcium phosphate cements. Journal of Biomedical Materials Research. Part A. 2018; 106(2):500-9. [DOI:10.1002/jbm.a.36245] [PMID] [PMCID]
93.Wubneh A, Tsekoura EK, Ayranci C, Uludağ H. Current state of fabrication technologies and materials for bone tissue engineering. Acta Biomaterialia. 2018; 80:1-30. [DOI:10.1016/j.actbio.2018.09.031] [PMID]
94.Ding W, Ge Y, Zhang T, Zhang C, Yin X. Advanced construction strategies to obtain nanocomposite hydrogels for bone repair and regeneration. NPG Asia Materials. 2024; 16(1):14.[DOI:10.1038/s41427-024-00533-z]
95.Wang B, Ye X, Chen G, Zhang Y, Zeng Z, Liu C, et al. Fabrication and properties of PLA/β-TCP scaffolds using liquid crystal display (LCD) photocuring 3D printing for bone tissue engineering. Frontiers in Bioengineering and Biotechnology. 2024; 12:1273541. [DOI:10.3389/fbioe.2024.1273541] [PMID] [PMCID]
مقاله مروری: مقاله مروری |
موضوع مقاله:
تخصصي
دریافت: 1402/11/21 | پذیرش: 1403/3/9 | انتشار: 1404/1/12
دریافت: 1402/11/21 | پذیرش: 1403/3/9 | انتشار: 1404/1/12
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |