دوره 33، شماره 2 - ( 4-1403 )
جلد 33 شماره 2 صفحات 227-216 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Mohamadianamiri M, Sourati A, Aklamli M. Comparing the Therapeutic Effects of Boric Acid and Fluconazole in the Treatment of Vaginal Candidiasis. JGUMS 2024; 33 (2) :216-227
URL: http://journal.gums.ac.ir/article-1-2626-fa.html
URL: http://journal.gums.ac.ir/article-1-2626-fa.html
محمدیان امیری مهدیس، صورتی آیناز، اکلملی مجید. مقایسه اثر درمانی اسید بوریک و فلوکونازول در درمان کاندیدیازیس واژینال. مجله علوم پزشکی گیلان. 1403; 33 (2) :216-227
1- گروه زنان و زایمان، مرکز تحقیقات آندومتریوز، دانشکده پزشکی، بیمارستان شهید اکبرآبادی، دانشگاه علومپزشکی ایران، تهران، ایران.
2- گروه آنکولوژی پرتودرمانی، دانشکده پزشکی، دانشگاه علومپزشکی گیلان، رشت، ایران.
3- گروه بیهوشی، دانشکده پزشکی، دانشگاه علوم پزشکی ایران، تهران، ایران.
2- گروه آنکولوژی پرتودرمانی، دانشکده پزشکی، دانشگاه علومپزشکی گیلان، رشت، ایران.
3- گروه بیهوشی، دانشکده پزشکی، دانشگاه علوم پزشکی ایران، تهران، ایران.
متن کامل [PDF 3783 kb]
(317 دریافت)
| چکیده (HTML) (1964 مشاهده)
متن کامل: (4266 مشاهده)
مقدمه
ﺗﺮﺷﺤﺎت واژن یﮑﯽ از دﻻیﻞ رایﺞ ﻣﺸﺎوره زﻧﺎن اﺳﺖ. دﺳﺘﮕﺎه ﺗﻨﺎﺳﻠﯽ زﻧﺎن دارای ﻓﻠﻮر ﻣﯿﮑﺮوﺑﯽ ﭘﯿﭽﯿﺪه اﺳﺖ و ﺑﺴﺘﻪ ﺑﻪ ﻋﻮاﻣﻞ ﻣﺨﺘﻠﻔﯽ ازﺟﻤﻠﻪ ﺳﻦ، دوره ﻗﺎﻋﺪﮔﯽ و اﺳﺘﻔﺎده از داروﻫﺎی ﺿﺪﺑﺎرداری ﺧﻮراﮐﯽ تغییرات فیزیولوژیک و پاتولوژیک متعددی در آن مشاهده خواهد شد. ﺗﺮﺷﺤﺎت ﻓﯿﺰیﻮﻟﻮژیﮑﯽ واژن ﺑﯽرﻧﮓ یﺎ ﺳﻔﯿﺪ، بدون ﺑﻮ و بدون ﻋﻮاﻗﺐ اﺳﺖ.
اختلال در عملکرد نرمال واژن عامل مساعدکننده در ایجاد واژینیت است که منجر به ترشحات ﻏﯿﺮﻃﺒﯿﻌﯽ واژن بهصورت زرد، ﺳﺒﺰ، ﻗﻬﻮهای یﺎ ﻗﺮﻣﺰرنگ، ﺑﺎ ﺑﻮی ﺑﺪ، ﺧﺎرش و ﺳﻮزش ادرار ﺑﺴﺘﻪ ﺑﻪ عوامل زمینهای میشود. ﻣﻄﺎﻟﻌﺎت ﻧﺸﺎن داده اﺳﺖ ﮐﻪ شایعترین علل ترشح غیرنرمال واژن، واژینیت کاندیدیایی، باکتریایی و تریکومونیازیس است [1-3].
ﺗﺸﺨﯿﺺ واژیﻨﯿﺖ کاندیدیایی ﺑﺮاﺳﺎس ﻋﻼﺋﻢ ﺑﯿﻤﺎر، ارزیﺎﺑﯽ دﻗﯿﻖ ﻣﯿﮑﺮوﺳﮑﻮﭘﯽ ﺗﺮﺷﺤﺎت واژن و ارزیﺎﺑﯽ PH واژن است [4]. درﻣﺎنﻫﺎی ﺗﺄیﯿﺪﺷﺪه ﺑﺮای ایﻦ ﺑﯿﻤﺎری که 41/4 درﺻﺪ از اﻧﻮاع واژیﻨﯿﺖﻫﺎ را ﺷﺎﻣﻞ ﻣﯽﺷﻮد، ﻋﺒﺎرتاند از: ﻃﯿﻒ ﮔﺴﺘﺮدهای از داروﻫﺎی ﻣﻮﺿﻌﯽ ﺿﺪقارچی ﮐﻪ ﺑﻪﺻﻮرت ﺗﯿﭙﯿﮏ ﺑﺮای 1 ﺗﺎ 3 روز ﻣﺼﺮف ﻣﯽﺷﻮﻧﺪ و داروی ﺧﻮراﮐﯽ ﻓﻠﻮﮐﻮﻧﺎزول 150 ﻣﯿﻠﯽﮔﺮم. ﻫﻢ داروﻫﺎی آزولی ﻣﻮﺿﻌﯽ و ﻫﻢ داروﻫﺎی آزولی ﺧﻮراﮐﯽ ﺑﺎﻋﺚ ﺗﺴﮑﯿﻦ ﻋﻼئو و ﻣﻨﻔﯽ ﺷﺪن ﮐﺸﺖ در 80 ﺗﺎ 90 درﺻﺪ از ﺑﯿﻤﺎران ﻣﯽﺷﻮﻧﺪ [5, 6, 7] درﻣﺎنﻫﺎیﯽ ﮐﻪ اﻣﺮوزه ﺑﺮای ﻋﻔﻮﻧﺖﻫﺎی واژینیت ﻗﺎرﭼﯽ ﻣﺰﻣﻦ و ﻋﻮدﮐﻨﻨﺪه ﺑﻪ ﮐﺎر ﻣﯽرود ﺗﺠﺮﺑﯽ ﺑﻮده و درﻣﺎن ﮐﺎﻣﻞ یﮏﻫﻔﺘﻪای ﺑﺎ ﻓﻠﻮﮐﻮﻧﺎزول ﻣﯽﺗﻮاﻧﺪ ﻣﯿﺰان ﻋﻮد کاندیدیازیس واژیﻨﺎل را ﮐﺎﻫﺶ دﻫﺪ [8, 9]. اﺻﻮل درﻣﺎن ﺑﺮﭘﺎیﻪ درﻣﺎن ﮐﺎﻣﻞ و ﺳﭙﺲ درﻣﺎن ﻧﮕﻬﺪارﻧﺪه ﺗﺎ 6 ﻣﺎه است. ﻗﻄﻊ درﻣﺎن در 50 درﺻﺪ ﺑﯿﻤﺎران ﻣﻨﺠﺮ ﺑﻪ ﺑﺎزﮔﺸﺖ ﻋﻔﻮﻧﺖ ﻣﯽشود. در عفونتهای مقاوم به درمان باید از درمانهای کمکی نظیر کتوکونازول و ایتراکونازول به همراه فلوکونازول استفاده کرد [10-12]. باتوجهبه اثر بخشی فلوکونازول بهعنوان داروی مؤثر بر طیف گستردهای از گونههای کاندیدا، استفاده از آن برای پیشگری از ابتلای به واژینیت کاندیدیایی عودکننده، توصیه میشود [13]. بااینحال در درمانهای طولانیمدت با فلوکوناول، کاندیدا آلبیکنس توانایی مقاوم شدن را دارد [14]. ﻫﻤﭽﻨﯿﻦ در ﻣﻄﺎﻟﻌﺎت ﺑﺮای ﻓﻠﻮﮐﻮﻧﺎزول ﻋﻮارﺿﯽ ازﺟﻤﻠﻪ ﻣﺸﮑﻼت ﮔﻮارﺷﯽ ﻣﺜﻞ اﺳﻬﺎل و اﺳﺘﻔﺮاغ، درد ﻣﻌﺪه و ﺳﻤﯿﺖ ﮐﺒﺪی دیﺪه ﺷﺪه اﺳﺖ [15]. اخیراً به دلیل کاهش پیدایش مهارکنندههای دارویی در واژن، تمایل به کوتاه کردن زمان درمان با داروهای آژولی به مدت 3 روز بهویژه برای فلوکونازول، افزایش یافته است [16].
هنگام عود بیماری کاندیدیازیس واژینال آن هم پس از استفاده از فلوکونازول بهعنوان اولین داروی انتخابی برای درمان و یا شک به حضور گونههای غیر از کاندیدا آلبیکنس، استفاده از شیاف و پماد موضعی اسید بوریک، توصیه میشود [17-20].
علیرﻏﻢ ایﻦ ﻣﻮﻓﻘﯿﺖ، اﺳﯿﺪ ﺑﻮریﮏ همچنان یﮏ درﻣﺎن ﺧﻂ دوم اﺳﺖ، زیﺮا ﻣﮑﺎﻧﯿﺴﻢ دﻗﯿﻖ اﺛﺮ آن ﻧﺎﺷﻨﺎﺧﺘﻪ اﺳﺖ و ﻣﻄﺎﻟﻌﺎت ﮐﻤﺘﺮی اﺛﺮﺑﺨﺸﯽ و اﺛﺮات ﻃﻮﻻﻧﯽﻣﺪت اﺣﺘﻤﺎﻟﯽ آن را ارزیﺎﺑﯽ ﮐﺮده اﺳﺖ [21، 22] ﺑﻮریﮏ اﺳﯿﺪ ﺑﻪﻋﻨﻮان داروی ﺿﺪﻣﯿﮑﺮوﺑﯽ وﺳﯿﻊاﻟﻄﯿﻒ، به شکل شیافهای روغنی داخل واژن، استفاده میشود. در اﻧﺘﺨﺎب درﻣﺎن ﻣﻨﺎﺳﺐ ﺑﺎیﺪ ﭘﺎﺳﺦ ﺑﻪ درﻣﺎن ﻗﺒﻠﯽ و ﻫﺰیﻨﻪ درﻣﺎن را در ﻧﻈﺮ داﺷﺖ.
کاندیدیازیس واژینال با عوارض شدید، به یک بیماری متوسط تا شدید با 4 دوره درگیری در سال و یا بیشتر، به همراه مشاهده میکروسکوپی مخمرهای جوانهزن و گهگاه عوامل مستعدکنندهای نظیر بارداری، دیابت و نقص ایمنی، گفته میشود [23].
در ﻣﻮارد ﮐﺎﻧﺪیﺪیﺎز ووﻟﻮواژیﻨﺎل ﺷﺪیﺪ ﺗﺠﻮیﺰ دُز دوم ﻓﻠﻮﮐﻮﻧﺎزول (150 ﻣﯿﻠﯽﮔﺮم) 72 ﺳﺎﻋﺖ ﭘﺲ از دُز اول، ﻣﯿﺰان ﻋﻼج را از 67 درﺻﺪ ﺑﻪ 80 درﺻﺪ اﻓﺰایﺶ میدﻫﺪ [24, 25]. آلودگی با گونههایی غیر ازکاندیدا آلبیکنس که اغلب مقاوم به فلوکونازول هستند در زﻧﺎﻧﯽ ﮐﻪ از ﮐﭙﺴﻮلﻫﺎی اﺳﯿﺪ ﺑﻮریﮏ واژیﻨﺎل (600 ﻣﯿﻠﯽﮔﺮم روزاﻧﻪ) ﺑﺮای ﺣﺪاﻗﻞ 14 روز اﺳﺘﻔﺎده میکنند، میتواند میزان بهبودی را به 75 درصد افزایش دهد [24-26]. ﺑﺎایﻦﺣﺎل در ﺑﺮﺧﯽ ﻣﻄﺎﻟﻌﺎت ﻋﻮارﺿﯽ ازﺟﻤﻠﻪ اﺣﺴﺎس ﺳﻮزش و ﺑﺜﻮرات ﭘﻮﺳﺘﯽ ﺑﺮای اﺳﯿﺪ ﺑﻮریﮏ ﮔﺰارش ﺷﺪه اﺳﺖ [27].
ﺑﺎﺗﻮﺟﻪﺑﻪ اﻫﻤﯿﺖ ﺷﻨﺎﺧﺖ ﺑﻬﺘﺮیﻦ ﺷﯿﻮه درﻣﺎﻧﯽ در ﻣﺒﺘﻼیﺎن ﺑﻪ واژیﻨﯿﺖ ﮐﺎﻧﺪیﺪایﯽ اﻧﺠﺎم ﮐﺎرآزﻣﺎیﯽهای ﺑﺎﻟﯿﻨﯽ اﻫﻤﯿﺘﯽ ویﮋه دارﻧﺪ. ﺑﺮ ﻫﻤﯿﻦ اﺳﺎس و ﺑﺎﺗﻮﺟﻪﺑﻪ اﻫﻤﯿﺖ ﻣﻮﺿﻮع، ﺑﺮ آن ﺷﺪیﻢ ﺗﺎ در ایﻦ ﻣﻄﺎﻟﻌﻪ ﺑﻪ ﺑﺮرﺳﯽ ﻣﻘﺎیﺴﻪای ﻣﯿﺰان اﺛﺮﺑﺨﺸﯽ ﺑﻮریﮏ اﺳﯿﺪ و ﻓﻠﻮﮐﻮﻧﺎزول و ﻣﯿﺰان ﻋﻮارض آنها در درﻣﺎن واژیﻨﯿﺖ ﮐﺎﻧﺪیﺪایﯽ ﺑﭙﺮدازیﻢ ﺗﺎ ﺑﺎ اﻧﺘﺨﺎب روش درﻣﺎﻧﯽ ﻣﻨﺎﺳﺐ از پیامدهای ناگوار اقتصادیاجتماعی پدیدآمده از واژنیت کاندیدیایی طولانیمدت کم کرده و درمان مناسبی را انتخاب کنیم.
روشها
این پژوهش یک مطالعه ﺗﺼﺎدﻓﯽ ﻏﯿﺮﮐﻮر است که از آبان تا دی 1400 بر روی50 ﻧﻔﺮ از ﺧﺎنمهای ﻣﺒﺘﻼ ﺑﻪ واژیﻨﯿﺖ ﮐﺎﻧﺪیﺪایﯽ (ﺑﺮاﺳﺎس ﺑﺮرﺳﯽهای ﺑﺎﻟﯿﻨﯽ و ﻣﯿﮑﺮوﺑﯿﻮﻟﻮژیﮏ) ﮐﻪ ﺑﻪ ﺑﯿﻤﺎرﺳﺘﺎنهای داﻧﺸﮕﺎه ایﺮان ﻣﺮاﺟﻌﻪ کردند، ﺑﻪﺻﻮرت دردﺳﺘﺮس انجام ﺷﺪ.
در ﺑﺪو ورود ﻫﺪف ﻣﻄﺎﻟﻌﻪ و روش ﮐﺎر ﺑﻪ ﺷﺮﮐﺖﮐﻨﻨﺪﮔﺎن ﺗﻮﺿﯿﺢ داده ﺷﺪ و از آنها رﺿﺎیﺖ ﻧﺎﻣﻪ ورود ﺑﻪ ﻣﻄﺎﻟﻌﻪ اﺧﺬ ﺷﺪ. ﻣﻄﺎﻟﻌﻪ ﺑﻪﺻﻮرت ﻣﯿﺪاﻧﯽ انجام شد و اﻃﻼﻋﺎت ﻣﻮردﻧﯿﺎز ﺑﯿﻤﺎران از ﺳﻦ، وﺿﻌﯿﺖ تأﻫﻞ، ﺳﺎﺑﻘﻪ اﺑﺘﻼ ﺑﻪ ﺑﯿﻤﺎریهای زﻣﯿﻨﻪای ازﺟﻤﻠﻪ دیﺎﺑﺖ، وﺿﻌﯿﺖ ﺑﺎرداری، ﺳﺎﺑﻘﻪ ﻣﺼﺮف دارویﯽ، ﺷﺎﺧﺺ ﺗﻮده ﺑﺪﻧﯽ و ﺳﺎیﺮ اﻃﻼﻋﺎت ﻣﻮردﻧﯿﺎز از ﭘﺮوﻧﺪه ﺑﯿﻤﺎران اﺳﺘﺨﺮاج و از ﭼﮏﻟﯿﺴﺖ از ﭘﯿﺶ ﺗﻬﯿﻪﺷﺪه ﺑﺮای ﺛﺒﺖ دادههای ﻫﺮیﮏ از ﮔﺮوهﻫﺎ اﺳﺘﻔﺎده ﺷﺪ.
بیماران تحت معاینه بالینی، اسمیر مستقیم ترشحات و کشت ترشحات قرار گرفتند که در صورت اثبات واژینیت کاندیدیایی وارد مطالعه شدند. مشاهده ترشحات پنیری، اریتم و ادم بهعنوان نشانه التهابی در نظر گرفته شد. سواپ واژینال برای اسمیر مستقیم و کشت ترشحات انجام شد. ﺗﺸﺨﯿﺺ و تأیﯿﺪ واژیﻨﯿﺖ ﺑﯿﻤﺎران ﺑﺮاﺳﺎس ﻋﻼﺋﻢ ﺑﯿﻤﺎر، ارزیﺎﺑﯽ دﻗﯿﻖ ﻣﯿﮑﺮوﺳﮑﻮﭘﯽ ﺗﺮﺷﺤﺎت واژن در آزﻣﺎیﺸﮕﺎه، ارزیﺎﺑﯽ ﮐﻤﯽ ﮔﻠﺒﻮلهای ﺳﻔﯿﺪ و ارزیﺎﺑﯽ PH واژن اﻧﺠﺎم ﺷﺪ [4]. ﻣﻌﯿﺎرﻫﺎی ﺗﺸﺨﯿﺺ آزﻣﺎیﺸﮕﺎﻫﯽ ﺷﺎﻣﻞ ﻣﻮارد زیﺮ است:
1. مشاهده ﻣﺴﺘﻘﯿﻢ ﻣﺨﻤﺮ ﺑﺎ رﻧﮓآﻣﯿﺰی ﮔﺮم 2. ﮐﺸﺖ ﺑﺮ روی سابورو دکستروز آگار مکمل با 2 میلیگرم در ﻣﯿﻠﯽﻟﯿﺘﺮ ﺟﻨﺘﺎﻣﺎیﺴﯿﻦ ﺑﺎ و ﺑﺪون ﺳﯿﮑﻠﻮﻫﮕﺰاﻣﯿﺪ (0/05 درصد).
ﺷﻨﺎﺳﺎیﯽ ﮔﻮﻧﻪهای ﮐﺎﻧﺪیﺪا ﺑﺎ ﺑﺮرﺳﯽ ﻣﻮرﻓﻮﻟﻮژی ﮐﻠﻨﯽ، آزﻣﺎیﺶ ﻟﻮﻟﻪ زایﺎ، ﻣﻮرﻓﻮﻟﻮژی ﻫﯿﻒ و ﺗﺸﮑﯿﻞ ﮐﻼﻣﯿﺪوﺳﭙﻮر ﺑﺮ روی آرد ذرت آﮔﺎر، آزﻣﺎیﺶ تری فنیل تترازولیوم کلراید، ﺗﺨﻤﯿﺮ و ﺟﺬب ﻗﻨﺪﻫﺎی ﻣﺨﺘﻠﻒ و ﺣﺴﺎﺳﯿﺖ ﺑﻪ سیکلوهگزآمید اﻧﺠﺎم ﺷﺪ.
بیماران مبتلا به سایر عفونتهای واژینال مثل تریکوموناس واژینالیس یا عفونتهای باکتریایی از مطالعه خارج شدند.
ﻣﻌﯿﺎر ورود ﺑﻪ ﻣﻄﺎﻟﻌﻪ: ﺳﻦ ﺑﺎﻻی 18 ﺳﺎل و ﻣﺮاﺟﻌﻪ ﺑﻪ درﻣﺎﻧﮕﺎههای علومپزشکی ایران ﺑﺎ ﺷﻮاﻫﺪ اﺑﺘﻼ ﺑﻪ واژیﻨﯿﺖ ﮐﺎﻧﺪیﺪیﺎیﯽ ﺑﺮاﺳﺎس ﺑﺮرﺳﯽهای ﺑﺎﻟﯿﻨﯽ و ﻣﯿﮑﺮوﺑﯿﻮﻟﻮژیﮏ. ﻣﻌﯿﺎرهای ﺧﺮوج از ﻣﻄﺎﻟﻌﻪ: اﺑﺘﻼی همزﻣﺎن به بیش از یک عامل بیماریزا، ﺑﯿﻤﺎران دﭼﺎر ﻧﻘﺺ ایﻤﻨﯽ، ﺑﯿﻤﺎراﻧﯽ ﮐﻪ ﺗﻤﺎیﻞ ﺑﻪ ﺷﺮﮐﺖ در ﻣﻄﺎﻟﻌﻪ ﻧﺪاشتند یﺎ اﻣﮑﺎن ﭘﯿﮕﯿﺮی آنها وﺟﻮد ﻧﺪاﺷﺖ، اﻓﺮاد ﺑﺎردار، ﮐﺴﺎﻧﯽ ﮐﻪ ﺗﺤﺖ درﻣﺎن ﺑﺎ اﺳﺘﺮوﺋﯿﺪ ﺑﻮدﻧﺪ، ﺑﯿﻤﺎراﻧﯽ ﮐﻪ ﺑﺮای ﻣﻌﺎیﻨﻪ ﻟﮕﻦ رﺿﺎیﺖ ﻧﺪادﻧﺪ، اﻓﺮادی ﮐﻪ در ﻃﯽ 3 ﻣﺎه ﮔﺬﺷﺘﻪ ﺑﺮای ﺗﺮﺷﺤﺎت واژن ﺗﺤﺖ درﻣﺎن ﻗﺮار ﮔﺮﻓﺘﻨﺪ و ﺑﯿﻤﺎران ﻋﻼﻣﺖدار ﮐﻪ رﺷﺪ ﮐﺎﻧﺪیﺪا در ﮐﺸﺖ ﻗﺎرچ در آنها ﻣﺸﺎﻫﺪه ﻧﺸﺪ.
در تعیین ﺣﺠﻢ ﻧﻤﻮﻧﻪ ﺑﺎﺗﻮﺟﻪﺑﻪ ﻧﺘﺎیﺞ ﻣﻄﺎﻟﻌﻪ ری و همکاران [28] و ﺑﺮاﺳﺎس ﻓﺮﻣﻮل شماره 1، ﺑﺎ در ﻧﻈﺮ ﮔﺮﻓﺘﻦ آﻟﻔﺎ ﺑﻪ ﻣﯿﺰان 0/05، ﺑﺘﺎ ﺑﻪ ﻣﯿﺰان 0/2، P1 به میزان 0/6 و P2 به میزان 0/3 46 ﻧﻔﺮدر 2 ﮔﺮوه 23 ﻧﻔﺮی وارد ﻣﻄﺎﻟﻌﻪ ﺷدﻧﺪ ﮐﻪ ﺑﺎ اﻓﺰایﺶ 10 درﺻﺪی ﺑﺮای ﻣﻮارد اﺣﺘﻤﺎﻟﯽ ﻏﯿﺮﻗﺎﺑﻞﭘﯿﮕﯿﺮی 25 ﻧﻔﺮ در ﻫﺮ ﮔﺮوه وارد شدﻧﺪ.
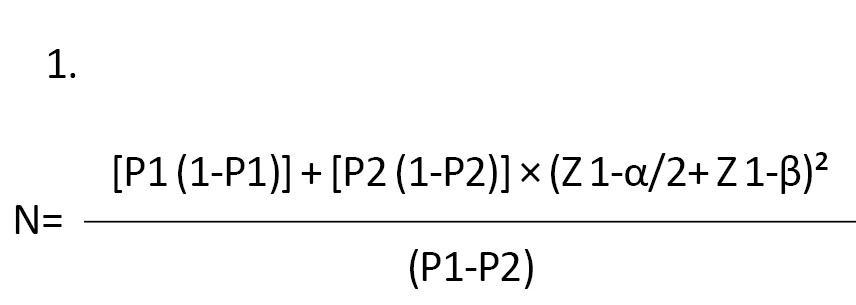
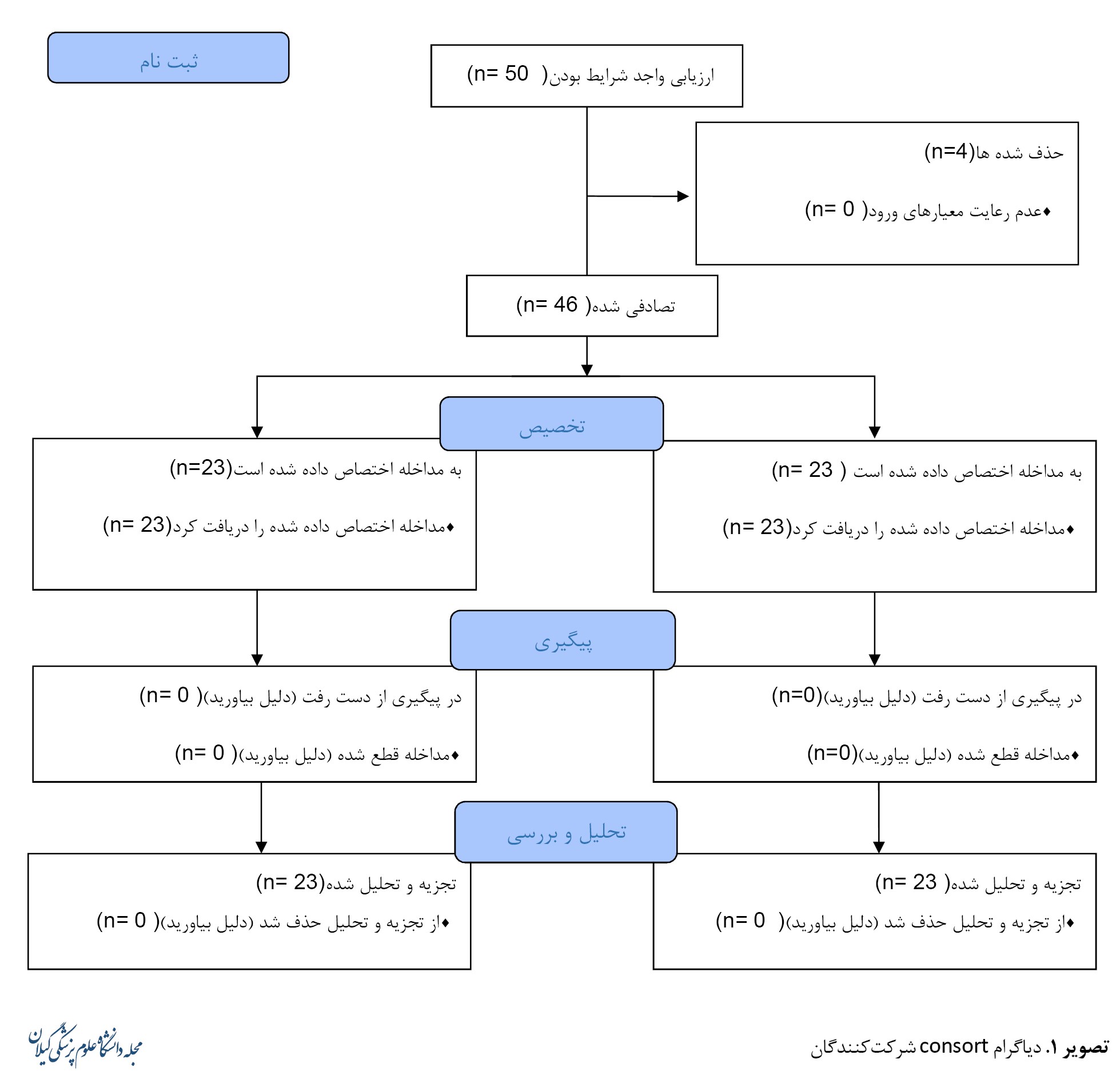
پس از تأیید واژینیت کاندیدایی 46 بیمار وارد مطالعه و 4 نفر از مطالعه خارج شدند (تصویر شماره 1).
ﺗﺮﺷﺤﺎت واژن یﮑﯽ از دﻻیﻞ رایﺞ ﻣﺸﺎوره زﻧﺎن اﺳﺖ. دﺳﺘﮕﺎه ﺗﻨﺎﺳﻠﯽ زﻧﺎن دارای ﻓﻠﻮر ﻣﯿﮑﺮوﺑﯽ ﭘﯿﭽﯿﺪه اﺳﺖ و ﺑﺴﺘﻪ ﺑﻪ ﻋﻮاﻣﻞ ﻣﺨﺘﻠﻔﯽ ازﺟﻤﻠﻪ ﺳﻦ، دوره ﻗﺎﻋﺪﮔﯽ و اﺳﺘﻔﺎده از داروﻫﺎی ﺿﺪﺑﺎرداری ﺧﻮراﮐﯽ تغییرات فیزیولوژیک و پاتولوژیک متعددی در آن مشاهده خواهد شد. ﺗﺮﺷﺤﺎت ﻓﯿﺰیﻮﻟﻮژیﮑﯽ واژن ﺑﯽرﻧﮓ یﺎ ﺳﻔﯿﺪ، بدون ﺑﻮ و بدون ﻋﻮاﻗﺐ اﺳﺖ.
اختلال در عملکرد نرمال واژن عامل مساعدکننده در ایجاد واژینیت است که منجر به ترشحات ﻏﯿﺮﻃﺒﯿﻌﯽ واژن بهصورت زرد، ﺳﺒﺰ، ﻗﻬﻮهای یﺎ ﻗﺮﻣﺰرنگ، ﺑﺎ ﺑﻮی ﺑﺪ، ﺧﺎرش و ﺳﻮزش ادرار ﺑﺴﺘﻪ ﺑﻪ عوامل زمینهای میشود. ﻣﻄﺎﻟﻌﺎت ﻧﺸﺎن داده اﺳﺖ ﮐﻪ شایعترین علل ترشح غیرنرمال واژن، واژینیت کاندیدیایی، باکتریایی و تریکومونیازیس است [1-3].
ﺗﺸﺨﯿﺺ واژیﻨﯿﺖ کاندیدیایی ﺑﺮاﺳﺎس ﻋﻼﺋﻢ ﺑﯿﻤﺎر، ارزیﺎﺑﯽ دﻗﯿﻖ ﻣﯿﮑﺮوﺳﮑﻮﭘﯽ ﺗﺮﺷﺤﺎت واژن و ارزیﺎﺑﯽ PH واژن است [4]. درﻣﺎنﻫﺎی ﺗﺄیﯿﺪﺷﺪه ﺑﺮای ایﻦ ﺑﯿﻤﺎری که 41/4 درﺻﺪ از اﻧﻮاع واژیﻨﯿﺖﻫﺎ را ﺷﺎﻣﻞ ﻣﯽﺷﻮد، ﻋﺒﺎرتاند از: ﻃﯿﻒ ﮔﺴﺘﺮدهای از داروﻫﺎی ﻣﻮﺿﻌﯽ ﺿﺪقارچی ﮐﻪ ﺑﻪﺻﻮرت ﺗﯿﭙﯿﮏ ﺑﺮای 1 ﺗﺎ 3 روز ﻣﺼﺮف ﻣﯽﺷﻮﻧﺪ و داروی ﺧﻮراﮐﯽ ﻓﻠﻮﮐﻮﻧﺎزول 150 ﻣﯿﻠﯽﮔﺮم. ﻫﻢ داروﻫﺎی آزولی ﻣﻮﺿﻌﯽ و ﻫﻢ داروﻫﺎی آزولی ﺧﻮراﮐﯽ ﺑﺎﻋﺚ ﺗﺴﮑﯿﻦ ﻋﻼئو و ﻣﻨﻔﯽ ﺷﺪن ﮐﺸﺖ در 80 ﺗﺎ 90 درﺻﺪ از ﺑﯿﻤﺎران ﻣﯽﺷﻮﻧﺪ [5, 6, 7] درﻣﺎنﻫﺎیﯽ ﮐﻪ اﻣﺮوزه ﺑﺮای ﻋﻔﻮﻧﺖﻫﺎی واژینیت ﻗﺎرﭼﯽ ﻣﺰﻣﻦ و ﻋﻮدﮐﻨﻨﺪه ﺑﻪ ﮐﺎر ﻣﯽرود ﺗﺠﺮﺑﯽ ﺑﻮده و درﻣﺎن ﮐﺎﻣﻞ یﮏﻫﻔﺘﻪای ﺑﺎ ﻓﻠﻮﮐﻮﻧﺎزول ﻣﯽﺗﻮاﻧﺪ ﻣﯿﺰان ﻋﻮد کاندیدیازیس واژیﻨﺎل را ﮐﺎﻫﺶ دﻫﺪ [8, 9]. اﺻﻮل درﻣﺎن ﺑﺮﭘﺎیﻪ درﻣﺎن ﮐﺎﻣﻞ و ﺳﭙﺲ درﻣﺎن ﻧﮕﻬﺪارﻧﺪه ﺗﺎ 6 ﻣﺎه است. ﻗﻄﻊ درﻣﺎن در 50 درﺻﺪ ﺑﯿﻤﺎران ﻣﻨﺠﺮ ﺑﻪ ﺑﺎزﮔﺸﺖ ﻋﻔﻮﻧﺖ ﻣﯽشود. در عفونتهای مقاوم به درمان باید از درمانهای کمکی نظیر کتوکونازول و ایتراکونازول به همراه فلوکونازول استفاده کرد [10-12]. باتوجهبه اثر بخشی فلوکونازول بهعنوان داروی مؤثر بر طیف گستردهای از گونههای کاندیدا، استفاده از آن برای پیشگری از ابتلای به واژینیت کاندیدیایی عودکننده، توصیه میشود [13]. بااینحال در درمانهای طولانیمدت با فلوکوناول، کاندیدا آلبیکنس توانایی مقاوم شدن را دارد [14]. ﻫﻤﭽﻨﯿﻦ در ﻣﻄﺎﻟﻌﺎت ﺑﺮای ﻓﻠﻮﮐﻮﻧﺎزول ﻋﻮارﺿﯽ ازﺟﻤﻠﻪ ﻣﺸﮑﻼت ﮔﻮارﺷﯽ ﻣﺜﻞ اﺳﻬﺎل و اﺳﺘﻔﺮاغ، درد ﻣﻌﺪه و ﺳﻤﯿﺖ ﮐﺒﺪی دیﺪه ﺷﺪه اﺳﺖ [15]. اخیراً به دلیل کاهش پیدایش مهارکنندههای دارویی در واژن، تمایل به کوتاه کردن زمان درمان با داروهای آژولی به مدت 3 روز بهویژه برای فلوکونازول، افزایش یافته است [16].
هنگام عود بیماری کاندیدیازیس واژینال آن هم پس از استفاده از فلوکونازول بهعنوان اولین داروی انتخابی برای درمان و یا شک به حضور گونههای غیر از کاندیدا آلبیکنس، استفاده از شیاف و پماد موضعی اسید بوریک، توصیه میشود [17-20].
علیرﻏﻢ ایﻦ ﻣﻮﻓﻘﯿﺖ، اﺳﯿﺪ ﺑﻮریﮏ همچنان یﮏ درﻣﺎن ﺧﻂ دوم اﺳﺖ، زیﺮا ﻣﮑﺎﻧﯿﺴﻢ دﻗﯿﻖ اﺛﺮ آن ﻧﺎﺷﻨﺎﺧﺘﻪ اﺳﺖ و ﻣﻄﺎﻟﻌﺎت ﮐﻤﺘﺮی اﺛﺮﺑﺨﺸﯽ و اﺛﺮات ﻃﻮﻻﻧﯽﻣﺪت اﺣﺘﻤﺎﻟﯽ آن را ارزیﺎﺑﯽ ﮐﺮده اﺳﺖ [21، 22] ﺑﻮریﮏ اﺳﯿﺪ ﺑﻪﻋﻨﻮان داروی ﺿﺪﻣﯿﮑﺮوﺑﯽ وﺳﯿﻊاﻟﻄﯿﻒ، به شکل شیافهای روغنی داخل واژن، استفاده میشود. در اﻧﺘﺨﺎب درﻣﺎن ﻣﻨﺎﺳﺐ ﺑﺎیﺪ ﭘﺎﺳﺦ ﺑﻪ درﻣﺎن ﻗﺒﻠﯽ و ﻫﺰیﻨﻪ درﻣﺎن را در ﻧﻈﺮ داﺷﺖ.
کاندیدیازیس واژینال با عوارض شدید، به یک بیماری متوسط تا شدید با 4 دوره درگیری در سال و یا بیشتر، به همراه مشاهده میکروسکوپی مخمرهای جوانهزن و گهگاه عوامل مستعدکنندهای نظیر بارداری، دیابت و نقص ایمنی، گفته میشود [23].
در ﻣﻮارد ﮐﺎﻧﺪیﺪیﺎز ووﻟﻮواژیﻨﺎل ﺷﺪیﺪ ﺗﺠﻮیﺰ دُز دوم ﻓﻠﻮﮐﻮﻧﺎزول (150 ﻣﯿﻠﯽﮔﺮم) 72 ﺳﺎﻋﺖ ﭘﺲ از دُز اول، ﻣﯿﺰان ﻋﻼج را از 67 درﺻﺪ ﺑﻪ 80 درﺻﺪ اﻓﺰایﺶ میدﻫﺪ [24, 25]. آلودگی با گونههایی غیر ازکاندیدا آلبیکنس که اغلب مقاوم به فلوکونازول هستند در زﻧﺎﻧﯽ ﮐﻪ از ﮐﭙﺴﻮلﻫﺎی اﺳﯿﺪ ﺑﻮریﮏ واژیﻨﺎل (600 ﻣﯿﻠﯽﮔﺮم روزاﻧﻪ) ﺑﺮای ﺣﺪاﻗﻞ 14 روز اﺳﺘﻔﺎده میکنند، میتواند میزان بهبودی را به 75 درصد افزایش دهد [24-26]. ﺑﺎایﻦﺣﺎل در ﺑﺮﺧﯽ ﻣﻄﺎﻟﻌﺎت ﻋﻮارﺿﯽ ازﺟﻤﻠﻪ اﺣﺴﺎس ﺳﻮزش و ﺑﺜﻮرات ﭘﻮﺳﺘﯽ ﺑﺮای اﺳﯿﺪ ﺑﻮریﮏ ﮔﺰارش ﺷﺪه اﺳﺖ [27].
ﺑﺎﺗﻮﺟﻪﺑﻪ اﻫﻤﯿﺖ ﺷﻨﺎﺧﺖ ﺑﻬﺘﺮیﻦ ﺷﯿﻮه درﻣﺎﻧﯽ در ﻣﺒﺘﻼیﺎن ﺑﻪ واژیﻨﯿﺖ ﮐﺎﻧﺪیﺪایﯽ اﻧﺠﺎم ﮐﺎرآزﻣﺎیﯽهای ﺑﺎﻟﯿﻨﯽ اﻫﻤﯿﺘﯽ ویﮋه دارﻧﺪ. ﺑﺮ ﻫﻤﯿﻦ اﺳﺎس و ﺑﺎﺗﻮﺟﻪﺑﻪ اﻫﻤﯿﺖ ﻣﻮﺿﻮع، ﺑﺮ آن ﺷﺪیﻢ ﺗﺎ در ایﻦ ﻣﻄﺎﻟﻌﻪ ﺑﻪ ﺑﺮرﺳﯽ ﻣﻘﺎیﺴﻪای ﻣﯿﺰان اﺛﺮﺑﺨﺸﯽ ﺑﻮریﮏ اﺳﯿﺪ و ﻓﻠﻮﮐﻮﻧﺎزول و ﻣﯿﺰان ﻋﻮارض آنها در درﻣﺎن واژیﻨﯿﺖ ﮐﺎﻧﺪیﺪایﯽ ﺑﭙﺮدازیﻢ ﺗﺎ ﺑﺎ اﻧﺘﺨﺎب روش درﻣﺎﻧﯽ ﻣﻨﺎﺳﺐ از پیامدهای ناگوار اقتصادیاجتماعی پدیدآمده از واژنیت کاندیدیایی طولانیمدت کم کرده و درمان مناسبی را انتخاب کنیم.
روشها
این پژوهش یک مطالعه ﺗﺼﺎدﻓﯽ ﻏﯿﺮﮐﻮر است که از آبان تا دی 1400 بر روی50 ﻧﻔﺮ از ﺧﺎنمهای ﻣﺒﺘﻼ ﺑﻪ واژیﻨﯿﺖ ﮐﺎﻧﺪیﺪایﯽ (ﺑﺮاﺳﺎس ﺑﺮرﺳﯽهای ﺑﺎﻟﯿﻨﯽ و ﻣﯿﮑﺮوﺑﯿﻮﻟﻮژیﮏ) ﮐﻪ ﺑﻪ ﺑﯿﻤﺎرﺳﺘﺎنهای داﻧﺸﮕﺎه ایﺮان ﻣﺮاﺟﻌﻪ کردند، ﺑﻪﺻﻮرت دردﺳﺘﺮس انجام ﺷﺪ.
در ﺑﺪو ورود ﻫﺪف ﻣﻄﺎﻟﻌﻪ و روش ﮐﺎر ﺑﻪ ﺷﺮﮐﺖﮐﻨﻨﺪﮔﺎن ﺗﻮﺿﯿﺢ داده ﺷﺪ و از آنها رﺿﺎیﺖ ﻧﺎﻣﻪ ورود ﺑﻪ ﻣﻄﺎﻟﻌﻪ اﺧﺬ ﺷﺪ. ﻣﻄﺎﻟﻌﻪ ﺑﻪﺻﻮرت ﻣﯿﺪاﻧﯽ انجام شد و اﻃﻼﻋﺎت ﻣﻮردﻧﯿﺎز ﺑﯿﻤﺎران از ﺳﻦ، وﺿﻌﯿﺖ تأﻫﻞ، ﺳﺎﺑﻘﻪ اﺑﺘﻼ ﺑﻪ ﺑﯿﻤﺎریهای زﻣﯿﻨﻪای ازﺟﻤﻠﻪ دیﺎﺑﺖ، وﺿﻌﯿﺖ ﺑﺎرداری، ﺳﺎﺑﻘﻪ ﻣﺼﺮف دارویﯽ، ﺷﺎﺧﺺ ﺗﻮده ﺑﺪﻧﯽ و ﺳﺎیﺮ اﻃﻼﻋﺎت ﻣﻮردﻧﯿﺎز از ﭘﺮوﻧﺪه ﺑﯿﻤﺎران اﺳﺘﺨﺮاج و از ﭼﮏﻟﯿﺴﺖ از ﭘﯿﺶ ﺗﻬﯿﻪﺷﺪه ﺑﺮای ﺛﺒﺖ دادههای ﻫﺮیﮏ از ﮔﺮوهﻫﺎ اﺳﺘﻔﺎده ﺷﺪ.
بیماران تحت معاینه بالینی، اسمیر مستقیم ترشحات و کشت ترشحات قرار گرفتند که در صورت اثبات واژینیت کاندیدیایی وارد مطالعه شدند. مشاهده ترشحات پنیری، اریتم و ادم بهعنوان نشانه التهابی در نظر گرفته شد. سواپ واژینال برای اسمیر مستقیم و کشت ترشحات انجام شد. ﺗﺸﺨﯿﺺ و تأیﯿﺪ واژیﻨﯿﺖ ﺑﯿﻤﺎران ﺑﺮاﺳﺎس ﻋﻼﺋﻢ ﺑﯿﻤﺎر، ارزیﺎﺑﯽ دﻗﯿﻖ ﻣﯿﮑﺮوﺳﮑﻮﭘﯽ ﺗﺮﺷﺤﺎت واژن در آزﻣﺎیﺸﮕﺎه، ارزیﺎﺑﯽ ﮐﻤﯽ ﮔﻠﺒﻮلهای ﺳﻔﯿﺪ و ارزیﺎﺑﯽ PH واژن اﻧﺠﺎم ﺷﺪ [4]. ﻣﻌﯿﺎرﻫﺎی ﺗﺸﺨﯿﺺ آزﻣﺎیﺸﮕﺎﻫﯽ ﺷﺎﻣﻞ ﻣﻮارد زیﺮ است:
1. مشاهده ﻣﺴﺘﻘﯿﻢ ﻣﺨﻤﺮ ﺑﺎ رﻧﮓآﻣﯿﺰی ﮔﺮم 2. ﮐﺸﺖ ﺑﺮ روی سابورو دکستروز آگار مکمل با 2 میلیگرم در ﻣﯿﻠﯽﻟﯿﺘﺮ ﺟﻨﺘﺎﻣﺎیﺴﯿﻦ ﺑﺎ و ﺑﺪون ﺳﯿﮑﻠﻮﻫﮕﺰاﻣﯿﺪ (0/05 درصد).
ﺷﻨﺎﺳﺎیﯽ ﮔﻮﻧﻪهای ﮐﺎﻧﺪیﺪا ﺑﺎ ﺑﺮرﺳﯽ ﻣﻮرﻓﻮﻟﻮژی ﮐﻠﻨﯽ، آزﻣﺎیﺶ ﻟﻮﻟﻪ زایﺎ، ﻣﻮرﻓﻮﻟﻮژی ﻫﯿﻒ و ﺗﺸﮑﯿﻞ ﮐﻼﻣﯿﺪوﺳﭙﻮر ﺑﺮ روی آرد ذرت آﮔﺎر، آزﻣﺎیﺶ تری فنیل تترازولیوم کلراید، ﺗﺨﻤﯿﺮ و ﺟﺬب ﻗﻨﺪﻫﺎی ﻣﺨﺘﻠﻒ و ﺣﺴﺎﺳﯿﺖ ﺑﻪ سیکلوهگزآمید اﻧﺠﺎم ﺷﺪ.
بیماران مبتلا به سایر عفونتهای واژینال مثل تریکوموناس واژینالیس یا عفونتهای باکتریایی از مطالعه خارج شدند.
ﻣﻌﯿﺎر ورود ﺑﻪ ﻣﻄﺎﻟﻌﻪ: ﺳﻦ ﺑﺎﻻی 18 ﺳﺎل و ﻣﺮاﺟﻌﻪ ﺑﻪ درﻣﺎﻧﮕﺎههای علومپزشکی ایران ﺑﺎ ﺷﻮاﻫﺪ اﺑﺘﻼ ﺑﻪ واژیﻨﯿﺖ ﮐﺎﻧﺪیﺪیﺎیﯽ ﺑﺮاﺳﺎس ﺑﺮرﺳﯽهای ﺑﺎﻟﯿﻨﯽ و ﻣﯿﮑﺮوﺑﯿﻮﻟﻮژیﮏ. ﻣﻌﯿﺎرهای ﺧﺮوج از ﻣﻄﺎﻟﻌﻪ: اﺑﺘﻼی همزﻣﺎن به بیش از یک عامل بیماریزا، ﺑﯿﻤﺎران دﭼﺎر ﻧﻘﺺ ایﻤﻨﯽ، ﺑﯿﻤﺎراﻧﯽ ﮐﻪ ﺗﻤﺎیﻞ ﺑﻪ ﺷﺮﮐﺖ در ﻣﻄﺎﻟﻌﻪ ﻧﺪاشتند یﺎ اﻣﮑﺎن ﭘﯿﮕﯿﺮی آنها وﺟﻮد ﻧﺪاﺷﺖ، اﻓﺮاد ﺑﺎردار، ﮐﺴﺎﻧﯽ ﮐﻪ ﺗﺤﺖ درﻣﺎن ﺑﺎ اﺳﺘﺮوﺋﯿﺪ ﺑﻮدﻧﺪ، ﺑﯿﻤﺎراﻧﯽ ﮐﻪ ﺑﺮای ﻣﻌﺎیﻨﻪ ﻟﮕﻦ رﺿﺎیﺖ ﻧﺪادﻧﺪ، اﻓﺮادی ﮐﻪ در ﻃﯽ 3 ﻣﺎه ﮔﺬﺷﺘﻪ ﺑﺮای ﺗﺮﺷﺤﺎت واژن ﺗﺤﺖ درﻣﺎن ﻗﺮار ﮔﺮﻓﺘﻨﺪ و ﺑﯿﻤﺎران ﻋﻼﻣﺖدار ﮐﻪ رﺷﺪ ﮐﺎﻧﺪیﺪا در ﮐﺸﺖ ﻗﺎرچ در آنها ﻣﺸﺎﻫﺪه ﻧﺸﺪ.
در تعیین ﺣﺠﻢ ﻧﻤﻮﻧﻪ ﺑﺎﺗﻮﺟﻪﺑﻪ ﻧﺘﺎیﺞ ﻣﻄﺎﻟﻌﻪ ری و همکاران [28] و ﺑﺮاﺳﺎس ﻓﺮﻣﻮل شماره 1، ﺑﺎ در ﻧﻈﺮ ﮔﺮﻓﺘﻦ آﻟﻔﺎ ﺑﻪ ﻣﯿﺰان 0/05، ﺑﺘﺎ ﺑﻪ ﻣﯿﺰان 0/2، P1 به میزان 0/6 و P2 به میزان 0/3 46 ﻧﻔﺮدر 2 ﮔﺮوه 23 ﻧﻔﺮی وارد ﻣﻄﺎﻟﻌﻪ ﺷدﻧﺪ ﮐﻪ ﺑﺎ اﻓﺰایﺶ 10 درﺻﺪی ﺑﺮای ﻣﻮارد اﺣﺘﻤﺎﻟﯽ ﻏﯿﺮﻗﺎﺑﻞﭘﯿﮕﯿﺮی 25 ﻧﻔﺮ در ﻫﺮ ﮔﺮوه وارد شدﻧﺪ.
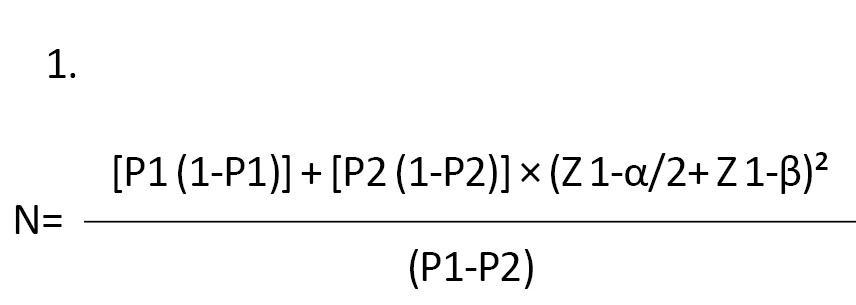
پس از تأیید واژینیت کاندیدایی 46 بیمار وارد مطالعه و 4 نفر از مطالعه خارج شدند (تصویر شماره 1).
بیماران ازنظر مصرف 2 داروی موردنظر در 2 گروه همسان شدند. ﺑﯿﻤﺎران ﺑﻪﺻﻮرت ﺗﺼﺎدﻓﯽ در 2 ﮔﺮوه ﺗﻘﺴﯿﻢ ﺷﺪﻧﺪ ﮐﻪ یﮏ ﮔﺮوه ﻓﻠﻮﮐﻮﻧﺎزول ﺧﻮراﮐﯽ ﺑﻪﺻﻮرت 150 ﻣﯿﻠﯽﮔﺮم در روز ﺑﻪ ﻣﺪت 3 روز و یﮏ ﮔﺮوه ﺑﻮریﮏ اﺳﯿﺪ ﺑﻪﺻﻮرت ﺷﯿﺎف 600 ﻣﯿﻠﯽﮔﺮﻣﯽ ﺑﻪ ﻣﺪت 14روز دریﺎﻓﺖ کردند. بعد از درمان، معاینه لگن مجدد انجام شد و سوآپ واژینال جهت اسمیر و کشت فرستاده شد. درﻣﺎن ﻗﺎرﭼﯽ ﺑﻪﺻﻮرت ﻋﺪم وﺟﻮد ﻋﻼﺋﻢ و رﺷﺪ ﮐﺎﻧﺪیﺪا در ﮐﺸﺖ ﺑﻌﺪ از اﺗﻤﺎم درﻣﺎن ﺗﻌﺮیﻒ ﺷﺪ. ﻣﯿﺰان ﺑﻬﺒﻮدی ﻋﻼﺋﻢ در اﻧﺘﻬﺎی دوره درﻣﺎن در دو ﮔﺮوه ﺑﺮرﺳﯽ و تأیﯿﺪ آن ﺑﺎ اﺳﺘﻔﺎده از ﮐﺸﺖ ﺗﺮﺷﺤﺎت اﻧﺠﺎم ﺷﺪ. ﻫﻤﭽﻨﯿﻦ ﻋﻮارض دارویﯽ ﺑﯿﻤﺎران ﭘﺮﺳﯿﺪه و ﺛﺒﺖ ﺷﺪ.
اﻃﻼﻋﺎت ﺑﺎ اﺳﺘﻔﺎده از ﻧﺮماﻓﺰار آﻣﺎری SPSS نسخه 26 مورد تجزیهوﺗﺤﻠﯿﻞ ﻗﺮار ﮔﺮﻓﺖ. در آﻧﺎﻟﯿﺰ ﺗﻮﺻﯿﻔﯽ نتایج، از ﻓﺮاواﻧﯽ و درﺻﺪ ﻓﺮاواﻧﯽ و ﻣﯿﺎﻧﮕﯿﻦ و ﺷﺎﺧﺺ ﭘﺮاﮐﻨﺪﮔﯽ اﻧﺤﺮاف ﻣﻌﯿﺎر اﺳﺘﻔﺎده ﺷﺪ. ﺑﺮای ﻣﺸﺨﺺ ﮐﺮدن ارتباط ﺑﯿﻦ ﻧﻮع ﻣﺘﻐﯿﺮﻫﺎی ﮔﺮوه و ﻧﻮع ﺑﯿﻤﺎری، ﻫﻤﭽﻨﯿﻦ رﻓﺘﺎر 2 ﻣﺘﻐﯿﺮ (زﻣﺎن در ﻣﻘﺎﺑﻞ ﻧﻮع ﻋﻼﺋﻢ) در 2 ﮔﺮوه ﺑﻪﻃﻮر ﻣﺴﺘﻘﻞ از آزﻣﻮن ﮐﺎیاﺳﮑﻮﺋﺮ اﺳﺘﻔﺎده ﺷﺪ.
یافتهها
درمجموع 50 بیمار دارای واژیﻨﯿﺖ ﮐﺎﻧﺪیﺪا در ایﻦ ﻣﻄﺎﻟﻌﻪ وارد ﺷﺪﻧﺪ. ﺑﯿﻤﺎران ﺑﻪﻃﻮر تصادفی در 2 دﺳﺘﻪ 25 نفری درﻣﺎن ﺑﺎ ﺷﯿﺎف اسید ﺑﻮریﮏ و ﮐﭙﺴﻮل ﻓﻠﻮﮐﻮﻧﺎزول ﻗﺮار ﮔﺮﻓﺘﻨﺪ. ﻣﯿﺎﻧﮕﯿﻦ ﺳﻨﯽ در گروه اسید بوریک 5/88±32 سال و در گروه فلوکونازول 3/85±31/5 ﺳﺎل و شاخص توده بدنی در گروه اسید بوریک 27/9 و در گروه فلوکونازول 27/1 ﺑﻮد. ﻣﻘﺎیﺴﻪ ﻣﺘﻐﯿﯿﺮﻫﺎی زﻣﯿﻨﻪای (جدول شماره 1) و فراواﻧﯽ ﻋﻼﺋﻢ ﻗﺒﻞ و ﺑﻌﺪ از درﻣﺎن در گروه شیاف اسید ﺑﻮریﮏ و در گروه ﮐﭙﺴﻮل ﻓﻠﻮﮐﻮﻧﺎزول در جدول شماره 2 نشان داده شده است.
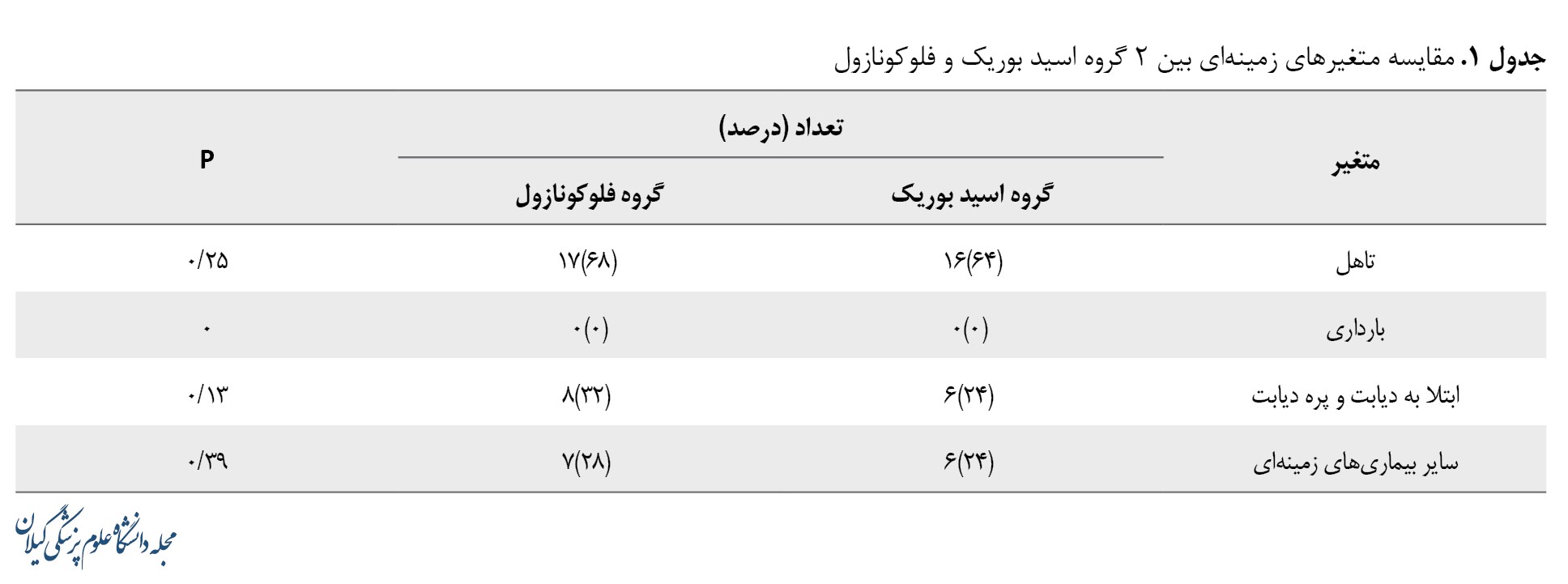
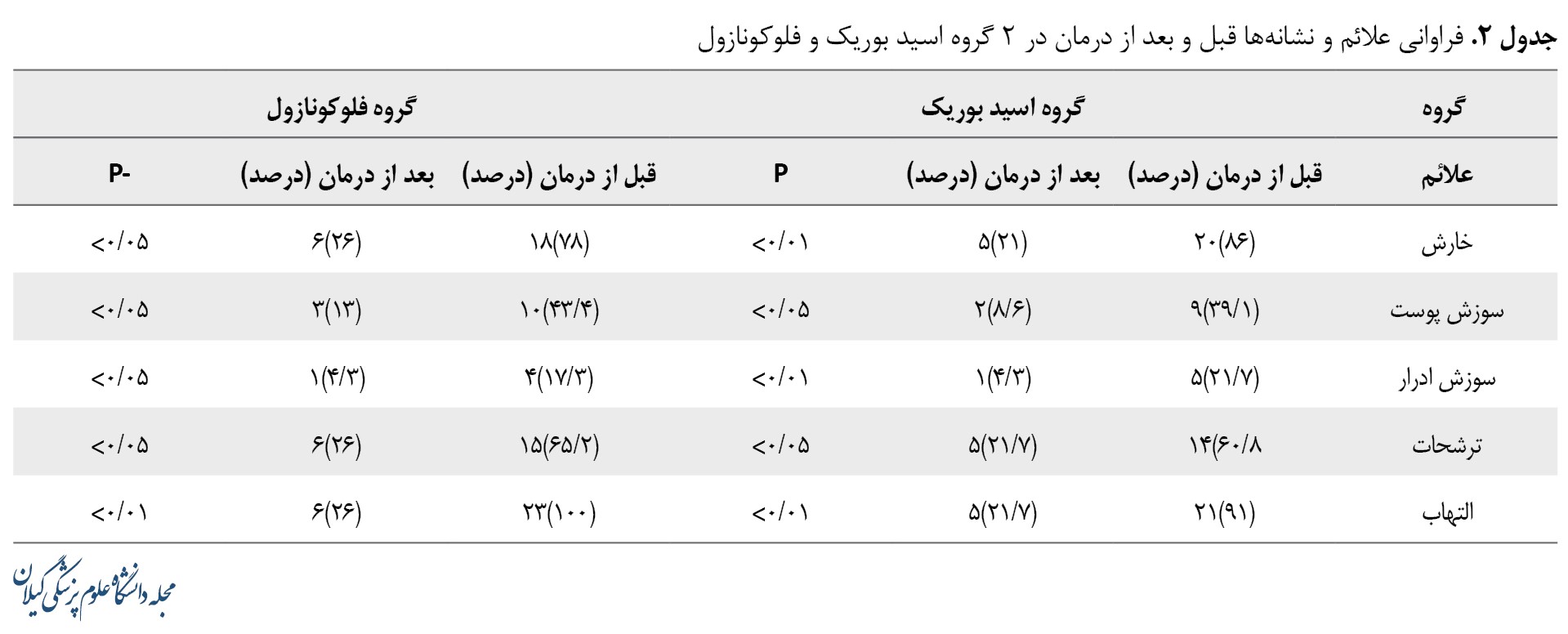
ﻋﻮارض ﻣﺼﺮف ﻓﻠﻮﮐﻮﻧﺎزول ﺷﺎﻣﻞ ﻋﻮارض ﮔﻮارﺷﯽ در بین 3 ﻧﻔﺮ (13 درصد) و ﻋﻮارض ﻣﺼﺮف ﺑﻮریﮏ اﺳﯿﺪ شامل ﺳﻮزش و ﻋﻮارض ﭘﻮﺳﺘﯽ در بین 2 ﻧﻔﺮ (8/6 درصد) بود ﮐﻪ ایﻦ اﺧﺘﻼف ﻣﻌﻨﯽدار ﻧﺒﻮد (P>0/05).
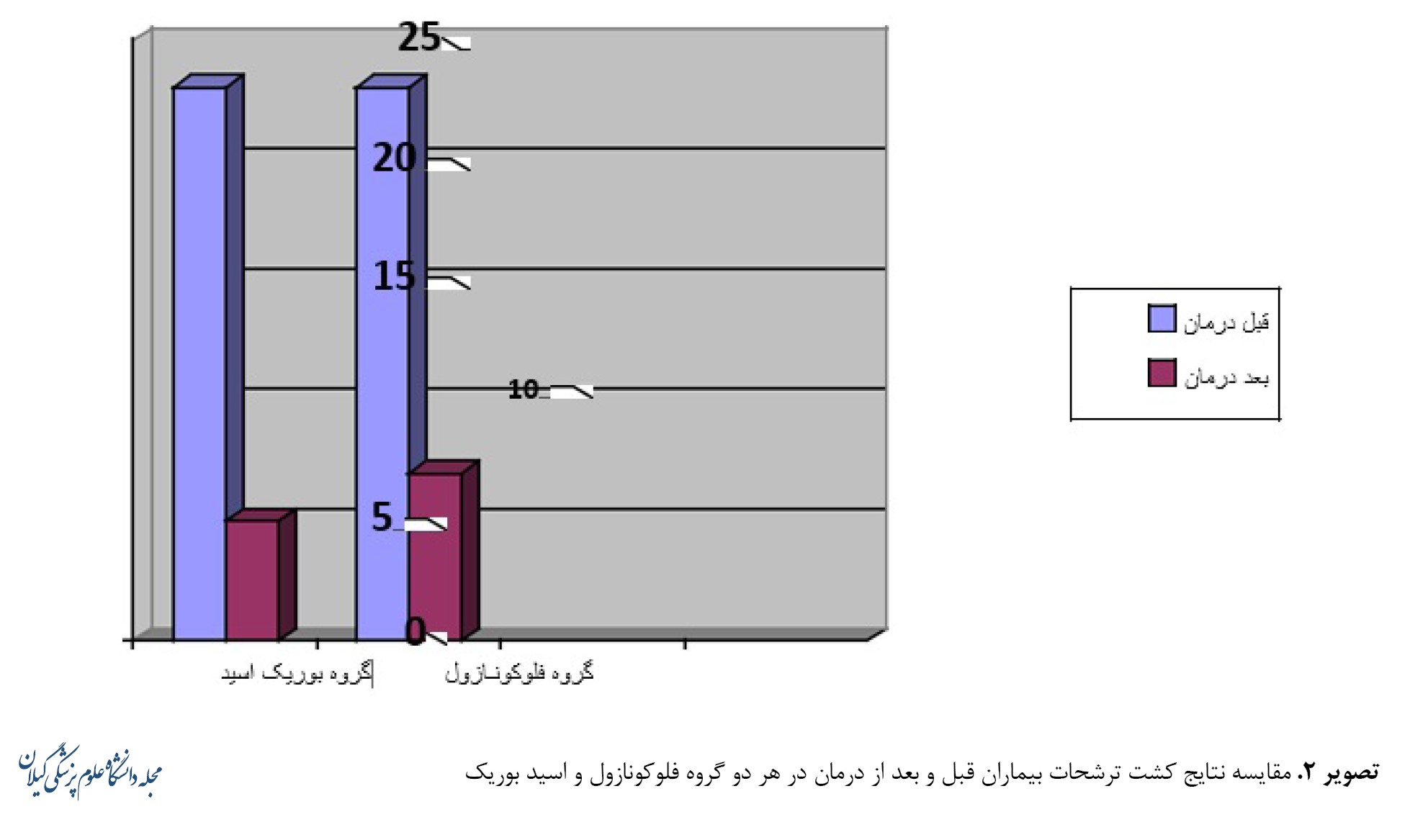
در ﮔﺮوه درﻣﺎن ﺑﺎ ﺑﻮریﮏ اﺳﯿﺪ 5 ﻧﻔﺮ از ﺑﯿﻤﺎران ﺑﻌﺪ از ﻃﯽ دوره درﻣﺎن، ﮐﺸﺖ ﻣﺜﺒﺖ داﺷﺘﻨﺪ (ﭘﺎﺳﺦ ﺑﻪ درﻣﺎن 78 درصد ﺑﺎ ﺑﻮریﮏ اﺳﯿﺪ) و در ﮔﺮوه درﻣﺎن ﺑﺎ ﻓﻠﻮﮐﻮﻧﺎزول 7 ﻧﻔﺮ از ﺑﯿﻤﺎران ﺑﻌﺪ از ﻃﯽ دوره درﻣﺎن، ﮐﺸﺖ ﻣﺜﺒﺖ داﺷﺘﻨﺪ (ﭘﺎﺳﺦ ﺑﻪ درﻣﺎن 69/5 درصد ﺑﺎ ﻓﻠﻮﮐﻮﻧﺎزول) ﮐﻪ ﻧﺸﺎن از ﺑﺮﺗﺮی ﻧﺴﺒﯽ اﺳﯿﺪ ﺑﻮریﮏ در ﺑﻬﺒﻮد ﻧﺘﺎیﺞ ﮐﺸﺖ ﺑﯿﻤﺎران دارد (تصویر شماره 2).
اﻃﻼﻋﺎت ﺑﺎ اﺳﺘﻔﺎده از ﻧﺮماﻓﺰار آﻣﺎری SPSS نسخه 26 مورد تجزیهوﺗﺤﻠﯿﻞ ﻗﺮار ﮔﺮﻓﺖ. در آﻧﺎﻟﯿﺰ ﺗﻮﺻﯿﻔﯽ نتایج، از ﻓﺮاواﻧﯽ و درﺻﺪ ﻓﺮاواﻧﯽ و ﻣﯿﺎﻧﮕﯿﻦ و ﺷﺎﺧﺺ ﭘﺮاﮐﻨﺪﮔﯽ اﻧﺤﺮاف ﻣﻌﯿﺎر اﺳﺘﻔﺎده ﺷﺪ. ﺑﺮای ﻣﺸﺨﺺ ﮐﺮدن ارتباط ﺑﯿﻦ ﻧﻮع ﻣﺘﻐﯿﺮﻫﺎی ﮔﺮوه و ﻧﻮع ﺑﯿﻤﺎری، ﻫﻤﭽﻨﯿﻦ رﻓﺘﺎر 2 ﻣﺘﻐﯿﺮ (زﻣﺎن در ﻣﻘﺎﺑﻞ ﻧﻮع ﻋﻼﺋﻢ) در 2 ﮔﺮوه ﺑﻪﻃﻮر ﻣﺴﺘﻘﻞ از آزﻣﻮن ﮐﺎیاﺳﮑﻮﺋﺮ اﺳﺘﻔﺎده ﺷﺪ.
یافتهها
درمجموع 50 بیمار دارای واژیﻨﯿﺖ ﮐﺎﻧﺪیﺪا در ایﻦ ﻣﻄﺎﻟﻌﻪ وارد ﺷﺪﻧﺪ. ﺑﯿﻤﺎران ﺑﻪﻃﻮر تصادفی در 2 دﺳﺘﻪ 25 نفری درﻣﺎن ﺑﺎ ﺷﯿﺎف اسید ﺑﻮریﮏ و ﮐﭙﺴﻮل ﻓﻠﻮﮐﻮﻧﺎزول ﻗﺮار ﮔﺮﻓﺘﻨﺪ. ﻣﯿﺎﻧﮕﯿﻦ ﺳﻨﯽ در گروه اسید بوریک 5/88±32 سال و در گروه فلوکونازول 3/85±31/5 ﺳﺎل و شاخص توده بدنی در گروه اسید بوریک 27/9 و در گروه فلوکونازول 27/1 ﺑﻮد. ﻣﻘﺎیﺴﻪ ﻣﺘﻐﯿﯿﺮﻫﺎی زﻣﯿﻨﻪای (جدول شماره 1) و فراواﻧﯽ ﻋﻼﺋﻢ ﻗﺒﻞ و ﺑﻌﺪ از درﻣﺎن در گروه شیاف اسید ﺑﻮریﮏ و در گروه ﮐﭙﺴﻮل ﻓﻠﻮﮐﻮﻧﺎزول در جدول شماره 2 نشان داده شده است.


ﻋﻮارض ﻣﺼﺮف ﻓﻠﻮﮐﻮﻧﺎزول ﺷﺎﻣﻞ ﻋﻮارض ﮔﻮارﺷﯽ در بین 3 ﻧﻔﺮ (13 درصد) و ﻋﻮارض ﻣﺼﺮف ﺑﻮریﮏ اﺳﯿﺪ شامل ﺳﻮزش و ﻋﻮارض ﭘﻮﺳﺘﯽ در بین 2 ﻧﻔﺮ (8/6 درصد) بود ﮐﻪ ایﻦ اﺧﺘﻼف ﻣﻌﻨﯽدار ﻧﺒﻮد (P>0/05).
در ﮔﺮوه درﻣﺎن ﺑﺎ ﺑﻮریﮏ اﺳﯿﺪ 5 ﻧﻔﺮ از ﺑﯿﻤﺎران ﺑﻌﺪ از ﻃﯽ دوره درﻣﺎن، ﮐﺸﺖ ﻣﺜﺒﺖ داﺷﺘﻨﺪ (ﭘﺎﺳﺦ ﺑﻪ درﻣﺎن 78 درصد ﺑﺎ ﺑﻮریﮏ اﺳﯿﺪ) و در ﮔﺮوه درﻣﺎن ﺑﺎ ﻓﻠﻮﮐﻮﻧﺎزول 7 ﻧﻔﺮ از ﺑﯿﻤﺎران ﺑﻌﺪ از ﻃﯽ دوره درﻣﺎن، ﮐﺸﺖ ﻣﺜﺒﺖ داﺷﺘﻨﺪ (ﭘﺎﺳﺦ ﺑﻪ درﻣﺎن 69/5 درصد ﺑﺎ ﻓﻠﻮﮐﻮﻧﺎزول) ﮐﻪ ﻧﺸﺎن از ﺑﺮﺗﺮی ﻧﺴﺒﯽ اﺳﯿﺪ ﺑﻮریﮏ در ﺑﻬﺒﻮد ﻧﺘﺎیﺞ ﮐﺸﺖ ﺑﯿﻤﺎران دارد (تصویر شماره 2).
به علاوه از 7 بیماری که بعد از اتمام دوره درمان با فلوکونازول همچنان کشت مثبت داشتند 5 نفر مبتلا به دیابت و پره دیابت بودند (71 درصد) اما از 5 بیماری که بعد از اتمام دوره درمان با بوریک اسید همچنان کشت مثبت داشتند 3 نفر مبتلا به دیابت و پره دیابت بودند (40 درصد) که نشانه پاسخ مناسبتر اسید بوریک در بیماران مبتلا به دیابت و مقاومت نسبی به فلوکونازول در این گروه بیماران است.
بحث
در مطالعه حاضر اثر درمانی اسید بوریک و فلوکونازول در درمان کاندیدیازیس واژینال با یکدیگر مقایسه شدند. نتایج این مطالعه استفاده بالینی از اسید بوریک بهعنوان خط اول درمان برای بیماران را بیان کرد. میزان موفقیت درمان در گروه اسید بوریک نسبت به گروه فلوکونازول بیشتر و با عوارض جانبی کمتر مشاهده شد که نشان از برتری اسید بوریک بود.
ﻣﻄﺎﻟﻌﻪ پل نیرجسی و ﻫﻤﮑﺎران [29] کشت مخمری ترشحات واژینال را اﺳﺘﺎﻧﺪارد ﻃﻼیﯽ ﺟﻬﺖ ﺗﺸﺨﯿﺺ ﻗﻄﻌﯽﮐﺎﻧﺪیﺪا ﻣﻌﺮﻓﯽ ﮐﺮده اﺳﺖ. اﻣﺎ نامارتا کالیا و ﻫﻤﮑﺎراﻧﺶ [30] ﮐﺸﺖ ﺗﺮﺷﺤﺎت ﺑﻪ ﻫﻤﺮاه ﻣﻌﺎیﻨﻪ واژن و ﺑﺮرﺳﯽ ﺷﮑﺎیﺖ ﺑﯿﻤﺎر را ﺟﻬﺖ تأیﯿﺪ ﺗﺸﺨﯿﺺ در ﻧﻈﺮ ﮔﺮﻓﺘﻪاند. زیرا ﻣﯿﮑﺮوﺑﯿﻮﺗﺎی واژن که برای یﮏ زن ﺧﻮب اﺳﺖ ﻣﻤﮑﻦ اﺳﺖ ﺑﺮای دیﮕﺮان دردﺳﺮﺳﺎز ﺑﺎﺷﺪ. ﻣﺎ ﻧﯿﺰ در ایﻦ ﻣﻄﺎﻟﻌﻪ از روش ﻣﺸﺎﻫﺪه ﺷﻮاﻫﺪ ﺑﺎﻟﯿﻨﯽ، ﺑﺮرﺳﯽ ﻋﻼﺋﻢ ﺑﯿﻤﺎر وﮐﺸﺖ ﺗﺮﺷﺤﺎت ﺟﻬﺖ ﺗﺸﺨﯿﺺ ﻗﻄﻌﯽ اﺳﺘﻔﺎده ﮐﺮدیﻢ.
تا به امروز اسید بوریک بهعنوان درمان خط اول در نظر گرفته نمیشود. در مطالعه حاضر، اسید بوریک با درمان خط اول، یعنی فلوکونازول مقایسه شد (78/2 درصد در ﻣﻘﺎﺑﻞ 69/5 درصد). ﻧﺘﺎیﺞ ایﻦ ﻣﻄﺎﻟﻌﻪ ﻫﻤﺴﻮ ﺑﺎ ﻣﻄﺎﻟﻌﺎت ﻗﺒﻠﯽ در ﺑﯿﻤﺎران غیردیابتی مبتلا به کاندیدیازیس وولواژینال و کاندیدا گلابراتا گزارش شده است [31، 32]. در ﺳﺎل 1974، سویت و همکاران [33] برای اوﻟﯿﻦ ﺑﺎر اﺳﯿﺪ ﺑﻮریﮏ را ﺑﻪﻋﻨﻮان یﮏ داروی ایمن، ﻣؤﺛﺮ و ارزان برای درمان کاندیدیازیس واژینال معرفی کردند. در مطالعه لاوازا و همکاران [20] استفاده واژینال اسیدبوریک ایمن بوده و کاهش عوارض جانبی مورد بررسی قرار گرفت. همچنین اسکمیت و همکاران نشان دادند اسید بوریک ممکن است با مهار چندین مسیر متابولیک ازجمله گلیکولیز، تخمیر و فعالیت میتوکندریایی [34] در مهار رشد بسیاری از گونههای کاندیدا، مؤثر باشد [35].
سوبل و همکاران [32] بهبود ﺑﺎﻟﯿﻨﯽ را در 81 درصد و درﻣﺎن کامل عفونت ﻗﺎرﭼﯽ را در 77 درصد از ﺑﯿﻤﺎران ﻏﯿﺮدیﺎﺑﺘﯽ ﻣﺒﺘﻼ ﺑﻪ واژیﻨﯿﺖ کاندیدا (ترولوپسیس) گلابراتا تحت درﻣﺎن ﺑﺎ اﺳﯿﺪ ﺑﻮریﮏ واژیﻨﺎل ﮔﺰارش ﮐﺮدﻧﺪ. ﻫﻤﭽﻨﯿﻦ ﮔﺰارشﻫﺎیﯽ از ﭘﺎﺳﺦ درﻣﺎﻧﯽ ﺑﻬﺘﺮ ﺑﻪ اﺳﯿﺪ ﺑﻮریﮏ در ﻣﻘﺎیﺴﻪ با ﻓﻠﻮﮐﻮﻧﺎزول در زﻧﺎن ﻏﯿﺮ دیﺎﺑﺘﯽ وﺟﻮد دارد [35، 36]
در مطالعه ری و ﻫﻤﮑﺎران [28]، سوبل و همکاران [37] و سالاما و همکاران [35] اسید بوریک یک داروی مؤثر در برابر کاندیدیازیس وولوواژینال بود ﮐﻪ تأیﯿﺪﮐﻨﻨﺪه ﻧﺘﺎیﺞ مطالعه ﻣﺎ است.
دُزﻫﺎی اﺳﯿﺪ ﺑﻮریﮏ ﻣﻮرداﺳﺘﻔﺎده ﺑﺮای درﻣﺎن کاندیدیازیس ولوواژینال از شیاف 600 ﻣﯿﻠﯽﮔﺮم 1 بار در روز ﺑﻪ ﻣﺪت 7 روز ﺗﺎ 2 ﺑﺎر در روز ﺑﻪ ﻣﺪت 14 روز ﻣﺘﻐﯿﺮ اﺳﺖ [28، 37]، ﻣﺎ ﻧﯿﺰ در ایﻦ ﻣﻄﺎﻟﻌﻪ از ﺷﯿﺎف 600 ﻣﯿﻠﯽﮔﺮﻣﯽ ﺑﻪ ﻣﺪت 14 روز اﺳﺘﻔﺎده ﮐﺮدیﻢ.
درﻣﺎن ﺑﺎ اﺳﯿﺪ ﺑﻮریﮏ (600 ﻣﯿﻠﯽﮔﺮم در روز ﺑﻪ ﻣﺪت 14 روز)، ﺑﻪﺟﺰ اﺣﺴﺎس ﺳﻮزش ﻣﻮﺿﻌﯽ و اریﺘﻢ وﺳﺘﯿﺒﻮﻻر در بعضی از بیماران، ﺑﯽﺧﻄﺮ اﺳﺖ [28، 32]. 2 ﻧﻔﺮ از ﺑﯿﻤﺎران ﻣﺎ ﻧﯿﺰ ایﻦ ﻋﺎرﺿﻪ ﺟﺎﻧﺒﯽ را ﮔﺰارش ﮐﺮدﻧﺪ ﮐﻪ ﺑﻌﺪ از ﻗﻄﻊ درﻣﺎن ﻋﻮارض ایﺠﺎدﺷﺪه ﻧﯿﺰ از ﺑﯿﻦ رﻓﺖ و ﺑﯿﻤﺎران دﭼﺎر ﻣﺸﮑﻞ ﺟﺪی ﻧﺸﺪﻧﺪ.
از 7 ﺑﯿﻤﺎری ﮐﻪ ﺑﻌﺪ از اﺗﻤﺎم دوره درﻣﺎن ﺑﺎ ﻓﻠﻮﮐﻮﻧﺎزول ﻫﻤﭽﻨﺎن ﮐﺸﺖ ﻣﺜﺒﺖ داﺷﺘﻨﺪ، 5 ﻧﻔﺮ ﻣﺒﺘﻼ ﺑﻪ دیﺎﺑﺖ و ﭘﺮه دیﺎﺑﺖ ﺑﻮدﻧﺪ (71 درصد) اﻣﺎ از 5 ﺑﯿﻤﺎری ﮐﻪ ﺑﻌﺪ از اﺗﻤﺎم دوره درﻣﺎن ﺑﺎ اﺳﯿﺪ ﺑﻮریﮏ ﻫﻤﭽﻨﺎن ﮐﺸﺖ ﻣﺜﺒﺖ داﺷﺘﻨﺪ، 2 ﻧﻔﺮ ﻣﺒﺘﻼ ﺑﻪ دیﺎﺑﺖ و ﭘﺮه دیﺎﺑﺖ ﺑﻮدﻧﺪ (40 درصد). ﺑﺎ ﻣﻘﺎیﺴﻪ ایﻦ آﻣﺎر میتوان ﭘﺎﺳﺦ ﻣﻨﺎﺳﺐﺗﺮ ﺑﻮریﮏ اﺳﯿﺪ در ﺑﯿﻤﺎران ﻣﺒﺘﻼ ﺑﻪ دیﺎﺑﺖ و ﻣﻘﺎوﻣﺖ ﻧﺴﺒﯽ به ﻓﻠﻮﮐﻮﻧﺎزول در اﻓﺮاد دیﺎﺑﺘﯽ را ﻧﺘﯿﺠﻪ ﮔﺮفت و همسو با مطالعه مارچیم و همکاران میتوان به این نتیجه رسید که اسید بوریک در درمان بیماران مقاوم به داروهای آزولی، نقش مهمی دارد [38].
ری و ﻫﻤﮑﺎران ﻧﯿﺰ [28] ﺑﺎ ﺑﺮرﺳﯽ ﮐﺎﻧﺪیﺪیﺎزیﺲ وﻟﻮواژیﻨﺎل در ﺑﯿﻤﺎران ﻣﺒﺘﻼ ﺑﻪ دیﺎﺑﺖ ﺷﯿﺮیﻦ دریﺎﻓﺘﻨﺪ ﺗﻨﻬﺎ یﮏﺳﻮم ﺑﯿﻤﺎران ﻣﺒﺘﻼ ﺑﻪ دیﺎﺑﺖ و کاندیدیازیس وولواژینال، به فلوکونازول ﺑﺎ دُز 150 ﻣﯿﻠﯽﮔﺮم ﭘﺎﺳﺦ میدﻫﻨﺪ. ﻫﻤﭽﻨﯿﻦ ﻣﻄﺎﻟﻌﺎﺗﯽ دال ﺑﺮ رﺷﺪ ﻣﮑﺮر ﮐﺎﻧﺪیﺪا در اﻓﺮاد ﻣﺒﺘﻼ ﺑﻪ دیﺎﺑﺖ ﮐﻨﺘﺮلﻧﺸﺪه دیﺪه ﺷﺪه اﺳﺖ.
ﺑﻬﺒﻮد ویﮋﮔﯽهای ﺑﺎﻟﯿﻨﯽ واژیﻨﯿﺖ ﮐﺎﻧﺪیﺪایﯽ در 2 ﮔﺮوه درﻣﺎﻧﯽ رخ داده و ﻗﺎﺑﻞﻣﻘﺎیﺴﻪ ﺑﻮد. ﺑﺎایﻦﺣﺎل، ﻣﺎ ﻧﻤﯽﺗﻮاﻧﯿﻢ ﺳﻮﮔﯿﺮی را در ﺗﺠﺰیﻪوﺗﺤﻠﯿﻞ ایﻦ ﭘﯿﺎﻣﺪ ﺣﺬف ﮐﻨﯿﻢ، زیﺮا ﻣﺤﻘﻖ ﻣﻌﺎیﻨﻪ ﺑﺎﻟﯿﻨﯽ قبل و ﭘﺲ از درﻣﺎن اﻧﺠﺎم داده است و ممکن است موفقیت درمان صرفاً به استفاده از اسید بوریک مرتبط نباشد و تغییر سبک زندگی بتواند به جای داروهای ضدقارچی سیستمیک قوی در درمان بیماران مؤثر باشد [36].
نتیجهگیری
درﺻﺪ ﺑﻬﺒﻮدی ﺑﻌﺪ از درﻣﺎن ﺑﺎ اﺳﯿﺪ ﺑﻮریﮏ، 78/2 درصد و ﺑﻌﺪ از درﻣﺎن با ﻓﻠﻮﮐﻮﻧﺎزول، 69/5 درصد ﺑﻮده اﺳﺖ. ﺑﻪﻃﻮرﮐﻠﯽ میتوان ﮔﻔﺖ اﺳﯿﺪ ﺑﻮریﮏ در ﻣﻘﺎیﺴﻪ ﺑﺎ ﻓﻠﻮﮐﻮﻧﺎزول اﺛﺮات درﻣﺎﻧﯽ ﻣﻄﻠﻮبﺗﺮی ﺑﺮ درﻣﺎن کاندیدیازیس واژینال دارد (P=0/023). ﻫﻤﭽﻨﯿﻦ ﺑﺎ ﻣﻘﺎیﺴﻪ ﻓﺮاواﻧﯽ ﻋﻮارض ﺑﯿﻦ 2 ﮔﺮوه، دیﺪه ﺷﺪ ﻋﻮارض در ﮔﺮوه دریﺎﻓﺖﮐﻨﻨﺪه اﺳﯿﺪ ﺑﻮریﮏ (2 نفر، 8/6 درصد) ﮐﻤﺘﺮ از ﮔﺮوه دریﺎﻓﺖﮐﻨﻨﺪه ﻓﻠﻮﮐﻮﻧﺎزول (3 ﻧﻔﺮ، 13درصد) ﺑﺮوز یﺎﻓﺘﻪ اﺳﺖ ﮐﻪ ایﻦ اﺧﺘﻼف ﻣﻌﻨﯽدار ﻧﺒﻮد (P>0/05).
ازﺟﻤﻠﻪ ﻣﺤﺪودیﺖهای ایﻦ ﻃﺮح میتوان ﺑﻪ ﻧﺎﻗﺺ ﺑﻮدن اﻃﻼﻋﺎت درجﺷﺪه در ﭘﺮوﻧﺪه ﺑﯿﻤﺎران اﺷﺎره کرد. از دیﮕﺮ ﻣﺤﺪودیﺖﻫﺎ میتوان ﺑﻪ از دست دادن پیگیری اﺷﺎره ﮐﺮد ﮐﻪ ﺑﺮای ﺟﺒﺮان آن به ﺣﺠﻢ ﻧﻤﻮﻧﻪ 10 درﺻﺪ اﻓﺰوده ﺷﺪ. بنابراین یک مطالعه موردشاهدی آیندهنگر مورد نیاز است.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه توسط کمیته اخلاق گروه تحقیقات و فناوری دانشگاه علومﭘﺰﺷﮑﯽ ایﺮان با شماره IR.IUMS.FMD.REC.1400.389 تصویب شد.
حامی مالی
این تحقیق هیچگونه کمک مالی از سازمانهای تأمین مالی در بخشهای عمومی، تجاری یا غیرانتفاعی دریافت نکرد.
مشارکت نویسندگان
نگارش پیشنویس، نهاییسازی نوشته: آیناز صورتی؛ مفهوم سازی ، نظارت: مهدیس محمدیان امیری؛ روششناسی، مدیریت پروژه: مجید اکلملی
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
بحث
در مطالعه حاضر اثر درمانی اسید بوریک و فلوکونازول در درمان کاندیدیازیس واژینال با یکدیگر مقایسه شدند. نتایج این مطالعه استفاده بالینی از اسید بوریک بهعنوان خط اول درمان برای بیماران را بیان کرد. میزان موفقیت درمان در گروه اسید بوریک نسبت به گروه فلوکونازول بیشتر و با عوارض جانبی کمتر مشاهده شد که نشان از برتری اسید بوریک بود.
ﻣﻄﺎﻟﻌﻪ پل نیرجسی و ﻫﻤﮑﺎران [29] کشت مخمری ترشحات واژینال را اﺳﺘﺎﻧﺪارد ﻃﻼیﯽ ﺟﻬﺖ ﺗﺸﺨﯿﺺ ﻗﻄﻌﯽﮐﺎﻧﺪیﺪا ﻣﻌﺮﻓﯽ ﮐﺮده اﺳﺖ. اﻣﺎ نامارتا کالیا و ﻫﻤﮑﺎراﻧﺶ [30] ﮐﺸﺖ ﺗﺮﺷﺤﺎت ﺑﻪ ﻫﻤﺮاه ﻣﻌﺎیﻨﻪ واژن و ﺑﺮرﺳﯽ ﺷﮑﺎیﺖ ﺑﯿﻤﺎر را ﺟﻬﺖ تأیﯿﺪ ﺗﺸﺨﯿﺺ در ﻧﻈﺮ ﮔﺮﻓﺘﻪاند. زیرا ﻣﯿﮑﺮوﺑﯿﻮﺗﺎی واژن که برای یﮏ زن ﺧﻮب اﺳﺖ ﻣﻤﮑﻦ اﺳﺖ ﺑﺮای دیﮕﺮان دردﺳﺮﺳﺎز ﺑﺎﺷﺪ. ﻣﺎ ﻧﯿﺰ در ایﻦ ﻣﻄﺎﻟﻌﻪ از روش ﻣﺸﺎﻫﺪه ﺷﻮاﻫﺪ ﺑﺎﻟﯿﻨﯽ، ﺑﺮرﺳﯽ ﻋﻼﺋﻢ ﺑﯿﻤﺎر وﮐﺸﺖ ﺗﺮﺷﺤﺎت ﺟﻬﺖ ﺗﺸﺨﯿﺺ ﻗﻄﻌﯽ اﺳﺘﻔﺎده ﮐﺮدیﻢ.
تا به امروز اسید بوریک بهعنوان درمان خط اول در نظر گرفته نمیشود. در مطالعه حاضر، اسید بوریک با درمان خط اول، یعنی فلوکونازول مقایسه شد (78/2 درصد در ﻣﻘﺎﺑﻞ 69/5 درصد). ﻧﺘﺎیﺞ ایﻦ ﻣﻄﺎﻟﻌﻪ ﻫﻤﺴﻮ ﺑﺎ ﻣﻄﺎﻟﻌﺎت ﻗﺒﻠﯽ در ﺑﯿﻤﺎران غیردیابتی مبتلا به کاندیدیازیس وولواژینال و کاندیدا گلابراتا گزارش شده است [31، 32]. در ﺳﺎل 1974، سویت و همکاران [33] برای اوﻟﯿﻦ ﺑﺎر اﺳﯿﺪ ﺑﻮریﮏ را ﺑﻪﻋﻨﻮان یﮏ داروی ایمن، ﻣؤﺛﺮ و ارزان برای درمان کاندیدیازیس واژینال معرفی کردند. در مطالعه لاوازا و همکاران [20] استفاده واژینال اسیدبوریک ایمن بوده و کاهش عوارض جانبی مورد بررسی قرار گرفت. همچنین اسکمیت و همکاران نشان دادند اسید بوریک ممکن است با مهار چندین مسیر متابولیک ازجمله گلیکولیز، تخمیر و فعالیت میتوکندریایی [34] در مهار رشد بسیاری از گونههای کاندیدا، مؤثر باشد [35].
سوبل و همکاران [32] بهبود ﺑﺎﻟﯿﻨﯽ را در 81 درصد و درﻣﺎن کامل عفونت ﻗﺎرﭼﯽ را در 77 درصد از ﺑﯿﻤﺎران ﻏﯿﺮدیﺎﺑﺘﯽ ﻣﺒﺘﻼ ﺑﻪ واژیﻨﯿﺖ کاندیدا (ترولوپسیس) گلابراتا تحت درﻣﺎن ﺑﺎ اﺳﯿﺪ ﺑﻮریﮏ واژیﻨﺎل ﮔﺰارش ﮐﺮدﻧﺪ. ﻫﻤﭽﻨﯿﻦ ﮔﺰارشﻫﺎیﯽ از ﭘﺎﺳﺦ درﻣﺎﻧﯽ ﺑﻬﺘﺮ ﺑﻪ اﺳﯿﺪ ﺑﻮریﮏ در ﻣﻘﺎیﺴﻪ با ﻓﻠﻮﮐﻮﻧﺎزول در زﻧﺎن ﻏﯿﺮ دیﺎﺑﺘﯽ وﺟﻮد دارد [35، 36]
در مطالعه ری و ﻫﻤﮑﺎران [28]، سوبل و همکاران [37] و سالاما و همکاران [35] اسید بوریک یک داروی مؤثر در برابر کاندیدیازیس وولوواژینال بود ﮐﻪ تأیﯿﺪﮐﻨﻨﺪه ﻧﺘﺎیﺞ مطالعه ﻣﺎ است.
دُزﻫﺎی اﺳﯿﺪ ﺑﻮریﮏ ﻣﻮرداﺳﺘﻔﺎده ﺑﺮای درﻣﺎن کاندیدیازیس ولوواژینال از شیاف 600 ﻣﯿﻠﯽﮔﺮم 1 بار در روز ﺑﻪ ﻣﺪت 7 روز ﺗﺎ 2 ﺑﺎر در روز ﺑﻪ ﻣﺪت 14 روز ﻣﺘﻐﯿﺮ اﺳﺖ [28، 37]، ﻣﺎ ﻧﯿﺰ در ایﻦ ﻣﻄﺎﻟﻌﻪ از ﺷﯿﺎف 600 ﻣﯿﻠﯽﮔﺮﻣﯽ ﺑﻪ ﻣﺪت 14 روز اﺳﺘﻔﺎده ﮐﺮدیﻢ.
درﻣﺎن ﺑﺎ اﺳﯿﺪ ﺑﻮریﮏ (600 ﻣﯿﻠﯽﮔﺮم در روز ﺑﻪ ﻣﺪت 14 روز)، ﺑﻪﺟﺰ اﺣﺴﺎس ﺳﻮزش ﻣﻮﺿﻌﯽ و اریﺘﻢ وﺳﺘﯿﺒﻮﻻر در بعضی از بیماران، ﺑﯽﺧﻄﺮ اﺳﺖ [28، 32]. 2 ﻧﻔﺮ از ﺑﯿﻤﺎران ﻣﺎ ﻧﯿﺰ ایﻦ ﻋﺎرﺿﻪ ﺟﺎﻧﺒﯽ را ﮔﺰارش ﮐﺮدﻧﺪ ﮐﻪ ﺑﻌﺪ از ﻗﻄﻊ درﻣﺎن ﻋﻮارض ایﺠﺎدﺷﺪه ﻧﯿﺰ از ﺑﯿﻦ رﻓﺖ و ﺑﯿﻤﺎران دﭼﺎر ﻣﺸﮑﻞ ﺟﺪی ﻧﺸﺪﻧﺪ.
از 7 ﺑﯿﻤﺎری ﮐﻪ ﺑﻌﺪ از اﺗﻤﺎم دوره درﻣﺎن ﺑﺎ ﻓﻠﻮﮐﻮﻧﺎزول ﻫﻤﭽﻨﺎن ﮐﺸﺖ ﻣﺜﺒﺖ داﺷﺘﻨﺪ، 5 ﻧﻔﺮ ﻣﺒﺘﻼ ﺑﻪ دیﺎﺑﺖ و ﭘﺮه دیﺎﺑﺖ ﺑﻮدﻧﺪ (71 درصد) اﻣﺎ از 5 ﺑﯿﻤﺎری ﮐﻪ ﺑﻌﺪ از اﺗﻤﺎم دوره درﻣﺎن ﺑﺎ اﺳﯿﺪ ﺑﻮریﮏ ﻫﻤﭽﻨﺎن ﮐﺸﺖ ﻣﺜﺒﺖ داﺷﺘﻨﺪ، 2 ﻧﻔﺮ ﻣﺒﺘﻼ ﺑﻪ دیﺎﺑﺖ و ﭘﺮه دیﺎﺑﺖ ﺑﻮدﻧﺪ (40 درصد). ﺑﺎ ﻣﻘﺎیﺴﻪ ایﻦ آﻣﺎر میتوان ﭘﺎﺳﺦ ﻣﻨﺎﺳﺐﺗﺮ ﺑﻮریﮏ اﺳﯿﺪ در ﺑﯿﻤﺎران ﻣﺒﺘﻼ ﺑﻪ دیﺎﺑﺖ و ﻣﻘﺎوﻣﺖ ﻧﺴﺒﯽ به ﻓﻠﻮﮐﻮﻧﺎزول در اﻓﺮاد دیﺎﺑﺘﯽ را ﻧﺘﯿﺠﻪ ﮔﺮفت و همسو با مطالعه مارچیم و همکاران میتوان به این نتیجه رسید که اسید بوریک در درمان بیماران مقاوم به داروهای آزولی، نقش مهمی دارد [38].
ری و ﻫﻤﮑﺎران ﻧﯿﺰ [28] ﺑﺎ ﺑﺮرﺳﯽ ﮐﺎﻧﺪیﺪیﺎزیﺲ وﻟﻮواژیﻨﺎل در ﺑﯿﻤﺎران ﻣﺒﺘﻼ ﺑﻪ دیﺎﺑﺖ ﺷﯿﺮیﻦ دریﺎﻓﺘﻨﺪ ﺗﻨﻬﺎ یﮏﺳﻮم ﺑﯿﻤﺎران ﻣﺒﺘﻼ ﺑﻪ دیﺎﺑﺖ و کاندیدیازیس وولواژینال، به فلوکونازول ﺑﺎ دُز 150 ﻣﯿﻠﯽﮔﺮم ﭘﺎﺳﺦ میدﻫﻨﺪ. ﻫﻤﭽﻨﯿﻦ ﻣﻄﺎﻟﻌﺎﺗﯽ دال ﺑﺮ رﺷﺪ ﻣﮑﺮر ﮐﺎﻧﺪیﺪا در اﻓﺮاد ﻣﺒﺘﻼ ﺑﻪ دیﺎﺑﺖ ﮐﻨﺘﺮلﻧﺸﺪه دیﺪه ﺷﺪه اﺳﺖ.
ﺑﻬﺒﻮد ویﮋﮔﯽهای ﺑﺎﻟﯿﻨﯽ واژیﻨﯿﺖ ﮐﺎﻧﺪیﺪایﯽ در 2 ﮔﺮوه درﻣﺎﻧﯽ رخ داده و ﻗﺎﺑﻞﻣﻘﺎیﺴﻪ ﺑﻮد. ﺑﺎایﻦﺣﺎل، ﻣﺎ ﻧﻤﯽﺗﻮاﻧﯿﻢ ﺳﻮﮔﯿﺮی را در ﺗﺠﺰیﻪوﺗﺤﻠﯿﻞ ایﻦ ﭘﯿﺎﻣﺪ ﺣﺬف ﮐﻨﯿﻢ، زیﺮا ﻣﺤﻘﻖ ﻣﻌﺎیﻨﻪ ﺑﺎﻟﯿﻨﯽ قبل و ﭘﺲ از درﻣﺎن اﻧﺠﺎم داده است و ممکن است موفقیت درمان صرفاً به استفاده از اسید بوریک مرتبط نباشد و تغییر سبک زندگی بتواند به جای داروهای ضدقارچی سیستمیک قوی در درمان بیماران مؤثر باشد [36].
نتیجهگیری
درﺻﺪ ﺑﻬﺒﻮدی ﺑﻌﺪ از درﻣﺎن ﺑﺎ اﺳﯿﺪ ﺑﻮریﮏ، 78/2 درصد و ﺑﻌﺪ از درﻣﺎن با ﻓﻠﻮﮐﻮﻧﺎزول، 69/5 درصد ﺑﻮده اﺳﺖ. ﺑﻪﻃﻮرﮐﻠﯽ میتوان ﮔﻔﺖ اﺳﯿﺪ ﺑﻮریﮏ در ﻣﻘﺎیﺴﻪ ﺑﺎ ﻓﻠﻮﮐﻮﻧﺎزول اﺛﺮات درﻣﺎﻧﯽ ﻣﻄﻠﻮبﺗﺮی ﺑﺮ درﻣﺎن کاندیدیازیس واژینال دارد (P=0/023). ﻫﻤﭽﻨﯿﻦ ﺑﺎ ﻣﻘﺎیﺴﻪ ﻓﺮاواﻧﯽ ﻋﻮارض ﺑﯿﻦ 2 ﮔﺮوه، دیﺪه ﺷﺪ ﻋﻮارض در ﮔﺮوه دریﺎﻓﺖﮐﻨﻨﺪه اﺳﯿﺪ ﺑﻮریﮏ (2 نفر، 8/6 درصد) ﮐﻤﺘﺮ از ﮔﺮوه دریﺎﻓﺖﮐﻨﻨﺪه ﻓﻠﻮﮐﻮﻧﺎزول (3 ﻧﻔﺮ، 13درصد) ﺑﺮوز یﺎﻓﺘﻪ اﺳﺖ ﮐﻪ ایﻦ اﺧﺘﻼف ﻣﻌﻨﯽدار ﻧﺒﻮد (P>0/05).
ازﺟﻤﻠﻪ ﻣﺤﺪودیﺖهای ایﻦ ﻃﺮح میتوان ﺑﻪ ﻧﺎﻗﺺ ﺑﻮدن اﻃﻼﻋﺎت درجﺷﺪه در ﭘﺮوﻧﺪه ﺑﯿﻤﺎران اﺷﺎره کرد. از دیﮕﺮ ﻣﺤﺪودیﺖﻫﺎ میتوان ﺑﻪ از دست دادن پیگیری اﺷﺎره ﮐﺮد ﮐﻪ ﺑﺮای ﺟﺒﺮان آن به ﺣﺠﻢ ﻧﻤﻮﻧﻪ 10 درﺻﺪ اﻓﺰوده ﺷﺪ. بنابراین یک مطالعه موردشاهدی آیندهنگر مورد نیاز است.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه توسط کمیته اخلاق گروه تحقیقات و فناوری دانشگاه علومﭘﺰﺷﮑﯽ ایﺮان با شماره IR.IUMS.FMD.REC.1400.389 تصویب شد.
حامی مالی
این تحقیق هیچگونه کمک مالی از سازمانهای تأمین مالی در بخشهای عمومی، تجاری یا غیرانتفاعی دریافت نکرد.
مشارکت نویسندگان
نگارش پیشنویس، نهاییسازی نوشته: آیناز صورتی؛ مفهوم سازی ، نظارت: مهدیس محمدیان امیری؛ روششناسی، مدیریت پروژه: مجید اکلملی
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
References
1.Mullick S, Watson-Jones D, Beksinska M, Mabey D. Sexually transmitted infections in pregnancy: Prevalence, impact on pregnancy outcomes, and approach to treatment in developing countries. Sexually Transmitted Infections. 2005; 81(4):294-302. [DOI:10.1136/sti.2002.004077] [PMID]
2.Becker M, Stephen J, Moses S, Washington R, Maclean I, Cheang M, et al. Etiology and determinants of sexually transmitted infections in Karnataka State, south India. Sexually Transmitted Diseases. 2010; 37(3):159-64. [DOI:10.1097/OLQ.0b013e3181bd1007] [PMID]
3.Prasad D, Parween S, Kumari K, Singh N. Prevalence, etiology, and associated symptoms of vaginal discharge during pregnancy in women seen in a tertiary care Hospital in Bihar. Cureus. 2021;13(1). [DOI:10.7759/cureus.12700]
4.Sparks JM. Vaginitis. The Journal of Reproductive Medicine. 1991; 36(10):745-52. [PMID]
5.Sobel JD. Pathogenesis of Candida vulvovaginitis. Current Topics in Medical Mycology. 1989; 3:86-108. [DOI:10.1007/978-1-4612-3624-5_5] [PMID]
6.Bitew A, Abebaw Y. Vulvovaginal candidiasis: Species distribution of Candida and their antifungal susceptibility pattern. BMC Women's Health. 2018; 18(1):94. [DOI:10.1186/s12905-018-0607-z] [PMID]
7.Maraki S, Mavromanolaki VE, Stafylaki D, Nioti E, Hamilos G, Kasimati A. Epidemiology and antifungal susceptibility patterns of Candida isolates from Greek women with vulvovaginal candidiasis. Mycoses. 2019; 62(8):692-7. [DOI:10.1111/myc.12946] [PMID]
8.Fakhim H, Vaezi A, Javidnia J, Nasri E, Mahdi D, Diba K, et al. Candida Africana vulvovaginitis: Prevalence and geographical distribution. Journal de Mycologie Médicale. 2020; 30(3):100966. [DOI:10.1016/j.mycmed.2020.100966] [PMID]
9.Zeng X, Zhang Y, Zhang T, Xue Y, Xu H, An R. Risk factors of vulvovaginal Candidiasis among women of reproductive age in Xi'an: A cross-sectional study. BioMed Research International. 2018; 2018:9703754. [DOI:10.1155/2018/9703754] [PMID]
10.Blostein F, Levin-Sparenberg E, Wagner J, Foxman B. Recurrent vulvovaginal Candidiasis. Annals of Epidemiology. 2017; 27(9):575-82.e3. [DOI:10.1016/j.annepidem.2017.08.010] [PMID]
11.Foxman B, Muraglia R, Dietz JP, Sobel JD, Wagner J. Prevalence of recurrent vulvovaginal candidiasis in 5 European countries and the United States: Results from an internet panel survey. Journal of Lower Genital Tract Disease. 2013; 17(3):340-5. [DOI:10.1097/LGT.0b013e318273e8cf] [PMID]
12.Yano J, Sobel JD, Nyirjesy P, Sobel R, Williams VL, Yu Q, et al. Current patient perspectives of vulvovaginal candidiasis: incidence, symptoms, management and post-treatment outcomes. BMC Women's Health. 2019; 19(1):48. [DOI:10.1186/s12905-019-0748-8] [PMID]
13.Story K, Sobel R. Fluconazole prophylaxis in prevention of symptomatic candida vaginitis. Current Infectious Disease Reports. 2020; ;22(1):2. [DOI:10.1007/s11908-020-0712-7] [PMID]
14.Lu H, Shrivastava M, Whiteway M, Jiang Y. Candida albicans targets that potentially synergize with fluconazole. Critical Reviews in Microbiology. 2021; 47(3):323-37. [DOI:10.1080/1040841X.2021.1884641] [PMID]
15.Egunsola O, Adefurin A, Fakis A, Jacqz-Aigrain E, Choonara I, Sammons H. Safety of fluconazole in paediatrics: A systematic review. European Journal of Clinical Pharmacology. 2013; 69(6):1211-21. [DOI:10.1007/s00228-012-1468-2] [PMID]
16.Goje O. Genitourinary Infections and Sexually Transmitted Diseases. In: Jonathan S. Berek DLB, editor. Berek & Novak's Gynecology. Philadelphia: Wolters Kluwer; 2020.
17.van Schalkwyk J, Yudin MH; INFECTIOUS DISEASE COMMITTEE. Vulvovaginitis: Screening for and management of trichomoniasis, vulvovaginal candidiasis, and bacterial vaginosis. Journal of Obstetrics and Gynaecology Canada. 2015; 37(3):266-74. [DOI:10.1016/S1701-2163(15)30316-9] [PMID]
18.Pappas PG, Kauffman CA, Andes DR, Clancy CJ, Marr KA, Ostrosky-Zeichner L, et al. Clinical practice guideline for the management of candidiasis: 2016 update by the Infectious Diseases Society of America. Clinical Infectious Diseases. 2016; 62(4):e1-50. [DOI:10.1093/cid/civ933] [PMID]
19.Sobel JD, Chaim W, Nagappan V, Leaman D. Treatment of vaginitis caused by Candida glabrata: Use of topical boric acid and flucytosine. American Journal of Obstetrics and Gynecology. 2003; 189(5):1297-300. [DOI:10.1067/S0002-9378(03)00726-9] [PMID]
20.Iavazzo C, Gkegkes ID, Zarkada IM, Falagas ME. Boric acid for recurrent vulvovaginal candidiasis: The clinical evidence. Journal of Women's Health. 2011; 20(8):1245-55. [DOI:10.1089/jwh.2010.2708] [PMID]
21.Prutting SM, Cerveny JD. Boric acid vaginal suppositories: A brief review. Infectious Diseases in Obstetrics and Gynecology. 1998; 6(4):191-4. [DOI:10.1002/(SICI)1098-0997(1998)6:43.0.CO;2-6] [PMID]
22.De Seta F, Schmidt M, Vu B, Essmann M, Larsen B. Antifungal mechanisms supporting boric acid therapy of Candida vaginitis. Journal of Antimicrobial Chemotherapy. 2009; 63(2):325-36. [DOI:10.1093/jac/dkn486] [PMID]
23.Sobel JD. Vulvovaginal candidosis. The Lancet. 2007; 369(9577):1961-71. [DOI:10.1016/S0140-6736(07)60917-9] [PMID]
24.Collins LM, Moore R, Sobel JD. Prognosis and long-term outcome of women with idiopathic recurrent vulvovaginal candidiasis caused by Candida albicans. Journal of Lower Genital Tract Disease. 2020; 24(1):48-52. [DOI:10.1097/LGT.0000000000000496] [PMID]
25.Gunther LS, Martins HP, Gimenes F, Abreu AL, Consolaro ME, Svidzinski TI. Prevalence of Candida albicans and non-albicans isolates from vaginal secretions: Comparative evaluation of colonization, vaginal candidiasis and recurrent vaginal candidiasis in diabetic and non-diabetic women. São paulo Medical Journal. 2014; 132(2):116-20. [DOI:10.1590/1516-3180.2014.1322640] [PMID]
26.Crouss T, Sobel JD, Smith K, Nyirjesy P. Long-term outcomes of women with recurrent vulvovaginal candidiasis after a course of maintenance antifungal therapy. Journal of Lower Genital Tract Disease. 2018; 22(4):382-6. [DOI:10.1097/LGT.0000000000000413] [PMID]
27.Hadrup N, Frederiksen M, Sharma AK. Toxicity of boric acid, borax and other boron containing compounds: A review. Regulatory Toxicology and Pharmacology. 2021; 121:104873. [DOI:10.1016/j.yrtph.2021.104873] [PMID]
28.Ray D, Goswami R, Banerjee U, Dadhwal V, Goswami D, Mandal P, et al. Prevalence of Candida glabrata and its response to boric acid vaginal suppositories in comparison with oral fluconazole in patients with diabetes and vulvovaginal candidiasis. Diabetes Care. 2007; 30(2):312-7. [DOI:10.2337/dc06-1469] [PMID]
29.Nyirjesy P, Brookhart C, Lazenby G, Schwebke J, Sobel JD. Vulvovaginal candidiasis: A review of the evidence for the 2021 Centers for Disease Control and Prevention of Sexually Transmitted Infections Treatment Guidelines. Clinical Infectious Diseases. 2022; 74(Supplement_2):S162-8. [DOI:10.1093/cid/ciab1057] [PMID]
30.Kalia N, Singh J, Kaur M. Microbiota in vaginal health and pathogenesis of recurrent vulvovaginal infections: A critical review. Annals of Clinical Microbiology and Antimicrobials. 2020; 19(1):5. [DOI:10.1186/s12941-020-0347-4] [PMID]
31.Redondo-Lopez V, Lynch M, Schmitt C, Cook R, Sobel JD. Torulopsis glabrata vaginitis: Clinical aspects and susceptibility to antifungal agents. Obstetrics & Gynecology. 1990; 76(4):651-5. [PMID]
32.Sobel JD, Chaim W. Treatment of Torulopsis glabrata vaginitis: Retrospective review of boric acid therapy. Clinical Infectious Diseases. 1997; 24(4):649-52. [DOI:10.1093/clind/24.4.649] [PMID]
33.Swate TE, Weed JC. Boric acid treatment of vulvovaginal candidiasis. Obstetrics & Gynecology. 1974; 43(6):893-5. [PMID]
34.Schmidt M, Tran-Nguyen D, Chizek P. Influence of boric acid on energy metabolism and stress tolerance of Candida albicans. Journal of Trace Elements in Medicine and Biology. 2018; 49:140-5. [DOI:10.1016/j.jtemb.2018.05.011] [PMID]
35.Salama OE, Gerstein AC. Differential response of Candida species morphologies and isolates to fluconazole and boric acid. Antimicrobial Agents and Chemotherapy. 2022; 66(5):e02406-21. [DOI:10.1128/aac.02406-21] [PMID]
36.Kalkan Ü, Yassa M, Sandal K, Teki̇ A, Kilinç C, Gülümser Ç, et al. The efficacy of the boric acid-based maintenance therapy in preventing recurrent vulvovaginal candidiasis. Journal of Experimental and Clinical Medicine. 2021; 38(4):461-5. [DOI:10.52142/omujecm.38.4.11]
37.Sobel J, Sobel R. Current treatment options for vulvovaginal candidiasis caused by azole-resistant Candida species. Expert Opinion on Pharmacotherapy. 2018; 19(9):971-7. [DOI:10.1080/14656566.2018.1476490] [PMID]
38.Marchaim D, Lemanek L, Bheemreddy S, Kaye KS, Sobel JD. Fluconazole-resistant Candida albicans vulvovaginitis. Obstetrics & Gynecology. 2012; 120(6):1407-14. [DOI:10.1097/AOG.0b013e31827307b2] [PMID]
1.Mullick S, Watson-Jones D, Beksinska M, Mabey D. Sexually transmitted infections in pregnancy: Prevalence, impact on pregnancy outcomes, and approach to treatment in developing countries. Sexually Transmitted Infections. 2005; 81(4):294-302. [DOI:10.1136/sti.2002.004077] [PMID]
2.Becker M, Stephen J, Moses S, Washington R, Maclean I, Cheang M, et al. Etiology and determinants of sexually transmitted infections in Karnataka State, south India. Sexually Transmitted Diseases. 2010; 37(3):159-64. [DOI:10.1097/OLQ.0b013e3181bd1007] [PMID]
3.Prasad D, Parween S, Kumari K, Singh N. Prevalence, etiology, and associated symptoms of vaginal discharge during pregnancy in women seen in a tertiary care Hospital in Bihar. Cureus. 2021;13(1). [DOI:10.7759/cureus.12700]
4.Sparks JM. Vaginitis. The Journal of Reproductive Medicine. 1991; 36(10):745-52. [PMID]
5.Sobel JD. Pathogenesis of Candida vulvovaginitis. Current Topics in Medical Mycology. 1989; 3:86-108. [DOI:10.1007/978-1-4612-3624-5_5] [PMID]
6.Bitew A, Abebaw Y. Vulvovaginal candidiasis: Species distribution of Candida and their antifungal susceptibility pattern. BMC Women's Health. 2018; 18(1):94. [DOI:10.1186/s12905-018-0607-z] [PMID]
7.Maraki S, Mavromanolaki VE, Stafylaki D, Nioti E, Hamilos G, Kasimati A. Epidemiology and antifungal susceptibility patterns of Candida isolates from Greek women with vulvovaginal candidiasis. Mycoses. 2019; 62(8):692-7. [DOI:10.1111/myc.12946] [PMID]
8.Fakhim H, Vaezi A, Javidnia J, Nasri E, Mahdi D, Diba K, et al. Candida Africana vulvovaginitis: Prevalence and geographical distribution. Journal de Mycologie Médicale. 2020; 30(3):100966. [DOI:10.1016/j.mycmed.2020.100966] [PMID]
9.Zeng X, Zhang Y, Zhang T, Xue Y, Xu H, An R. Risk factors of vulvovaginal Candidiasis among women of reproductive age in Xi'an: A cross-sectional study. BioMed Research International. 2018; 2018:9703754. [DOI:10.1155/2018/9703754] [PMID]
10.Blostein F, Levin-Sparenberg E, Wagner J, Foxman B. Recurrent vulvovaginal Candidiasis. Annals of Epidemiology. 2017; 27(9):575-82.e3. [DOI:10.1016/j.annepidem.2017.08.010] [PMID]
11.Foxman B, Muraglia R, Dietz JP, Sobel JD, Wagner J. Prevalence of recurrent vulvovaginal candidiasis in 5 European countries and the United States: Results from an internet panel survey. Journal of Lower Genital Tract Disease. 2013; 17(3):340-5. [DOI:10.1097/LGT.0b013e318273e8cf] [PMID]
12.Yano J, Sobel JD, Nyirjesy P, Sobel R, Williams VL, Yu Q, et al. Current patient perspectives of vulvovaginal candidiasis: incidence, symptoms, management and post-treatment outcomes. BMC Women's Health. 2019; 19(1):48. [DOI:10.1186/s12905-019-0748-8] [PMID]
13.Story K, Sobel R. Fluconazole prophylaxis in prevention of symptomatic candida vaginitis. Current Infectious Disease Reports. 2020; ;22(1):2. [DOI:10.1007/s11908-020-0712-7] [PMID]
14.Lu H, Shrivastava M, Whiteway M, Jiang Y. Candida albicans targets that potentially synergize with fluconazole. Critical Reviews in Microbiology. 2021; 47(3):323-37. [DOI:10.1080/1040841X.2021.1884641] [PMID]
15.Egunsola O, Adefurin A, Fakis A, Jacqz-Aigrain E, Choonara I, Sammons H. Safety of fluconazole in paediatrics: A systematic review. European Journal of Clinical Pharmacology. 2013; 69(6):1211-21. [DOI:10.1007/s00228-012-1468-2] [PMID]
16.Goje O. Genitourinary Infections and Sexually Transmitted Diseases. In: Jonathan S. Berek DLB, editor. Berek & Novak's Gynecology. Philadelphia: Wolters Kluwer; 2020.
17.van Schalkwyk J, Yudin MH; INFECTIOUS DISEASE COMMITTEE. Vulvovaginitis: Screening for and management of trichomoniasis, vulvovaginal candidiasis, and bacterial vaginosis. Journal of Obstetrics and Gynaecology Canada. 2015; 37(3):266-74. [DOI:10.1016/S1701-2163(15)30316-9] [PMID]
18.Pappas PG, Kauffman CA, Andes DR, Clancy CJ, Marr KA, Ostrosky-Zeichner L, et al. Clinical practice guideline for the management of candidiasis: 2016 update by the Infectious Diseases Society of America. Clinical Infectious Diseases. 2016; 62(4):e1-50. [DOI:10.1093/cid/civ933] [PMID]
19.Sobel JD, Chaim W, Nagappan V, Leaman D. Treatment of vaginitis caused by Candida glabrata: Use of topical boric acid and flucytosine. American Journal of Obstetrics and Gynecology. 2003; 189(5):1297-300. [DOI:10.1067/S0002-9378(03)00726-9] [PMID]
20.Iavazzo C, Gkegkes ID, Zarkada IM, Falagas ME. Boric acid for recurrent vulvovaginal candidiasis: The clinical evidence. Journal of Women's Health. 2011; 20(8):1245-55. [DOI:10.1089/jwh.2010.2708] [PMID]
21.Prutting SM, Cerveny JD. Boric acid vaginal suppositories: A brief review. Infectious Diseases in Obstetrics and Gynecology. 1998; 6(4):191-4. [DOI:10.1002/(SICI)1098-0997(1998)6:43.0.CO;2-6] [PMID]
22.De Seta F, Schmidt M, Vu B, Essmann M, Larsen B. Antifungal mechanisms supporting boric acid therapy of Candida vaginitis. Journal of Antimicrobial Chemotherapy. 2009; 63(2):325-36. [DOI:10.1093/jac/dkn486] [PMID]
23.Sobel JD. Vulvovaginal candidosis. The Lancet. 2007; 369(9577):1961-71. [DOI:10.1016/S0140-6736(07)60917-9] [PMID]
24.Collins LM, Moore R, Sobel JD. Prognosis and long-term outcome of women with idiopathic recurrent vulvovaginal candidiasis caused by Candida albicans. Journal of Lower Genital Tract Disease. 2020; 24(1):48-52. [DOI:10.1097/LGT.0000000000000496] [PMID]
25.Gunther LS, Martins HP, Gimenes F, Abreu AL, Consolaro ME, Svidzinski TI. Prevalence of Candida albicans and non-albicans isolates from vaginal secretions: Comparative evaluation of colonization, vaginal candidiasis and recurrent vaginal candidiasis in diabetic and non-diabetic women. São paulo Medical Journal. 2014; 132(2):116-20. [DOI:10.1590/1516-3180.2014.1322640] [PMID]
26.Crouss T, Sobel JD, Smith K, Nyirjesy P. Long-term outcomes of women with recurrent vulvovaginal candidiasis after a course of maintenance antifungal therapy. Journal of Lower Genital Tract Disease. 2018; 22(4):382-6. [DOI:10.1097/LGT.0000000000000413] [PMID]
27.Hadrup N, Frederiksen M, Sharma AK. Toxicity of boric acid, borax and other boron containing compounds: A review. Regulatory Toxicology and Pharmacology. 2021; 121:104873. [DOI:10.1016/j.yrtph.2021.104873] [PMID]
28.Ray D, Goswami R, Banerjee U, Dadhwal V, Goswami D, Mandal P, et al. Prevalence of Candida glabrata and its response to boric acid vaginal suppositories in comparison with oral fluconazole in patients with diabetes and vulvovaginal candidiasis. Diabetes Care. 2007; 30(2):312-7. [DOI:10.2337/dc06-1469] [PMID]
29.Nyirjesy P, Brookhart C, Lazenby G, Schwebke J, Sobel JD. Vulvovaginal candidiasis: A review of the evidence for the 2021 Centers for Disease Control and Prevention of Sexually Transmitted Infections Treatment Guidelines. Clinical Infectious Diseases. 2022; 74(Supplement_2):S162-8. [DOI:10.1093/cid/ciab1057] [PMID]
30.Kalia N, Singh J, Kaur M. Microbiota in vaginal health and pathogenesis of recurrent vulvovaginal infections: A critical review. Annals of Clinical Microbiology and Antimicrobials. 2020; 19(1):5. [DOI:10.1186/s12941-020-0347-4] [PMID]
31.Redondo-Lopez V, Lynch M, Schmitt C, Cook R, Sobel JD. Torulopsis glabrata vaginitis: Clinical aspects and susceptibility to antifungal agents. Obstetrics & Gynecology. 1990; 76(4):651-5. [PMID]
32.Sobel JD, Chaim W. Treatment of Torulopsis glabrata vaginitis: Retrospective review of boric acid therapy. Clinical Infectious Diseases. 1997; 24(4):649-52. [DOI:10.1093/clind/24.4.649] [PMID]
33.Swate TE, Weed JC. Boric acid treatment of vulvovaginal candidiasis. Obstetrics & Gynecology. 1974; 43(6):893-5. [PMID]
34.Schmidt M, Tran-Nguyen D, Chizek P. Influence of boric acid on energy metabolism and stress tolerance of Candida albicans. Journal of Trace Elements in Medicine and Biology. 2018; 49:140-5. [DOI:10.1016/j.jtemb.2018.05.011] [PMID]
35.Salama OE, Gerstein AC. Differential response of Candida species morphologies and isolates to fluconazole and boric acid. Antimicrobial Agents and Chemotherapy. 2022; 66(5):e02406-21. [DOI:10.1128/aac.02406-21] [PMID]
36.Kalkan Ü, Yassa M, Sandal K, Teki̇ A, Kilinç C, Gülümser Ç, et al. The efficacy of the boric acid-based maintenance therapy in preventing recurrent vulvovaginal candidiasis. Journal of Experimental and Clinical Medicine. 2021; 38(4):461-5. [DOI:10.52142/omujecm.38.4.11]
37.Sobel J, Sobel R. Current treatment options for vulvovaginal candidiasis caused by azole-resistant Candida species. Expert Opinion on Pharmacotherapy. 2018; 19(9):971-7. [DOI:10.1080/14656566.2018.1476490] [PMID]
38.Marchaim D, Lemanek L, Bheemreddy S, Kaye KS, Sobel JD. Fluconazole-resistant Candida albicans vulvovaginitis. Obstetrics & Gynecology. 2012; 120(6):1407-14. [DOI:10.1097/AOG.0b013e31827307b2] [PMID]
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |